喜泊芬對人食管癌Eca-109細胞的光動力效應
黃維甄 謝劍明 陳錦章 李榮 張蘭英 李黎波 羅榮城
(南方醫科大學南方醫院腫瘤中心,廣東 廣州 510515)
自20世紀70年代光動力療法進入臨床研究以來,它不僅在各種良性疾病的治療中取得了很好的療效,并且在惡性腫瘤的治療中取得了令人矚目的成就[1]。光動力治療(photodynamic therapy,PDT)也稱光化學反應,氧、光敏劑和激光(常用激光)是其基本要素,其基本原理是利用某些光敏劑在新生物組織的定向分布或優先分布,同時在相應波長的可見光激發下,這些光敏劑能夠激活,從而產生活性分子[2-3],這些活性分子包括單線態氧或三重態氧,它們和相鄰的多種生物大分子發生氧化反應,進而對亞細胞結構(細胞膜、線粒體、溶酶體等)造成不可逆性損傷,最終導致細胞死亡。目前我國食管癌發病率居世界第1位,且90%的病理類型為鱗癌。由于光動力治療具有創傷小、毒性小、可重復性好等優點,已逐漸成為食管癌的一種治療手段,但在臨床治療中,其療效并不穩定。本研究是采用我國自主研發的第3代光敏劑-喜泊分(HiPorfin),研究不同濃度光敏劑及不同光照劑量密度對人食管鱗狀細胞癌Eca-109細胞體外效應的影響,探討PDT殺傷人食管癌細胞效應與孵育濃度及光照劑量密度的關系,為臨床HiPorfin-PDT的治療參數選擇提供一定的實驗依據。
1 資料與方法
1.1 試劑及設備 喜泊芬每瓶5 mL 25 mg(重慶市華鼎現代生物制藥有限責任公司);Bio-Rad550型博賽自動酶標儀;DIOMED 630型半導體激光器;CO2培養箱;LXJ-Ⅱ離心沉淀機;倒置相差顯微鏡;人食管癌細胞株Eca-109。
1.2 細胞培養 RPMI-1640高糖培養基,10%小牛血清,青霉素及鏈霉素雙抗,置于37℃、5%CO2的培養箱中,常規細胞培養,3~5 d傳代1次。
1.3 四甲基偶氮唑鹽(MTT)法檢測喜泊芬-PDT對食管癌Eca-109細胞的殺傷效應 取對數生長期(第3天,細胞長滿約占培養瓶的80%)Eca-109細胞,胰蛋白酶消化30 s~1 min,鏡下觀察細胞大部分變形后棄消化液,加入RPMI-1640培養液,吹打,以1000 r?min-1離心5 min,取上清液,加入全培養基,調整細胞濃度為105?mL-1,接種于96孔板,每孔100 mL,37℃、5%CO2的培養箱培養24 h后,加入光敏劑,每孔 100μL。Eca-109細胞分為PDT實驗組和完全空白對照組。PDT實驗組加入不同孵育濃度的喜泊芬(每個濃度4個復孔),使喜泊芬終濃度為:0、2.5 、5.0、10.0、15.0 、20.0 μ g ?mL-1。加入喜泊芬后繼續于37℃、5%CO2培養箱內培養12 h,去培養液,PBS洗3次后加入含2%小牛血清的1640培養液后除空白對照組外均即刻給予光照,光源采用DIOMED 630 PDT系統,波長630 nm,給予飽和光劑量照射,光照劑量密度分別為 0、12、24、30 J?cm-2。光照后繼續在培養箱內培養24 h,每孔加入 MT T 20μL,并繼續避光培養4 h后去培養液,每孔加入二甲基亞砜100μL,于振蕩器上搖勻后于酶標儀上測A570OD值,并按照以下公式計算細胞生存率。細胞生存率=(光動力實驗組A570OD值-本底組A570OD值)/(完全空白對照A570OD值-本底組A570OD值)[4]。以上實驗重復3次。
1.4 統計學處理 數據分析用SPSS13.0分析軟件,采用析因設計的方差分析。
2 結 果
在喜泊芬不同孵育濃度及不同光照劑量密度下PDT對食管癌Eca-109細胞體外效應的影響見表1和圖1。
表1 不同孵育濃度喜泊芬及不同光照劑量密度食管癌Eca-109細胞的生存率(%)比較 ()
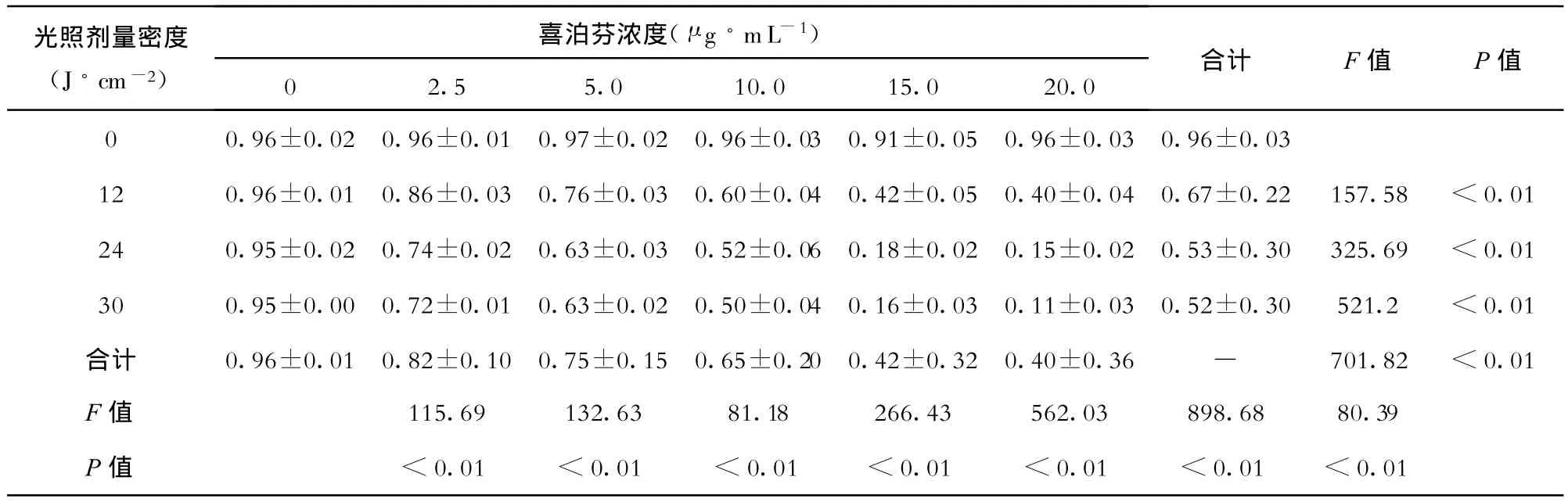
表1 不同孵育濃度喜泊芬及不同光照劑量密度食管癌Eca-109細胞的生存率(%)比較 ()
光照劑量密度(J?cm-2)喜泊芬濃度(μ g?mL-1)02.5 5.0 10.0 15.0 20.0合計 F值 P值0 0.96±0.020.96±0.010.97±0.020.96±0.030.91±0.050.96±0.030.96±0.0312 0.96±0.010.86±0.030.76±0.030.60±0.040.42±0.050.40±0.040.67±0.22 157.58 <0.0124 0.95±0.020.74±0.020.63±0.030.52±0.060.18±0.020.15±0.020.53±0.30 325.69 <0.0130 0.95±0.000.72±0.010.63±0.020.50±0.040.16±0.030.11±0.030.52±0.30 521.2 <0.01合計 0.96±0.010.82±0.100.75±0.150.65±0.200.42±0.320.40±0.36 — 701.82 <0.01 F值 115.69 132.63 81.18 266.43 562.03 898.68 80.39 P值 <0.01 <0.01 <0.01 <0.01 <0.01 <0.01 <0.01

圖1 喜泊芬不同孵育濃度(J?cm-2)和不同光照劑量密度(μ g?mL-1)間的交互效應
從表1及圖1可見,喜泊芬的不同孵育濃度和在4種不同光照劑量密度下食管癌Eca-109細胞的生存率均有顯著差異(P<0.01)。同一光照劑量密度下(除濃度為0 μ g?mL-1組外),不同喜泊芬孵育濃度的食管癌 Eca-109細胞的生存率有顯著差異(P<0.000),同一喜泊芬孵育濃度下(除光照劑量密度為0 J/cm2組外),不同光照劑量密度的食管癌Eca-109細胞的生存率亦有顯著差異(P<0.01)。光照劑量密度與孵育濃度之間有顯著的交互效應(P <0.01),當孵育濃度為20 μ g?mL-1,光照劑量密度為24 J?cm-2時其殺傷效應最強。孵育濃度由 15.0 μ g?mL-1增加到 20 μ g ?mL-1時,光照劑量密度由 24 J?cm-2延長為 30 J?cm-2并不能提高殺傷效應,這說明當喜泊芬孵育濃度和光照劑量密度達到一定程度時,其殺傷效應已達到平臺期。
3 討 論
在我國,食管癌的發病率和死亡率仍均居惡性腫瘤的第2位,僅次于胃癌[5]。隨著我國腫瘤治療水平的進展,食管癌的療效有了一定的提高。光動力治療PDT在食管癌,尤其是早期食管癌及癌前病變,如Barret食管的治療上已取得很大進展[6]。目前PDT已成為繼放化療后治療食管癌的另一重要手段,并且在中晚期食管癌的治療中取得較好的療效[7]。居云勝等[8]報道,PDT治療食管癌的有效率高達76%,并且具有以下優點:(1)能選擇性地消滅腫瘤細胞而不損害正常組織;(2)與化療、放療有一定協同作用;(3)可以縮小手術的范圍和改善手術的預后。PDT的作用原理是光敏劑通過細胞膜進入腫瘤細胞內部與細胞器結合在腫瘤組織中大量積存,光照后所產生單線態氧和大量的氧自由基對其生物膜和線粒體造成損害,從而影響線粒體呼吸鏈中許多酶,如細胞色素氧化酶、琥珀酸脫氫酶、單胺氧化酶、乳酸脫氫酶、磷酸激酶以及微粒體細胞色素P450的活性,因而減少ATP的合成[9-10]。這些均可直接或間接地影響到腫瘤細胞的增殖。有研究[11]揭示光敏劑在腫瘤細胞中容易積存是因為新生細胞的細胞膜上表達大量的低密度脂蛋白受體(low density lipoprotein receptor,LDLP),而腫瘤細胞細胞膜上具有比靜止細胞更多的LDLP。這使得一些易附于LDLP上的親脂性光敏劑在腫瘤細胞上高度聚集。從PDT作用機制可見,在細胞的體外PDT效應中,光照劑量密度、光敏劑的種類和光敏劑的孵育濃度及孵育時間均可影響其效應。本研究結果表明,喜泊芬的不同孵育濃度和4種不同光照劑量密度的食管癌Eca-109細胞生存率均有顯著差異(P<0.01)。在同一光照劑量密度下(除濃度為0 μ g?mL-1組外),不同喜泊芬孵育濃度的食管癌Eca-109細胞的生存率有顯著差異(P<0.01),同一濃度下(除光照劑量密度為0 J?cm-2組外),不同光照劑量密度的食管癌Eca-109細胞生存率亦有顯著差異(P<0.01)。光照劑量密度與孵育濃度之間有顯著的交互效應(P<0.01),當孵育濃度和光照劑量密度達到一定程度時,其殺傷效應達到平臺期。有研究[12]結果表明,這可能與細胞存在胞內飽和光敏劑濃度相關。因此對于同一種光敏劑,當孵育濃度和光照劑量密度達到一定程度時,增加孵育濃度及提高光照劑量密度并不能提高PDT效應,即殺傷效應達到了平臺期。本研究中當光敏劑孵育濃度為15.0 μ g?mL-1而且光照劑量密度為24 J?cm-2時達到最佳治療效應,即使再提升光敏劑濃度和光照劑量密度也無法提高治療效應。從臨床治療角度上,一旦達到最佳光照劑量密度之后,如再進一步增加光照劑量密度,有可能導致正常組織的損傷,因此不提倡過多的光照劑量。綜上所述,在特定孵育時間下,光敏劑孵育濃度及光照劑量密度為影響PDT效應的主要因素,本研究為臨床HiPorfin-PDT參數的選擇提供一定的實驗依據。
1 Rosenthal DI.Gatstein Clinical applications of photodynamic therapy[J].Ann Med,1994,26:405-409.
2 Epstein JH.Phototoxieity and photoallergy[J].Semin Cutan M ed Surg,1999,18(4):74-84.
3 Price M,Reiners JJ,Santlago AM,et al.M onitoring singht oxygen and hydroxy l radical formation with fluorescent probes during photodynamie therapy[J].Photoehem Photobiol,2009,10(3):3-5.
4 尚立群,周乃康,顧瑛,等.竹紅菌乙素-PDT與血卟啉衍生物-PDT對食管癌殺傷效應的比較研究[J].腫瘤防治雜志,2005,12(15):1139-1142.
5 孫燕,石遠凱.臨床腫瘤內科手冊[M].第5版.北京:人民衛生出版社,2008:466.
6 Radua,Wagineres G,Vanden BH,et al.Photodynamic therapy of early squamous cell cancers of the esophagus[J].Gastrointest Chin N Am,2000,10(3):430-460.
7 李黎波,羅榮城,廖旺軍,等.Photofrin光動力治療晚期腫瘤近期療效觀察[J].第一軍醫大學學報,2003,23(12):1341-1343.
8 居云勝,陶祥元.光動力治療消化道惡性腫瘤的療效觀察[J].中國臨床醫學,1997,4(3):162-163.
9 Hilf R,Murant R S,Narayanan U,et al.Relationship of mitoehondria function and cellular adenosine triphosphate levels to hematoporphyrin defivatine-induced photosensitization in R3230 AC mammary tumorg[J].Cancer Res,1986,46(1):211-217.
10 Gibson SL,Vander M eid K R,Mutant RS,et al.Increased eficacy of photod ynamie therapy of R3230 AC mamlnary adenecarcinoma by intratumoral injection of photofrin I[J].Br J Cancer,1990,61(4):553-557.
11 張林,虞樂華.光動力療法作用機制的研究進展[J].中國激光醫學雜志,2003,24(2):91-93.
12 劉慧龍,劉凡光,顧瑛.影響光動力療法的幾個主要因素[J].中國激光醫學雜志,2005,11(12):121-124.

