氮素濃度對黃檗幼苗生長及氮代謝相關酶類的影響1)
李 霞 閻秀峰
(吉林師范大學,四平,136000) (東北林業大學)
氮素在植物營養生理中有很重要的作用,供氮水平可通過影響氮代謝關鍵酶活性而影響植物的生長、發育以及對環境的適應[1-3]。氮素供應水平對植物體內的硝酸還原酶(NR)和谷氨酰胺合成酶(GS)活性有不同程度的影響;也在一定程度上影響可溶性蛋白含量,而可溶性蛋白大部分為參與各種代謝的酶類,是植物體內貯藏氮的主要形式,其中絕大多數是卡爾文循環中最關鍵的酶,在植物的光合作用、生長發育及植物生物量的建成中起著重要作用[2-3]。黃檗(Phellodendron amurense)為蕓香科(Rutaceae)黃檗屬(Phellodendron)植物,是東北闊葉紅松林的重要伴生樹種,也是我國名貴中藥黃柏的藥源植物,其內皮(韌皮部)入藥,稱為關黃柏。近年來,筆者就黃檗中主要生物堿的分布規律和部分環境因子對黃檗中主要生物堿含量的影響、氮素形態對黃檗幼苗主要生物堿及氮代謝關鍵酶活性的影響等作了一些研究工作[4-6]。研究了不同氮素水平對當年生黃檗幼苗葉片中氮代謝關鍵酶活性的影響,為明確氮素對黃檗生長及一些生理過程的影響,確定黃檗生長所需的最佳氮素條件,以便進一步探討黃檗生長與主要藥用成分含量均佳的氮肥管理與調控。
1 材料與方法
黃檗幼苗在陽光溫室內培養,溫室為自然采光,溫度控制在18~30℃,水培容器為長50 cm、寬37 cm、高13 cm的塑料盆,上覆具孔泡沫板用于黃檗幼苗的固定。從苗圃選取生長一致的1年生黃檗幼苗,先以自來水培養2d,再澆灌氮素濃度為8 mmol/L的正常營養液,以使幼苗生長健壯。完全營養液主要按Ultriainen等[7]方法配制,但略加修改:NH4NO34 mmol/L、KH2PO41 mmol/L、KC1 1 mmol/L、CaCl2-6H2O 1 mmol/L、MgSO4-7H2O 0.6 mmol/L、FeCl3-6H2O 0.02 mmol/L、MnCl2-4H2O 6 μmol/L、H3BO30.016 mmol/L、ZnCl20.3 μmol/L、CuCl2-2H2O 0.3 μmol/L、Na2MoO4-2H2O 0.3 μmol/L。在完全營養液基礎上,通過改變NH4NO3的量調配出5種營養水平的氮素處理液,既1、4、8、16和32 mmol/L。每天用0.1 mmol/L的KOH和HCl將營養液pH值調至6.0左右。每個處理設3次重復,營養液3 d更換1次,全天用泵通氣,并相應地補充損失的水分。
處理后每隔10 d分別采集黃檗幼苗頂端完全展開的第1片成熟葉片,并進行各項生理指標的測定,每重復5株。硝態氮和銨態氮測定參照Richardson[8]方法,可溶性蛋白含量采用考馬斯亮蘭比色法測定[9],NR 的測定采用活體法[10-11],GS的測定參照Miflin[12]的方法,用紫外可見分光光度計測定吸光值。處理后第50天,測量黃檗幼苗的株高、莖直徑(基部)、單株生物量,并重復8株。所得數據用SAS 8.1 for Windows進行統計分析,用方差分析檢驗差異顯著性。
2 結果與分析
2.1 氮素濃度對黃檗幼苗生長的影響
氮素濃度不同對黃檗幼苗的生長影響明顯。表1是處理結束時(第50天)黃檗幼苗的生長狀況。可以看出,隨著營養液氮素濃度的升高,黃檗幼苗的株高、莖直徑和全株生物量逐漸升高,16 mmol/L處理達到最大值,當氮素濃度升高到32 mmol/L時,株高、莖直徑和全株生物量都比16 mmol/L時的最大值略有下降,但兩者差異不顯著。氮素濃度為16 mmol/L時黃檗幼苗的生長狀況最好,而氮素濃度為1 mmol/L時,黃檗幼苗的生長狀況最差。
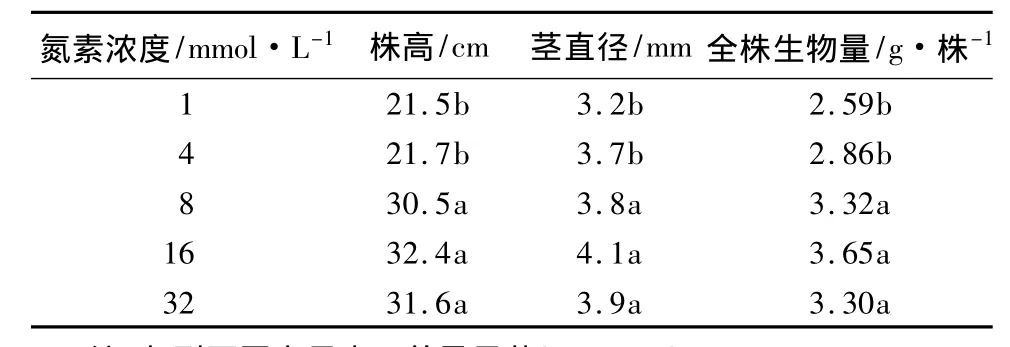
表1 不同氮素濃度下黃檗幼苗的生長狀況
2.2 氮素濃度對黃檗幼苗葉片中銨態氮、硝態氮及可溶性蛋白質量分數的影響
隨著處理時間的延長,氮素濃度較高的16和32 mmol/L 2個處理銨態氮質量分數略高于其他處理,而這2個處理間無明顯差異;1和4 mmol/L 2個處理隨著處理時間增加銨態氮質量分數明顯下降;8 mmol/L處理銨態氮質量分數變化不大,只在后期略有增加。在處理第50天,氮素濃度較高的處理銨態氮質量分數相對較高,但不是完全的對應關系(表2)。在氮素處理20 d時,各處理黃檗幼苗葉片中硝態氮質量分數都有升高的趨勢,然后逐漸下降趨于穩定。從處理第30天后測定的結果表明,培養液氮素濃度增加,硝態氮質量分數有升高的趨勢,在16和32 mmol/L 2個處理硝態氮質量分數明顯高于1、4和8 mmol/L 3個處理,但兩者之間差異不顯著,1、4和8 mmol/L 3個處理間差異也不顯著,見表2所示。可見,培養液氮素濃度的變化不同程度地影響了黃檗幼苗中銨態氮和硝態氮的質量分數,總體看,雖然不是完全的對應關系,但基本上是氮素濃度升高,葉片中銨態氮和硝態氮的質量分數也較高。
在處理的前20 d,氮素濃度對黃檗幼苗葉片中可溶性蛋白質量分數的影響不明顯,從處理的30d后,氮素濃度為8、16和32 mmol/L的3個處理,可溶性蛋白質量分數升高幅度較大,在處理后期,16和32 mmol/L的2個處理明顯高于其他處理,但兩者之間無顯著差異;其他3個處理是氮素濃度越高,可溶性蛋白質量分數越高。可見,氮素濃度升高在一定程度上可提高黃檗幼苗葉片中可溶性蛋白質量分數,但當升高到一定程度時,可溶性蛋白質量分數不會繼續升高,見表2。
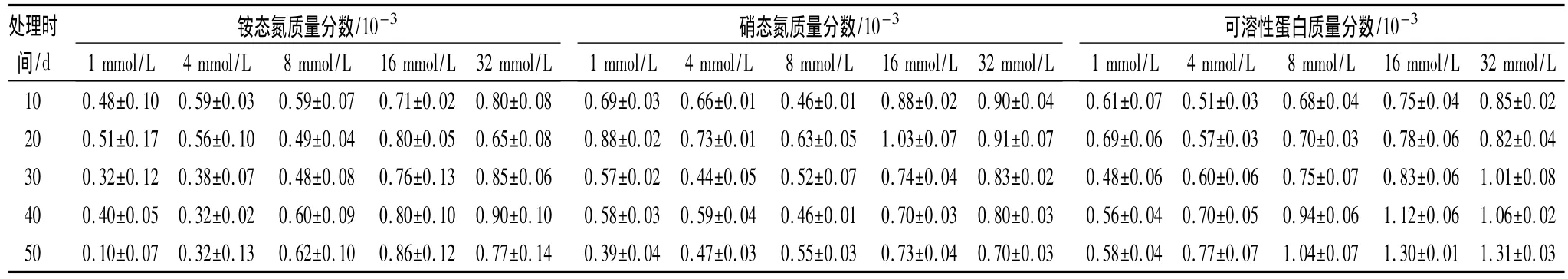
表2 不同氮素濃度下黃檗幼苗葉片銨態氮和硝態氮質量分數
2.3 氮素濃度對黃檗幼苗葉片中NR和GS活性的影響
由表3可見,在處理的最初階段,氮素濃度對黃檗幼苗葉片中NR的影響較大,各處理間的差異較大,表現為氮素濃度越高NR活性越強。在處理的20 d后,8、16和32 mmol/L的3個處理NR活性波動較小,在處理后期都略有下降,3者差異不明顯。1、4 mmol/L 2個處理NR活性波動較大,且都明顯低于其他3個處理,兩者差異不顯著。氮素濃度對GS活性的影響與NR比較相似,在整個氮素處理的過程中,基本上是氮素濃度越高,GS活性越強,但不完全對應,比較顯著的特征是8、16和32 mmol/L 3個處理GS活性比較相似,顯著高于1、4 mmol/L這2個處理,而3者之間差異不顯著,1、4 mmol/L 2個處理之間差異也不顯著,見表3所示。
總體看,氮素濃度升高,可在一定程度上提高中NR和GS的活性。
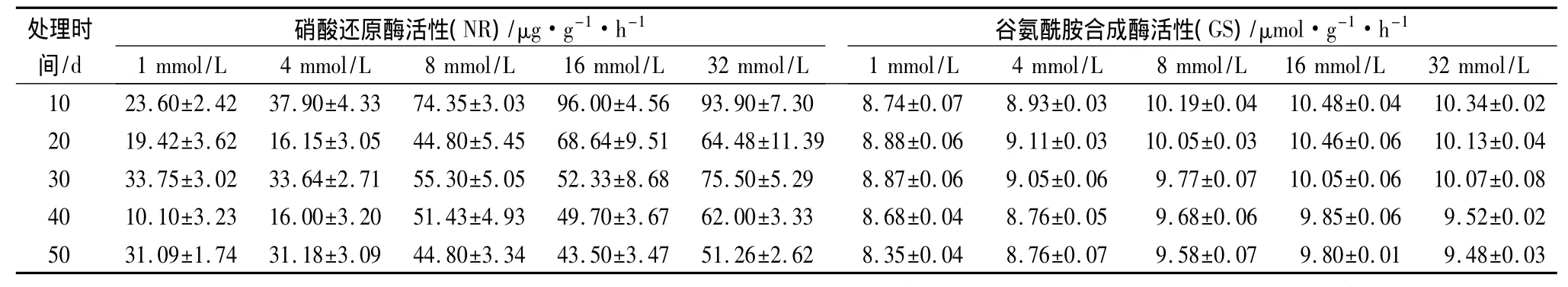
表3 不同氮素濃度下黃檗幼苗葉片NR和GS活性
3 結論與討論
氮素作為重要的營養因子對樹木生物量的限制作用尤為明顯。可溶性蛋白大部分為參與各種代謝的酶類,是植物體內貯藏氮的主要形式,供氮水平可在一定程度上影響可溶性蛋白質質量分數,進而反映供氮對植物生長發育和代謝的影響。從本文的結果來看,1 mmol/L處理可溶性蛋白質量分數最低,且生物量也最低,說明缺氮可能導致氮素同化能力減弱,光合產物流向氮素代謝、用于NH3同化為氨基酸和蛋白質的相對較少。16和32 mmol/L的2個處理可溶性蛋白質量分數明顯高于其他處理,但兩者無明顯差異,這也與生物量的變化相同,說明隨著氮素水平的增加和氮素同化能力的增加,越來越多的光合產物流向氮素代謝,因而葉片中可溶性蛋白質質量分數增加。但由于黃檗幼苗的氮素同化能力有限,過量的供氮可能引發營養失衡,根系為抵御高氮脅迫,必須提高呼吸強度來盡量適應旱育環境,引起細胞早衰,生長受到嚴重限制,最終造成膜傷害[13]。所以只有供氮水平適宜,才能最大限度提高氮素利用率。
植物獲取氮素營養包括吸收、轉運和同化3個主要過程,即 NO-3和 NH+4的吸收轉運、NO-3被 NR 還原為 NH+4,NH+4被谷氨酰胺合成酶/谷氨酸合酶(GS/GOGAT)同化為谷氨酸和谷氨酰胺,NR是一種誘導酶,為硝態氮同化的限速酶,其活性取決于介質中的NO-3濃度。在一定范圍內,植物體內的NO-3濃度與NR的活性呈正相關,且NR只有在NO-3溶液中經過一段時間的誘導才能逐步形成。近年也有研究表明,即使同一物種,不同品種間的NR活性并非只受硝態氮的激活。中筋小麥豫麥49在施用銨態氮時,GS和GOGAT活性增強的同時,NR活性也有較大增強[14]。本試驗結果表明,黃檗葉片中NR活性明顯受供氮水平高低的影響,營養液供氮水平的提高,葉片中NR活性增加,并表現出了與黃檗葉片中硝態氮質量分數相似的變化趨勢,從而再度證明,谷氨酰胺合成酶(GS)是NH+4同化過程中的一個關鍵酶,參與多種氮代謝的調節,是氮代謝中心的多功能酶。目前,尚不清楚對GS基因表達及活性起刺激信號的作用是NO-3還是其同化產物。
[1] 張福鎖,樊小林,李曉林.土壤與植物營養研究新動態:第2卷[M].北京:中國農業出版社,1995:42-69.
[2] Inokuchi R,Kuma K,Miyata T,et al.Nitrogen-assimilating enzymes in land plants and algae phylogenic and physiological perspectives[J].Physiol Plantarum,2002,116:1-11.
[3] Wang Y H,Garvin D F,Kochian L V.Nitrate-induced genes in tomato roots.Array analysis reveals novel genes that may play a role in nitrogen nutrition[J].Plant Physiol,2001,127:345-359.
[4] 李霞,劉劍鋒,閻秀峰.氮素形態對黃檗幼苗三種生物堿含量的影響[J].生態學報,2005,25(9):2159-2164.
[5] 李霞,閻秀峰,劉劍鋒.氮素形態對黃檗幼苗生長、氮代謝相關酶類的影響[J].植物學通報,2006,23(3):255-261.
[6] 李霞,楊立學,閻秀峰.一年生黃檗幼苗藥用生物堿的分布及其含量變化[J].東北師大學報:自然科學版,2006,38(2):101-104.
[7] Ultriainen J,Holopainen T.Nitrogen availability modifies the ozone responses of Scots pine seedlings exposed in an open-field system[J].Tree Physiol,2001,21:1205-1213.
[8] Richardson M,Cabrera R I,Murphy J A,et al.Nitrogen-form and endophyte-infection effects on growth,nitrogen uptake and alkaloid content of chewings fescue turfgrass[J].J Plant Nutr,1999,22:67-79.
[9] Baricevic D,Umek A,Kreft S,et al.Effect of water stress and nitrogen fertilization on the content of hyoscyamine and scopolamine in the roots of deadly nightshade(Atropa belladonna)[J].Environ Exp Bot,1999,42:17-24.
[10] 張志良,瞿偉菁.植物生理學實驗指導[M].北京:高等教育出版社,2003:41-67.
[11] 周樹,鄭相穆.NR體內分析方法的探討[J].植物生理學通訊,1985(1):47-49.
[12] Miflin B J,Lea P J.Ammonia metabolism[J].Annual Review of Plant Physiology,1977,28:288-329.
[13] 王強盛,丁艷鋒,嚴定春,等.不同施氮量對水稻旱育秧苗形態特征和生理特性的影響[J].南京農業大學學報,2004,27(3):11-14.
[14] 王小純,熊淑萍,馬新明,等.不同形態氮素對專用型小麥花后氮代謝關鍵酶活性及籽粒蛋白質含量的影響[J].生態學報,2005,25(4):802-807.

