豬細小病毒病國內流行狀況以及防治策略
藺文成,胡 峰,,任 梅,,崔玉東,錢愛東,崔尚金,,
(1.中國農科院哈爾濱獸醫研究所 獸醫生物技術國家重點實驗室 豬傳染病學研究室,黑龍江 哈爾濱 150001;2.黑龍江八一農墾大學動物科學技術學院,黑龍江 大慶 163319;3.吉林農業大學,吉林 長春 130118)
豬細小病毒病是由豬細小病毒(porcineparvovirus,PPV)引起的一種繁殖障礙疾病,同時與豬滲出性皮炎、斷奶仔豬多系統衰弱綜合征等疾病有關,對妊娠母豬與仔豬具有極大的威脅,給養殖業造成了巨大的經濟損失。
1 病原學
豬細小病毒(porcineparvovirus,PPV)屬于細小病毒科、細小病毒屬,耐熱能力極強,對脂、酶溶劑及有機溶劑抵抗力強,耐酸范圍大,感染能力在pH值3.0~10.0范圍內無明顯的改變。具有血凝性,能凝集人、猴、豚鼠、小鼠和雞的紅細胞,對豚鼠紅細胞血凝效果最好。因此,臨床上常利用這一特性檢測PPV的存在。PPV幾乎能在所有的豬原代細胞(如豬腎、豬睪丸細胞)和傳代細胞(如PK15、ST、IBRS2等細胞)中生長,甚至能在牛腎原代細胞及人的某些傳代細胞中增殖。
目前國內PPV只有一個血清型,哈爾濱獸醫研究所的崔尚金研究員按照PPV的致病性與組織嗜性對其代表毒株進行了分類(如表1),包括非致病性毒株(KBSH、NADL-2)、對免疫不完全胎兒致病并能導致胎兒死亡的毒株(如NADL-8、IAF-76)、對免疫不完全胎兒致病并能引起皮炎的毒株(高致病性,如Kresse、IAFA54)、腸炎型毒株和呼吸道型毒株[1]。
2 流行病學
1966年,Mayr進行豬瘟病毒組織培養時發現了PPV[1];1967年,Cartwright和Huck等人首次在流產胎兒中分離到PPV;此后相繼在德國、美國、荷蘭、日本、澳大利亞等國發現,中國在1982年首次分離到豬細小病毒,隨后潘雪珠等學者相繼在上海、四川、廣西、黑龍江、天津、湖北等地分離到了病毒,這表明豬細小病毒呈全國性分布。上世紀80年代到90年代中期,國內豬群PPV感染率極高,此階段的抽樣檢測結果(如表2)顯示:全國范圍內,豬群PPV的陽性感染率普遍在60%以上,個別省份的陽性感染率甚至達到87.50%,極大的威脅到了養豬業的發展,造成了巨大的經濟損失。

表1 五種豬細小病毒的生物型分類

表2 國內部分地區豬群PPV陽性感染率抽樣檢測結果
隨著PPV疫苗的投入使用,PPV疫情得到了有效的控制,自90年代中期開始,豬群的發病率顯著下降。但近年來,豬細小病毒病感染率和發病率都呈不斷升高的趨勢。以貴州遵義地區為例,自2006年開始,該區內規模養豬場的PPV陽性感染率分別為4.80%、7.22%、10.38%、14.20%,呈現逐年遞升的趨勢(如圖1)。
2005年以來,國內多個省份陸續對豬細小病毒陽性感染率進行了調查,結果發現:全國范圍內,豬群的陽性感染率較高,有暴發豬細小病毒病的可能性;西南地區、華南地區和華北地區的陽性感染率顯著高于其他地區。
3 發病機理

圖1 貴州遵義地區豬細小病毒檢測陽性率
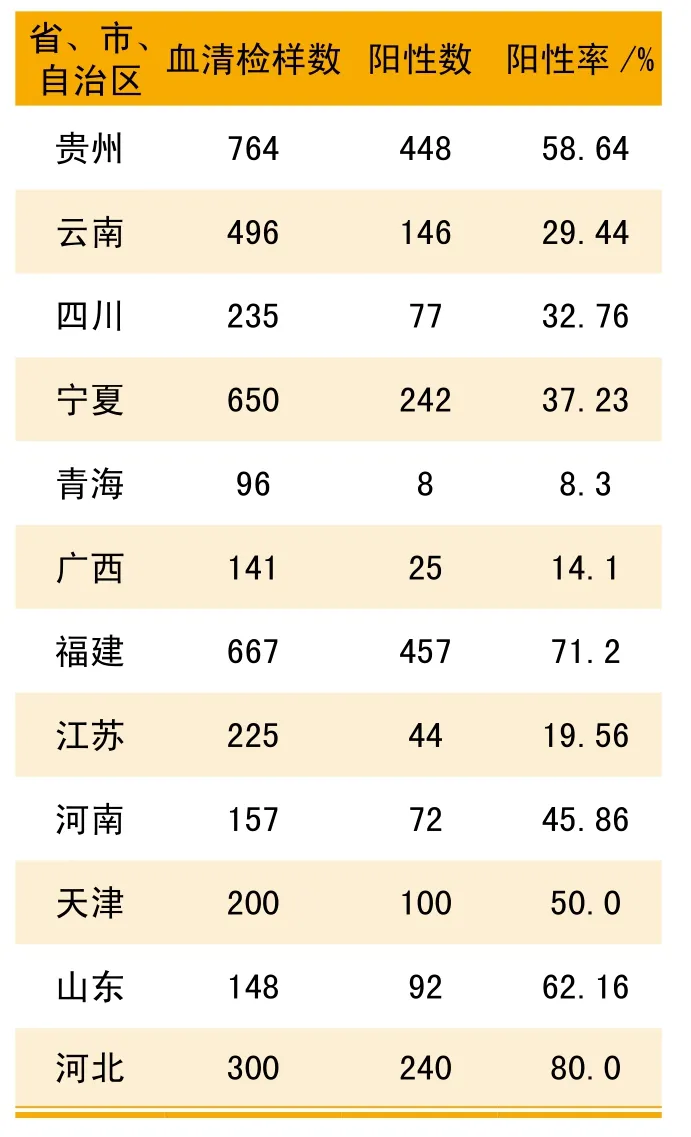
表3 國內部分地區豬群PPV陽性感染率抽樣檢測結果
PPV在心臟、肺臟、脾臟和性腺中復制,主要攻擊母豬子宮,子宮內病毒含量最高可達1012拷貝/mL;對仔豬而言,病毒同樣在心臟、肺臟、脾臟和性腺中復制,以性腺含量最高。由此可見,病毒對母豬的致病位置主要在繁殖器官,同時也破壞肺臟等呼吸器官和脾臟等免疫器官;而對小豬的損傷主要在于破壞脾臟、性腺等的正常生理功能,同時破壞心臟等中樞器官,從而造成死亡。
目前PPV具體的致病機理研究多集中在豬感染PPV后體內激素水平變化和病毒對作用方式的角度。相關研究發現:PPV可以吸附在豬受精卵細胞上,部分PPV能穿過透明帶進入受精卵細胞,病毒可能在受精卵細胞內起一定的作用從而導致流產、死胎、胎兒木乃伊化及新生仔豬死亡;PPV還能使母豬黃體發生萎縮,而妊娠黃體的主要作用是分泌孕激素,支持胎兒發育,PPV造成黃體萎縮使母豬失去了這一生物學功能。這些作用可能是導致豬細小病毒病發生繁殖障礙和仔豬死亡的原因之一。母豬經口鼻感染PPV后,母體與胎兒結合處的絨毛膜的間質細胞和內皮細胞內病毒含量隨妊娠期的發展而明顯增加,而子宮內皮細胞和滋養外胚層未檢測到病原,這表明母豬與胎兒間的病毒傳染可能通過這些組織進行,但也有學者認為病毒在母體之間是通過巨噬細胞傳播的。
PPV不同毒株的致病方式和組織嗜性有較大的差異,不同毒株的復制具有顯著的組織選擇性。NADL-8株和NADL-2株的區別在于能否通過胎盤感染胎兒從而造成胎兒的死亡,其中NADL-2株可作為弱毒疫苗使用。Molitor等發現NADL-2毒株感染的細胞中存在缺損性病毒顆粒NADL-2*,這種顆粒能干擾NADL-2毒株的復制,從而為免疫反應提供足夠的時間,阻止繼發胎盤感染和毒血癥等的發生。Oraveetakul等利用原位雜交技術證實了NADL-8株與Kresse株在胎兒體內復制部位和數量的差異,二者的DNA在肝臟內的數量差異不大,但腦組織和脾臟內僅有Kresse株的DNA。
4 混合感染
PPV可以和許多病毒發生混合感染,包括豬繁殖與呼吸綜合征病毒(PRRSV)、豬瘟病毒(CSFV)、豬圓環病毒2型(PCV2)和豬偽狂犬病毒(PRV)等;同時還可以與某些細菌、寄生蟲等發生混合感染,如附紅細胞體原蟲、沙門氏菌和大腸桿菌等
鄔捷等(1987)報道了我國豬細小病毒與乙型腦炎病毒混合感染,這是國內首次對細小病毒混合感染的報道,隨后相繼有人報道豬細小病毒和圓環病毒、繁殖與呼吸障礙綜合征病毒(PRRSV)混合感染的情況。
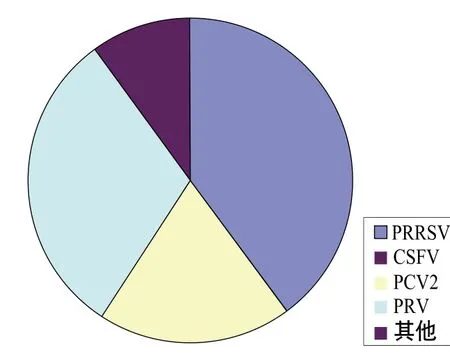
圖2 與PPV混合感染的病原示意圖
2004年,華東地區(上海、江蘇、浙江及山東等四省市)豬場的調查情況顯示:PCV2與PPV二重混合感染樣品占樣品總數的26.9%,PPV、PCV2與PRRSV三重感染的病例占檢測樣本總數7.5%[3];2006年,廣西南寧、玉林、貴港、柳州、欽州和桂林6個市的檢測結果顯示:PPV與PRRSV、CSFV、PCV2和/或PRV4種病毒均有混合感染現象,混合感染樣品占PPV陽性樣品的48.00%[4];Krakowka等應用PCV2分離毒株實驗感染未經母乳哺育的仔豬或悉生仔豬僅產生輕微的PMWS癥狀,但如將PPV及PCV2共同實驗感染仔豬則可以成功復制出典型的PMWS癥狀及病變,但如用PPV單獨感染沒有任何癥狀和病變[5]。2007年,云南省屏邊縣發生PPV與豬附紅細胞體病混合感染疫情,混合感染率高達60%;2008年,四川省眉山市發生PPV與沙門氏菌混合感染病例;2009年,貴州省貴陽市發生PPV與仔豬水腫病混合感染病例,都給當地養殖業造成了巨大的損失。
如圖2所示,目前國內與PPV混合感染的主要病原是PRRSV、PCV2和PRV等,與其他病原混合感染的程度明顯小于這3種病原。現階段各地豬場中PPV的混合感染現象非常普遍,與其他病原的混合感染趨勢可能會進一步擴大,感染方式可能會逐漸呈現多元化,感染范圍也可能會逐步擴大,出現除目前已知的繁殖障礙、腸炎、皮炎、呼吸道感染、PMWS以外的其他新情況,因此防控混合感染的任務任重而道遠。
5 基因與表達
PPV為單股負鏈DNA病毒,大小約為5000bp,成熟的病毒顆粒只含有負鏈DNA。豬細小病毒與同屬的其他病毒有很高的序列同源性和結構相似性,基因組兩端具有發夾結構,3'端形成長約102bp的Y字型發夾結構,其中2-16nt、27-40nt為保守序列;5'端構成長約127bp的U型回文序列。病毒基因組具有兩個開放閱讀框(ORF),靠近3'端的ORF主要編碼結構蛋白,靠近5'端ORF主要編碼非結構蛋白,編碼區基因相互重疊,各自有獨立的啟動子。
PPV遵循滾筒式復制原則,在細胞周期的S期晚期和G2期早期依賴于宿主DNA的復制機制進行自身復制,在宿主DNA多聚酶的作用下,從基因組3'端的羥基開始合成互補鏈,將感染的負鏈DNA轉變為雙鏈復制型DNA(RFDNA),再以RFDNA為模板,合成病毒mRNAs和子代病毒基因組。PPV感染宿主細胞后,啟動子P4與P40分別從基因組225nt和2035nt處起始轉錄,共同終止于4833nt的終止序列區,終止序列區包括poly(A)(CAATAAA,4813nt)、CA二核苷酸(4833nt)、GT富集區(TGTGTTT,4843nt),轉錄產物經不同的拼接方式形成4種轉錄終產物,即R1(4.7kb)、R2(3.3kb)、R3和R4(均為2.9kb),可進一步分別編碼非結構蛋白NS1、NS2、NS3和結構蛋白VP1、VP2。
本實驗室曾對國內收集到的毒株和GenBank中收錄的毒株的序列進行分析,發現VP1/VP2終止密碼子處存在一段重復序列,從疫苗株到疫苗前毒株、中等毒力毒株、古典型毒株、皮膚型毒株、高致病力毒株,堿基缺失從0到44、45、63、127、128各自不同,缺失數目有越來越多的趨勢,由此推斷,豬細小病毒的毒力變化可能與此有關[7]。進一步的分析發現,所有弱毒疫苗株都存在127的重復序列,這可作為區分弱毒疫苗株和其他流行病毒株的依據。李昌文等(2001)的分析結果表明,不同毒株VP2基因序列的同源性在99%左右,并含有細小病毒屬的保守序列,即UFPNGQIWDKEL,在無感染性缺損病毒NADL-2的基因組中并沒有類似的保守序列,因此推測這段保守序列可能是產生完整的病毒結構蛋白和成熟的病毒粒子必不可少的功能區域。
6 PPV的診斷方法
6.1 病原學檢測
PPV在細胞中進行培養后分離,從而確診PPV的感染,此方法在早期PPV診斷中發揮了重要作用。但病毒分離繁瑣,成本高、時間長,易受其他病毒干擾,而且PPV的感染力會隨著胎兒死亡時間的延長而降低,因此在臨床應用上頗受限制。
6.2 血清學診斷
6.2.1 血凝試驗和血凝抑制試驗
血凝試驗(HA)用于檢查組織提取物中的病毒抗原。李永江[8]等人采用生理鹽水、PBS、巴比妥緩沖液3種緩沖液進行血凝試驗,結果表明經生理鹽水作稀釋,血凝滴度最高,達1∶8192,比PBS高2個滴度,較巴比妥緩沖液高3個滴度。
血凝抑制試驗(HI)用于感染后抗體檢測。HI試驗方法具有較高的特異性,操作簡便、快速,能大量診斷,是基層獸醫檢測PPV較為經典的方法,但該方法靈敏度低,只能檢出被PPV感染,但在低滴度感染時難以檢出,不能區分滅活疫苗免疫的豬和野毒感染的豬,只能作為輔助診斷方法。
6.2.2 血清中和試驗
血清中和試驗(SN)就是利用被檢血清的抗體中和PPV,根據細胞病變來計算抗體滴度,JooHS[9]等人研究表明SN比HI更敏感。但該方法首先需要對毒力進行測定,低劑量不能引起細胞病變,花費的時間長,對細胞培養和細胞病變結果的判定要求較高,不適用于基層診斷。
6.2.3 酶聯免疫吸附試驗
姜永厚[10]等人建立了從胎豬臟器中檢測PPV抗原的酶聯免疫吸附試驗(ELISA)雙抗體夾心法,該方法與豬瘟病毒、乙腦病毒無交叉反應,具有較高特異性。同時還將ELISA與HA的敏感性進行比較,結果表明ELISA可以檢出稀釋度為10-4~10-10的培養物,而HA在稀釋度為10-7~10-8時檢不出現血凝活性,ELISA的敏感性比HA高100倍,而且檢測時間比HA短,對54份自然感染樣品的檢測結果ELISA的陽性檢出率是59.3%,HA是31.5%。雙抗體夾心ELISA操作簡便、敏感、特異,用于快速診斷,便于基層使用。冉旭華等[11]初步建立了檢測PPV抗體的PPV-NS1-ELISA方法,與豬圓環病毒、偽狂犬病病毒、豬繁殖與呼吸綜合癥無交叉反應,表明特異性高。與Western-blot比較,二者符合率是87.4%。采用HI和PPVNS1-ELISA方法對256份血清檢測,其中有73份ELISA檢測結果為陰性,而HI為陽性。與PPVELISA抗體試劑盒比較,該方法檢出的陽性率高6%,二者的符合率是94%,表明該方法的敏感性高。同時還可以區分滅活疫苗免疫豬和自然感染豬。付利之[12]等人建立了間接斑點辣根過氧化物酶標記葡萄球菌A蛋白免疫試驗(間接Dot-PPAELISA)用來檢測PPPV抗體。該方法特異性強,不與偽狂犬病病毒、豬瘟病毒、豬乙型腦炎病毒發生交叉反應。與HI相比間接Dot-PPA-ELISA檢測抗體效價最高時1∶4096,而HI檢測抗體最高效價是1∶1024,證明該方法的靈敏度高于HI。
6.2.4 免疫熒光技術
該方法包括直接免疫熒光技術和間接免疫熒光技術。直接熒光抗體技術是將熒光色素標記在抗體上與相應的抗原反應,在熒光顯微鏡下觀察特異性熒光反應,但PPV較小,使檢出率較低。蕫齊等[13]建立了間接免疫熒光技術,先是PPV高免血清與PPV抗原反應,再加熒光標記的二抗,熒光顯微鏡下觀察。該方法與豬偽狂犬病毒、豬傳染性胃腸炎病毒、豬流行性腹瀉病毒、豬輪狀病毒不發生交叉反應,特異性強。對PPV人工感染豬7頭胎兒的肝、肺、腎冰凍切片均檢出了特異性熒光陽性細胞,敏感性強,檢出率高,耗時短。但該方法需利用熒光顯微鏡等精密儀器,對操作人員要求高,所以只適用于實驗室診斷,不適合基層運用。
6.2.5 乳膠凝集試驗
何啟蓋等[14]建立了乳膠凝集試驗(LAT),并與HI試驗檢測了203份豬血清,二者陽性符合率是93.1%,差異不顯著。該方法可用于對大量血樣進行血凝抑制試驗前的初選,簡便準確,結果穩定,值得廣大基層推廣。但該方法只能檢測IgM用于PPV定性診斷,不能進行抗體滴度的檢測。
6.3 分子生物學診斷技術
6.3.1 PCR檢測技術
吳淑芳等[15]人建立了PPVPCR檢測方法,能檢測的最小病毒滴度值是0.398,在混合感染組織中檢測的最小滴度值是0.500TCD50的特異性。岳豐雄等[16]人建立了檢測多種病毒的多重PCR技術,最低檢測量為8.64×10-3μg,具有良好的敏感性和特異性。熒光定量PCR是一種比常規PCR敏感性更高、特異性更強、快速的診斷技術,宋傳敏等建立了SYBRGreenⅠ熒光定量PCR,靈敏度可達1.0×102拷貝/μL,對10份疑似病料進行檢測,發現10份均為熒光定量PCR,而常規PCR檢出7份陽性。
6.3.2 核酸探針技術
核酸探針技術具有快速、敏感、特異性強等特點,適用于疾病的早期診斷和類癥鑒別診斷。Krell等首先將核酸探針技術應用于PPV的診斷,侯喜林等[17]利用地高辛標記的PUP重組質粒探針,對PPV培養物的DNA進行斑點雜交檢測PPV,結果表明地高辛標記與32P標記探針有相同的敏感性,同時克服了生物素標記探針敏感性差、背景深的不足。與HA試驗比較,兩者檢測結果基本一致,但該方法對操作技術要求高,只適合實驗室檢測。
6.3.3 單克隆抗體技術
國外1984年就研制出PPV單克隆抗體應用于臨床診斷,目前國內已制備出了PPVNADL-2和PPV7909株的單克隆抗體。謝琴等[18]人研制出了抗豬細小病毒單克隆抗體,與ELISA結合對308份豬血清進行檢測,陽性檢出率達66.6%,與HI試驗相比,敏感性更高,陽性檢出率比HI高出5.7個百分點。謝紅玲等制備了抗PPV單克隆抗體細胞株15株,該單抗不與豬圓環病毒、豬偽狂犬病毒、豬繁殖與呼吸綜合征病毒發生交叉反應,特異性極強。單克隆抗體的成本高,制備復雜,限制了其在基層的使用,只能用于實驗室診斷。
6.3.4 基因芯片技術
王溫田等[19]人克隆豬細小病毒基因保守序列作為探針固定到硝酸纖維素膜上,制備了診斷基因芯片,對樣品的檢測結果表明該方法有良好的特異性和重復性。符芳等[20]建立了針對5種豬病病毒的基因芯片,能特異性的檢測出5種病毒,敏感性優于多重PCR,同時檢測的病毒種類比熒光定量PCR多。
7 疫苗防治
豬細小病毒主要引起母豬流產、不孕、死胎、畸形胎、木乃伊胎及弱仔等。但帶毒母豬臨床表現不明顯,血清學調查表明PPV感染在豬群中普遍存在,給養豬業造成重大損失。目前能有效預防豬細小病毒還沒有其他方法,只能通過使用疫苗進行免疫預防。豬細小病毒疫苗主要分為滅活疫苗、弱毒疫苗、基因工程亞單位疫苗、基因工程活病毒載體疫苗、基因疫苗等。
7.1 滅活疫苗
滅活疫苗是一種傳統疫苗,具有安全性好,誘導產生抗體時間長,不需要低溫保存等優點。中國農業科學院哈爾濱獸醫研究所的科研人員,經過幾年的努力,研制成豬細小病毒氫氧化鋁滅活疫苗。該產品是以豬細小病毒PKZ株接種新生仔豬腎原代細胞培養增殖,收獲的毒液滅活后,再加入一定比例的氫氧化鋁佐劑而制成的。此產品可用于初產母豬和種公豬的免疫接種,預防豬細小病毒感染。該產品已用100余萬頭份,證明安全有效,受到用戶歡迎和好評。張超范等[21]對豬細小病毒滅活疫苗安全性及佐劑的篩選進行試驗,對2種滅活劑滅活的病毒液分別用3種佐劑制備10種滅活疫苗,然后分別對動物進行免疫效果對比試驗。初步確認甲醛滅活的病毒液與佐劑ISA15AVG的組合為PPV滅活疫苗的最佳滅活劑和佐劑組合。Joo等應用β-丙內酯和福爾馬林滅活PPV研制出凝膠佐劑PPV滅活疫苗;Mengeling等用乙酰二甲亞胺滅活PPV制成的滅活疫苗;Mengeling等用PPV、偽狂犬病病毒二聯滅活疫苗,免疫豬都有良好的效果。但是滅活疫苗產生抗體慢,不能誘導細胞免疫反應,抗體水平相對活疫苗較低,需重復接種,使用劑量大,費用較高,免疫效果不穩定。
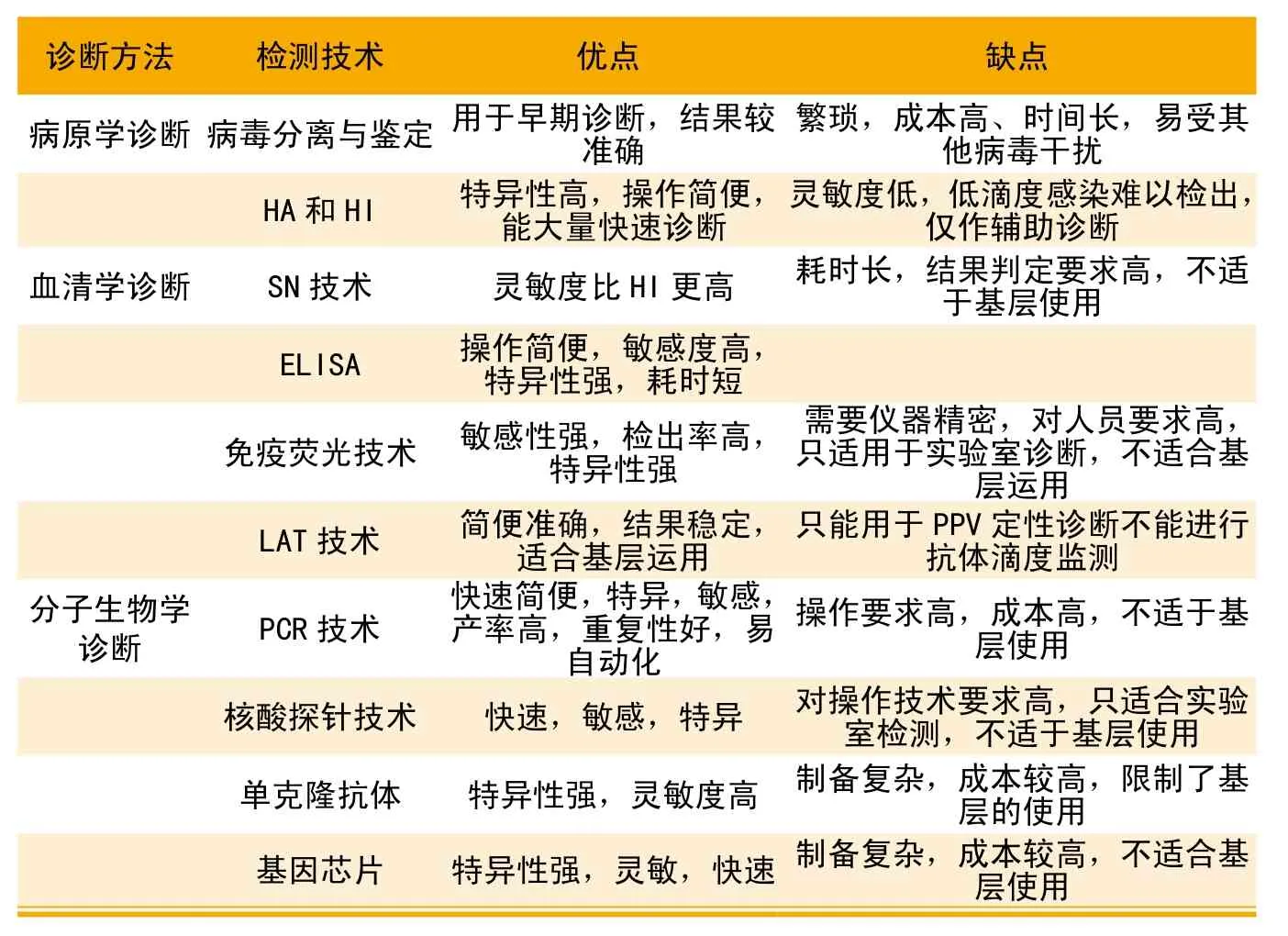
表4 各種診斷方法的優劣比較
7.2 弱毒苗
弱毒疫苗免疫力較強,能同時誘導細胞和體液免疫反應。產生抗體快,用量少,成本低。目前弱毒疫苗主要是通過強毒株的連續傳代致弱而制的。白安斌等[22]研制出能預防該病感染的豬細小病毒N株弱毒疫苗(PPV-N株)并對3個規模化豬場的后備母豬進行田間試驗,結果表明1579頭免疫豬和108頭未免疫豬(對照)產仔成績,平均每窩免疫豬比對照豬多產活仔3.95頭,少產死胎、木乃伊胎3.5頭,對照豬死仔占產仔總數43.84%,而試驗豬僅為6%,免疫效果良好。盤寶近也用該弱毒苗進行動物實驗,證明該苗有良好免疫原性和保護性。Fujisaki等得到HT株的弱毒株,并進行免疫實驗,試驗豬無病毒血癥,無病毒排出,不會將病毒傳染給別的豬,但可以維持長時間的PPV抗體。雖然弱毒苗在預防PPV中發揮重要作用,但有些弱毒苗還存在安全性問題,即毒力反強產生不良影響。由于PPV具有獨特的生物學特性,目前已研制開發并成為商品化生產的PPV弱毒疫苗還非常少。
7.3 基因工程亞單位疫苗及活病毒載體疫苗
基因工程亞單位苗是在受體中高效表達某種特定蛋白質,然后提取所表達的特定多肽,加入佐劑制成的一種新型疫苗。病毒活載體疫苗是將異源性病毒的保護性抗原基因及啟動子序列插入到作為載體的另一種病毒如弱毒疫苗株的基因組非必需區中而構建的疫苗,可達到1針防2病或多病目的。目前有的將PPVVP2基因克隆到原核表達載體上表達蛋白如司艷紅等;也可以克隆到真核表達載體上,如范京惠等[23]構建了同時含有PPVVP2基因和CSFV特異性T細胞表位基因的重組桿狀病毒,并在昆蟲細胞中得到了高效表達。QHong等應用偽狂犬病毒基因缺失株TK-/gE-/LacZ+作為一個活病毒載體成功重組出可預防豬的偽狂犬病、口蹄疫、細小病毒病的新型三聯疫苗的候選毒株。亞單位疫苗不含感染性組分,因而無需滅活,也無致病性,免疫原性好,但技術要求高,成本昂貴,難以在臨床上推廣應用。活病毒載體疫苗與弱毒疫苗相似,能誘導強而持久的免疫反應,而且改造過的活病毒疫苗其安全性較傳統弱毒疫苗大為提高。但其生產技術復雜,成本較高,還處于實驗室研究階段。
7.4 核酸疫苗
核酸疫苗是將編碼病毒保護性抗原基因克隆到真核表達質粒直接注射到動物體內,合成抗原蛋白,誘導宿主產生保護性免疫應答。魏戰勇等[24]成功將PPVVP2基因克隆至pCI-neo真核表達載體中并轉染PK-15細胞中,并以小鼠為模型進行免疫,經檢測1周后能誘導機體產生抗體,4周時達到最大,能誘導產生細胞免疫和體液免疫。基因疫苗以其成分單一、易于構建、生產工藝簡單、免疫劑量小、成本低廉、免疫原性好、可構建多基因或多價疫苗。但是構建的核酸載體可能面臨以下問題:是否與宿主的染色體發生整合,改變宿主的基因;載體本身是否會產生免疫應答;是否會誘發癌癥等。
由于目前對PPV的防治只能是通過疫苗預防,所以選擇合適的PPV疫苗對養豬業來說是非常重要的。隨著人們對本病研究的不斷深入以及生物學技術的飛速發展,將來會有更多的疫苗用于對PPV的防治。現將目前研究的各種疫苗的優缺點列出,以便選擇使用(見表5)。

表5 不同疫苗優缺點比較
8 問題與展望
近年來,隨著高致病性豬繁殖與呼吸綜合征病毒(PRRSV)以及2型豬圓環病毒(PCV2)的出現,二者逐漸被視為引起大范圍母豬繁殖障礙和仔豬死亡的主要原因,而對PPV感染的危害性估計不足,相關調查發現,PPV和PRRSV、PCV2混合感染的現象非常普遍,仍然是引起繁殖障礙的重要原因。PPV的早期研究主要集中在病原、理化性質與防治方面,隨后在分子水平上明確了病毒基因組的一級結構、轉錄與翻譯圖譜,但實際研究中仍然存在著許多問題。
1)由于缺少前期的基礎研究,現階段的PPV研究中,無法深入地探究病毒各個基因和蛋白的功能,不能明確病毒與宿主、細胞的相互作用機制,無法從基因角度區分毒株致病力的強弱、改造毒力基因,因此構建PPV的感染性克隆,從分子生物學角度探究PPV的相關情況將成為PPV研究的重要內容;
2)病毒的致病機理研究尚停留在理論分析上,對于為什么引起死胎、畸形胎、木乃伊胎、流產及病弱仔豬,對母豬有無影響等一系列問題都有待于試驗的探索與驗證;
3)宿主的免疫機制、混合感染的協同作用機制等方面了解還不深入,有待進一步的研究。
[1]崔尚金,苗嵐飛.豬細小病毒病流行的新特點、流行趨勢與防控對策[J].養豬,2008(6):65-68.
[2]MayrA,BachmanPA.CharacterizationofaamallporcineDNAvirus[J].ArchGesamteVirusforsh,1968,25(l):38-51.
[3]賈赟,蘆銀華,張素芳,等.豬圓環病毒2型、豬繁殖與呼吸綜合征病毒及豬細小病毒混合感染的流行病學調查[J].中國病毒學,2004,19(5):467-470.
[4]黃夏,陳義祥,何丹,等.廣西豬細小病毒與PRRSV、CSFV、PCV2、PRV混合感染的檢測[J].廣西畜牧獸醫,2007,23(2):54-56.
[5]KrakowkaS,AllanGM,EllisJ,etal.Experimentalinfectionofcolostrumsdeprivedpigletswithporcinecircovirus2andporcinereproductiveandrespiratorysyndromeviruspotentiatesPCV2replication[J].VetPathol,2000,37:254-263.
[6]崔立,姚從斌,蘆銀華,等.豬圓環病毒2型、豬繁殖與呼吸綜合征病毒豬細小病毒混合感染的流行病學調查[J].上海交通大學學報,2006,24(4):330-334.
[7]BergeronJ.IdentificationoftheallotropicdeterminantandcomparisonwiththoseofNADL-2andfieldisolates[J].JVirol,1996,70(4):2508-2515.
[8]李永江,郭雪靖,武曉東.豬細小病毒血凝試驗的幾點體會[J].畜牧獸醫科技信息,2006,31.
[9]JooHS,DonaldsonWoodCR,JohnsonRH.Amicroneutralizationtestfortheassayofporcineparvovirusantibody[J].ArchVirol,1975,47(4):337-341.
[10]姜永厚,孫宗禹,劉文周,等.應用ELISA雙抗體夾心法檢測豬細小病毒抗原的研究[J].黑龍江畜牧獸醫,1997(04):1-3.
[11]冉旭華,聞曉波,孟凡,等.豬細小病毒NS1蛋白主要抗原表位區的原核表達及間接ELISA方法的建立[J].中國預防獸醫學報,2009,29(8):964-968.
[12]付利芝.間接Dot-PPV-ELISA檢測豬細小病毒抗體的研究[D].四川:四川農業大學,2001.
[13]蕫齊,韓孝成,王潤芝.應用間接免疫熒光技術快速檢測豬細小病毒抗原[J].中國預防獸醫學報,1999,21(1):56-59.
[14]何啟蓋,陳煥春,吳斌,等.檢測豬細小病毒血清抗體乳膠凝集試驗方法的建立及初步應用[J].中國預防獸醫學報,1999,21(6):457-459.
[15]吳淑芳,付瑞,邢瑞昌,等.豬細小病毒PCR檢測方法的建立與應用[J].中國生物制品學雜志,2007,20(4):292-295.
[16]岳豐雄,等.多重PCR方法用于檢測豬圓環病毒2型、豬細小病毒、豬偽狂犬病病毒、豬繁殖與呼吸綜合征病毒診斷方法的建立[J].養豬,2010(3):41-44.
[17]侯喜林,甘孟侯,余麗蕓.應用地高辛探針診斷豬細小病毒病[J].中國獸醫科技,1998,28(10):11-13.
[18]謝紅玲,等.抗豬細小病毒單克隆抗體雜交瘤細胞株的制備及鑒定[J].中國預防獸醫學報,2009,31(10):813-815.
[19]王溫田,田振宇,徐守振.豬瘟病毒和豬細小病毒檢測基因芯片的構建[J].中國動物檢疫,2009,26(10):36-37.[20]符芳,楊玉菊,陳微晶,等.五種重要豬病病毒基因芯片探針的建立及其應用[J].中國獸醫科學,2010,40(5):501-505.
[21]張超范,等,豬細小病毒滅活疫苗安全性試驗及佐劑的篩選[J],中國預防獸醫學報,2009,31(6):462-465.
[22]白安斌,杜堅,姚瑞英,等.豬細小病毒N株弱毒苗田間試驗[J],廣西畜牧獸醫,2006,22(6):248-250.
[23]范京惠,左玉柱,王玉玲,等.豬瘟病毒T細胞表位與豬細小病毒VP2融合基因在重組桿狀病毒中的表達[J].中國獸醫科學,2007,37(8):661-665.
[24]魏戰勇,王學斌,崔保安,等,豬細小病毒核酸疫苗的構建及其對小鼠免疫原性的研究[J].中國生物工程雜志,2006,26(12):63-67.

