補陽還五湯對血管性癡呆大鼠學習記憶功能及海馬組織ERK2與CaMKⅡβ蛋白表達的影響*
唐敬龍, 高維娟, 李玉明, 錢濤, 張泓波, 李君, 謝志
(承德醫學院病理生理學教研室,河北 承德 067000)
大腦對缺血缺氧十分敏感,其中反復腦缺血再灌注損傷和長期慢性低灌流是引發血管性癡呆(vascular dementia,VD)的主要原因。而海馬CA1區被認為是學習記憶等高級神經活動的重要部位,是腦缺血最敏感的區域之一,故腦海馬CA1區常被用來作為缺血缺氧損傷研究的模型[1]。在缺血性腦血管疾病的發生發展過程中,細胞外信號調節激酶2(extracellular signal-regulated kinase,ERK2)能調控海馬神經元的生長、發育、分化,參與海馬神經元的可塑性;鈣/鈣調素依賴性蛋白激酶Ⅱβ(calcium/calmodulin-dependent protein kinaseⅡβ,CaMKⅡβ)蛋白則參與突觸構建過程,增強長時程增強效應(long-term potentiation,LTP),促進學習記憶的恢復。益氣活血中藥補陽還五湯是中醫治療腦缺血再灌注損傷的經典方劑,已經證實其有顯著的抗VD作用[2],但其分子機制尚未闡明,本實驗通過觀察補陽還五湯對VD大鼠CA1區ERK2與CaMKⅡβ蛋白表達的影響,探討補陽還五湯對VD大鼠學習記憶的影響及其對海馬神經元保護的分子機制。
材料和方法
1 材料
1.1 試劑儀器 補陽還五湯(由黃芪、當歸尾、芍藥、川芎、桃仁、紅花、地龍組成 )由北京同仁堂醫藥公司承德分公司提供;戊巴比妥鈉為進口分裝;兔來源ERK2、兔來源CaMKⅡβ購自Cell Signaling Technology;兔來源β-actin購自Santa Cruz Biotechnology;羊抗兔IgG購自Proteintech;發光液購自Thermo;Morris水迷宮(Morris Water Maze,MWM)由中國醫學科學院生產。
1.2 實驗動物與分組 成年SD雄性大鼠60只,體重220g±20g,由北京維通利華實驗動物技術有限公司提供,許可證號為SCXK(京)2007-0001,SPF級。通過水迷宮試驗篩選出智力水平相當的大鼠,并隨機分為假手術組、模型組、補陽還五湯組和尼莫地平組(陽性藥物對照),每組15只。
2 方法
2.1 VD動物模型制備 采用改良的Pulsinelli’s 4血管阻斷 (four-vessel occlusion,4VO)方法制備VD動物模型[3]:大鼠于術前12 h禁食,4 h禁水,戊巴比妥鈉(45-50 mg/kg)腹腔注射麻醉。將大鼠伏臥固定于固定臺上,行背側頸正中切口,逐層鈍性分離暴露雙側第1頸椎橫突翼小孔,用直徑0.5 mm的電凝針燒灼雙側翼小孔內的椎動脈,造成永久性閉塞。24 h后再將大鼠麻醉,仰臥固定,行腹側頸正中切口,鈍性分離雙側頸總動脈,以“4”號絲線穿線牽拉頸總動脈,用微動脈夾夾閉雙側頸總動脈5 min,共夾閉3次,每次間隔1 h。假手術組只做皮膚切口和組織分離處理,不進行椎動脈燒灼和頸總動脈夾閉,皮膚縫合后正常飼養。模型組大鼠造模后自然飼養;補陽還五湯組和尼莫地平組大鼠按上述方法造模后分別灌服補陽還五湯(50 g·kg-1·d-1)和尼莫地平(20 mg·kg-1·d-1),持續灌服 30 d。
2.2 大鼠行為學檢測 采用Morris水迷宮法進行大鼠學習記憶功能的測定。(1)定位航行實驗(place navigation)分別在術后7 d、14 d、28 d將大鼠從標記的4個入水點依次朝向池壁輕輕放入水中,記錄其在90 s內尋找到并爬上平臺的搜索持續時間即逃避潛伏期(escape latency,EL)。若大鼠90s內尚未找到平臺,則將其引導至平臺停留15 s,放回籠中。取3 d的平均成績作為測試的成績。(2)空間探索實驗(space navigation)定位航行結束后撤除平臺,讓大鼠在水池中游90 s來尋找平臺,記錄大鼠90 s內跨越平臺次數,取3 d的平均成績作為測試的成績。
2.3 取材、固定、HE染色 術后第30 d,水迷宮實驗結束后,每組取5只大鼠用戊巴比妥鈉(45-50 mg/kg)腹腔注射麻醉大鼠后仰臥固定,快速開胸,暴露心臟,直視下左心室插管入升主動脈,剪開右心耳,以生理鹽水約500 mL經升主動脈灌注沖洗后,再灌注4%多聚甲醛溶液(pH7.4)500 mL,持續2 h后開顱取腦,并將腦組織置于4℃4%多聚甲醛中浸置4-6 h后,截取視交叉至大腦橫裂的部分,PBS漂洗3次,每次1 h,4℃冰箱過夜,將固定好的腦組織予以常規脫水,透明,浸蠟,包埋,連續冠狀切片,片厚4 μm,用于HE染色。染色方法:石蠟切片常規用二甲苯脫蠟,經逐級乙醇脫水后,蘇木素、伊紅染色,中性樹膠封片。
2.4 海馬CA1區神經元計數 HE切片采用Mivnt圖像分析軟件系統進行拍照。顯微鏡觀察海馬CA1區神經元并進行計數,每張切片選6個不同子午線方向視野行各層細胞計數,取其平均值。
2.5 ERK2與CaMKⅡβ蛋白的檢測 術后第30 d,水迷宮實驗結束后,每組取10只大鼠用戊巴比妥鈉(45-50 mg/kg)麻醉,取海馬放入液氮,于立體鏡下切除CA1之后轉存到-70℃冰箱中。待所有標本收集完畢后將樣品立即放到4℃預冷的勻漿器中,先用PBS勻漿至清澈,棄上清,加裂解緩沖液中,裂解40 min。之后12000 r/min離心15 min取上清液分裝。用BCA試劑盒測定蛋白質含量。將提取蛋白樣品加入等體積的2×loading buffer混勻,在100℃沸水中煮3 min,變性,-80℃保存,備用。以12%SDS聚丙烯酰胺凝膠電泳分離蛋白質,ERK2蛋白按每孔蛋白上樣量為30 μg,CaMKⅡβ蛋白按每孔蛋白上樣量為50 μg按積層膠80 V,分離膠120 V條件(恒壓)進行電泳,直至溴酚藍移動至膠底部終止電泳。轉膜前先用甲醇激活PVDF膜(1 min),按陰極近膠、陽極近膜的位置準備好轉膜裝置,4℃條件下300 mA(恒流)轉膜2.5 h,將凝膠上的蛋白質轉移到PVDF膜上。轉膜結束后,用5%TBST脫脂奶粉封閉液封閉PVDF膜2 h,后加入兔抗ERK2多克隆抗體(1∶1000稀釋)、CaMKⅡβ多克隆抗體(1∶1000稀釋)、β -actin(1∶600稀釋)4℃ 過夜。TBST洗3次,15 min×1次,10 min×2次,Ⅱ抗用生物素標記羊抗兔 IgG(1∶2000稀釋)孵育1 h,TBST洗3次,5 min×3次,經ECL發光試劑盒顯影,X射線底片曝光。以β-actin為內參照。實驗重復6次。將蛋白印跡顯影圖像掃描。用Quantity One分析軟件進行半定量分析,將ERK2與CaMKⅡβ蛋白灰度值與內參照β-actin灰度值比較,所得比值表示各組樣品ERK2與CaMKⅡβ蛋白的表達水平。
3 統計學處理
結 果
1 補陽還五湯對大鼠水迷宮逃避潛伏期的影響
假手術組大鼠在術后7 d、14 d、28 d的逃逸潛伏期分別為(26.65±1.23)s、(12.96 ±1.13)s、(8.44±1.10)s;與之比較,模型組大鼠在各個時點的逃逸潛伏期[(63.57 ±2.14)s、(59.45 ±2.01)s、(54.25 ±1.83)s]均明顯延長(P<0.05);與模型組相比,補陽還五湯組[(38.62 ±2.07)s、(21.36 ±1.23)s、(12.91±1.31)s]和尼莫地平組[(40.11 ±2.04)s、(22.58 ±1.65)s、(13.63 ±1.46)s]在術后第 7 d、14 d、28 d逃避潛伏期均顯著縮短(P<0.05);補陽還五湯組和尼莫地平組相比,大鼠在術后各個時點逃避潛伏期均無明顯區別(P>0.05),見圖1。
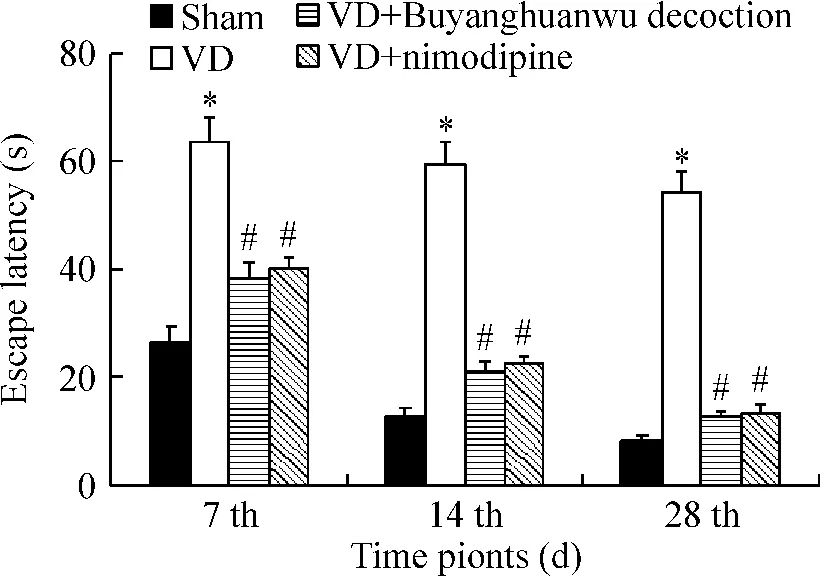
Figure 1.The effect of Buyinghuanwu decoction on the escape latency of rats in Morris water maze at different time points..n=15.*P<0.05 vs sham group;#P<0.05 vs VD group.圖1 補陽還五湯對大鼠水迷宮逃避潛伏期的影響
2 補陽還五湯對大鼠水迷宮跨越平臺次數的影響
假手術組大鼠在術后第7 d、14 d、28 d跨越平臺次數在90s內分別為(7.94±0.72)次、(12.83±0.80)次、(15.89±0.82)次;與之相比,模型組大鼠在各個時點的跨越平臺次數[(3.13±0.28)次、(5.62±0.33)次、(6.33±0.48)次]均顯著減少(P<0.05);與模型組相比,補陽還五湯組[(6.75±0.61)次、(11.55±0.69)次、(14.92±0.72)次]和尼莫地平組[(6.42±0.58)次、(10.63±0.69)次、(13.71±0.70)次]在術后第 7 d、14 d、28 d跨越平臺次數均顯著增多(P<0.05);補陽還五湯組和尼莫地平組相比,大鼠在術后各個時點跨越平臺次數均無明顯區別(P>0.05),見圖2。

Figure 2.The effect of Buyanghuanwu decoction on times of striding over platform of rats in Morris water maze at different time points..n=15.*P<0.05 vs sham group;#P <0.05 vs VD group.圖2 補陽還五湯對大鼠水迷宮跨越平臺次數的影響
3 補陽還五湯對大鼠海馬CA1區神經元形態的影響
術后30d,假手術組表現為正常組織形態,海馬CA1區神經元排列整齊,均勻,細胞結構完整,見圖3A;而模型組CA1區海馬神經細胞排列欠規則,界限不清楚,正常細胞結構消失,胞核區域濃染,出現凝固性壞死,細胞脫失明顯,見圖3B;補陽還五湯組及尼莫地平組大部分海馬神經元細胞接近正常,核膜輪廓清晰,核仁清楚,排列規則,見圖3C、D。
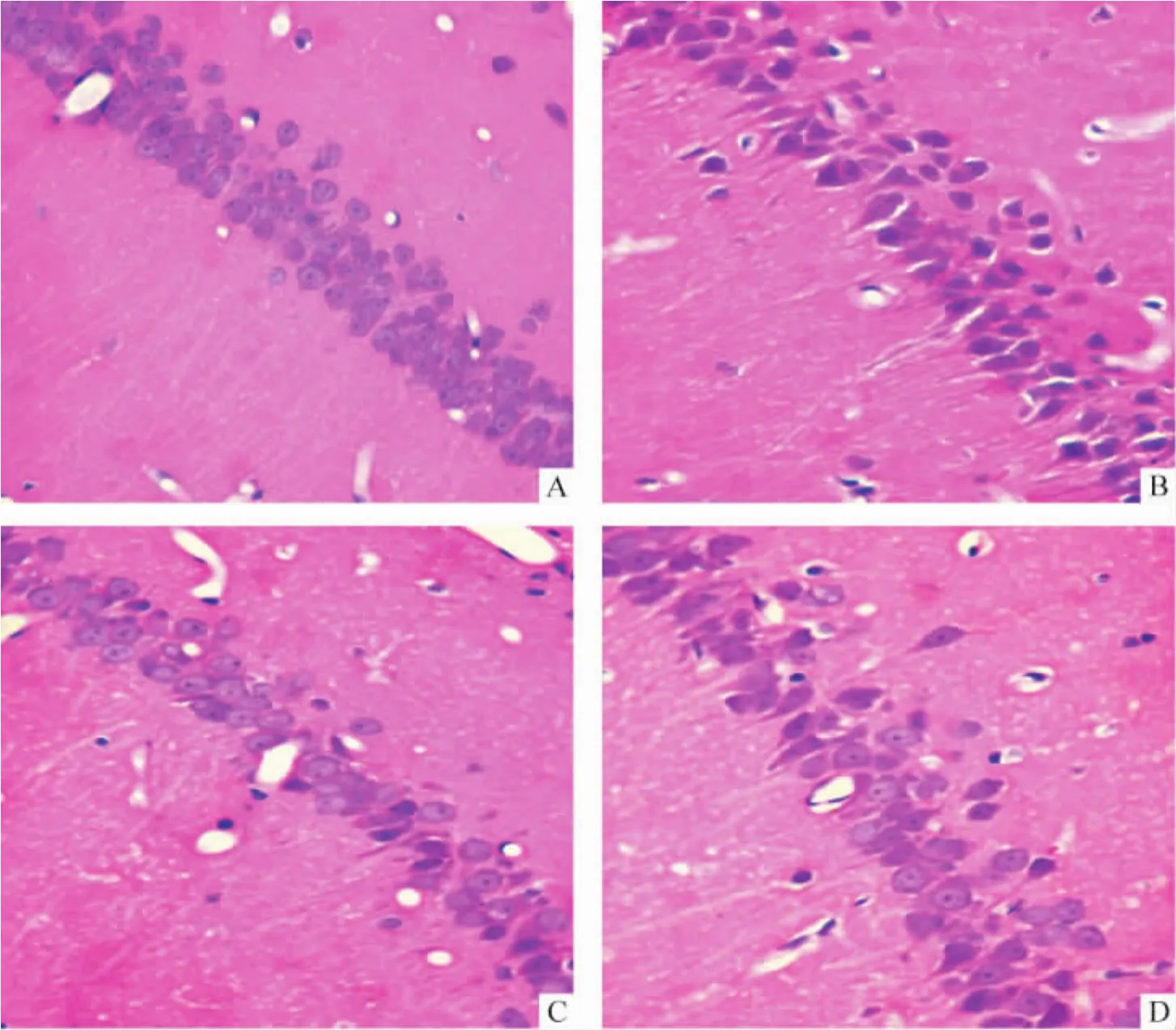
Figure 3.The effect of Buyanghuanwu decoction on morphological changes in hippocampal CA1 of rats 30 d after operation(×400).A:sham group,the neurons were in neat rows,integral structure;B:model group,cells showed irregular arrangement,coagulation necrosis and obvious deletion;C:VD+Buyanghuanwu decoction group,the neurons were in neat rows,integral structure and close to those in sham group;D:VD+nimodipine group,the neurons were in neat rows,integral structure and close to those in sham group.圖3 術后30 d補陽還五湯對大鼠海馬CA1區形態學的影響
4 補陽還五湯對大鼠海馬CA1區神經元數目的影響
術后30 d,進行細胞計數顯示:與假手術組(48.56±3.23)比較,模型組大鼠海馬神經元數目(16.33±1.08)明顯減少(P<0.05);補陽還五湯組(45.92±3.06)和尼莫地平組(43.19±2.87)大鼠海馬神經元數目明顯多于模型組(P<0.05);補陽還五湯組與尼莫地平組比較無明顯差別(P>0.05),見圖4。
5 補陽還五湯對大鼠海馬組織神經元胞漿蛋白ERK2表達的影響
術后30 d,對蛋白條帶平均灰度值進行分析結果顯示:與假手術組(1.01±0.09)比較,模型組(0.53±0.07)大鼠海馬ERK2蛋白在術后28 d表達顯著減少(P<0.05),而補陽還五湯組(0.99±0.08)和尼莫地平組(0.93±0.08)ERK2蛋白的表達則明顯高于模型組(P<0.05),且補陽還五湯組和尼莫地平組相比,蛋白表達無顯著差異(P>0.05),見圖5。
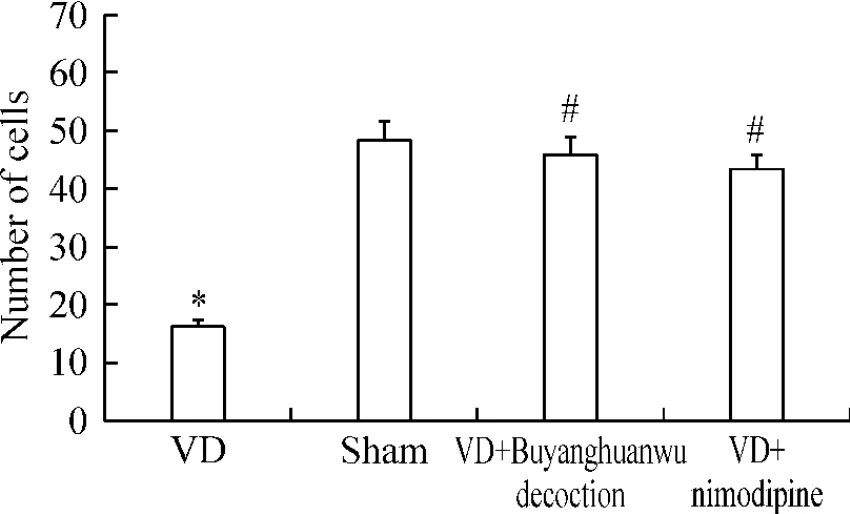
Figure 4.The effect of Buyanghuanwu decoction on the numbers of hippocampal CA1 neurons of rats 30 d after operation..n=5.*P<0.05 vs sham group;#P<0.05 vs VD group.圖4 術后30 d補陽還五湯對大鼠海馬CA1區神經元數目的影響

Figure 5.The effect of Buyanghuanwu decoction on the expression of ERK2 in hippocampal CA1 neurons of rats 30 d after operation.A:VD group;B:VD+nimodipine group;C:VD+Buyanghuanwu decoction;D:sham group..n=10.*P<0.05 vs sham group;#P<0.05 vs VD group.圖5 術后30 d補陽還五湯對大鼠海馬組織神經元ERK2蛋白表達的影響
6 補陽還五湯對大鼠海馬組織神經元CaMKⅡβ蛋白表達的影響
術后30 d,對蛋白條帶平均灰度值進行分析結果顯示:與假手術組(1.12±0.04)比較,模型組(0.56±0.03)大鼠海馬CaMKⅡβ蛋白在術后28 d表達顯著減少(P<0.05),而補陽還五湯組(1.01±0.04)和尼莫地平組(1.00±0.05)CaMKⅡβ蛋白的表達則明顯高于模型組(P<0.05),補陽還五湯組和尼莫地平組相比,CaMKⅡβ蛋白表達無顯著差異(P>0.05),見圖6。
討 論
VD是由腦血管疾病所致的智能及認知功能障礙臨床綜合征。最終導致神經細胞損傷、學習記憶能力下降。ERK2是細胞內絲氨酸/蘇氨酸蛋白激酶,調控神經細胞的生長、分化和損傷修復[4],保護受損神經元。VD還與CaMKⅡβ密切相關,Okamoto等[5]發現 CaMKⅡβ亞基的285-542和344-542氨基酸位點突變導致其蛋白激酶活性喪失,從而影響信號通路轉導,造成突觸構建障礙。
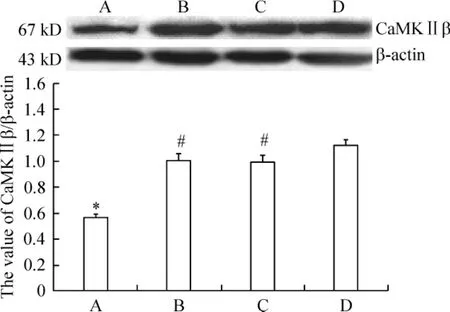
Figure 6.The effect of Buyanghuanwu decoction on the expression of CaMKⅡβ in hippocampal CA1 neurons of rats 30 d after operation.A:VD group;B:VD+nimodipine group:C:VD+Buyanghuanwu decoction;D:sham group..n=10.*P<0.05 vs sham group;#P<0.05 vs VD group.圖6 術后30 d補陽還五湯對大鼠海馬組織神經元CaMKⅡβ蛋白表達的影響
近年來,國內進行了大量的實驗研究,證實益氣活血中藥有顯著的抗VD作用[6-9]。而補陽還五湯是益氣活血中藥中的經典方劑,由黃芪、當歸尾、芍藥、川芎、桃仁、紅花、地龍組成,本方重用黃芪,補益元氣,瘀去絡通,為君藥。實驗證實黃芪有擴張血管、改善微循環等作用[10]。當歸尾活血通絡而不傷血,用為臣藥。赤芍、川芎、桃仁、紅花協同當歸尾以活血化瘀,地龍通經活絡,力專善走,周行全身,以行藥力,亦為佐藥[11]。此外補陽還五湯干預后明顯減低VD大鼠鈣離子通道的開放時間和開放率[12],減輕鈣超載對神經細胞的損傷,改善微循環。尼莫地平是二氫吡啶類鈣離子通道阻滯劑,有解除腦血管痙攣,改善微循環等作用。臨床上可用于治療輕重度VD[13]。本實驗以尼莫地平為陽性對照藥物。
本實驗給予補陽還五湯干預治療后,Morris水迷宮實驗顯示:隨時間的延長各組大鼠的EL均有不同程度的縮短,垮臺次數有不同程度的增多,這與水迷宮訓練次數的增加促進大鼠的學習記憶有關系。但是假手術組大鼠的EL縮短和跨越平臺次數增多較模型組顯著,表明正常大鼠學習、記憶功能較模型組好。此外,VD大鼠的EL縮短幅度與垮臺次數增加幅度小,表明其學習記憶能力隨時間的延長而降低,提示腦損害逐漸加重。HE染色及細胞計數均證實,補陽還五湯對VD大鼠的缺血再灌注損傷有一定的保護作用,改善學習記憶。Western blotting實驗證實,模型組大鼠海馬CA1區ERK2蛋白表達下調,使ERK2與下游轉錄因子(如CREB)結合能力下降,影響下游基因的轉錄、翻譯、合成等水平,使ERK2蛋白總量減少,導致受損細胞因不能被修復而死亡[4]。CaMKⅡβ蛋白表達下調,降低AMPA受體的電導作用,使LTP難以維持[14],同時CaMKⅡβ向突觸后膜移動減少,使突觸構建能力下降,無法激活細胞核內基因表達及新突觸的形成[15],從而使PSD間隙變寬,信息傳遞時間延長,減弱學習記憶能力。
綜上所述,應用促進ERK2與CaMKⅡβ蛋白表達的藥物可能成為治療VD的有效方法之一。本實驗給予補陽還五湯治療30 d后能顯著上調ERK2與CaMKⅡβ蛋白的表達(P<0.05),顯著改善大鼠學習記憶能力,這為治療血管性癡呆提供了新選擇。
[1]Davis RJ.Signal transduction by the JNK group of MAP kinases[J].Cell,2000,103(4):221 -229.
[2]廖春來,佟 麗,沈劍剛.補陽還五湯抗腦缺血的實驗研究進展[J].中國藥物與臨床,2003,3(3):176 -178.
[3]Schmidt- Kastner R,Paschen W,Ophoff BG,et al.A modified four-vessel occlusion model for inducing in complete forebrain ischemia in rats[J].Stroke,1989,20(7):938-646.
[4]Cobb MH.MAP kinase pathways[J].Prog Biophys Mol Biol,1999,71(3-4):479-500.
[5]Okamoto K,Narayanan R,Lee SH,et al.The role of CaMKⅡ as an F-actin-bundling protein crucial for maintenance of dendritic spine structure[J].PNAS,2007,104(15):6418-6423.
[6]Gao WJ,Xue JF.Effect of cerebral ischemia-reperfusion injury on choline acetyltransferase activity related to study and memory in rat hippocampal tissue[J].Chinese Jour-nal of Clinical Rehabilitation,2005,9(24):242 -243.
[7]高維娟,錢 濤,叢 斌,等.益腎降濁湯對小鼠腦缺血再灌注后細胞能荷的影響[J].中國老年學雜志,2005,25(3):12 -13.
[8]高維娟,錢 濤,叢 斌.益腎降濁湯對腦缺血再灌注大鼠海馬EAA含量的影響[J].中西醫結合心腦血管病雜志,2003,1(6):319 -321.
[9]高維娟,錢 濤,叢 斌.益腎降濁湯對腦缺血再灌注大鼠海馬NE、5-HT含量的影響[J].中國藥理學通報,2003,19(5):587 -589.
[10]葉冬青,高維娟,閆鳳霞,等.黃芪注射液抑制缺氧缺糖/復氧復糖大鼠海馬神經元 JNK3 mRNA的表達[J].中國病理生理雜志,2009,25(9):1756 -1761.
[11]陳 冬,楊潔紅.補陽還五湯抗腦缺血作用的研究進展[J].中華中醫藥學刊,2010,28(1):72 -74.
[12]關 莉,閆福曼,張嘵東,等.補陽還五湯對全腦缺血模型大鼠再灌注不同時點皮質神經細胞鈣超載的影響[J].安徽中醫學院學報,2008,27(4):45 -48
[13]Pantoni L,Del Ser T,Soglian AG,et al.Efficacy and safety of nimodipine in subcortical vascular dementia:a randomized placebo - controlled trial[J].Stroke,2005,36(3):619-624.
[14]唐敬龍,高維娟.谷氨酸NMDA受體與學習記憶的關系[J].中國老年學雜志,2009,29(18):2408-2410.
[15]Wang Z,Edwards JG,Riley N,et al.Myosin Vb mobilizes recycling endosomes and AMPA receptors for postsynaptic plasticity[J].Cell,2008,135(3):535-548.

