乳酸菌同源重組載體的構建與鑒定
趙學峰,羅麗貞,區云枝
(南方醫科大學附屬南海醫院,廣東佛山 528200)
乳酸菌(lactic-acid bacteria)廣泛存在于人、畜、禽的腸道,能夠調節機體胃腸道正常菌群生態平衡,提高食物消化率和生物價,降低血清膽固醇,控制機體內毒素、腸道內腐敗菌生長繁殖和腐敗產物的產生,制造營養物質,刺激組織發育,從而對機體的營養狀態、生理功能、細胞感染、藥物效應、毒性反應、免疫反應、腫瘤發生、衰老過程和應急反應等產生作用。目前,已有眾多文獻報道利用乳酸菌作為載體表達外源基因,進行疾病的防治;但傳統的乳酸菌表達載體為保持一定的選擇壓力,大多帶有1個或多個編碼特定抗生素抗性的基因(如紅霉素抗性基因等),存在潛在的抗生素耐藥性播散的危險。
細菌的營養缺陷型是指細菌的某些基因如管家基因編碼的產物催化細菌的基本代謝反應,這些基因突變或缺失后,不能合成相應產物,導致細菌在外界環境中或基本培養基上不能生長,需要補充相應的底物。胸苷酸合成酶(thymidylate synthase,ThyA)基因編碼胸苷酸合成酶,在DNA合成中起關鍵作用,缺失ThyA基因的菌株在基本培養基上不能生長;染色體整合是一種有效的改造微生物的手段,插入序列、轉座子和同源重組是染色體整合的通常形式,其中同源重組的特點是能夠按人們所預期的基因位置進行染色體整合[1-2]。
因此,本研究擬利用細菌營養缺陷型互補和同源重組的原理,構建一個可應用于乳酸菌的同源重組載體。利用該同源重組載體可將目的基因整合于消化道共生乳酸菌染色體中,實現外源基因在乳酸菌中的整合型表達,為構建能高效、安全分泌表達外源目的基因的轉基因乳酸菌奠定基礎。
1 材料與方法
1.1 材料
1.1.1 菌株、質粒、培養基和生長條件
大腸埃希菌 DH5α、乳酸乳球菌 MG1363(Lactococcus lactis MG1363)、質粒 pMUTIN4[3]由本室保存。DH5α 常規培養用LB培養基,37℃振蕩培養;乳酸菌常規培養在GM17培養基(M17培養基,0.5%葡萄糖),30℃靜止培養。氨芐青霉素在E.coli培養中的濃度為 100 μg/ml。
1.1.2 主要試劑和材料
高保真DNA聚合酶、T4 DNA連接酶、DL2000 Marker、限制性內切酶均購自大連Takara公司;M17購自Oxoid公司;質粒抽提試劑盒、DNA純化試劑盒購自Sigma公司;引物委托上海英俊公司合成。其余試劑均為國產分析純。
1.2 方法
1.2.1 L.lactisMG1363基因組DNA的制備及質粒小量提取
參考革蘭陽性菌基因組DNA提取試劑盒說明書進行。主要操作如下:收集適量處于對數生長期的乳酸菌細菌沉淀,加入適量溶菌酶,充分酶解后加入適量無水乙醇混勻,將其全部轉移至柱中。充分洗滌后用洗脫液將吸附在柱子膜上的DNA洗脫,采用紫外分光光度法測定基因組DNA濃度,-80℃保存,備用。
參考質粒小量提取試劑盒說明書提取質粒DNA(堿裂解法)。采用紫外分光光度法測定質粒DNA濃度,-80℃保存,備用。
1.2.2 引物設計及目的基因的PCR擴增
1.2.2.1 引物設計 根據已發表的乳酸菌L.lactis MG1363全基因組中ThyA基因序列[4],用軟件Primer 5.0設計引物并引入相應的酶切位點,用作重組質粒的多克隆位點(表1)。引物委托上海英俊公司合成。
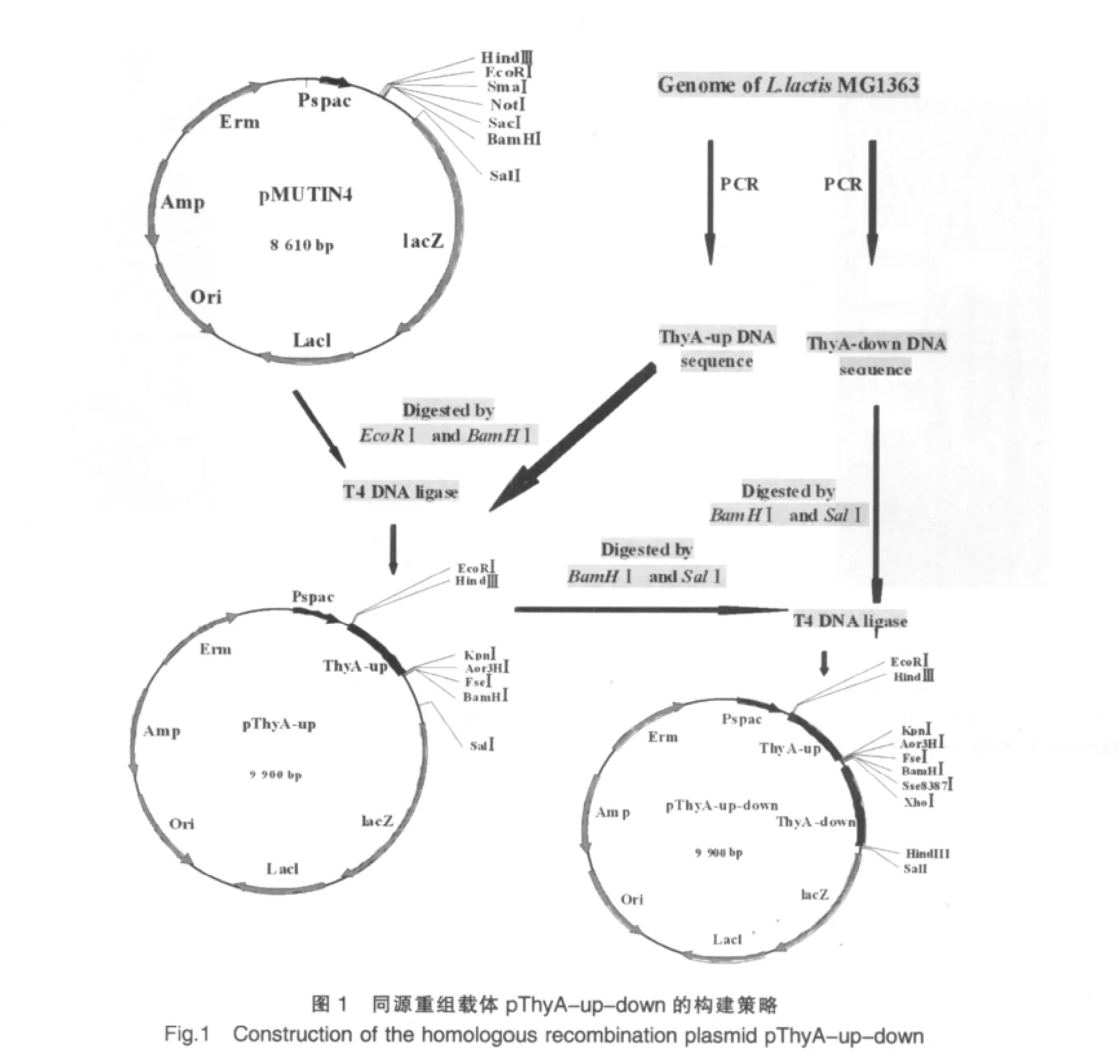
1.2.2.2 ThyA基因ATG上游片段(ThyA-up)的PCR擴增與鑒定 PCR擴增乳酸菌基因組中ThyA基因起始密碼上游1050 bp片斷。PCR反應體系如下:5×PCR PrimerSTAR Buffer(Mg2+plus)10 μl,dNTP Mixture 4 μl,模板 2 μl,引物各1 μl,PrimerSTAR HS DNA Polymerase 0.5 μl, 補水至 50 μl。反應條件如下:98℃預變性 30 s;98℃ 10 s,60℃ 10 s,72℃1 min,共30個循環;72℃延伸5 min。擴增產物用1%瓊脂糖凝膠電泳檢測。膠回收純化目的片段,-80℃保存,備用。
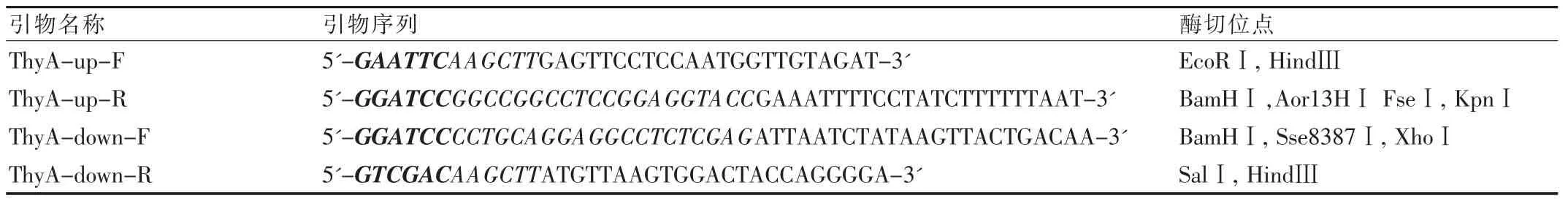
表1 引物序列及其引入的酶切位點Tab.1 The sequences of primers and the introduced restriction enzyme sites
1.2.2.3 ThyA基因終止密碼下游片段(ThyA-down)的PCR擴增與鑒定 PCR擴增乳酸菌基因組中ThyA基因起始密碼下游1010 bp片斷,以ThyA-down-F和ThyA-down-R為引物,PCR反應體系、反應條件同“1.2.2.2”。擴增產物用1%瓊脂糖凝膠電泳檢測。膠回收純化目的片段,-80℃保存,備用。
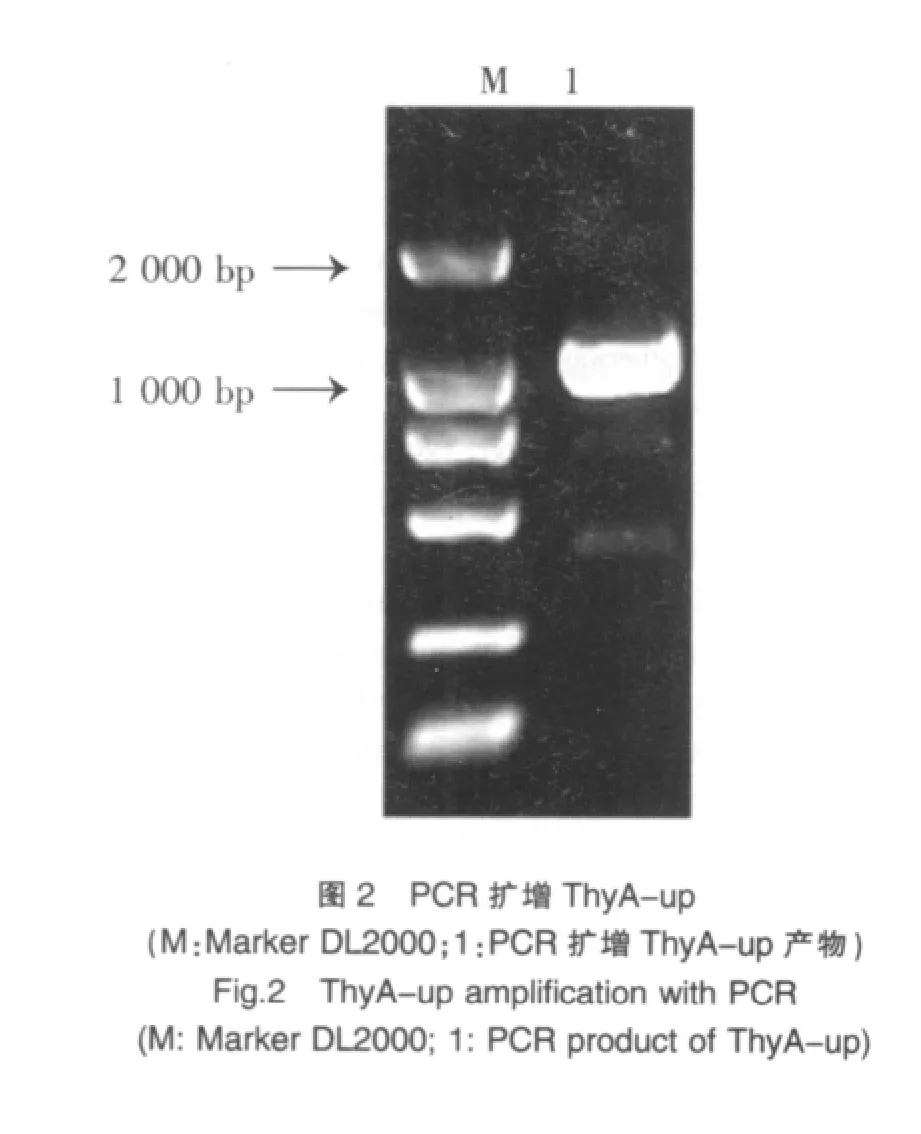
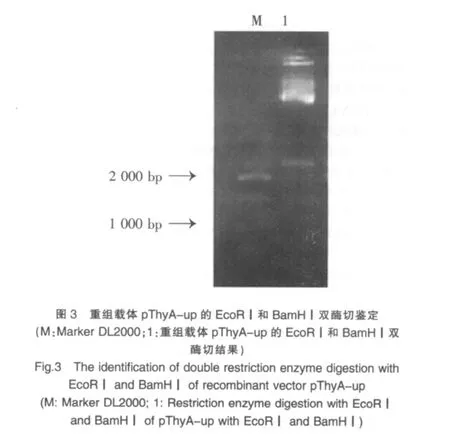
1.2.2.4 同源重組載體的構建策略與鑒定 ①純化后的ThyA-up基因片段與質粒pMUTIN4經EcoRⅠ和BamHⅠ雙酶切后連接,轉化感受態DH5α,涂布于含氨芐青霉素的LB平板,37℃培養。次日挑取單菌落增菌,提取質粒進行EcoRⅠ和BamHⅠ雙酶切鑒定,構建的重組質粒命名為pThyA-up(圖1)。②重組載體pThyA-up和制備好的PCR片斷ThyA-down經BamHⅠ和SalⅠ雙酶切后連接,轉化感受態DH5α,涂布于含氨芐青霉素的LB平板,37℃培養。次日挑取單菌落增菌,提取質粒經BamHⅠ和SalⅠ雙酶切鑒定,構建的重組質粒命名為pThyA-up-down(圖1)。
2 結果
2.1 ThyA-up基因的PCR擴增與鑒定
以乳酸乳球菌基因組為模板,進行PCR擴增,其產物經瓊脂糖凝膠電泳鑒定,產物片段約1050 bp,符合預期片段長度(圖 2)。
2.2 重組載體pThyA-up的酶切鑒定
將PCR產物ThyA-up基因經膠回收純化后克隆到質粒pMUTIN4多克隆位點上,對重組載體進行雙酶切鑒定(圖3)。結果顯示,目的片段ThyA-up已成功連接至質粒pMUTIN4多克隆位點上,表明pThyA-up構建成功。
2.3 ThyA-down基因的PCR擴增與鑒定
以乳酸乳球菌基因組為模板,進行PCR擴增,其產物經瓊脂糖凝膠電泳鑒定,產物片段約1010 bp,符合預期片段長度(圖 4)。
2.4 將PCR產物經膠回收純化后克隆到重組質粒pThyA-up,對重組載體進行雙酶切鑒定(圖5)
結果顯示,ThyA-down基因已成功連接至重組質粒pThyA-up(pThyA-up-down)。將乳酸菌同源重組載體pThyA-up-down進一步測序確證,測序結果顯示與理療序列完全一致(測序圖略),表明乳酸菌同源重組載體pThyA-up-down構建成功。
3 討論
乳酸菌不產生內毒素,表達的外源蛋白無需經過純化可以直接連同菌體一起服用,被公認為是安全級(generally regarded as safe,GRAS)微生物;其外源基因容量大,刺激細胞免疫能力強,并可誘導產生大量的細胞因子,亦是理想的基因治療載體;但無論何種類型的載體都必須帶有1個或多個有效的篩選標記以確保重組子的篩選;但如果這種帶有抗性基因的菌株投放到環境中或人體、動物體內,由于抗性基因有轉移的可能,將為相應抗生素的使用帶來嚴重后果,因此其實際應用必然要受到限制[5]。
由此可見,更安全有效的方法就是將目的基因整合至乳酸菌染色體中,讓其在乳酸菌中持續表達,同時又避免了抗性基因的引入(但可通過細菌營養互補篩選重組菌株)。因此,本研究利用細菌營養缺陷型互補和同源重組的原理,構建了可應用于乳酸菌的同源重組載體pThyA-up-down,其全長9900 bp,包括一個來自大腸埃希菌的復制子ColE1,一個報告基因LacZ以及2個篩選標記(selective marker):來自乳酸菌的ThyA基因和能在乳酸菌中進行抗性篩選的紅霉素基因(當整合完成的同時,紅霉素抗性基因隨之丟失)。此外,目的基因與染色體發生重組是一個隨機過程,重組效率很低,后期陽性克隆的獲得需要大量的篩選工作;而報告基因LacZ的引入,可在培養基上直接挑取藍色菌落進行鑒定,從而提高篩選效率,并大大簡化陽性克隆篩選的過程。
同源重組的特點是能夠按人們所預期的基因位置甚至堿基序列位置進行染色體整合。ThyA是一種廣泛存在于原核、真核細胞中的管家基因。ThyA基因編碼胸苷酸合成酶,在體內DNA合成中起關鍵作用,ThyA基因缺失導致dTMP從頭合成途徑受阻,以至于ThyA缺失株不能在體外環境中生長[6-7]。除非在培養基中添加胸腺嘧啶或胸苷,或導入含有完整ThyA基因野生型序列的互補質粒后,才能使其生存。ThyA基因的上述特點使其成為篩選標志基因。
研究證實,在同源重組的染色體整合中,同源片段越長,整合頻率越高,通常情況下,只要達到300 bp的同源片段的同源重組是完全可以成功的[8]。因此,本研究擴增了L.lactis MG1363染色體ThyA基因起始密碼上游和終止密碼下游各約1000 bp的基因序列作為同源片斷,從而提高外源基因在乳酸菌染色體中的整合效率。同時在引物序列中引入6個酶切位點(KpnⅠ、Aor3HⅠ、FseⅠ、BamHⅠ、Sse8387Ⅰ、XhoⅠ),作為同源重組載體的多克隆位點,可根據研究的需要插入不同目的基因在乳酸菌染色體上進行同源重組。pThyA-updown也可攜帶目的基因在含ThyA基因的其他細菌中進行染色體整合。
在下一步研究中,我們擬利用攜外源基因的同源重組載體pThyA-up-down,通過雙交叉同源重組,替換乳酸菌基因組中的ThyA基因,實現目的基因在乳酸菌中的整合型表達,而不引入抗藥性基因和其他外源基因,使得插入的外源DNA片斷最小化,并且不會發生外源基因的水平轉移,因此這種乳酸菌同源重組載體具有較高的生物安全性,可望安全有效地應用于相關疾病的防治。
[1]Steidler L,Rottiers P.Therapeutic drug delivery by genetically modified Lactococcus lactis[J].Ann N Y Acad Sci,2006,1072:176-186.
[2]Scott KP,Mercer DK,Richardson AJ,et al.Chromosomal integration of the green fluorescent protein gene in lactic acid bacteria and the survival of marked strains in human gut simulations[J].FEMS Microbiol Lett,2000,182(1):23-27.
[3]Vagner V,Dervyn E,Ehrlich SD.A vector for systematic gene inactivation in bacillus subtilis[J].Microbiology,1998,144(11):3097-3104.
[4]Wegmann U,O'Connell-Motherway M,Zomer A,et al.Complete genome sequence of the prototype lactic acid bacterium Lactococcus lactis subsp.cremoris MG1363[J].J Bacteriol,2007,189(8):3256-3270.
[5]王海英,祁克宗,彭開松.乳酸菌食品級基因表達系統的研究進展[J].上海畜牧獸醫通訊,2008,(1):8-9.
[6]Sasaki Y,Ito Y,Sasaki T.ThyA as a selection marker in construction of food-grade host-vector and integration systems for Streptococcus thermophilus[J].Appl Environ Microbiol,2004,70(3):1858-1864.
[7]Pedersen MB,Jensen PR,Janzen T,et al.Bacteriophage resistance of a deltathy A mutant of Lactococcus lactis blocked in DNA replication[J].Appl Environ Microbiol,2002,68(6):3010-3023.
[8]Biswas I,Gruss A,Ehrlich SD,et al.High-efficiency gene inactivation and replacement system for gram-positive bacteria[J].J Bacteriol,1993,175(11):3628-3635.

