ICU與普通病房陰溝腸桿菌的臨床分布及耐藥性比較
王玉春
(桂林醫學院附屬醫院檢驗科,廣西桂林541001)
陰溝腸桿菌是條件致病菌,已成為醫院感染的重要病原菌,該菌常呈現出對抗菌藥物的多藥耐藥而導致嚴重的醫院感染[1]。為了解陰溝腸桿菌所致醫院ICU病房及普通病房感染的現狀,筆者對本院2005年1月-2010年3月ICU病房及普通病房分離的陰溝腸桿菌的臨床分布及耐藥性進行比較分析。
1 材料與方法
菌株為2005年1月-2010年3月本院ICU及普通病房送檢的各類標本中分離的陰溝腸桿菌352株,去除同一患者的重復菌株,ICU 51株,普通病房301株。根據《臨床檢驗操作規程》中常規方法分離菌株,用全自動細菌鑒定儀VITEK系統(法國生物梅里埃公司)對分離的細菌進行鑒定及用配套的藥敏板進行藥敏試驗。大腸埃希菌ATCC 25922及銅綠假單胞菌ATCC 27853為質控菌。
2 結果
從6 437份臨床標本中分離出陰溝腸桿菌352株,總分離率為5.5%。ICU為51株(14.5%),普通病房為301株(85.5%),主要分離自痰標本,占77.6%。分布見表1。
352株陰溝腸桿菌的耐藥情況見表2。
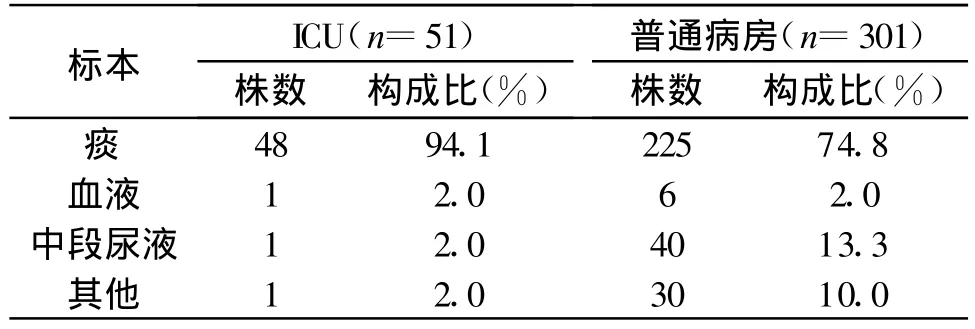
表1 臨床分離陰溝腸桿菌標本的臨床分布
3 討論
重癥監護病房(ICU)收治的患者病情均危重,機體的免疫功能低下,治療和監護的侵襲性操作多,住院時間長,其院內感染率明顯高于普通病房,其中以下呼吸道感染最為常見[2]。本研究顯示,ICU及普通病房分離出的陰溝腸桿菌主要是從痰液標本中檢出,占77.6%。由此可見呼吸道感染是本院ICU病房及普通病房陰溝腸桿菌感染的主要途徑。
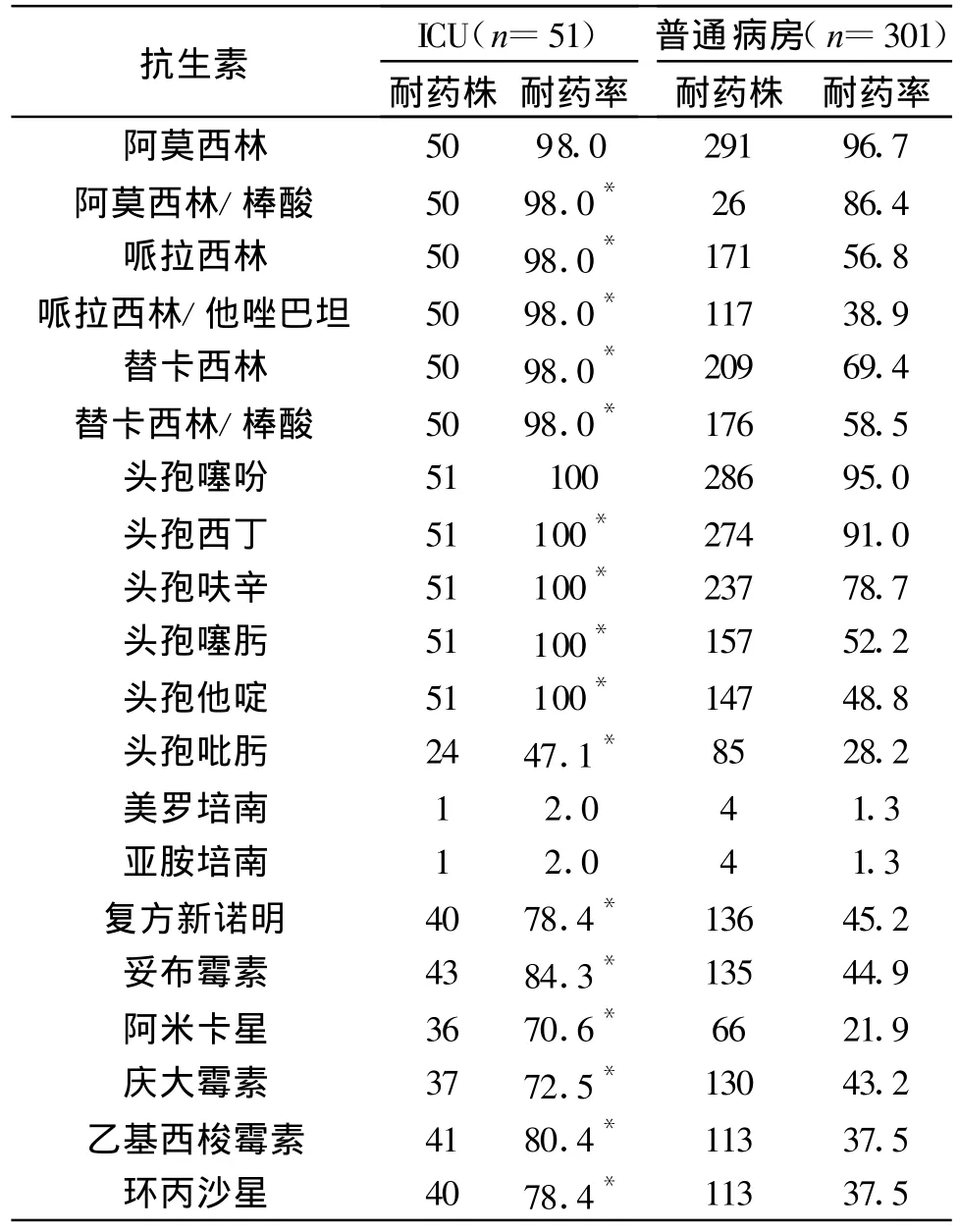
表2 ICU和普通病房陰溝腸桿菌對20種抗生素的耐藥率(%)
陰溝腸桿菌耐藥機制復雜,自發突變率高,AmpC酶、ESBLs、膜蛋白丟失、喹諾酮耐藥等機制共同作用,因此在菌株的耐藥表型上,常呈現耐藥譜廣、耐藥特征復雜的特點[3]。由于天然攜帶染色體介導的AmpC酶,陰溝腸桿菌對阿莫西林、阿莫西林/克拉維酸、窄譜頭孢菌素和頭霉素如頭孢西丁具有天然耐藥性[4]。本調查顯示,陰溝腸桿菌對此類抗生素均具較高的耐藥性。特別是對β-內酰胺類藥物的耐藥率較高,與一些文獻研究的結果相同[5,6]。產生ESBLS與AmpC酶是陰溝腸桿菌對三代頭孢菌素耐藥的重要原因[7],四代頭孢菌素頭孢吡肟的抗菌活性強于第三代頭孢菌素,這是因為四代頭孢菌素對β-內酰胺酶的親和力較低,且能迅速通過細胞外膜屏障與青霉素結合蛋白(PBP)結合。
在相關文獻報道中,碳青酶烯類抗生素對陰溝腸桿菌有較高的敏感性[1-3],在本院ICU及普通病房中,陰溝腸桿菌對亞胺培南及美羅培南呈現較高的抗菌活性(耐藥率〈3%),可作為抗菌治療用藥,對其它各種抗生素均有不同程度的耐藥,并表現出嚴重的多重耐藥性。
對ICU及普通病房中陰溝腸桿菌的耐藥性進行比較,發現除阿莫西林、頭孢噻吩、美羅培南、亞胺培南外,從ICU分離出的陰溝腸桿菌對上述17種抗生素的耐藥性明顯高于從普通病房分離的陰溝腸桿菌耐藥性(P<0.05),且多重耐藥更加明顯。ICU分離菌株的耐藥性高與其進入ICU前大量使用了廣譜抗生素,造成耐藥菌株的積累有關。
綜上所述,從ICU分離出的菌株多為耐藥株,且具有多重耐藥性。臨床合理使用第三代頭孢菌素是減少產ESBLS和AmpC酶突變株引發耐藥的關鍵,鑒于ICU病房的特殊性,在進行侵入操作時,應嚴格進行消毒隔離制度,減少陰溝腸桿菌的醫源性感染發生。
[1]梁志科,劉朝暉,葉惠芬,等.陰溝腸桿菌臨床感染分析及藥敏監測[J].中華醫院感染學雜志,2008,18(2):264.
[2]謝翠娥,尹 凱,何周文,等.重癥監護病房下呼吸道感染中革蘭氏陰性桿菌分布及耐藥分析[J].中國現代醫學雜志,2007,17(7):849.
[3]李 巖,許淑珍,蘇建榮,等.2002年至 2006年陰溝腸桿菌耐藥性監測分析[J].中國實驗診斷學,2007,11(2):241.
[4]董德中,韓立中,陳士林,等.陰溝腸桿菌流行菌株產超廣譜β-內酰胺酶分析[J].中華醫院感染學雜志,2007,17(3):337.
[5]沈蓓瓊,徐 娟,張益新,等.第三代頭孢耐藥腸桿菌AmpC酶及ESBLS酶的表型測定[J].中國微生態學雜志,2006,18(1):64.
[6]余 嫻,凌保東,周岐新,等.臨床分離頭孢菌素酶陰溝腸桿菌的耐藥性研究[J].四川生理科學雜志,2005,27(4):156.
[7]劉建民,聶新民,孫圣華,等.產AmpC酶及或產超廣譜β-內酰胺酶的陰溝腸桿菌的檢測及耐藥性研究[J].中國現代醫學雜志,2008,18(21):3096.

