黃鱔性腺差異表達基因的篩選和克隆
曲憲成,程 翠,尚曉莉,曲學偉,張開岳,張 勇
(1.上海海洋大學水產與生命學院,上海 201306;2.煙臺市牟平區漁業技術服務中心,山東 煙臺 264100)
黃鱔(Monopterus albus),屬于硬骨魚綱(Osteichthyes)、輻鰭亞綱(Actinopterygii)、合鰓目(Synbranchiformes)、合鰓科(Symbranchidae)、黃鱔屬(Monopterus),為溫熱帶淡水魚類。黃鱔主要分布于我國,以及東南亞、澳洲、中南美及非洲等地區,尤其在我國分布最為廣泛[1]。研究表明,黃鱔第一次性成熟為雌性,以后漸漸地發育為雄性,其中間轉變階段叫雌雄間體,這種由雌到雄的轉變過程稱為性逆轉現象[2-3],黃鱔這種獨特的生理現象使它成為研究性別控制機理的一種動物。對黃鱔性腺分化、發育和性別轉變機制進行研究顯得非常重要。在一定程度上理解和明確黃鱔性逆轉的機理,能夠人為地控制黃鱔的養殖數量、滿足市場對苗種的需要[4],也能夠為理解脊椎動物性決定與性分化的可能機理以及闡明魚類性別決定和分化的機制,豐富魚類性別控制的基因調節模式,同時為研究高等脊椎動物性別控制等問題提供參考。
性別決定是確定性別分化的方向,指決定未分化性腺向精巢方向發育還是向卵巢方向發育的過程;性分化是指具有雙向分化潛力的未分化性腺經過一系列程序性發生的事件,發育成精巢或卵巢,并出現第二性征的過程[5]。目前,在人和其他動物性別控制的研究方面積累了不少資料,特別是SRY[6]基因和DMY[7]基因的發現,已掀起了對性別控制及其相關基因的研究熱潮。性別決定和性轉變最終是受基因調控的,人類及其他哺乳動物性別決定與分化是一個以SRY基因為主導的、多基因參與和有序協調的表達過程[8]。Bardoni用Xp21探針研究了DSS(dosage sensitive sex reversal)片段,認為 Xp21上確實存在性反轉基因,且DSS的候選基因DAX-1可促進雌性發育[9]。迄今為止,有關報道的性別決定基因包括 SRY/sry、DMY、SOX、AMH、WT-1、SF-1及DAX-1等,但同時也表明性別分化過程還需其他基因的作用,包括上游調控因子和下游調控因子[10]。然而,有關魚類性別分化發育的分子遺傳機制研究甚少,有報道稱魚類芳香化酶等基因的表達可能參與了魚類性腺分化的調節[11-12]。魚類在性別決定機制上是多樣的,大多數魚雌雄異體,還有雌雄同體魚,有些魚能自然發生性逆轉(如黃鱔等),有些能發生天然的雌核發育(如銀鯽)。這表明魚類性別的可塑性很強,可以通過激素等進行性別轉變。關于魚類性別決定的模式有3種:染色體決定、基因決定和環境決定[13-14]。
ACP (Annealling Control Primer) 技 術 是 在DDRT-PCR基礎上發展起來的一種對差異表達基因克隆的新方法。該技術的理論基礎在于:普通引物的靈敏度和特異性是一個矛盾的雙方面,當引物較短時,其靈敏度高,但由于退火溫度較低,特異性就會比較差,反之強調特異性,會使擴增的效率(靈敏度)下降。ACP技術使用一種特殊的引物,使得特異性和靈敏度同時兼顧[15-17]。筆者運用ACPDDRT-PCR技術篩選黃鱔不同發育時期性腺基因的差異表達,利用2個隨機ACP引物篩選差異表達基因,并對其進行克隆測序分析,以期為進一步研究黃鱔性逆轉的機理奠定基礎。
1 材料和方法
1.1 材料
1.1.1 試驗材料 試驗所用黃鱔購自上海崇明三沙洪農貿市場。
1.1.2 主要試劑 凝膠回收試劑盒、100 bp DNA Marker、IPTG、X-gal、pMD18-T 載體等購自 TaKaRa寶生物工程(大連)有限公司;DH5α感受態細胞購自天根生化科技(北京)有限公司;瓊脂糖、氨芐青霉素、酵母粉、蛋白胨、瓊脂粉購自美著生物技術有限公司;GeneFishingTM Kit購自杭州紐羅西敏生物科技有限公司。
1.1.3 引 物 試驗所用的2條ACP隨機引物序列如下。ACP2:5'-GTCTACCAGGCATTCGCTTCA TXXXXXAGGCGATGCC-3';ACP3:5'-GTCACCAG GCATTCGCTTCATXXXXXCCGGAGGATG-3′。
1.2 試驗方法
1.2.1 黃鱔性腺發育時期的確定 稱取黃鱔體重后,用頸椎切斷法處死黃鱔,打開腹腔,觀察、取其完整性腺組織,剪取長度約0.5 cm樣品,用Bouin氏液固定,石蠟包埋,連續切片(8 μm),HE 染色,拍照,觀察[18],確定各性腺發育時期;其余部分裝入1.5 mL離心管,放入液氮中速凍,待樣品取完后,轉入-80℃保存。
1.2.2 總RNA的抽提 選取卵巢發育IV期和間期性腺作為試驗對象。從-80℃冰箱中取出存放于1.5 mL離心管的組織,稱取100 mg樣本立即加入Trizol reagant試劑1 mL,勻漿后,氯仿抽提、異丙醇沉淀后,適量0.1%DEPC水溶解總RNA,并對RNA進行定性定量分析。
1.2.3 第一鏈cDNA的合成 取3 μg總RNA利用 T-ACP1(5′-CTGTGAATGCTGCGACTACGATXX XXX(T)18-3′)引物進行反轉錄。反轉錄過程如下:80℃孵育 3 min,冰上 2 min后,離心,加入 5×RT buffer 4 μL、2 m mol/L dNTP 5 μL、RNase inhibitor(40 U/μL)0.5 μL 和 M-MLV reverse transcriptase(200 U/μL)1 μL,混勻,42℃孵育 90 min、94℃加熱2 min,冰上冷卻2 min,加入80 μL滅菌雙蒸水稀釋,-20℃保存備用。
1.2.4 GeneFishingTM PCR GeneFishingTM PCR利用隨機引物(arbitrary ACPs)進行PCR擴增。20 μL的PCR反應體系包括:50 ng Diluted first-strand cDNA,2 μL 5 μmol/L arbitrary ACP,1 μL 10μM dT-ACP2(5′-CTGTGAATGCTGCGACTACGAGATX XXXX(T)15-3′),10 μL 2×SeeAmp ACP Master Mix加ddH 20至20 μL混勻后,進入PCR循環。PCR反應過程如下:94℃5 min;50℃3min,72℃ 2 min;94℃40s;65℃40 s;72℃2 min;40 個循環;72℃10 min;4℃終止。
取PCR產物進行2%的瓊脂糖凝膠電泳,EB染色,紫外光下觀察,找出差異表達的條帶,利用凝膠回收試劑盒對其進行回收純化。
1.2.5 差異片段的克隆測序 將純化后的差異片段,與pMD18-T載體相連,然后轉化大腸桿菌DH5α感受態細胞,平板培養、藍白斑篩選后,經菌落PCR驗證呈陽性的菌落擴大培養后送菌液測序。測序結果到NCBI上利用Blast進行同源性分析(http://blast.ncbi.nlm.nih.gov/Blast.cgi)。
1.2.6 差異片段的RT-PCR分析 對已獲得差異表達基因的部分cDNA測序后,根據其部分序列設計引物,并以β-actin為內參,利用半定量RT-PCR技術檢測篩選的差異片段在黃鱔卵巢和間期性腺的表達水平。
2 結果與分析
2.1 黃鱔性腺發育時期的選擇
通過石蠟切片確定所采黃鱔性腺的發育時期,根據黃鱔性腺發育各期的特點,選取黃鱔發育IV期卵巢和間期性腺組織進行ACP-DDRT-PCR。這兩個時期樣本的組織結構如圖1所示。由圖可明顯看出在卵巢發育IV期并沒有精巢組織發生,而在間期性腺中出現了初級精母細胞,選用這兩個發育時期的組織進行比較符合本試驗的設計要求。
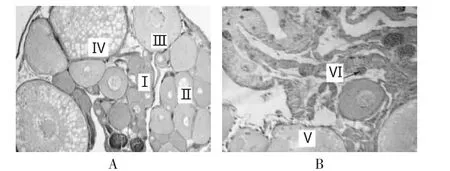
圖1 黃鱔性腺組織切片(10×10)
2.2 黃鱔性腺差異表達基因的篩選
試驗利用ACP-DDRT-PCR技術篩選黃鱔發育IV卵巢與間期性腺組織的差異表達基因,通過2條ACP引物篩選到2條差異極顯著的基因片段,差異顯示結果如圖2所示。

圖2 ACP DDRT-PCR結果
2.3 差異表達基因的克隆與同源性分析
對上述克隆片段測序結果如圖3所示。將序列與GeneBank上的已有序列進行比對,結果顯示DEG2與黃鱸卵巢cDNA文庫中的一條序列(GeneBank No.GO 657 149.1)高度同源,此序列是在經17α,20β-雙羥孕酮誘導后產生的黃鱸卵巢中篩選得到的;而DEG1經Blast比對,并未發現有與其同源性較高的已知序列,因此推測它可能為新報道的基因。

圖3 差異片段DEG1和DEG2的部分cDNA序列
2.4 差異表達基因的半定量表達分析
差異表達基因DEG1和DEG2的半定量RTPCR分析結果如圖4所示。從圖中可以看出兩個差異片段在黃鱔卵巢和間期性腺中的差異表達極其顯著,與ACP-DDRT-PCR結果一致。
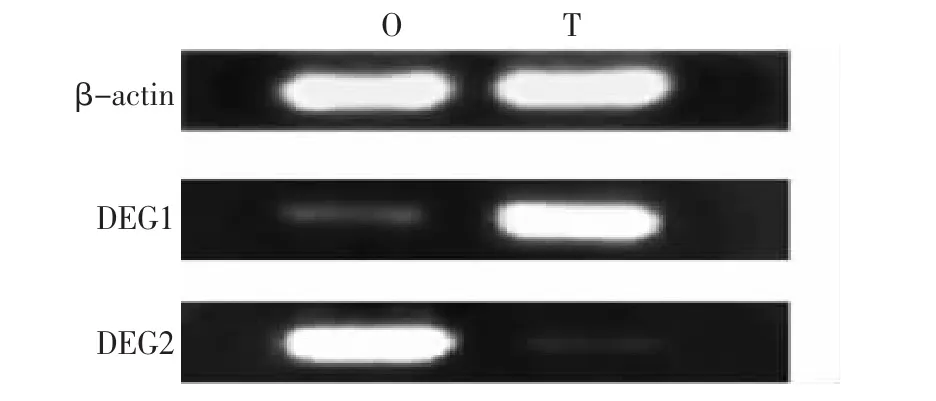
圖4 差異片段的RT-PCR分析
3 討論
ACP-DDRT-PCR技術可用來檢測不同樣品間的表達差異,著眼于解決目前用來檢測基因表達差異方法所面臨的問題,如芯片技術和差異顯示技術。該技術的優點在于:(1)無假陽性;(2)無需PAGE(聚丙烯酰胺凝膠),瓊脂凝膠法即足夠;(3)無需昂貴的檢測方法;(4)重復性保證;(5)無需特殊技術;(6)快速經濟,ACP技術使得研究者可以在較短時間內確認有效的差異表達基因,不必因為假陽性而浪費時間;(7)大范圍的PCR產物,每一個GeneFishing PCR反應產生從150 bp至2 kb長度范圍的PCR產物,這不僅提高了鑒別差異表達基因的機會,還為預測基因功能提供了更多的有效序列信息。
筆者采用此項技術來篩選黃鱔不同發育時期性腺的差異表達基因。石蠟切片確定所采樣本的發育時期,結果顯示卵巢在發育至IV卵黃才大量積累,卵巢接近成熟狀態,而且在IV、V、VI期時組織切片觀察均未發現明顯的雄性組織出現,而在產卵后的間期性腺中可看到初級精母細胞,預計在從IV卵巢到間期的發育過程中,應該有性逆轉相關基因的表達,因此選用間期性腺與IV后卵巢進行比較。而在卵巢發育到V期以后已經成熟,卵巢腔內幾乎充滿了卵泡,對后續的試驗會有一定的影響。綜合以上原因,最終確定利用黃鱔發育IV期卵巢和間期性腺進行差異表達基因的分析試驗。
利用2個隨機ACP引物,通過GeneFishing PCR擴增,篩選到2條差異表達顯著的基因片斷,并對這兩條片段進行純化、克隆、測序,分析后發現在卵巢中高度表達的基因DEG2與黃鱸卵巢cDNA文庫中的一條序列(GeneBank No.GO657149.1)高度同源,此序列是在經17 α,20 β-雙羥孕酮誘導后,在黃鱸卵巢中篩選得到的。根據所得部分DEG2 cDNA序列設計引物,半定量RT-PCR檢測結果同ACP-DDRT-PCR結果一致,該基因在卵巢中表達量極顯著高于間期性腺。眾所周知,17 α,20 β-雙羥孕酮是由促性腺激素作用于卵泡膜細胞而產生的類固醇激素,它是誘導魚類卵母細胞最后成熟和排卵的介體[19-20],體外培養試驗也證實 17 α,20 β-雙羥孕酮是金魚[21]、虹鱒和白斑狗魚[22]等卵泡最后成熟有效的誘導劑。而黃鱔IV期卵巢組織在外形上呈較粗大,卵呈橘黃色,且組織切片可以看出,此期卵巢含有I-IV時相卵泡,特別是IV時相卵泡占據大部分卵巢腔,卵巢已接近成熟。由此可見,所研究的DEG2基因對黃鱔卵巢的發育、成熟有重要作用,同時也證實了ACP-DDRT-PCR技術的可行性。
另一條差異表達基因DEG1是在黃鱔性腺轉化過程中表達量升高的基因,同樣對其進行半定量RT-PCR檢測,結果顯示與ACP-DDRT-PCR結果一致。但經Blast分析,并未找到其同源性基因,因此認為它是新報道的基因,推測其對黃鱔的性逆轉過程有重要的作用,對其功能的進一步研究將有助于認識黃鱔的性逆轉分子機制。
綜上所述,本文利用一種新的差異顯示技術—ACP-DDRT-PCR技術分析了黃鱔IV卵巢和間期性腺基因的差異表達。對所得2個差異表達基因的克隆和分析結果顯示,此項技術是可行的。本研究為進一步探索黃鱔在性逆轉過程中基因表達的時空調控機理奠定了基礎,同時也為研究高等脊椎動物的性別調控機制提供了參考。
[1] 王方雨,張世萍.黃鱔生物學研究進展[J].水利漁業,2004,24(6):1-3.
[2] 隗黎麗,張世萍.黃鱔性腺發育的研究概況[J].河北漁業,2003(6):6-8.
[3] 楊文云,顧忠旗,王春華,等.黃鱔性逆轉過程中性腺形態學初步觀察[J].動物醫學進展,2004,25(6):113-115.
[4] 胡寶林.黃鱔養殖技術之三——黃鱔人工繁殖及苗種培育技術[J].中國水產,2004(2):42-44.
[5] Robert H.Devlin,Yoshitaka Nagahama.Sex determination and sex differentiation in fish:an overview of genetic,physiological,and environmental inf luences[J].Aquaculture 2002(208):191-364
[6] Sinclair A H,Berta P,Palmer M S,et a1.A gene from the human sex-determining region encodes a protein with homology to a conserved DNA-binding motif[J].Nature,1990,346:240-244.
[7] Masaru Matsuda,Yoshitaka Nagahama,Ai Shinomiya,et a1.DMY is a Y-specific DM-domain gene required for male development in the medaka fish[J].Nature,2002,417:559-563
[8] Koopman P,Munsterberg A,Capel B,et a1.Expression of a candidate sex-determining gene during mouse testis differentiation[J].Nature,1990,348:450-452.
[9] Bardoni B,Zasnaria E,Guioli S,et a1.A dosage sensitive locus at chromosome Xp21 is involved in male to female sex reversal[J].Nature Genet,1994,7:497-501.
[10] 張 悅,魯曉萱,單祥年.性別決定基因的研究進展 [J].遺傳2000,22(5):328-330.
[11] Callard G V,Petro Z,Ryan K J.Biochemical evidence for aromatization of androgen to estro gen in the pituitary[J].Gen Comp Endocrinol,1981,44:395-364.
[12] 洪萬樹,方永強.魚類芳香化酶活性研究的進展[J].水產學報,2000,24(3):285-288.
[13] Price D J.Genetics of sex determination in fishes-a brief review[J].In:Potts GW,Wotton R J,eds.Fish reproduction:Strategy and tactics[C].New York:Academic press,1984.67-75.
[14] Devlin R H,Nagahama Y.Sex determination and sex differentiation in fish:an overview of genetic,physiological,and environmental influences[J].Aquaculture,2002,208:191-364.
[15] Hwang I T,Kim Y J,Kim S H,et a1.Annealing control primer system forimproving specificity ofPCR amplification [J].BioTechniques,2003,35:1180-1184.
[16] Martin F H,Castro M M,Aboulela F,et a1.Base pairing involving deoxyinosine:implication for probe design[J].Nucleic Acids Res,1985,13:8927-8938.
[17] Ohtsuka E,Matsuka S,Ikehara M,et a1.An alternative approach to deoxyoligonucleotides as hybridization probes by insertion of deoxyinosine at ambiguous codon positions [J].J Biol Chem,1985,260:2605-2608.
[18] 劉桂芝.石蠟切片標本的制作過程 [J].通化師范學院學報.2004,(11):90-91.
[19] Nagahama Y.17 α,20 β -Dihydroxy-4-pregnene-3-one:A teleost maturatio n-inducing hormone[J].Devel.Growth Diff.,1987b,29:1-12.
[20] 林浩然.魚類生理學 [M].廣州:廣東高等教育出版社,2007.204.
[21] Sorensen P W,Hara T J,Stacey N E,et a1.Prostaglandins functions as potent olfactory stimulant which comprise the postovulatory female sex pheromone in goldfish [J].Biology of Reproduction,1988,39:1039-1050.
[22] Jalabert B.In vitro oocyte maturation and ovulation in rainbow trout(Salmo gairdneri),northern pike(Esox lucius),and goldfish(Carassius auratus)[J].J.Fish.Res.Bd.Can.,1976,33:974-988.

