益生菌對大腸埃希菌O157:H7的抑制作用
(雀巢研發中心上海有限公司,上海 201812)
雙歧桿菌和嗜酸乳桿菌等被稱為益生菌,近幾年來一直受到廣泛的關注。大量發酵和未經發酵的奶制品,如牛奶、酸奶、冰淇淋和奶酪等都可以為人體提供這種有益菌。但同時,由于它們對生存環境有著極高的要求(極度厭氧環境下生長和抗酸性環境能力差),很難在產品中保持較高的活菌數。因此,目前的研究更多地關注于在不適合的生長環境下益生菌的表現,以拓寬益生菌在工業生產中的應用并降低生產過程中的成本。
當有大量活菌存在時,益生菌具有抑制Clostridiumperfringens、Salmonellatyphimurium、Listeriamonocytogenes、Campylobacterjejuni、Bacteroidesvulgatus和Escherichiacoli等致病菌的作用,許多研究認為這是由于其自身代謝產生的有機酸、過氧化氫、抗菌素和其它抑菌成分所造成的[1]。大腸埃希菌O157:H7是非常常見的食源性致病菌,受感染的人會有嚴重的腹瀉、腹痛和發燒等癥狀。鑒于它極強的致病性(尤其是對青少年和老年人)和生存能力,在食品中是不能檢出的[2]。
雖然研究已經證實了益生菌對大腸埃希菌O157:H7的抑制作用,但是它們都強調了大量活菌數和厭氧條件(尤其對雙歧桿菌)的必要性。而對于益生菌(主要是雙歧桿菌)在有氧條件下對于大腸埃希菌O157:H7的影響卻很少涉及。因此,本研究旨在了解益生菌混合物在利于大腸埃希菌O157:H7生長的條件(37℃, 有氧)下對該致病菌的影響,具體考察培養基的pH值和益生菌(主要是雙歧桿菌)有氧狀態下的代謝產物在其中所起到的作用。
1 實驗
1.1 菌株
5株益生菌:Bifidobacteriumlactis/animalis、B.bifidum、B.longum、Lactobacillusacidophilus,Chr.Hansen 。大腸埃希菌(Escherichiacoli)O157:H7(ATCC 43890) 由Juan L.Silva(Mississippi State University, MS, USA) 博士提供。
1.2 細菌細胞的處理
所有菌株都在含有50%甘油和11%脫脂牛奶的凍藏管中-80℃下儲藏。益生菌在MRS肉湯(Becton Dickinson, Sparks, MD, USA)中,37℃、厭氧條件下復活和復壯[3]。大腸埃希菌O157:H7在TSB肉湯(Becton Dickinson)中,37℃、有氧條件下復活復壯[4]。每次實驗之前菌株都必須經過12 h的培養,然后用0.85%的鹽水離心(1000 g,4℃, 2 min)清洗2次。在0 h、4 h(快速生長階段)、8 h(平穩生長階段)和24 h取樣,使用TSA(Becton Dickinson)平板來記錄大腸埃希菌O157:H7的活菌數(log CFU·mL-1)。
1.3 益生菌對大腸埃希菌O157:H7生長的抑制作用的研究
將益生菌混合物(5株)和10 μL大腸埃希菌O157:H7分別接入10 mL 11%的脫脂牛奶和MRS肉湯中,在37℃、 100 r·min-1振蕩(C24型溫控搖床)培養24 h。培養過程中監控大腸埃希菌O157:H7的活菌總數和培養基的pH值。
1.4 低pH值環境對大腸埃希菌O157:H7生長的影響研究
將10 μL大腸埃希菌O157:H7分別接入用1 mol·L-1氫氧化鈉調酸的11%脫脂牛奶(pH值3.8)和MRS肉湯(pH值3.9)中[5],在37℃、 100 r·min-1振蕩培養24 h。和在未經調酸的11%脫脂牛奶(pH值6.4)和MRS肉湯(pH值6.5)中培養生長情況比較。
1.5 益生菌對經過酸適應的大腸埃希菌O157:H7抑制作用的研究
將大腸埃希菌O157:H7接入1 mL TSB肉湯(多加入10 g·L-1葡萄糖,用1 mol·L-1氫氧化鈉調pH值至4.8),在37℃、100 r·min-1振蕩培養24 h,得到經過酸性環境適應的酸適應大腸埃希菌O157:H7,用0.85%鹽水離心(1000 g,4℃, 2 min)清洗2次,然后取10 μL和益生菌混合物一起接入11%脫脂牛奶中,在37℃、 100 r·min-1振蕩培養24 h。以10 μL酸適應大腸埃希菌O157:H7直接接入11%脫脂牛奶中在37℃、100 r·min-1振蕩培養24 h作為參照,比較大腸埃希菌O157:H7的生長情況。
1.6 益生菌在有氧狀態下的代謝產物對大腸埃希菌O157:H7抑制作用的研究
益生菌混合物接入新鮮的MRS肉湯中,在37℃、100 r·min-1振蕩培養8 h,離心(30 000 g,4℃, 20 min),用0.22 μm的濾紙抽真空過濾得到無菌的澄清液,將澄清液分成兩份,其中一份用6 mol·L-1氫氧化鈉調pH值至6.5(新鮮MRS肉湯的pH值)。10 μL大腸埃希菌O157:H7被分別接入這兩份澄清液中,然后在37℃、100 r·min-1振蕩培養24 h[6]。
1.7 統計分析
每個實驗重復3次,得到平均值和標準方差。用Fisher的LSD(Least significance difference)實驗判斷方法判斷樣品之間是否有顯著差異(P≤0.05)(SAS 9.0版本; SAS, 2004)。
2 結果與討論
2.1 益生菌對大腸埃希菌O157:H7生長的抑制作用(表1、圖1)
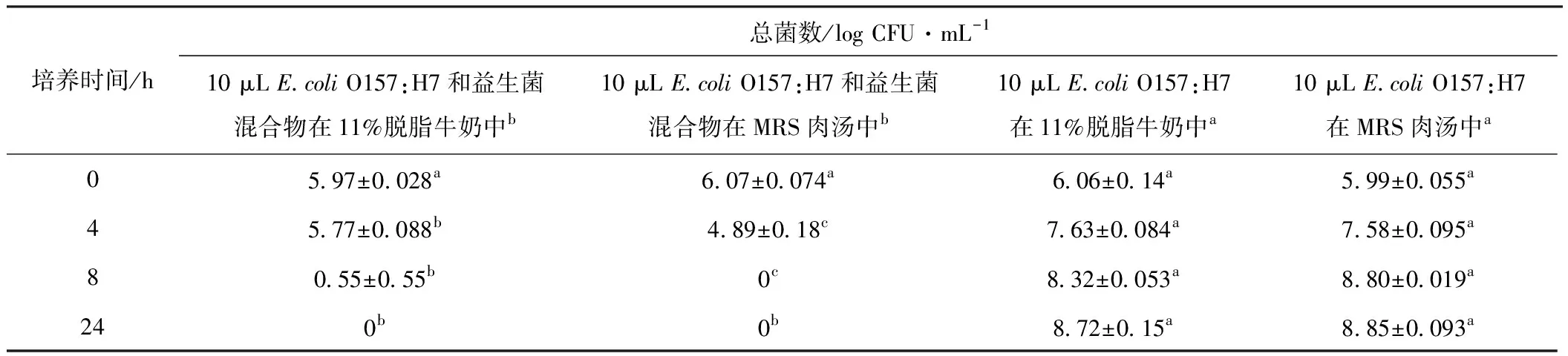
表1 有氧狀態下益生菌在11%脫脂牛奶和MRS肉湯中對大腸埃希菌O157:H7的抑制作用(n=3)
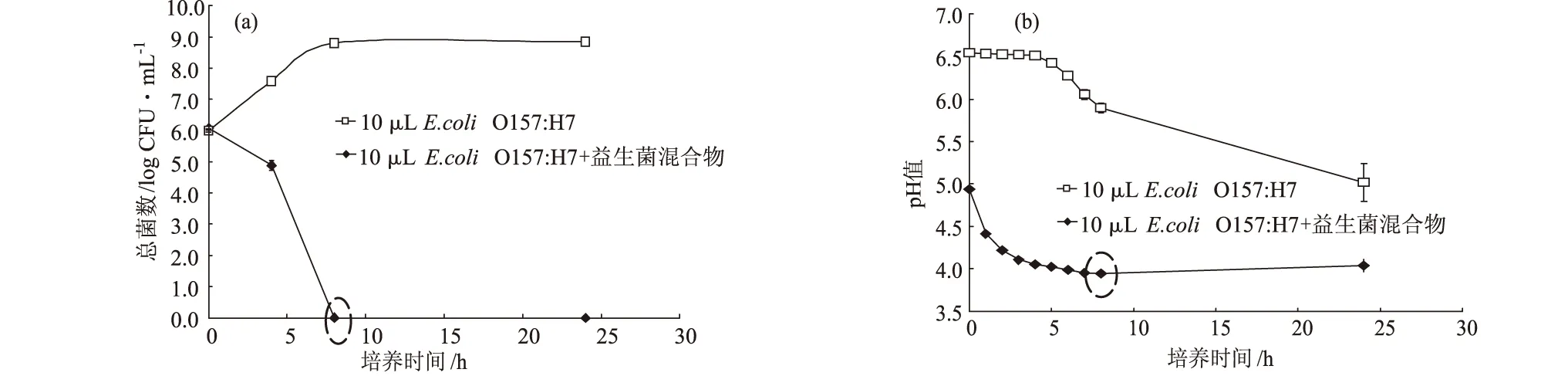
圖1 有氧條件下益生菌混合物和大腸埃希菌O157:H7在MRS肉湯中培養時,大腸埃希菌O157:H7的生長(a)和MRS肉湯pH值(b)的變化情況(n=3)
由表1可知,沒有加益生菌的脫脂牛奶中,大腸埃希菌O157:H7經過8 h培養,總菌數從約6 log CFU·mL-1增加到了約8 log CFU·mL-1。而加了益生菌的脫脂牛奶中,總菌數從約6 log CFU·mL-1降低到了約1 log CFU·mL-1。由于MRS肉湯適于益生菌的生長,所以用MRS肉湯為培養基,重復了以上的實驗,結果極為相似:在加了益生菌的MRS肉湯中,大腸埃希菌O157:H7經過8 h培養,總菌數達到了不可檢出。從以上結果可以看出,無論活菌的含量多少,益生菌對大腸埃希菌O157:H7的生存生長起著抑制的作用。
由圖1可知,大腸埃希菌O157:H7在加了益生菌的MRS肉湯中培養8 h時已經不可檢出,因此,將MRS肉湯在第8 h的pH值作為后續實驗中調整培養基pH值的標準,用來研究低pH值環境對大腸埃希菌O157:H7生長的影響,而8 h也作為益生菌在MRS肉湯里有氧條件下的培養時間,以便研究益生菌在有氧狀態下代謝產物對大腸埃希菌O157:H7生長的影響。
2.2 低pH值環境對大腸埃希菌O157:H7生長的影響(圖2)
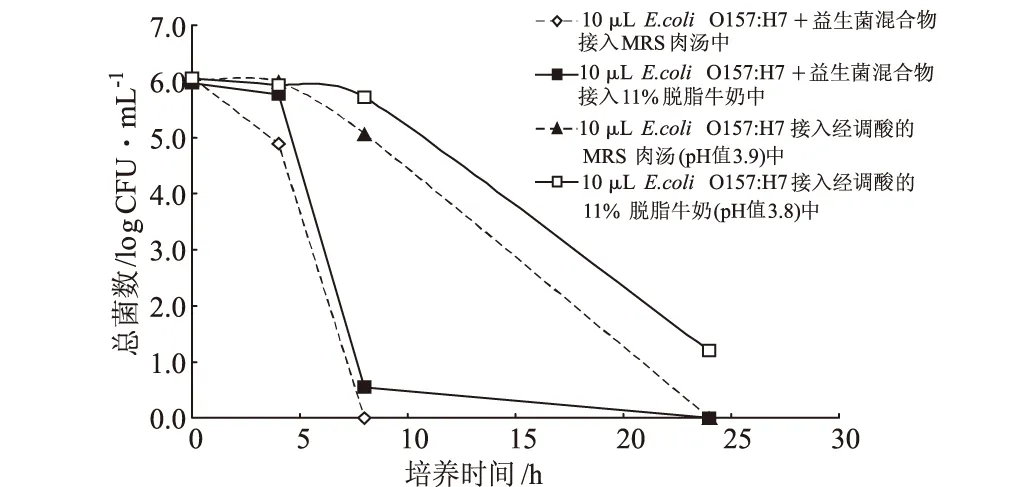
圖2 大腸埃希菌O157:H7在酸性環境和在益生菌共存的有氧環境中的生長情況(n=3)
由圖2可知,低pH值環境和益生菌混合物均對大腸埃希菌O157:H7的生長有抑制作用。資料顯示大腸埃希菌O157:H7能夠存活的最低pH值在4.0~4.5之間[7],本次實驗得到了類似的結果,進一步研究發現,益生菌混合物對大腸埃希菌O157:H7的抑制作用比低pH值環境更為迅速。
2.3 益生菌對經酸適應的大腸埃希菌O157:H7的抑制作用(圖3)
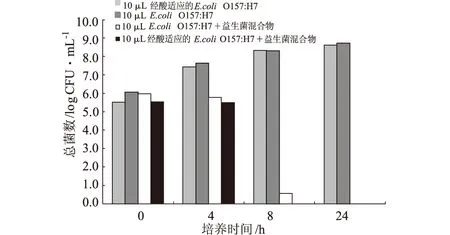
圖3 酸適應和未經酸適應的大腸埃希菌O157:H7在和益生菌共存的11%脫脂牛奶中有氧狀態下的生長情況(n=3)
經過酸適應的大腸埃希菌O157:H7在低pH值環境下擁有更強的存活能力[8],同時抵抗其它環境壓力的能力也更高于未經酸適應的大腸埃希菌O157:H7[9]。因此經酸適應的大腸埃希菌O157:H7和益生菌混合物一起被接入11%的脫脂牛奶中,在37℃、100 r·min-1振蕩培養24 h。本次實驗結果(圖3)顯示經酸適應的大腸埃希菌O157:H7在抵抗益生菌方面的能力并沒有提高。
2.4 益生菌在有氧狀態下的代謝產物對大腸埃希菌O157:H7的抑制作用(圖4)
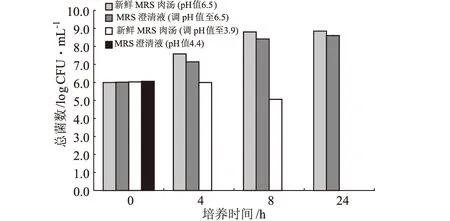
圖4 低pH值環境和益生菌有氧狀態下的代謝產物對大腸埃希菌O157:H7的抑制作用(n=3)
由圖4可知,將澄清液的pH值調回6.5(新鮮MRS肉湯的pH值),大腸埃希菌O157:H7生長較好,這表明低pH值是抑制其生長的最主要因素,同時也證明了益生菌的酸類代謝產物(如乙酸)[10]降低了環境的pH值從而達到了抑制大腸埃希菌O157:H7生長的目的。并且,由于大腸埃希菌O157:H7在pH值4.4的澄清液中死亡速度反而比在pH值3.9的新鮮MRS肉湯中更快,表明益生菌在有氧狀態下的其它代謝產物也同時對大腸埃希菌O157:H7的死亡起著推進作用。
許多研究支持了這個假設:雙歧桿菌B.longum的代謝產物被報道具有阻礙大腸埃希菌O157:H7吸附腸道上皮細胞的功能[11];益生菌在有氧狀態下的代謝產物的組成可能與益生菌含有6-磷酸果糖磷酸酮酶有關。該酶能將葡萄糖轉化為醋酸和乳酸,同時也能將氧氣轉化為許多不同的物質(如超氧和過氧化氫),從而導致了雙歧桿菌不能在有氧狀態下存活[12]。醋酸、乙酸和過氧化氫都有抑制大腸埃希菌O157:H7的作用[13],而這三種物質也能被氫氧化鈉在調整pH值時中和。因此這三種物質是最有可能在澄清液中造成大腸埃希菌O157:H7死亡的主要原因之一。以上假設需要進一步的實驗進行論證。
3 結論
益生菌混合物(5株)在11%脫脂牛奶和MRS肉湯中對大腸埃希菌O157:H7的生存生長有抑制作用。酸性環境是阻礙大腸埃希菌O157:H7生存生長的主要原因之一。而益生菌在有氧狀態下的代謝產物是加速大腸埃希菌O157:H7死亡的另一個主要原因,這些代謝產物有可能被氫氧化鈉中和或者是在低酸性環境下失去作用。需要用進一步的研究來確定這些代謝產物的組成和成分。
參考文獻:
[1] Leahy S C, Higgins D G,Fitzgerald G F,et al.Getting better with bifidobacteria[J]. J Appl Microbiol,2005,98(6):1303-1315.
[2] Centers for Disease Control and Prevention(CDC) [EB]. 2006.EscherichiacoliO157:H7. http://www.cdc.gov/ncidod/dbmd/diseaseinfo/escherichiacoli_g.htm.
[3] De Man J C, Rogosa M,Sharpe M E. A medium for the cultivation ofLactobacilli[J]. J Appl Micro,1960,23(1): 130-135.
[4] Gagnon M, Kheadr E E,Le Blay G, et al.Invitroinhibition ofEscherichiacoliO157:H7 by bifidobacterial strains of human origin[J]. Int J Food Microbiol,2004, 92(1): 69-78.
[5] Dave R I, Shan N P. Evaluation of media for selective enumeration ofStreptococcusthermophilus,Lactobacillusdelbrueckiispp.bulgaricus,Lactobacillusacidophilus, and bifidobacteria[J]. J Dairy Sci, 1996,79: 1529-1536.
[6] Yamamoto Y, Togawa Y, Shimosaka M, et al. Purification and characterization of a novel bacteriocin produced byEnterococcusfaecalisstrain RJ-11[J]. Appl Environ Microbiol, 2003,69(10): 5746-5753.
[7] Buchanan R L,Bagi L K. Expansion of response surface models for the growth ofEscherichiacoliO157:H7 to include sodium nitrite as a variable[J]. Int J Food Microbiol, 1994,23(3-4): 317-332.
[8] Cheng H Y, Yang H Y,Chou C C.Influence of acid adaptation on the tolerance ofEscherichiacoliO157:H7 to some subsequent stresses[J]. J Food Prot, 2002,65(2): 260-265.
[9] Rowbury R J.An assessment of environmental factors influencing acid tolerance and sensitivity inEscherichiacoli,Salmonellaspp. and other enterobacteria[J]. Lett Appl Microbiol, 1995,20(6): 333-337.
[10] Asahara T, Shimizu K, Nomoto K, et al. Probiotic bifidobacteria protect mice from lethal infection with Shiga toxin-producingEscherichiacoliO157:H7[J]. Infec Immun, 2004, 72(4): 2240-2247.
[11] Kim S H, Yang S J, Koo H C, et al. Inhibitory activity ofBifidobacteriumlongumHY8001 againstVerocytotoxinofEscherichiacoliO157:H7[J]. J Food Prot, 2001, 64(11): 1667-1673.
[12] Tamine A Y, Marshall V M, Robinson R K. Microbiological and technological aspects of milks fermented by bifidobacteria[J]. J Dairy Res, 1995,62(1): 151-187.
[13] Ouwehand A C, Vesterlund S. Antimicrobial Components from Lactic Acid Bacteria(3rd ed)[M]. New York: Marcel Dekker Inc, 2004:375-389.

