藥品不良反應數據規范化研究
侯永芳
(國家食品藥品監督管理局藥品評價中心,北京 100045)
自全國藥品不良反應監測網絡運行(報告系統)以來,我國藥品不良反應病例報告數據增長迅速,目前,報告數量已以百萬計,但種種原因使得大量報告數據呈現為非規范化狀態,在現有數據質量和數據狀態下,不僅難以準確、快速地完成各種統計分析,難以快速為藥品監管決策提供數據依據,還限制了信息的分析利用和進一步深入挖掘,某種程度上影響了藥品再評價工作的效率和質量。筆者分析藥品不良反應數據不規范表現形式和產生原因,提出提高數據質量的解決方法,為藥品不良反應監測工作提供技術支持。
1 不規范數據表現形式
我國藥品不良反應病例報告表以在線報告為主,網絡報表共有數據49項(多個藥品未重復計數數據項),其中結構化數據29個,非結構化數據項(可自由錄入的數據項)20個。數據的不規范主要表現在非結構化數據項當中,筆者僅分析影響不良反應檢索、統計、匯總和預警等涉及數據有效利用的主要數據項,包括藥品不良反應名稱、藥品商品名、藥品通用名、生產廠家、用藥原因、原患疾病。主要不規范形式見表1。
2 不規范數據產生原因
數據不規范主要有兩方面的原因,一是藥品不良反應病例報告表填表時就是不規范的,這與我國報告形式的多樣性、報告人員的素質、報告系統的不完善等因素有關;二是不規范數據產生后,缺乏有效的規范化手段和工具對數據進行規整。

表1 網絡報表數據主要不規范形式
2.1 報告形式的多樣性
目前,并非全部藥品不良反應病例報告均由報告人直接通過全國藥品不良反應監測網絡在線填寫,在沒有網絡報告條件情況下報告人可以以紙質報告或傳真形式進行報告,然后由監測機構通過網絡途徑代為錄入。報告人填寫紙質報告表時缺乏輔助規范措施,容易出現習慣性用語和非醫學用語等自由文本,加之錄入人員和原始報告人缺乏溝通,增加了非規范化數據產生。
2.2 報告人員素質水平參差不齊
我國藥品不良反應監測體系大陸地區已覆蓋所有省份,縱深方向,各省大型醫院(如三甲醫院)到基層醫療服務機構(社區醫院、村衛生室、個人診所)、生產企業到零售藥店亦均有報告,尤其需注意的是,基層醫療機構報告不在少數。在各類報告單位中,負責藥品不良反應報告的具體人員專業背景呈現多樣性的特點,有醫學背景,有藥學背景,甚至有的報告人員沒有醫藥相關知識學習的經歷。報告人員專業背景的差異,加之區域性習慣性差異,必然導致數據的多樣性,造成數據的不規范。
2.3 報告系統不夠完善
藥品不良反應不規范數據主要體現在不良反應名稱、藥品商品名、藥品通用名、用藥原因、生產廠家、原患疾病等數據項,以上數據項除生產企業外,其他數據項在線錄入時均可以檢索的方式進行輔助錄入(檢索到的數據是規范的),但輔助錄入的效果取決于后臺支撐數據庫的完善,而支撐數據庫是否完善與支撐數據庫的選擇和其更新維護的及時性密切相關。目前,我國報告系統支撐數據庫更新嚴重滯后,在報告輔助錄入時無檢索結果的情況較多,報告人只能以自由文本形式錄入,增加了不規范數據產生的機會。
2.4 缺乏有效的規范化工具
對藥品不良反應數據的規范化程度要求越高,對藥品不良反應病例報告人員和報告工具的要求就越高,這與藥品不良反應數據收集要及時、全面的要求是矛盾的。國際上通用的手段是,在不規范化數據產生之后,分析不規范數據的規律,建立不規范化數據與規范數據之間的對應關系(規則庫),輔以信息化工具對數據進行規整和整理。目前,尚未建立針對全國藥品不良反應數據的規則庫和數據規范化工具,無法對數據進行及時有效處理。后期數據處理手段的缺失也是大量非規范化數據存在的原因之一。
3 數據規范化方法探討
不規范數據的產生涉及報告人、報告形式、收集工具等多個方面,應建立一個科學、完備的數據規范化體系保證數據的規范性。報告人素質可以通過培訓等方式提高,但短期內難以改變現狀,限定全國單一網絡報告途徑亦不可行,因尚有無網絡條件的區域或機構。筆者認為,完善報告系統和建立規范化工具是有效可行途徑。
3.1 完善報告系統
完善藥品不良反應報告系統,其核心是完善支撐數據庫。我國藥品不良反應報告系統支持數據庫主要有藥品名稱數據庫、藥品不良反應數據庫和原患疾病數據庫,分別依據化學藥品(原料、制劑)分類與代碼、世界衛生組織術語集(WHO-ART)2001版和國際疾病分類-9(ICD-9)建立,尚未建立生產企業數據庫。
3.1.1 完善藥品名稱支撐數據庫 藥品名稱有數量多、更新快的特點,依據現有任何分類和標準均無法保證更新的及時性,筆者建議在現有選擇分類和標準的基礎上建立維護機制,一是與藥品注冊部門建立溝通機制,及時補充新數據,二是考慮到藥品注冊部門的藥品名稱信息同樣存在更新滯后問題,可考慮對報告系統中的不規范藥品名稱數據進行核實驗證,對于確實存在但未在藥品名稱數據庫中收錄的藥品名稱進行分類,將其補充到支撐數據庫中。
3.1.2 完善藥品不良反應術語和疾病名稱支撐數據庫目前,國際上在上市后藥品不良反應監測中用于藥品不良反應的常用術語集為世界衛生組織不良反應術語集(WHO-ART)和人用藥品注冊技術規范國際協調會(ICH)開發的國際醫學用語詞典(Medical Dictionary for Regulatory Activities,MedDRA)。MedDRA編碼術語較多,編碼比較復雜,尚未在國內醫藥行業全面推廣和掌握,筆者建議繼續使用WHOART,并對現行的WHOART進行更新和維護,對于我國使用頻率較高尚未在該術語集中體現的術語,應將其納入到藥品不良反應術語數據庫,使WHOART術語集更全面、準確和實用。考慮到MedDRA術語豐富,WHOART到MedDRA可橋梁映射,可以將使用WHOART術語的數據轉換到MedDRA編碼,可對引入MedDRA進行相關研究。疾病名稱支撐數據庫目前使用國際疾病分類-9,建議更新至最新版本,MedDRA在我國推廣后,可考慮使用MedDRA作為疾病名稱數據庫。
3.2 建立規范化工具
完善報告系統、更新維護支撐數據庫可減少但無法避免不規范化數據的產生。應在不規范數據產生后建立規范化機制對其進行處理。目前,我國報告數量已以百萬計,靠人工形式進行數據規整效率低下,建議借助信息化手段輔助進行規范,建立規范化工具。規范化工具應能夠以自動和手工兩種方式對數據進行規整,自動化方式可依據規則庫(不規范化數與規范數據的映射集合)對數據進行自動處理,對于沒有“規則”的不規范數據,可通過手工方式進行規范,手工規范的同時能夠“記憶”新規則,規整工具在運行過程中規則不斷完善,規整效率和能力不斷增強(整數據流程見圖1)。
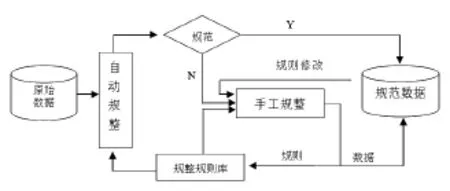
圖1 數據規整流程圖
藥品不良反應數據規范化是一項長期、系統性的工程,其工作內容、數據量、難度都比較大,實施周期也比較長,需要循序漸進、逐步推進。需要注意的是,數據規范僅是報表數據質量提高的基礎手段,能為數據的統計、匯總和報表等打下基礎,但無法代替評價人員對每一份報表的真實性和準確性作出判斷。

