干擾素生物活性兩種測定方法的比較研究
趙鴻
(北京雙鷺藥業股份有限公司,北京 100041)
干擾素(interferon,IFN)是第一個被發現的細胞因子,也是第一個應用于臨床的基因工程產品。根據其來源、理化性質、氨基酸序列和生物學活性的不同,可分為α、β、γ三種類型。IFN的作用具有種屬特異性,其主要功能有抗病毒、抗腫瘤、增強NK、Tc細胞的活性及進行免疫調節等多種生物學活性,是一類重要的細胞因子。通常干擾素生物活性測定方法是采用《中國藥典》三部附錄ⅩC細胞病變抑制法(結晶紫染色法,方法一)。由于日常實驗中發現生物活性測定曲線不理想,重復性較差,故對其操作進行一些改動,同時考慮到該實驗中間操作較多,容易引入操作誤差,故探討一種中間操作少的方法,以減少實驗誤差,提高實驗結果的準確性。MTT比色法(方法二)廣泛應用于細胞生物活性檢測,故筆者旨在通過本實驗證實改進的結晶紫染色法與MTT比色法哪一種方法更適合用于干擾素生物活性的測定,得到更為準確的實驗結果,為干擾素的臨床應用提供有力的保證。
1 材料與方法
1.1 原理
1.1.1 方法一原理 根據干擾素能刺激某些指示細胞,如人羊膜上皮細胞(WISH細胞)、人喉癌細胞(Hep2細胞)、人胚肌皮細胞和肺單層細胞(2BS細胞)等,產生抗病毒蛋白,使細胞免受牛水泡性口炎病毒(VSV)的攻擊。根據待測樣品干擾素不同稀釋度的保護能力,計算出干擾素的生物活性單位。
1.1.2 方法二原理 MTT比色法的基本原理是活細胞線粒體中富含琥珀酸脫氫酶,氧化型MTT進入細胞后可被該酶還原生成藍色formazan顆粒,沉積于細胞內或細胞周圍,經溶劑溶解后比色定量,其顏色深淺直接與活細胞數有關。
1.2 實驗試劑、材料與實驗器具
1.2.1 DMEM培養液 取DMEM培養基粉末1袋(Gibco公司,規格為1 L,批號31600-034),加水溶解并稀釋至1 000 ml,加青霉素1.0×105U和鏈霉素10.×105U,再加碳酸氫鈉2.0 g、L-谷氨酰胺 0.292 3 g(Sigma公司, 批號 G3126)、HEPES 2.838 g(Amersco公司)溶解后,混勻,過濾除菌,4℃保存。
1.2.2 基礎培養液(10%)取新生牛血清10 ml(四季青生物公司,批號061202),加DMEM培養液至100 ml,4℃保存。
1.2.3 測定培養液(7%)取新生牛血清7 ml,加DMEM培養液至 100 ml,4℃保存。
1.2.4 攻毒培養液(2%)取新生牛血清2 ml,加DMEM培養液至 100 ml,4℃保存。。
1.2.5 消化液 0.5%胰蛋白酶消化液∶0.02%EDTA=1∶1(0.5%胰蛋白酶及0.02%EDTA均用PBS溶液配制)。
1.2.6 染色液 結晶紫染色液(0.1 g+20 ml無水乙醇溶解后加水至 100 ml)。
1.2.7 脫色液 50%無水乙醇、50%蒸餾水及0.1%乙酸。
1.2.8 細胞 WISH細胞。
1.2.9 VSV-70℃凍存。
1.2.10 裂解液 取十二烷基硫酸鈉(SDS,分析純)15 g,用適量蒸餾水和50 ml DMF(N,N-二甲基甲酰胺)溶解,加蒸餾水至100 ml,用鹽酸調節pH至4.7。
1.2.11 MTT溶液 取0.5 g MTT,加 PBS溶解成 100 ml,配制成0.5%MTT溶液,經0.22 μm濾膜過濾除菌。4℃避光保存。
1.2.12 PBS溶液 取8 g氯化鈉、0.2 g氯化鉀、1.44 g磷酸氫二鈉、0.24 g磷酸二氫鉀加蒸餾水配成1 000 ml溶液,經121℃15 min高壓滅菌。
1.2.13 干擾素α活性測定國家標準品 批號97/04,-20℃貯存,7 500 IU/支。
1.2.14 器材 96孔細胞培養板若干個,百級工作臺,二氧化碳培養箱(三洋公司),酶標儀(Molecular Devices公司),生物倒置顯微鏡(COIC,重慶光學儀器廠),單道微量移液器,8道微量移液器,無菌1.5 ml塑料離心管和200 μl、1 ml tip頭若干。
1.3 測定法(以下操作均為無菌操作)
1.3.1 方法一[1]①使WISH細胞在培養基中貼壁生長,按1∶2~1∶4傳代,每周2~3次,于完全培養液中培養。輕搖WISH細胞,棄去培養瓶中的培養液,用PBS溶液洗2次后加消化液(0.5%胰蛋白酶消化液∶0.02%EDTA=1∶1,即 1.5 ml∶1.5 ml)消化,鏡下觀察消化程度,見鏡下大部分細胞離散后,吸棄消化液,立即加5 ml 10%DMEM培養液,終止消化反應,用10 ml移液管用力吹打將細胞吹散,鏡下觀察大部分細胞呈單個細胞,用10%DMEM培養液配成3.0×105個/ml的細胞懸液,接種于 96孔培養板中, 每孔 100 μl,37℃,5%CO2條件下培養4~6 h。②標準品溶液的配制:取1支干擾素活性測定國家標準品,按使用說明書復溶后,用7%DMEM培養液稀釋至1 000 IU/ml(IFN國家標準品直接加7%DMEM培養液220 μl稀釋)。在96孔培養板中,以4倍稀釋度做梯度稀釋(50 μl+150 μl),共8個稀釋度,每個稀釋度做2個復孔。供試品溶液的配制:將供試品按標示量復溶后,用7%DMEM培養液稀釋成約1 000 IU/ml。在96孔培養板中,以4倍稀釋度做梯度稀釋,共8個稀釋度,每個梯度做2個復孔。③將②項配制的標準品溶液和供試品溶液加入接種WISH細胞的培養板中,每孔 100 μl,于 37℃、5%CO2條件下培養 18~24 h。 ④制備病毒液與攻毒:取-70℃凍存的VSV用2%DMEM攻毒培養液稀釋至100TCID50。吸棄細胞培養板的上清,將稀釋好的病毒液加入培養板中,每孔 100 μl,37℃、5%CO2培養 24 h。⑤鏡檢標準溶液的50%病變點在1 IU/ml,即為F行。然后棄去細胞培養板中的上清液,每孔加入50 μl結晶紫染色液,室溫放置30 min后,用水盆盛上純化水,換水漂洗培養板3次,并在吸水紙上輕叩幾下,然后每孔加入100 μl脫色液,室溫放置5~10 min。用微量振蕩器振蕩混勻1~2 min,然后于波長540 nm處測定。根據樣品稀釋倍數計算實驗測定結果。
1.3.2 方法二[1-3]此方法中①~④與方法一中相同。⑤每孔加入 0.5%MTT 溶液 20 μl, 于 37℃、5%CO2條件下培養 5 h,然后每孔加入100 μl裂解液,于37℃、5%CO2條件下培養過夜,用微量振蕩器振蕩混勻1~2 min,然后于波長540 nm處測定。根據樣品稀釋倍數計算實驗測定結果。
2 結果
2.1 方法一測定結果
見表1。
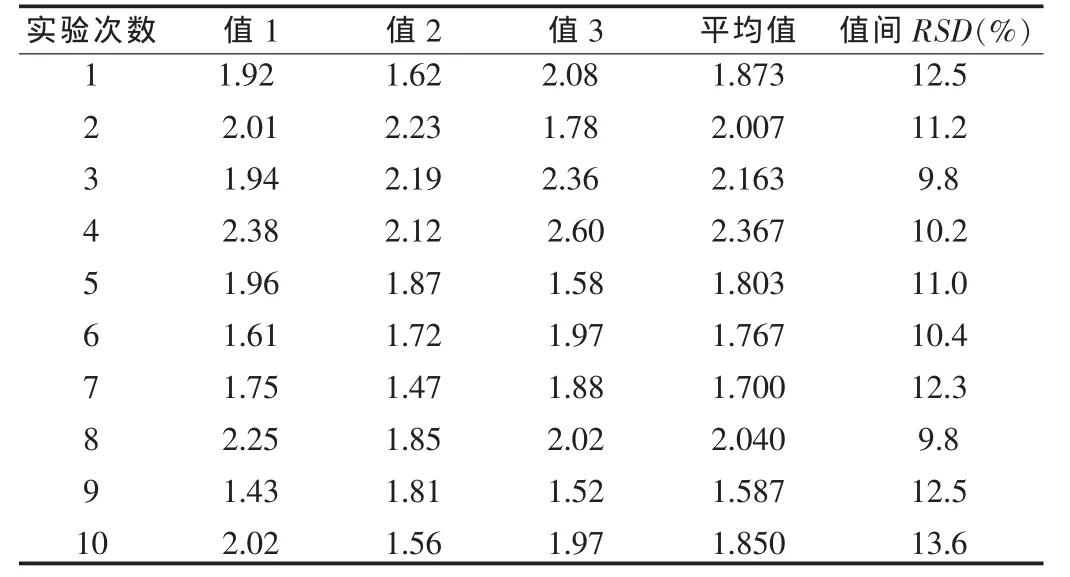
表1 方法一測定結果(107IU/ml)
方法一總平均值為1.916×107IU/ml,所有測定值間的RSD為15.0%。
2.2 方法二測定結果
見表2。
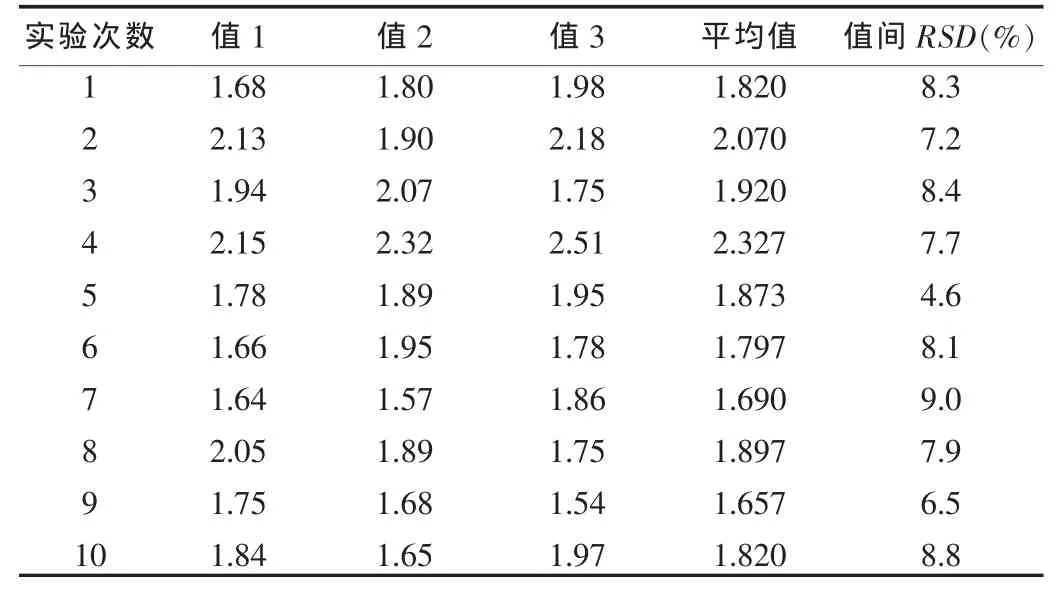
表2 方法二測定結果(107IU/ml)
方法二總平均值為1.887×107IU/ml,所有測定值間的RSD為11.8%。
2.3 方法一每次測定的r值
見表3。

表3 方法一每次測定的r值
2.4 方法二每次測定的r值
見表4。
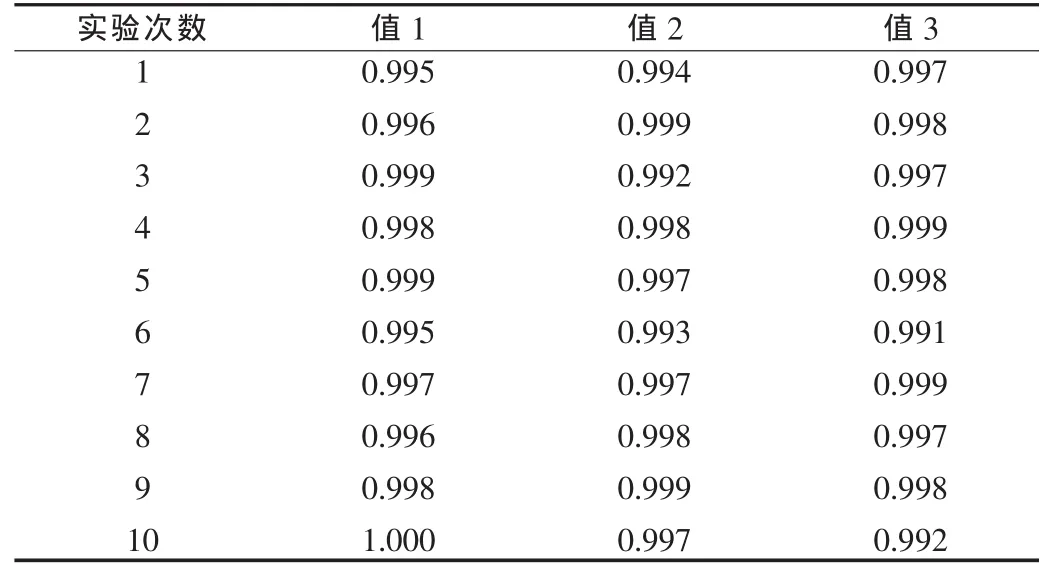
表4 方法二每次測定的r值
3 討論
由表1、2可以看出,兩種方法平均值偏差不大,方法一單次測定結果之間偏差較大,r值較小;方法二單次測定結果之間偏差較小,r值較大。由此可以看出,方法二測定的結果準確性較高。
實驗所用WISH細胞株的生長狀態、鋪板細胞數目、VSV滴度以及病變終止時間的確定等因素都會影響實驗結果,尤其是病變終止時間的確定存在個人主觀偏差。為了保證實驗結果的良好重復性,需要嚴格保持實驗條件的一致性。
目前測定干擾素活性更為靈敏的方法還有ELISA檢測法和LDH釋放法[4-5]等,更為客觀的方法正在摸索中,希望不久能夠建立更為靈敏的檢測方法。
[1]國家藥典委員會.中國藥典[S].三部.北京:化學工業出版社,2005:附錄56-57,附錄59.
[2]黃志榮.MTT比色法在干擾素生物學活性測定中應用的探討[J].海峽藥學,2006,18(6):60-61.
[3]伊春德,金伯泉,黃傳書.應用MTT法測定IFN的生物活性效價[J].上海免疫學雜志,1999,10(4):247.
[4]程偉,顧瑛,李新元,等.用LDH釋放法判斷細胞病變程度確定干擾素生物活性[J].軍醫進修學院學報,1999,20(4):295-297.
[5]何金生,宗庭益.LDH釋放法檢測NK細胞活性的方法學研究[J].中國實驗臨床免疫學雜志,1996,8(2):10-13.

