硅膠管包裹大鼠頸動脈對血管收縮功能的影響
謝蓮娜,曾定尹,張海山,孫丹萌,龐雪峰,關啟剛
(中國醫科大學 附屬第一醫院心內科,沈陽 110001)
動脈壁由內膜、中膜、外膜三層結構組成。外膜為血管最外層結構,由較厚的致密結構組成,含有大量的膠原纖維和彈性纖維,細胞成分主要為成纖維細胞。越來越多的證據顯示外膜調節血管功能的作用遠大于其作為血管壁支撐結構的作用。Gonz觃lez等[1]發現去除血管外膜的大鼠頸動脈及腸系膜動脈對去甲腎上腺素的收縮反應明顯減弱;提示血管外膜能調節血管平滑肌的收縮功能,參與血管張力的調節。通過損傷血管外膜的方法建立早期動脈粥樣硬化動物模型被廣泛應用于研究動脈粥樣硬化的發病機理。動脈粥樣硬化往往伴有血管收縮功能的改變,利用外膜參與血管張力調節的機制建立血管外膜損傷致血管痙攣的動物模型有助于深入認識外膜調節調節血管功能的作用機制。
本實驗應用硅膠管包裹大鼠頸動脈外膜,觀察血管外膜損傷對血管收縮功能的影響,探討構建血管外膜損傷介導血管收縮性增強的大鼠頸動脈動物模型的可行性。
1 材料與方法
1.1 實驗動物
12周清潔級雄性Wistar Kyoto大鼠30只,體質量200~250 g(由吉林大學動物室提供)。普通大鼠食料喂養,自由進食、飲水。
1.2 硅膠管包裹大鼠頸動脈手術
手術在室溫下進行。腹腔內注射水合氯醛30 mg/kg麻醉大鼠,仰臥固定于自制鼠板上(40 cm×60 cm)。頸前脫毛后常規碘酊、乙醇消毒。沿正中線縱形切開頸部皮膚,逐層鈍性分離頸部筋膜及肌肉,暴露右側頸動脈鞘,仔細游離出右頸動脈,長約15~18 mm。用內徑1.5 mm、長12 mm的硅膠管縱向切開后包裹于右頸動脈外(包管側);左側頸動脈未處理,作為自身對照(對照側)。逐層縫合傷口,讓大鼠自主恢復。術后3 d每日1次腹腔注射青霉素16萬U,預防感染。
1.3 在體血管收縮性評價
包管術后 3 d(n=6)、1 周(n=6)、2周(n=6),用以上方法麻醉大鼠,暴露雙側頸動脈,去除右頸動脈包裹的硅膠管。將頸動脈置于已預熱的超聲血流量探頭(2PSB,Transonic Systems Inc.,USA)內,穩定2 min后用超聲實時外周血管血流量儀(TS420,Transonic system Inc.,USA)測定血流量(ml/min),同時用MP150多導生理記錄儀(Biopac Systems,USA)連續記錄頸動脈血流波形圖。測完兩側基礎頸動脈血流量后,用寬4 mm、4層厚紗布條圍繞頸動脈中段。待血流量穩定,往紗布條上滴注用生理鹽水配置的 5-羥色胺(5-hydroxytryptamine,5-HT,美國 Sigma公司)0.05 ml。局部5-HT用量依次遞增:10μg、50μg、100μg、500μg。每次局部應用 5-HT 后持續觀察2 min,記錄頸動脈血流量最大變化值,并連續記錄血流量變化波形圖。取出紗布條,室溫生理鹽水局部沖洗后更換新紗布條。穩定5~10min后進行下一濃度的5-HT誘發實驗,直至結束。兩側頸動脈依次進行。為排除頸動脈血流量的個體差異,血管對5-HT的反應以與自身基礎血流量比變化的百分數表示。
1.4 病理學檢查
分別于術后 3 d(n=4)、1 周(n=4)、2 周(n=4)按前述方法麻醉大鼠,暴露雙側頸動脈,取目標血管(包管部位頸動脈及對側相同部位頸動脈)約10 mm長。冰鹽水沖洗后4%多聚甲醛固定,石蠟包埋標本。石蠟標本按3~4μm厚度連續切片,蘇木素-伊紅染色,在光學顯微鏡下數碼照相輸入計算機。用Image Pluse圖像分析軟件進行測量分析:測外彈力板圍繞面積(external elastielamina area,EELA)、內彈力板內面積(internal elastielamina area,IELA)、平均外彈力板內管腔直徑及平均內彈力板內管腔直徑。計算中膜厚度(mediadiameter,MD)及中膜面積(mediaarea,MA)。MD=(平均外彈力板內管腔直徑-平均內彈力板內管腔直徑)/2;MA=EELA-IELA。EELA代表血管總面積;對沒有內膜增生的血管環,血管環管腔橫截面積(lumen area,LA)為IELA,對有新生內膜形成的血管環測LA,計算內膜增生面積(neointima area,NA)=IELA-LA。每個目標血管取3張切片測量后取平均值作為該標本的最終數值。硅膠管包裹導致血管形態學變化程度以與自身對照側頸動脈比較變化的百分數表示。
1.5 統計學處理
用SPSS13.0統計分析軟件進行統計學分析,計量資料以x±s表示,兩側頸動脈血流量及形態學分析所測值比較用配對t檢驗。多組間均數比較用單因素方差分析檢驗,P<0.05為差異有統計學意義。
2 結果
2.1 硅膠管包裹對大鼠頸動脈血管形態學的影響
2.1.1 血管形態學改變:對照側頸動脈手術后3 d、1周及2周血管形態無明顯改變。硅膠管包裹大鼠頸動脈損傷血管外膜后,包管側頸動脈血管出現明顯的形態學改變。硅膠管包裹3 d,血管腔縮小、血管內皮完整、內彈力板輕度彎曲、血管壁增厚、血管外膜炎性細胞侵潤。硅膠管包裹1周,血管腔明顯縮小、內皮完整、內彈力板極度彎曲、內皮細胞變形并突向管腔、血管壁明顯增厚、血管外膜大量炎性細胞浸潤及滋養血管增生。硅膠管包裹2周,血管腔較包管1周時擴大,出現彌漫性內膜增生,新生內膜中主要是縱行排列的合成型的血管平滑肌細胞及單核炎性細胞;內彈力板彎曲現象消失;血管中膜平滑肌細胞復制及單核炎性細胞浸潤,血管壁增厚;血管外膜炎性細胞浸潤較1周時減輕(圖1)。
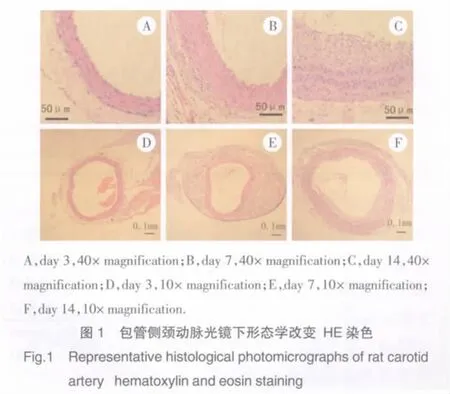
2.1.2 形態學測量分析結果:形態學分析結果如表1所示。硅膠管包裹大鼠頸動脈3 d、1周及2周對照側頸動脈的EELA、MA、MD及IELA均無明顯差異。與對照側比較:包管術后3 d包管側頸動脈的EELA及MA無明顯變化、MD增加(23.04±5.96)%(P=0.009)、IELA 縮小(12.15±2.29)%(P=0.003);包管術后1周包管側頸動脈的EELA縮小(35.41±3.41)%(P<0.001)、MA無明顯變化、MD 增厚(61.65±10.32)%(P<0.001)、IELA 縮小(45.17±3.84)%(P<0.001);包管術后2周包管側頸動脈的EELA、MA及IELA無明顯變化、MD增厚(31.52±4.56)%(P=0.012)、LA 縮小(37.17±4.57)%(P<0.001)、NA 平均(0.19±0.05)mm2。
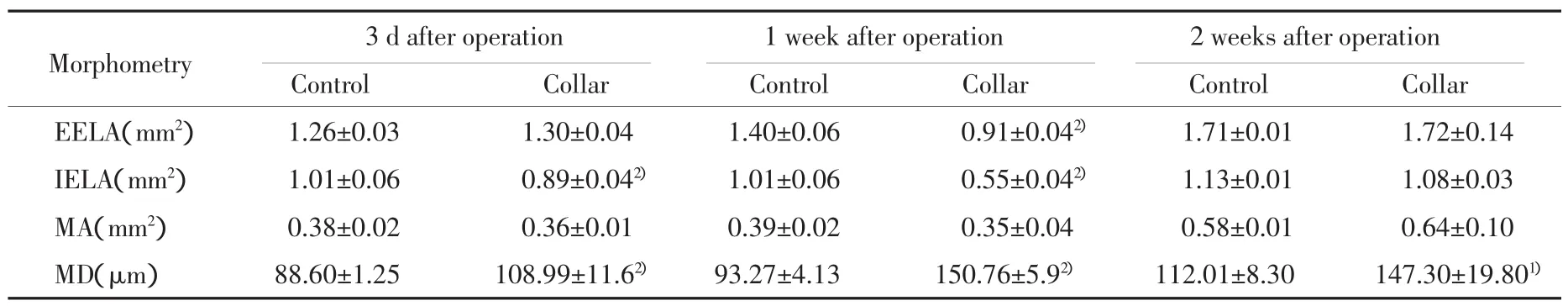
表1 硅膠包裹后大鼠頸動脈血管形態學變化分析(x±s)Tab.1 Effect of collar-induced adventitia injury on rat carotid morphometry(x ±s)
2.2 硅膠管包裹對大鼠頸動脈血管收縮功能的影響
2.2.1 頸動脈血流量的變化:硅膠管包裹術后3 d、1周、2周,包管側頸動脈血流量均較對側明顯降低,包管 3 d時分別為(3.35±0.77)ml/min和(4.55±0.92)ml/min(P=0.028);包管 1 周時分別為(2.79±0.71)ml/min 和(3.64±0.83)ml/min(P<0.001);包管 2周時分別為 (2.92±0.35)ml/min 和(4.35±0.97)ml/min,(P=0.0091)。見圖 2。
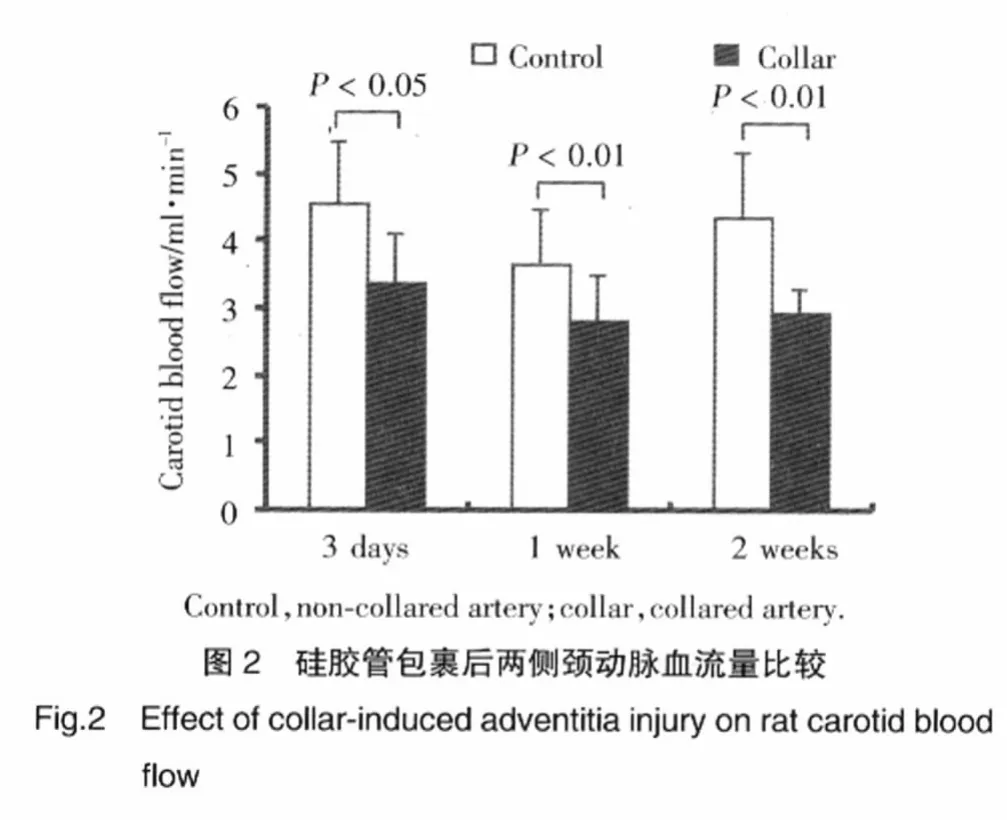
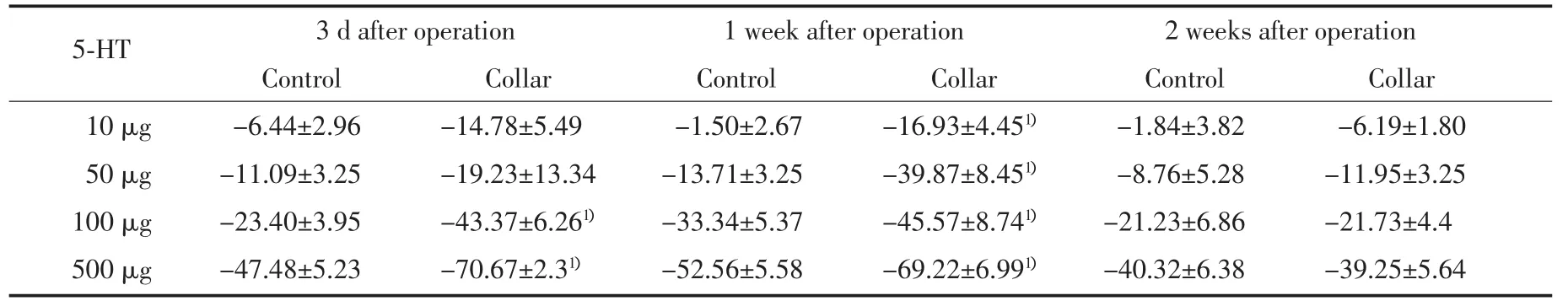
表2 局部應用5-HT大鼠兩側頸動脈血流量變化率比較(x±s,%)Tab.2 Effects of collar-induced adventitia injury on vascular reactivity to serotonin(x±s,%)
2.2.2 頸動脈血管對局部應用5-HT的反應:局部應用遞增劑量(10~500μg)5-HT誘發血管痙攣(n=6)結果如表2所示。隨5-HT用量增加,兩側頸動脈血流量均在基礎血流量的基礎上呈劑量依賴性降低。硅膠管包裹大鼠頸動脈3 d,在較低劑量5-HT(10~50μg)時,包管側頸動脈血流量下降程度與對照側比較無明顯差異;在高劑量5-HT(100~500μg)時,包管側頸動脈5-HT誘發的血流量降低程度明顯大于對照側。硅膠管包裹大鼠頸動脈1周,局部應用遞增濃度的5-HT,包管側頸動脈血流量下降程度明顯大于對照側,這種差異在較低濃度5-HT時更明顯,包管側頸動脈5-HT誘發的最大血流量降低程度也明顯大于對照側。包管術后2周,包管側頸動脈對局部應用5-HT的反應與對照側比較無明顯差異。
3 討論
本研究結果顯示,用硅膠管包裹大鼠頸動脈造成血管外膜慢性損傷后,早期出現血管收縮功能的改變,表現為血管中膜平滑肌慢性收縮、血流量降低及血管對5-HT的收縮反應增強;包管2周血管壁出現具有動脈粥樣硬化早期特征的新生內膜病損。
3.1 硅膠管包裹大鼠頸動脈導致血管內膜增生
目前認為血管外膜是血管壁主要的“損傷-感應組織”。能“由外向內”影響血管功能及結構。眾多研究證實血管外膜損傷能在短期內出現具有動脈粥樣硬化早期特征的新生內膜。多種損傷血管外膜的方法被用來制造動脈粥樣硬化的動物模型,包括外膜電刺激、血管外壓迫、外膜剝離及血管外膜包管等。硅膠管生物相容性好、柔軟、有彈性。Booth等[2]首先應用其包裹兔頸動脈制作動脈粥樣硬化的動物模型:將一非閉合的硅膠管包繞于兔頸動脈外膜,在正常飲食的情況下,1周內包管處出現具有動脈粥樣硬化早期特征的新生內膜病損。此后眾多研究均證實用硅膠包裹血管的動物模型是研究動脈粥樣硬化形成可靠、快速的方法。該動物模型的優點是:血管外包管不直接損傷血管中膜及內膜;而且在同一動物能同時得到正常及外膜受損的血管,因此可以利用兩側血管進行自身對照研究。目前該動物模型被廣泛應用于研究動脈粥樣硬化機制及藥物療效。以往多數該方面的研究主要是以兔頸動脈作為目標血管。但由于抗兔抗體較少,限制了該動物模型的更廣泛應用。大鼠具有飼養方便、抵抗力強、相關抗體多等優勢。既往報道應用球囊損傷大鼠血管內膜能誘發與人類動脈粥樣硬化早期改變相似的病變[3]。本實驗用大鼠作為實驗動物,用硅膠管包裹大鼠頸動脈造成血管外膜慢性損傷,光鏡下觀察硅膠管包裹后3 d、1周及2周大鼠頸動脈血管壁形態學變化。結果顯示硅膠管包裹損傷血管外膜后,大鼠頸動脈血管壁出現與硅膠管包裹兔頸動脈后相似的形態學變化。與以往報道的硅膠管包裹兔頸動脈1周出現彌漫性內膜增生不同的是,本實驗硅膠管包裹大鼠頸動脈后1周無明顯內膜增生,包管2周才出現明顯的內膜增生。被廣泛用于研究腦出血致血管痙攣的大鼠股動脈模型也證實經外膜刺激大鼠股動脈7~12 d血管主要表現為慢性痙攣,未見內膜增生性改變[4,5]。大鼠頸動脈對包裹硅膠管的反應與兔不完全相同,機理還不清楚,可能與動物的種屬有關。本實驗證實可以以大鼠作為實驗動物,用硅膠管包裹頸動脈的方法制作外膜損傷致動脈粥樣硬化模型用于探討血管外膜在動脈粥樣硬化形成中的作用及治療方法。
3.2 硅膠管包裹大鼠頸動脈導致血管對5-HT反應敏感性增加
冠脈痙攣是眾多缺血性心臟病包括變異型心絞痛、不穩定型心絞痛、急性心肌梗死及猝死的基本發病機制。動脈粥樣硬化在血管痙攣發病中具有重要的作用。目前認為血管平滑肌細胞收縮性增強是動脈粥樣硬化引起血管痙攣的主要發病機理。從聚集的血小板中局部釋放的5-HT是血管收縮的內源性刺激。在多種動脈粥樣硬化動物模型中觀察到血管選擇性的對5-HT的收縮血管反應敏感性增加,如高膽固醇喂養的兔動脈粥樣硬化模型[6]、高膽固醇喂養+球囊損傷豬冠脈血管內膜[7]等。人體動脈的離體研究顯示粥樣硬化血管對5-HT的收縮反應性增加[8]。臨床研究顯示動脈粥樣硬化的患者對5-HT收縮血管反應的敏感性增高易誘發血管痙攣[9]。關啟剛等[10]用白介素1包裹豬冠狀動脈外膜介導冠脈病變的動物模型,證明在體情況下血管外膜慢性炎癥刺激能導致血管對5-HT的收縮反應敏感性增加。硅膠管包裹兔頸動脈動物模型的早期研究證實,除了內膜增厚,包管部位的血管對5-HT的反應敏感性增加,且動脈對5-HT的超敏先于內膜增厚及其他與動脈粥樣硬化有關的肉眼形態學變化[11]。以上研究為本實驗動物模型的構建提供了充分的依據。本研究結果顯示硅膠管包裹大鼠頸動脈3 d,血管對5-HT的收縮反應增加;包管1周,血管對5-HT的反應敏感性及收縮反應強度均明顯增加,與以上研究結果一致,進一步證實外膜慢性損傷的早期階段血管中膜平滑肌細胞收縮性增強。硅膠管包裹大鼠頸動脈2周,隨著彌漫性新生內膜形成,血管對5-HT的反應敏感性及收縮反應強度均恢復至對照側水平。
3.3 硅膠管包裹大鼠頸動脈導致血管中膜平滑肌細胞慢性持續性收縮
本實驗利用硅膠管對血管外膜慢性刺激,構建血管收縮性增強的動物模型的另一依據來源于目前已廣泛應用于研究蛛網膜下腔出血致腦血管痙攣機制的大鼠股動脈模型,該動物模型將自體血放置于大鼠股動脈外證實血管外膜刺激能導致血管慢性痙攣,表現為血管中膜增厚,血管腔橫截面積縮小[4,5]。本實驗應用硅膠管包裹大鼠頸動脈損傷血管外膜后,包管部位血管腔橫截面積明顯縮小,同時伴損傷側頸動脈血流量明顯降低。進一步測量分析發現硅膠管包裹早期尤其是在包管后1周時血管外彈力板內面積及內彈力板內面積均明顯縮小,中膜面積無變化、而中膜厚度明顯增加,同時伴有內彈力板彎曲,說明此階段血管腔縮小主要源于中膜平滑肌的慢性收縮,與早期Iplikcioglu等[12]在大鼠股動脈觀察的結果一致。包管后2周同樣表現為血管腔橫截面積縮小;不同的是內彈力板彎曲現象消失,內彈力板內面積無明顯變化,出現彌漫性內膜增生,說明此階段血管腔縮小主要源于血管壁結構性重構,表現為血管中膜增厚及新生內膜形成。以上結果證實硅膠管包裹大鼠頸動脈刺激血管外膜的的早期階段血管中膜平滑肌細胞慢性持續性收縮,導致血管慢性痙攣。
血管外膜慢性損傷能引起血管收縮功能的改變,表現為血管中膜平滑肌慢性收縮、血流量降低及對血管5-HT的收縮反應敏感性增強。血管收縮功能的改變出現在內膜增生性病變之前。該動物模型可以被用來研究血管外膜慢性損傷致血管痙攣的機制及觀察抗痙攣藥物的療效。
[1]González MC,Arribas1 SM,Molero1 F.Effect of removal of adventitiaonvascularsmoothmusclecontractionandrelaxation[J].AmJPhysiol Heart Circ Physiol,2001,280(6):H2876-H2881.
[2]Booth RFG,Martin JF,Honey AC,et al.Rapid development of atherosclerotic lesions in the rabbit carotid artery induced by perivascular manipulation[J].Atherosclerosis,1989,76(2-3):257-268.
[3]Villa AE,Guzman LA,Chen W,et al.Local delivery of dexamethasone for prevention of neointimal proliferation in a rat model of balloon angioplasty[J].JClin Invest,1994,93(3):1243-1249.
[4]Clatterbuck RE,Oshiro EM,Hoffman PA,et al.Inhibition of vasospasm with lymphocyte function-associated antigen-1 monoclonal antibody in a femoral artery model in rats[J].JNeurosurg,2002,97(3):676-682.
[5]Choi JM,Shin YW,Hong KW.Rebamipide prevents periarterial blood-inducedvasospasmintheratfemoralarterymodel[J].Pharmacol Res,2001,43(5):489-496.
[6]Henry PD,Yokoyama M.Supersensitivityof atherosclerotic rabbit aortatoergonovine.Mediationbyaserotonergic mechanism[J].JClin Invest,1980,66(2):306-313.
[7]Shimokawa H,Tomoike H,Nabeyama S,et al.Coronary artery spasm induced in miniature swine:angiographic evidence and relation to coronary atherosclerosis[J].Am Heart J,1985,110(2):300-310.
[8]Kandabashi T,Shimokawa H,Mukai Y,et al.Involvement of Rho-Kinasein Agonists-Induced Contractions of Arteriosclerotic Human Arteries[J].Arteriosc Throm Vasc Biol,2002,22(2):243-248.
[9]Mcfddden EP,Clarke JG,Davies GJ,et al.Effect of intracoronary serotonin on coronary vessels in patients with stable angina and patients with variant angina[J].N Engl JMed,1991,324(10):648-654.
[10]關啟剛,曾定尹,孫喜琢,等.RhoK激酶在小型豬IL-1β介導的冠狀動脈痙攣中的作用機制[J].中華心血管病雜志,2006,34(1):50-54.
[11]Van Put DJM,Van Hove CE,De Meyer GRY,et al.Dexamethasone influences intimal thickening and vascular reactivity in the rabbit collared carotid artery[J].Eur JPharmacol,1995,294(2-3):753-761.
[12]Iplikcioglu AC,Bayar MA,Sav A,et al.Angiotensin-converting enzymeinhibitor cilazapril preventschronic morphologic vasospasmin rat[J].Surg Neurol,1994,41(4):294-298.

