轉(zhuǎn)基因飼料的PCR檢測(cè)策略
河南農(nóng)業(yè)大學(xué)牧醫(yī)工程學(xué)院 管慶豐
農(nóng)業(yè)部飼料生物技術(shù)重點(diǎn)實(shí)驗(yàn)室
中國農(nóng)業(yè)科學(xué)院飼料研究所基因工程研究室 王秀敏 楊雅麟 滕 達(dá) 尹清強(qiáng) 王建華*
我國是世界第二飼料生產(chǎn)大國,飼料產(chǎn)業(yè)已成為國民經(jīng)濟(jì)發(fā)展支柱產(chǎn)業(yè)之一。由于轉(zhuǎn)基因作物大量進(jìn)入飼料領(lǐng)域,給飼料行業(yè)質(zhì)量檢測(cè)帶來新課題,為了保證飼料安全與有效監(jiān)管,建立科學(xué)可行的飼料轉(zhuǎn)基因成分檢測(cè)方法非常重要。由于飼料由多種飼料原料按照一定比例混合而成,飼料轉(zhuǎn)基因檢測(cè)在繼承既有轉(zhuǎn)基因植物食品檢測(cè)方法的基礎(chǔ)上還需要兼顧飼料特點(diǎn),過去這方面工作相對(duì)薄弱,本文針對(duì)飼料轉(zhuǎn)基因檢測(cè)策略及特點(diǎn)進(jìn)行概述。
1 轉(zhuǎn)基因飼料
1.1 轉(zhuǎn)基因飼料中所含轉(zhuǎn)基因植物 表1為中國近年所批準(zhǔn)種植或進(jìn)口的用于飼料的玉米、大豆及油菜清單。
1.2 轉(zhuǎn)基因飼料PCR檢測(cè)的影響因素
1.2.1 飼料成分復(fù)雜給轉(zhuǎn)基因成分檢測(cè)技術(shù)帶來挑戰(zhàn) (1)飼料原料種類多,其中植物源轉(zhuǎn)基因成分主要有能量飼料(如玉米、油脂等)和蛋白質(zhì)飼料(大豆餅粕、棉籽餅粕、油菜餅粕等)。由于不同類型和不同用途的飼料組成相差較大,造成轉(zhuǎn)基因成分檢測(cè)的復(fù)雜性,如需要檢測(cè)的基因多、盲測(cè)的幾率大等問題。一些送檢樣品成分標(biāo)識(shí)不全或未如實(shí)標(biāo)識(shí),也增加了檢測(cè)難度和周期。(2)復(fù)雜飼料產(chǎn)品中轉(zhuǎn)基因成分的檢測(cè)不同于單一作物及其加工品,含多種轉(zhuǎn)基因作物成分,每種轉(zhuǎn)基因成分相對(duì)含量降低,這增加了檢測(cè)的難度和復(fù)雜度。(3)由于飼料組成成分復(fù)雜,提取的DNA是多種作物DNA的混合物,這為后續(xù)轉(zhuǎn)基因成分PCR檢測(cè)造成一定困難。如表1所示,在飼料中,一種外源基因可能存在于不同原料中,如Bt176和MON810都含有Cry1Ab基因,Bt11和T25都含有修飾的PAT基因等;或者是一種飼料原料含有不同外源基因,如59122玉米同時(shí)含有耐除草劑基因 PAT及抗蟲基因 Cry34ab1和 Cry35Ab1,TC1507同時(shí)含有耐除草劑基因PAT和抗蟲基因Cry1Fa2等。當(dāng)這些具有相同外源基因的不同原料及具有不同外源基因的相同原料混合到一起時(shí),使定性定量檢測(cè)變得更復(fù)雜。
1.2.2 飼料加工對(duì)轉(zhuǎn)基因成分及其檢測(cè)的影響飼料的基本加工工藝包括先粉碎后配料加工工藝和先配料后粉碎加工工藝,這兩種工藝均包括以下加工環(huán)節(jié):原料接收、粉碎、配料、混合、制粒或膨化、成品包裝:(1)用于飼料原料的餅粕中DNA經(jīng)過浸提、壓榨等工藝后,大部分已經(jīng)被降解,玉米蛋白粉在加工過程中DNA也大部分降解(Angela和Mae,2001)。膨化及制粒使飼料發(fā)生一系列物理、化學(xué)變化,蛋白質(zhì)的變性和剪切、核酸斷裂等,增加轉(zhuǎn)基因成分檢測(cè)的難度和靈敏度,從而影響檢測(cè)。飼料原料經(jīng)高溫高壓等加工工藝后,大片段DNA會(huì)降解為小片段,加熱時(shí)間越長(zhǎng),溫度越高,降解越明顯(Vijayakumar等,2009)。 DNA的降解可能造成假陽性的結(jié)果。(2)飼料混合對(duì)飼料原料的轉(zhuǎn)基因成分沒有降解作用,但增加轉(zhuǎn)基因成分檢測(cè)背景的復(fù)雜性,飼料混合均勻度不同,飼料中轉(zhuǎn)基因成分添加量不均衡,會(huì)影響檢測(cè)結(jié)果。(3)粉碎對(duì)蛋白質(zhì)、DNA等成分溶出有影響。

表1 中國近年批準(zhǔn)種植或進(jìn)口的用于飼料的玉米及大豆
2 轉(zhuǎn)基因飼料PCR檢測(cè)策略
2.1 轉(zhuǎn)基因檢測(cè)的不同層次 轉(zhuǎn)基因檢測(cè)按特異性有4種層次:通用元件檢測(cè)、基因特異性檢測(cè)、構(gòu)建特異性檢測(cè)及品系特異性檢測(cè),特異性依次升高。(1)通用元件特異性:針對(duì)轉(zhuǎn)基因常用的啟動(dòng)子和終止子等構(gòu)件進(jìn)行檢測(cè)。常用的通用元件為花椰菜花葉病毒CaMV 35S啟動(dòng)子,NOS終止子,CaMV 35S終止子等 (Barbau-Piednoir等,2010)。(2)基因特異性:針對(duì)插入的性狀基因進(jìn)行檢測(cè)。轉(zhuǎn)基因作物常見的性狀有抗蟲類,多為蘇云金芽孢桿菌內(nèi)毒素家族,有Cry1Ab(Lutz等,2006),Cry1Ac、Cry3Bb1 及 Cry1Fa 等; 抗除草劑類, 常見的有 cp4 epsps (Alexander等,2006)和PAT(張舒亞等,2007)基因等。 (3)構(gòu)建特異性:針對(duì)載體的構(gòu)件特異性進(jìn)行檢測(cè)。(4)品系特異性:針對(duì)插入序列與內(nèi)源基因的邊界序列進(jìn)行檢測(cè)。每種轉(zhuǎn)基因作物的品系的邊界序列是唯一的,在邊界序列設(shè)計(jì)引物可以特異地對(duì)飼料原料進(jìn)行品系特異性檢測(cè)。圖1為4種檢測(cè)層次。Rudi等(2003)針對(duì)MON 810等7種轉(zhuǎn)基因玉米成分設(shè)計(jì)引物,采用了基因特異性、構(gòu)件特異性及品系特異性PCR檢測(cè)方法,有效地檢測(cè)出了飼料及食品中的轉(zhuǎn)基因玉米成分。
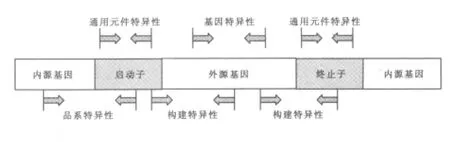
圖1 4種轉(zhuǎn)基因檢測(cè)水平圖示
2.2 PCR檢測(cè)策略及應(yīng)用 常規(guī)PCR、巢氏PCR、降落式PCR、復(fù)合PCR及實(shí)時(shí)定量PCR等PCR技術(shù)及不同檢測(cè)水平組成了轉(zhuǎn)基因飼料檢測(cè)策略。圖2為轉(zhuǎn)基因飼料PCR檢測(cè)常見策略。
2.2.1 常規(guī)PCR法 常規(guī)PCR常用于定性檢測(cè)飼料原料是否含有轉(zhuǎn)基因成分。鑒于加工工藝對(duì)DNA片段的降解,引物設(shè)計(jì)擴(kuò)增片段不宜過大,避免由于大片段的降解而出現(xiàn)假陽性的結(jié)果。Tengel等(2001)對(duì)飼料中的轉(zhuǎn)基因大豆和玉米及原料進(jìn)行檢測(cè)發(fā)現(xiàn),玉米和大豆的檢測(cè)靈敏度為30~200 bp。
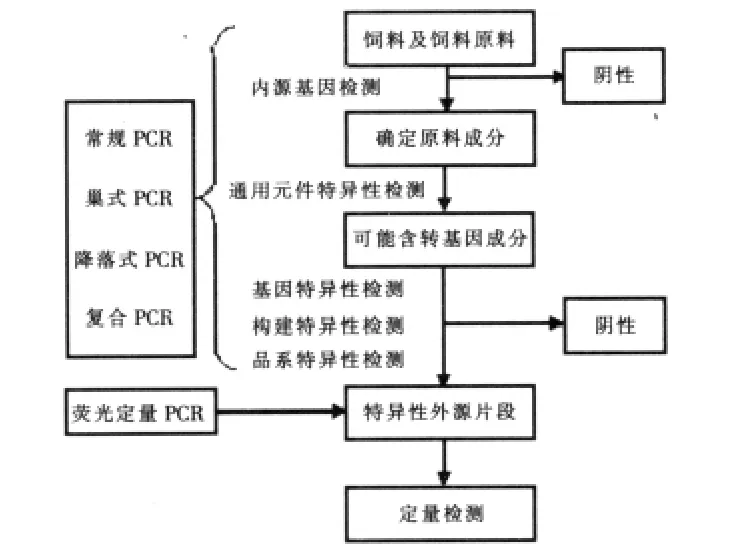
圖2 轉(zhuǎn)基因飼料檢測(cè)策略
2.2.2 巢式PCR法 巢式PCR是常規(guī)PCR的一種改良模式,使用巢式PCR對(duì)目的基因進(jìn)行多輪連續(xù)擴(kuò)增,可提高靈敏度和特異性。在飼料等深加工產(chǎn)品中,DNA片段部分降解,且混合后相對(duì)濃度降低,常規(guī)PCR擴(kuò)增時(shí)會(huì)出現(xiàn)假陰性結(jié)果。巢式PCR則可彌補(bǔ)這一缺陷。Zhang等(2007)用三重巢式PCR技術(shù)檢測(cè)抗草甘膦大豆深加工產(chǎn)品,檢 測(cè) 基 因 為 lectin、CaMV 35S、CTP、CP4~EPSPS和NOS,靈敏度達(dá)0.005%。陶冉等(2007)利用巢式PCR對(duì)水產(chǎn)飼料和食品中的轉(zhuǎn)基因成分的檢測(cè)發(fā)現(xiàn),轉(zhuǎn)基因大豆不同稀釋度DNA溶液用常規(guī)PCR擴(kuò)增靈敏度為1%,經(jīng)引物 F1R1(532 bp)、F2R2(324 bp)擴(kuò)增以后,分別采用F2R2或F3R3(254 bp)進(jìn)行第二輪擴(kuò)增,采用F1R1-F2R2兩對(duì)引物進(jìn)行巢式PCR擴(kuò)增,檢測(cè)靈敏度為0.1%,而采用F2R2、F3R3兩對(duì)引物進(jìn)行巢式PCR擴(kuò)增,檢測(cè)靈敏度為0.01%。說明巢式PCR可提高檢測(cè)靈敏性,且在一定范圍內(nèi)檢測(cè)的目的片段越小,靈敏度越高。但巢式要經(jīng)多輪PCR反應(yīng),檢測(cè)時(shí)間相對(duì)于常規(guī)PCR檢測(cè)時(shí)間更長(zhǎng),不利于大規(guī)模的轉(zhuǎn)基因樣品檢測(cè)。
2.2.3 降落式PCR法 降落式PCR對(duì)常規(guī)PCR的優(yōu)化體現(xiàn)在退火溫度上,可以有效避免非特異產(chǎn)物的出現(xiàn)。降落式PCR可以單獨(dú)使用,也可以與其他PCR方法結(jié)合。Forte等(2005)用降落式PCR同復(fù)合PCR結(jié)合,分別擴(kuò)增出了轉(zhuǎn)基因玉米Bt176的內(nèi)源基因及35S啟動(dòng)子,Roundup Ready轉(zhuǎn)基因大豆內(nèi)源基因、35S啟動(dòng)子及NOS終止子和轉(zhuǎn)基因玉米Bt11內(nèi)源基因、35S啟動(dòng)子及NOS終止子,檢測(cè)最低限是0.5%。
2.2.4 復(fù)合PCR法 復(fù)合PCR是在一個(gè)PCR反應(yīng)體系中加入兩對(duì)或多對(duì)不同的引物,分別與相對(duì)應(yīng)的模板反應(yīng),在同一個(gè)反應(yīng)體系中擴(kuò)增出多條目的DNA片段。同常規(guī)PCR相比,擴(kuò)增相同條數(shù)的目的DNA,復(fù)合PCR具有時(shí)間短、效率高,經(jīng)濟(jì)便捷等優(yōu)點(diǎn),同時(shí)又具有常規(guī)PCR反應(yīng)的靈敏性和特異性,非常適合用于飼料中若干原料的轉(zhuǎn)基因檢測(cè)。于忠娜等(2007)以大豆內(nèi)源基因、35S啟動(dòng)子、NOS終止子和35S~CTP4為檢測(cè)對(duì)象,研究了對(duì)內(nèi)源基因與外源基因的引物終濃度配比及退火溫度對(duì)轉(zhuǎn)基因豆粕多重PCR檢測(cè)的影響,結(jié)果表明,建立的多重PCR方法能夠準(zhǔn)確地檢測(cè)出豆粕中的內(nèi)源基因和外源轉(zhuǎn)基因成分。Hernández 等 (2005)針 對(duì) MON810、Bt11、T25 及GA21基因設(shè)計(jì)特異性的引物,在一個(gè)PCR反應(yīng)體系中擴(kuò)增出468、280、177 bp及90 bp的目的片段,成功的鑒別出該4種轉(zhuǎn)基因玉米,靈敏度為0.05%。理論上,只要擴(kuò)增條件合適,引物對(duì)數(shù)量可以無限。但由于引物之間對(duì)模板的競(jìng)爭(zhēng)、引物與模板之間以及引物與酶之間的互作,往往達(dá)不到理想效果。在同一個(gè)反應(yīng)體系當(dāng)中,引物之間Tm值和退火溫度相差不能太大,引物之間互補(bǔ)堿基不能太多,否則易形成引物二聚體,擴(kuò)增片段之間也不能太接近(鄧鴻鈴等,2007),否則不易區(qū)分。聚丙烯酰胺凝膠電泳分離DNA時(shí),具有很高靈敏性,能檢測(cè)出差異為3~10 bp的DNA片段,可用于復(fù)合PCR擴(kuò)增產(chǎn)物檢測(cè)。同時(shí)聚丙烯酰胺凝膠電泳的靈敏度是瓊脂糖凝膠電泳的10倍左右,能獲得更高靈敏結(jié)果(馮家望等,2006)。
近年來,復(fù)合PCR與基因芯片結(jié)合越來越多地應(yīng)用到轉(zhuǎn)基因檢測(cè)上。Hamels等(2009)用多重PCR擴(kuò)增出目的片段,雜交于帶有熒光探針的基因芯片上,從通用元件特異性、基因特異性及品系特異性3個(gè)層次成功地檢測(cè)出了轉(zhuǎn)基因玉米、大豆及油菜等多種轉(zhuǎn)基因作物,靈敏度≤0.1%。這種方法的優(yōu)勢(shì)在于:(1)由于特異性探針的存在,即使出現(xiàn)非特異性擴(kuò)增,也不會(huì)被檢測(cè)出來,所以特異性非常高(Alexandre 等,2001)。 (2)可以把多個(gè)復(fù)合PCR的產(chǎn)物集合在同一個(gè)基因芯片上進(jìn)行同步檢測(cè),既實(shí)現(xiàn)了高通量,且省時(shí)省力。
2.2.5 定量PCR法 由于轉(zhuǎn)基因作物的含量是進(jìn)行轉(zhuǎn)基因標(biāo)識(shí)的依據(jù),所以對(duì)轉(zhuǎn)基因的定量分析非常重要。轉(zhuǎn)基因作物的定量PCR非常靈敏,且和提取工藝也有一定關(guān)系 (Charels等,2007),高質(zhì)量及純度的提取方法對(duì)定量檢測(cè)非常重要。徐淼鋒等(2009)用熒光定量PCR技術(shù)對(duì)轉(zhuǎn)基因菜籽粕CaMV 35S啟動(dòng)子、NOS終止子及NPTⅡ檢測(cè)時(shí)發(fā)現(xiàn),深加工的菜籽粕內(nèi)、外源基因的Ct值一般都出現(xiàn)較晚,且使用DNA濃度低于100 ng/μL 或高于 1500 ng/μL 時(shí) Ct值都大于 40,建議模板使用濃度為500~1300 ng/μL。
隨著實(shí)時(shí)定量PCR技術(shù)的發(fā)展,對(duì)多種轉(zhuǎn)基因成分同時(shí)進(jìn)行實(shí)時(shí)定量檢測(cè)成為可能。針對(duì)不同目的基因設(shè)計(jì)不同熒光基團(tuán),可在同一個(gè)PCR體系中同時(shí)檢測(cè)兩種以上轉(zhuǎn)基因成分的含量。多重定量PCR同時(shí)具有多重PCR和定量PCR的優(yōu)點(diǎn),探針的存在有效地避免了假陽性的存在。Oguchi等(2009)用雙重實(shí)時(shí)定量PCR同時(shí)檢測(cè)花椰菜花葉病毒35S啟動(dòng)子及GA21玉米特異性基因,檢測(cè)效果與單一的檢測(cè)效果差異很小,并可減少一半時(shí)間及成本。但熒光定量PCR儀器及探針成本較高,是制約該方法普及的一個(gè)重要因素。
3 小結(jié)及展望
綜上所述,轉(zhuǎn)基因飼料檢測(cè)的實(shí)質(zhì)是在不同的特異性檢測(cè)水平上,用一系列檢測(cè)技術(shù)有針對(duì)性地對(duì)轉(zhuǎn)基因飼料原料進(jìn)行快速、靈敏及高通量檢測(cè)。隨著生物技術(shù)日益成熟,轉(zhuǎn)基因作物品系越來越多,由于具有雙親的優(yōu)點(diǎn),轉(zhuǎn)基因雜交品系也越發(fā)受歡迎,目前尚未有有效方法將兩者區(qū)分開,這是轉(zhuǎn)基因飼料成分檢測(cè)技術(shù)研究需要加強(qiáng)的方向。飼料原料的復(fù)雜性及加工工藝的特殊性等因素,也都給轉(zhuǎn)基因飼料檢測(cè)帶來挑戰(zhàn)。PCR技術(shù)可使基因片段指數(shù)擴(kuò)增,有效地放大轉(zhuǎn)基因信號(hào),加上PCR技術(shù)與其他技術(shù)結(jié)合,如PCR-ELISA、PCR-基因芯片、PCR-生物傳感器等 (陳福生等,2004),可以滿足不同檢測(cè)需要,但是需要針對(duì)不同飼料產(chǎn)品的特點(diǎn)進(jìn)行優(yōu)化和完善,這是轉(zhuǎn)基因飼料檢測(cè)值得引起重視的新課題。
[1]陳福生,高志賢,王建華.食品安全檢測(cè)與現(xiàn)代生物技術(shù)[M].北京:化學(xué)工業(yè)出版社,2004.,162 ~ 184.
[2]鄧鴻鈴,郭新東,吳玉鑾.利用PCR方法檢測(cè)水稻及其加工產(chǎn)品中轉(zhuǎn)基因水稻[J].食品科技,2007,32(2):248 ~ 251.
[3]馮家望,王小玉,李丹琳.多重PCR檢測(cè)食品中轉(zhuǎn)基因成分研究[J].檢驗(yàn)檢疫科學(xué),2006,16(4):16 ~ 19.
[4]陶冉,劉梅,王雷,等.應(yīng)用巢式PCR技術(shù)對(duì)水產(chǎn)飼料及食品轉(zhuǎn)基因成分檢測(cè)的研究[J].飼料工業(yè),2007,28(21):34 ~ 38.
[5]徐淼鋒,尹浩,莫義武,等.實(shí)時(shí)熒光PCR定量檢測(cè)菜籽粕中轉(zhuǎn)基因成分的研究[J].植物檢疫,2009,23(1):4 ~ 6.
[6]于忠娜,苗向陽,單虎.豆粕飼料中轉(zhuǎn)基因成分的多重PCR快速檢測(cè)[J].動(dòng)物醫(yī)學(xué)進(jìn)展,2007,28(1):53 ~ 56.
[7]張舒亞,潘良文,呂蓉,等.飼料中轉(zhuǎn)基因成分的實(shí)時(shí)熒光PCR檢測(cè)研究[J].中國飼料,2007,(19):9 ~ 11,19.
[8]Alexandre I,Hamels S,Dufour S,et al.Colorimetric Silver Detection of DNA Microarrays[J].Analytical Biochemistry,2001,295(1):1 ~ 8.
[9]Barbau-Piednoir E,Lievens A,Mbongolo-Mbella G,et al.SYBR Green qPCR screening methods for the presence of “35S promoter”and “NOS terminator”elements in food and feed products[J].Eruopean Food Research and Technology,2010,230(3):383 ~ 393.
[10]Charels D,Broeddrs S,Corbisier P,et al.Toward metrological traceability forDNA fragmentratiosin GM quantification.2.Systematic study of paratmters influencing the quantitative determination of MON810 corn by real-time PCR[J].Agricultual and Food Chemistry,2007,55(9):3258 ~ 3267.
[11]Forte V T,Di Pinto A,Martino C.A general multiplex-PCR assay for the general detection of genetically modified soya and maize[J].Food Control,2005,16(6):535 ~ 539.
[12]Hamels S,Glouden T,Gillard K,et al.A PCR-microarray method for the screening of genetically modified organisms[J].European Food Research and Technology,2009,228(4):531 ~ 541.
[13]Hernández M,Rodríguez-Lázaro D,Zhang D,et al.Interlaboratory Transfer of a PCR Multiplex Method for Simultaneous Detection of Four Genetically Modified Maize Lines:Bt11,MON810,T25,and GA21[J].Journal of Agricultural and Food Chemistry,2005,53(9):3333 ~ 3337.
[14]Lutz B,Wiedemann S,Albrecht C.Degradation of transgenic Cry1Ab DNA and protein in Bt-176 maize during the ensiling process[J].Journal of Animal Physiology and Animal Nutrition,2006,90(3 ~ 4):116 ~ 123.
[15]Oguchi T,Onishi M,Minegishi Y.Development of quantitative duplex real-time PCR method for screening analysis of genetically modified maize[J].Journal of Food Hygienic Society of Japan,2009,50(3):117 ~ 25.
[16]Rudi K,Rud I,Holck A.A novel multiplex quantitative DNA array based PCR (MQDA-PCR)for quantification of transgenic maize in food and feed[J].Nucleic Acids Research,2003,31(11):e62.
[17]TengelC,SchüβlerP,Setzke E,etal.PCR-Based Detection of Genetically Modified Soybean and Maize in Raw and Highly Processed Foodstuffs[J].BioTechniques,2001,31(2):426 ~ 429.
[18]Vijayakumar K R,Martin A,Gowda L R,et al.Detection of genetically modified soy and maize:impact of heat processing [J].Food Chemistry,2009,117:514 ~ 521.
[19]Zhang M H,Gao X J,Yu Y B,et al.Detection of Roundup Ready soy in highly processed products by triplex nested PCR[J].Food Control,2007,18(10):1277 ~ 1281.

