腺病毒介導(dǎo)HGF基因轉(zhuǎn)染對人脂肪干細(xì)胞生物學(xué)特性影響的研究
吳一杰 王黔 穆大力 欒杰
腺病毒介導(dǎo)HGF基因轉(zhuǎn)染對人脂肪干細(xì)胞生物學(xué)特性影響的研究
吳一杰 王黔 穆大力 欒杰
目的觀察腺病毒介導(dǎo)的HGF基因轉(zhuǎn)染對人脂肪干細(xì)胞(Human adipose-derived stem cells,hADSCs)生物學(xué)特性的影響。方法利用腺病毒介導(dǎo)HGF(MOI=200)轉(zhuǎn)染hADSCs,檢測轉(zhuǎn)染組細(xì)胞目的基因HGF表達(dá)情況,并與未轉(zhuǎn)染組細(xì)胞的形態(tài)、細(xì)胞生長曲線、細(xì)胞表面標(biāo)志物、細(xì)胞周期和成脂、成骨誘導(dǎo)分化能力進(jìn)行比較。結(jié)果hADSCs轉(zhuǎn)染24 h后,即可檢測出HGF,并于48 h后達(dá)到高峰,1周后HGF表達(dá)逐漸降低。hADSCs轉(zhuǎn)染后仍呈成纖維細(xì)胞樣生長,其生長增殖能力與未轉(zhuǎn)染hADSCs無明顯差別;轉(zhuǎn)染后的hADSCs仍表達(dá)CD44、CD90、CD49d、CD105,不表達(dá)CD45、CD34、CD31、CD106和STRO-1。轉(zhuǎn)染組與未轉(zhuǎn)染組細(xì)胞周期、成脂和成骨誘導(dǎo)分化能力無明顯差別。結(jié)論腺病毒表達(dá)載體介導(dǎo)HGF基因轉(zhuǎn)染hADSCs并不影響其生物學(xué)特性,是將hADSCs用于基因治療的良好途徑。
人脂肪干細(xì)胞 腺病毒表達(dá)載體 基因轉(zhuǎn)染 生物學(xué)特性
人脂肪干細(xì)胞 (Human adipose derived stem cells,hADSCs)是組織工程理想的種子細(xì)胞,由Zuk等[1]于2001年首次分離獲得。hADSCs具有來源豐富、易于獲取、自體移植可以避免排斥反應(yīng)、可分化為多種中胚層來源細(xì)胞及跨胚層分化等優(yōu)點(diǎn)[2-4]。研究證實(shí),hADSCs在體外培養(yǎng)可以穩(wěn)定增殖,在不同的誘導(dǎo)條件下,hADSCs可誘導(dǎo)分化為脂肪細(xì)胞、成骨細(xì)胞和軟骨細(xì)胞等[5]。利用種子細(xì)胞作為基因治療的載體具有廣闊的應(yīng)用前景,而hADSCs是外源性基因的最為有效的細(xì)胞載體之一,可使外源性基因在體內(nèi)持續(xù)地發(fā)揮生物學(xué)作用。腺病毒轉(zhuǎn)染是調(diào)控基因、構(gòu)建基因表達(dá)載體最有利的工具之一[6],而腺病毒可以高效轉(zhuǎn)染hADSCs。肝細(xì)胞生長因子(Hepatocyte growth factor,HGF)具有強(qiáng)大的促血管生長作用[7],將HGF利用腺病毒轉(zhuǎn)染到hADSCs中并移植到受區(qū),使HGF在受區(qū)持續(xù)發(fā)揮促血管生長作用,是再生醫(yī)學(xué)中具有廣闊應(yīng)用前景的治療方式。但腺病毒介導(dǎo)HGF轉(zhuǎn)染對hADSCs生物學(xué)特性是否有影響尚不十分清楚,如果改變其生物學(xué)特性可能會(huì)對以后的實(shí)驗(yàn)及臨床應(yīng)用造成一定影響。因此,本研究擬針對Ad-HGF轉(zhuǎn)染的hADSCs與未經(jīng)轉(zhuǎn)染的hADSCs的生物學(xué)特性進(jìn)行比較。
1 材料
1.1 腺病毒
攜帶人肝細(xì)胞生長因子基因的腺病毒基因表達(dá)載體(Ad-HGF)和攜帶綠色熒光蛋白基因的腺病毒載體(Ad-GFP)由軍事醫(yī)學(xué)科學(xué)院放射醫(yī)學(xué)研究所實(shí)驗(yàn)血液學(xué)實(shí)驗(yàn)室饋贈(zèng)。
1.2 人脂肪組織來源
脂肪來源于中國醫(yī)學(xué)科學(xué)院整形外科醫(yī)院吸脂患者。經(jīng)知情同意,局麻下行腹部抽脂,獲取脂肪顆粒,生理鹽水充分洗滌,靜置約10 min,去除上清液,獲得純度較高的脂肪顆粒。
1.3 主要試劑
L-DMEM培養(yǎng)基、胎牛血清(HyClone公司);Ⅰ型膠原酶、胰蛋白酶、卡那霉素、青霉素、誘導(dǎo)培養(yǎng)基(Sigma公司);ELISA檢測試劑盒 (R&D公司);MTT (Amerison公司);CD90、CD44、CD49d、CD105、CD34、CD31、CD45、CD106、STRO-1(Sigma公司)。
2 實(shí)驗(yàn)方法
2.1 細(xì)胞培養(yǎng)
取10 mL脂肪顆粒加入0.125%Ⅰ型膠原酶10 mL,37℃搖床250 r/min震蕩消化45 min,然后用等量含10%胎牛血清的L-DMEM中和膠原酶,1 300 g離心7 min,去上層未消化的脂肪組織及上清,加3 mL L-DMEM懸浮沉淀物,篩網(wǎng)過濾,再次離心,棄上清,加入10 mL含10%胎牛血清LDMEM重懸沉淀物,再次篩網(wǎng)過濾,接種至培養(yǎng)皿中。次日換液,之后每隔2 d換液,7 d后胰蛋白酶消化傳代。第2代hADSCs用于轉(zhuǎn)染、檢測以及誘導(dǎo)等。選擇L-DMEM,是因?yàn)長-DMEM更適合培養(yǎng)hADSCs,低糖可能更有利于維持hADSCs的多向分化潛能[8-9]。
2.2 腺病毒擴(kuò)增純化及滴定
2.2.1 利用293細(xì)胞擴(kuò)增腺病毒
將293細(xì)胞接種于150 mm平皿,擴(kuò)增至60個(gè)平皿,待細(xì)胞生長至90%融合時(shí)進(jìn)行病毒感染,感染48 h后細(xì)胞出現(xiàn)完全細(xì)胞病變效應(yīng)時(shí),收集細(xì)胞及少量上清液,液氮和室溫下反復(fù)凍融3次,使細(xì)胞破裂釋出病毒顆粒,2 500 r/min離心10 min,棄細(xì)胞碎片,收集上清液約10 mL,-80℃保存。
2.2.2 氯化銫密度梯度離心法純化病毒
依次將1.4 g/mL CsCL溶液 2.5 mL、1.2 g/mL CsCL溶液2.5 mL加入超速離心管中,將凍融后的待純化病毒加于CsCL梯度溶液之上。28 000 r/min 10℃離心2 h,1.4 g/mL CsCL溶液和1.2 g/mL CsCL溶液之間出現(xiàn)白色霧狀病毒帶,上層為缺陷病毒,下層為完整病毒,盡量吸取下層病毒,與 1.3 g/mL CsCL溶液5 mL混合,28 000 r/min 10℃離心16 h。吸取白色霧狀病毒帶,以1~2倍體積的PBS稀釋。以PBS為透析液于4℃透析病毒,每2 h更換一次透析液,共換5次。取出純化的病毒,加入滅菌甘油至終濃度為10%,分裝,-80℃凍存。
2.2.3 噬斑分析法滴定病毒滴度
病毒濃度梯度的配制:10-2~10-14,加入96孔板中,每個(gè)孔加100 μL對應(yīng)濃度的病毒,對照組直接加100 μL培養(yǎng)基。培養(yǎng)10 d后,觀察各孔噬斑和CPE現(xiàn)象,確定病毒滴度。以最高濃度孔為全陽、最低濃度孔和對照孔為全陰的測定結(jié)果為有效結(jié)果。感染滴度(pfu/mL)=平均噬斑數(shù)×稀釋倍數(shù),根據(jù)公式計(jì)算病毒滴度為:2×1011pfu/mL。
2.3 篩選轉(zhuǎn)染濃度
將第2代細(xì)胞接種于24孔板中,等細(xì)胞生長至80%融合,Ad-GFP、Ad-HGF分別以 MOI為50、100、200、300、400、500、1 000轉(zhuǎn)染hADSCs。方法如下:吸棄孔內(nèi)培養(yǎng)基,加入Ad-HGF、Ad-GFP的無血清L-DMEM培養(yǎng)基,37℃,5%CO2孵育2 h,期間搖勻2次,去除含病毒培養(yǎng)基,然后換成含10 mL 10%胎牛血清的L-DMEM繼續(xù)培養(yǎng)。每天用熒光顯微鏡觀察細(xì)胞狀態(tài)和GFP綠色熒光蛋白的表達(dá)情況。24 h、48 h收集Ad-HGF組細(xì)胞上清液之后,每隔48 h收集該組細(xì)胞上清液(-80℃凍存),持續(xù)至第10天。
2.4 細(xì)胞形態(tài)學(xué)觀察
將第2代hADSCs接種于6孔板中,分為對照組和轉(zhuǎn)染組,為了便于觀察單個(gè)細(xì)胞形態(tài),待hADSCs長到60%融合時(shí)即可轉(zhuǎn)染,以MOI=200轉(zhuǎn)染2 h,更換含10%胎牛血清的L-DMEM,1 d后鏡下觀察細(xì)胞形態(tài),連續(xù)觀察10 d。
2.5 繪制轉(zhuǎn)染組和對照組hADSCs生長曲線
將第2代hADSCs以1×105cells/mL的密度接種于96孔板,待貼壁轉(zhuǎn)染組轉(zhuǎn)染腺病毒2 h,換成含10%胎牛血清的L-DMEM,次日開始MTT測定。兩組各選3孔加入20 μL MTT,37℃孵育4 h,吸棄含MTT的培養(yǎng)基,加入150 μL DMSO,振蕩10 min,使結(jié)晶物充分溶解,選擇490 nm波長,在酶聯(lián)免疫監(jiān)測儀上測定各孔光吸收值,記錄結(jié)果,以時(shí)間為橫坐標(biāo),吸光值為縱坐標(biāo)繪制細(xì)胞生長曲線。
2.6 細(xì)胞表面標(biāo)志物測定
將第1代hADSCs接種于6孔板中,待細(xì)胞80%融合,轉(zhuǎn)染3孔為實(shí)驗(yàn)組,另3孔為對照組。
2.7 細(xì)胞周期測定
將第2代hADSCs接種于24孔板中,每組細(xì)胞接種6孔,共18孔。待細(xì)胞80%融合時(shí),轉(zhuǎn)染9孔為實(shí)驗(yàn)組,另9孔為對照組,流式細(xì)胞儀檢測,得出兩組細(xì)胞的G2/G1周期。
2.8 誘導(dǎo)成脂和誘導(dǎo)成骨
2.8.1 成骨誘導(dǎo)
第2代hADSCs接種至6孔板中,其中3孔分別為轉(zhuǎn)染后加入成骨誘導(dǎo)培養(yǎng)基的實(shí)驗(yàn)組 (A組)、正常hADSCs加入誘導(dǎo)培養(yǎng)基的對照組 (B組),hADSCs加入普通全培養(yǎng)基的空白對照組(C組)。
成骨誘導(dǎo)培養(yǎng)基:0.1 μmol/L地塞米松、10 mmol/L β-甘油磷酸鈉、50 μmol/L抗壞血酸、含10%胎牛血清的L-DMEM。加入誘導(dǎo)培養(yǎng)基后,每3 d換液,至第20天。
2.8.2 成脂誘導(dǎo)
第2代hADSCs接種至6孔板中,其中3孔分別為轉(zhuǎn)染后加入誘導(dǎo)成脂培養(yǎng)基的實(shí)驗(yàn)組 (A組)、正常hADSCs加入誘導(dǎo)培養(yǎng)基的對照組 (B組)、hADSCs加入普通全培養(yǎng)基的空白對照組(C組)。
成脂誘導(dǎo)培養(yǎng)基:0.5 mol/L IBMX、1 μmol/L地塞米松、10 μmol/L胰島素、200 μmol/L消炎痛、含10%胎牛血清的L-DMEM。
加入培養(yǎng)基后,每3 d換液,至第14天,進(jìn)行油紅染色。
3 結(jié)果
3.1 轉(zhuǎn)染48 h后HGF表達(dá)量的測定
通過熒光顯微鏡觀察,Ad-GFP以MOI=100、 MOI=200、MOI=300時(shí)轉(zhuǎn)染效率均可達(dá)到90%以上;轉(zhuǎn)染組細(xì)胞上清液ELISA分析顯示,48 h時(shí)HGF表達(dá)量最高,Ad-HGF以MOI=200轉(zhuǎn)染時(shí)細(xì)胞HGF表達(dá)量最高(圖1)。
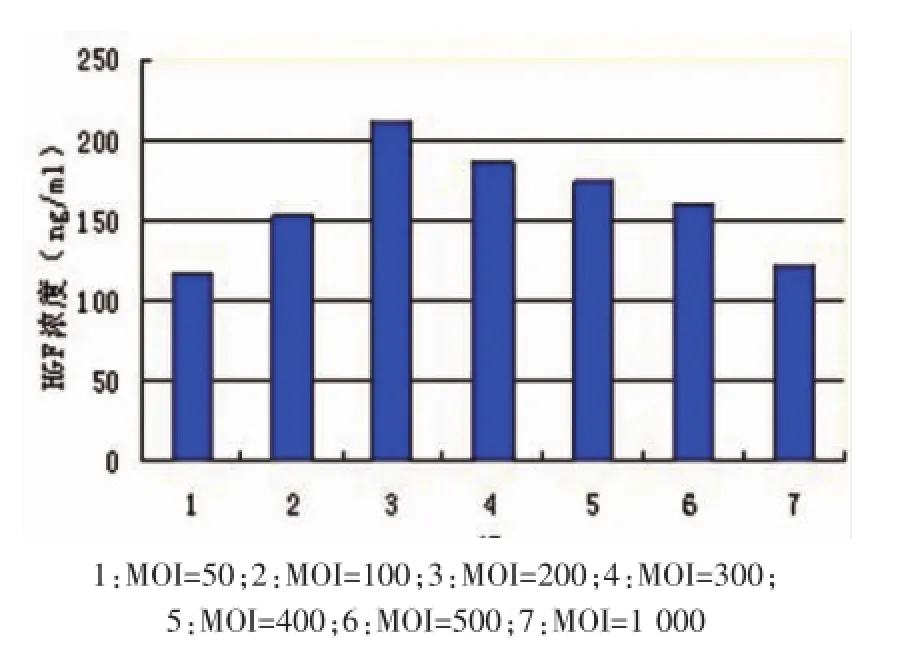
圖1 轉(zhuǎn)染48h后HGF表達(dá)量的測定
3.2 細(xì)胞形態(tài)
對照組和轉(zhuǎn)染組hADSCs在48 h時(shí),細(xì)胞均呈成纖維細(xì)胞樣生長,細(xì)胞形態(tài)未見明顯差異(圖2)。

圖2 兩組細(xì)胞形態(tài)未見明顯差異
3.3 細(xì)胞生長曲線
轉(zhuǎn)染組與對照組細(xì)胞生長曲線相似,數(shù)值相差甚小,生長趨勢吻合(圖3)。
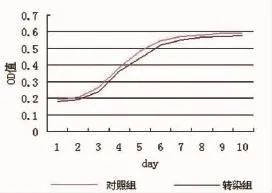
圖3 細(xì)胞生長曲線
3.4 細(xì)胞表面標(biāo)志物:
流式細(xì)胞儀測定細(xì)胞表面標(biāo)志物顯示,兩組細(xì)胞 CD44、CD90、CD49d、CD105均呈陽性表達(dá),CD45、CD34、CD31、CD106和STRO-1均呈陰性表達(dá)(圖4)。
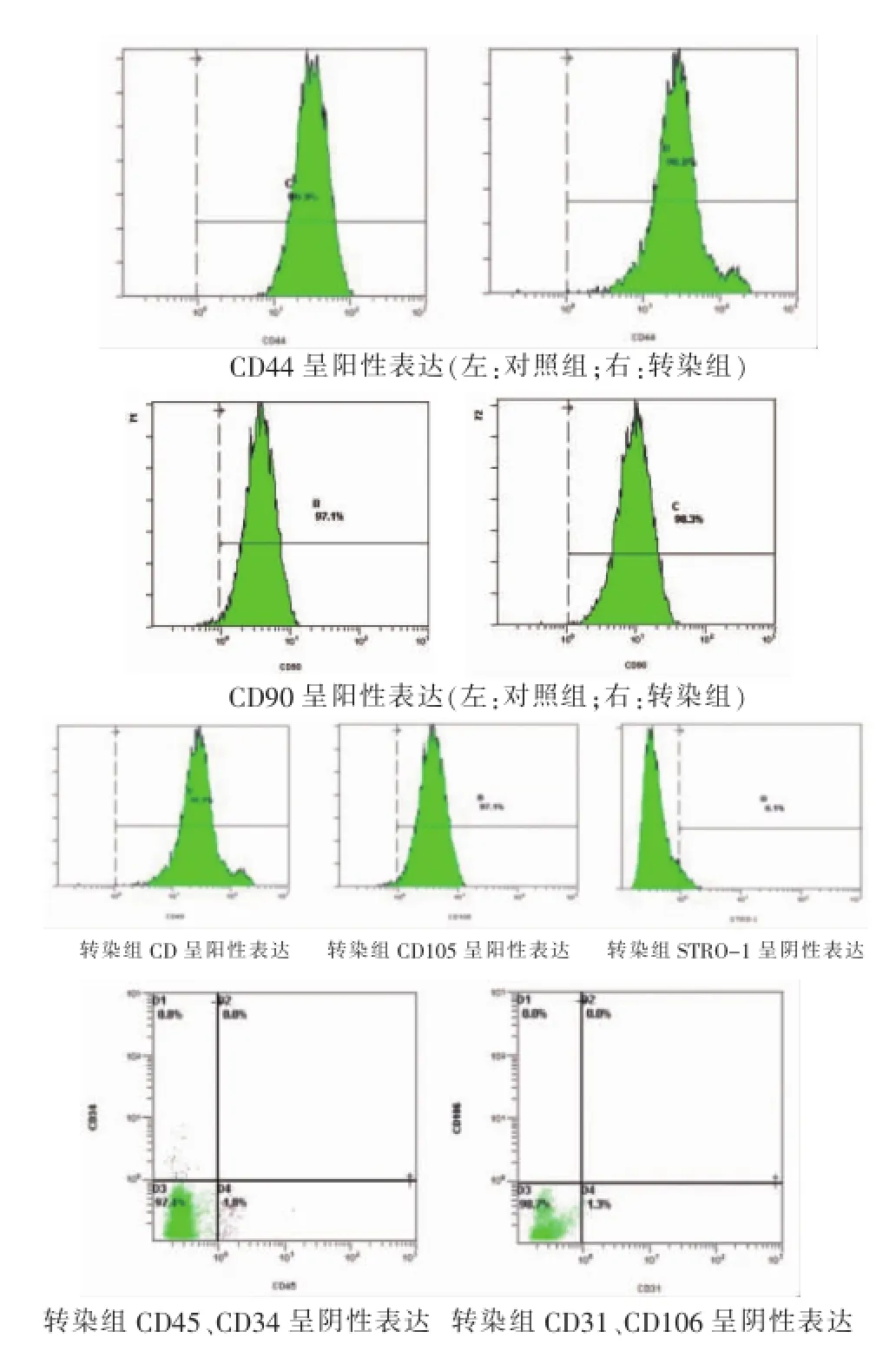
圖4 流式細(xì)胞儀檢測
3.5 細(xì)胞生長周期
經(jīng)流式細(xì)胞儀檢測,轉(zhuǎn)染組和對照組G2/G1期細(xì)胞分別為(1.9548±0.0522)和(1.9756±0.0324),差別無統(tǒng)計(jì)學(xué)意義(P>0.05)。
3.6 分化能力比較
3.6.1 誘導(dǎo)成骨
加入成骨誘導(dǎo)培養(yǎng)基A、B兩組均可明顯看到鈣結(jié)節(jié),加入普通培養(yǎng)基的C組無明顯鈣結(jié)節(jié)形成(圖5)。A、B兩組的各3孔均取5個(gè)視野,以Image Pro Plus軟件進(jìn)行分析,鈣結(jié)節(jié)面積占視野面積比例分別為:A組(44.1±3.8)%,B組(42.7±2.1)%,P>0.05。

圖5 成骨誘導(dǎo)結(jié)果
3.6.2 誘導(dǎo)成脂
加入成脂誘導(dǎo)培養(yǎng)基的A、B兩組均可明顯看到脂滴,C組無明顯脂滴形成。A、B兩組各3孔均取5個(gè)視野,以Image Pro Plus軟件進(jìn)行分析,脂滴面積占視野面積比例分別為:A組 (30.6±2.2)%,B組(32.4±1.3)%,P>0.05。
4 討論
選擇理想的種子細(xì)胞是組織工程與基因治療的重要課題之一,利用細(xì)胞作為載體,使各種目的基因在體內(nèi)有效持續(xù)表達(dá),是目前最具有應(yīng)用前景的基因治療手段。hADSCs作為一種擁有多項(xiàng)優(yōu)勢的成體多能干細(xì)胞,受到廣泛關(guān)注。而重組利用腺病毒載體整合外源性基因具有安全性、高效性和穩(wěn)定性,是目前基因工程中最常用的病毒載體。將具有強(qiáng)大促血管生成能力的HGF以腺病毒轉(zhuǎn)染到脂肪干細(xì)胞中再移植到體內(nèi),是解決移植脂肪成活問題極有前景的方式。采用人脂肪干細(xì)胞作為腺病毒表達(dá)載體是否對其生物學(xué)特性產(chǎn)生影響,目前研究甚少,因此該方面的研究將會(huì)為組織工程和基因治療提供重要的理論基礎(chǔ)。
本研究采用傳統(tǒng)的hADSCs分離培養(yǎng)方法,通過與未轉(zhuǎn)染的對照組比較,觀察轉(zhuǎn)染對于hADSCs生物學(xué)特性的影響。
首先通過對轉(zhuǎn)染率和基因表達(dá)率的雙重篩選,選取Ad-HGF轉(zhuǎn)染hADSCs的較佳濃度。一般認(rèn)為,較低或過高的MOI都會(huì)對載體轉(zhuǎn)染的效率產(chǎn)生不利影響。Morizono等[10]報(bào)道,當(dāng)MOI=100時(shí),腺病毒對hADSCs的轉(zhuǎn)染效率可達(dá)到99%; Hiroyuki等[11]報(bào)道,當(dāng)MOI=300時(shí),腺病毒對hADSCs的轉(zhuǎn)染效率可達(dá)到95%。以往研究證實(shí),過高濃度的腺病毒載體并不能提高轉(zhuǎn)染效率,反而會(huì)引發(fā)機(jī)體的免疫反應(yīng),并由于細(xì)胞凋亡而導(dǎo)致基因表達(dá)效果下降。我們通過熒光顯微鏡觀察,發(fā)現(xiàn)Ad-GFP以MOI= 100、MOI=200、MOI=300時(shí)轉(zhuǎn)染效率均可達(dá)到90%以上,轉(zhuǎn)染組細(xì)胞上清液ELISA分析,48 h時(shí)HGF表達(dá)量最高,Ad-HGF以MOI=200轉(zhuǎn)染時(shí)細(xì)胞HGF表達(dá)量最高。因此,從轉(zhuǎn)染率和基因表達(dá)量兩方面綜合考慮,MOI=200為Ad-HGF轉(zhuǎn)染hADSCs較佳的濃度。
細(xì)胞形態(tài)學(xué)方面,兩組hADSCs均為梭形和多角形,呈成纖維細(xì)胞樣生長,形態(tài)無明顯差異,與已往研究報(bào)道一致,表明Ad-HGF轉(zhuǎn)染對hADSCs形態(tài)并無明顯影響。
MTT法繪制細(xì)胞生長曲線,兩組生長趨勢一致,故Ad-HGF轉(zhuǎn)染并未影響hADSCs生長增殖能力。觀察到轉(zhuǎn)染組細(xì)胞數(shù)稍低于對照組,我們認(rèn)為可能是腺病毒轉(zhuǎn)染本身會(huì)造成少量細(xì)胞死亡,故細(xì)胞數(shù)初始值即低于對照組。
細(xì)胞表面標(biāo)志物的檢測,兩組CD44、CD90、CD49d、CD105均呈陽性表達(dá),CD45、CD34、CD31、CD106和STRO-1均呈陰性表達(dá),與已有文獻(xiàn)[12]。本實(shí)驗(yàn)結(jié)果證實(shí),我們所用的細(xì)胞的確為hADSCs,轉(zhuǎn)染并沒有造成細(xì)胞表面標(biāo)志物的改變。
檢測細(xì)胞周期發(fā)現(xiàn),兩組種G2/G1期細(xì)胞差異無統(tǒng)計(jì)學(xué)意義,證明Ad-HGF轉(zhuǎn)染對ADSC細(xì)胞周期沒有明顯影響。
分別成骨成脂誘導(dǎo)后,兩組細(xì)胞均可分化為成骨細(xì)胞和脂肪細(xì)胞(脂滴),證明轉(zhuǎn)染后的hADSCs仍然具有多向分化潛能。Image Pro Plus軟件分析結(jié)果顯示,兩組細(xì)胞在分化能力方面差別微小。
腺病毒轉(zhuǎn)染對hADSCs的生物學(xué)特性影響很小,hADSCs仍然保持了它的干細(xì)胞特性,為今后的進(jìn)一步實(shí)驗(yàn)奠定了基礎(chǔ)。
致謝 北京協(xié)和醫(yī)學(xué)院整形外科醫(yī)院實(shí)驗(yàn)中心、整形八科和軍事醫(yī)學(xué)科學(xué)院二所三室對本實(shí)驗(yàn)給予了支持和指導(dǎo),在此一并表示感謝。
[1] Zuk PA,Zhu M,Mizuno H,et al.Multilineage cells from human adipose tissue:implication for cell-based therapies[J].Tissue Eng,2001,7(2):211-227.
[2] Giese SY,Bulan EJ,Commons GW,et al.Improvements in cardiovascular risk profile with large-volume liposuction:a pilot study[J].Plast Reconstr Surg,2001,108:510-521.
[3] Baksh D,Song L,Tuan RS.Adult mesenchymal stem cells: characterization,differentiation,and application in cell and gene therapy[J].J Cell Mol Med,2004,8(3):301-316.
[4] Safford KM,Safford SD,Gimble JM,et al.Characterization of neuronal/glial differentiation of murine adipose-derived adult stromal cells[J].Exp Neurol,2004,187(2):319-328.
[5] Perry TE, Roth SJ. Cardiovascular tissue engineering: constructing living tissue cardiac valves and blood vessels using bone marrow,umbilical cord blood,and peripheral blood cells [J].J Cardiovasc Nuts,2003,18(1):30-37.
[6] Hauser MA,Amalfltano A,Kumar SR,et al.Improved adenoviral vectors for gene therapy of Duchenne muscular dystrophy [J]. Neuromuscul Disord,1997,7(5):277-283.
[7] Ido A,Moriuchi A,Marusawa H,et al.Translational research on HGF: a phase I/II study of recombinant human HGF for the treatment of fulminant hepatic failure[J].Hepatol Res,2008,38: 88-92.
[8] Yeh P,Perricaudet M.Advances in adenoviral vectors:from genetic engineering to their biology[J].FASEB J,1997,11(8):615-623.
[9] Mischen BT,Follmar KE,Mover KE,et al.Metabolic and funetional characterization of human adipose derived stem cells in tissue engineering[J].Hast Reconstr Surg,2008,122(3):725-738.
[10] Morizono K,De Uqarte DA,Zhu M,et al.Multilineage cells from adipose tissue as gene delivery vehicles[J].Human gene ther, 2003,14(1):59-66.
[11] Hiroyuki M,Tomomi S,Kenji K,et al.Fiber-modified adenovirus vectors mediate efficient gene transfer into undifferentiated and adipogenic-differentiated human mesenchymal stem cells [J]. Bichemical and Biophys Res Commun,2005,332:1101-1106.
[12] Peroni D,Scambi I,Pasini A,et al.Stem molecular signature of adipose-derived stromal cells[J].Exp Cell Res,2008,314(3):603-615.
Study on Biological Characteristics of Adipose Derived Stem Cells Transfected with HGF Gene by Adenovirus Vector
WU Yijie,WANG Qian,MU Dali,LUAN Jie.
Plastic Surgery Hospital,Chinese Academy of Medical Sciences,Beijing 100144,China.Corresponding Author:LUAN Jie.
Objective To investigate the effect of HGF transfection by adenovirus vector (Ad-HGF) on biological characteristics of human adipose derived stem cells(hADSCs).Methods hADSCs was transfected by Ad-HGF in MOI=200. The expression of HGF gene was detected by ELISA.The differences of biological characteristics such as cell morphology, growth curve,surface markers,cell cycle,differentiation potential between hADSCs transfected by HGF group and hADSCs group were observed.Results The expression of HGF was detected in supernatant 24 hours post transfection.The peak of it presented at 48 hours post transfection and sustained till 1 week after transfection. The hADSCs transfected by Ad-HGF grows as fibroblast-like style.There were no morphology and cell viability changes observed between transfected group and control group.Both two groups were shown to be positive for the expression of CD44,CD90,CD49d and CD105.On the other hand,expression of CD45,CD34,CD31,CD106 and STRO-1 were negative.There was no significant difference between two groups in cell cycle,adipogenic and osteogenic differentiation potential were observed. Conclusion The biological characteristics of hADSCs are not affected by adenovirus transfection. Adenovirus transfection is an ideal way to integrate HGF gene to hADSCs.
Human adipose derived stem cells; Adenovirus vector; Gene transfection; Biological characteristics
Q813.1+1
A
1673-0364(2010)06-0306-05
2010年9月6日,
2010年10月21日)
10.3969/j.issn.1673-0364.2010.06.002
100144 北京 北京協(xié)和醫(yī)學(xué)院整形外科醫(yī)院。
欒杰。

