水酶法提取斑點叉尾鮰內臟油的工藝研究
陸劍鋒,林 琳,張偉偉,翁世兵,葉應旺,姜紹通
(合肥工業大學生物與食品工程學院,安徽 合肥 230009)
水酶法提取斑點叉尾鮰內臟油的工藝研究
陸劍鋒,林 琳,張偉偉,翁世兵,葉應旺,姜紹通
(合肥工業大學生物與食品工程學院,安徽 合肥 230009)
為提高魚類加工廢棄物的綜合利用率,以斑點叉尾鮰內臟為原料,采用水酶法制備魚油。結果表明:水酶法提取魚油的最佳工藝條件為初始pH7.5、料液比1:1、加酶量3500U/g、酶解溫度55℃、酶解時間0.5h,該條件下魚油的提取率達到80.94%;提取到的魚油(即粗魚油)外觀呈黃褐色,具有魚腥味和輕微的酸敗味,其過氧化值較低,而酸值相對較高;粗魚油中的飽和脂肪酸相對含量為19.42%,單不飽和脂肪酸和多不飽和脂肪酸分別為61.76%和16.83%,∑n-3/∑n-6的脂肪酸比值達到3.63。表明斑點叉尾鮰內臟是生產魚油的良好來源。
斑點叉尾鮰;內臟;魚油;水酶法
斑點叉尾鮰(Ictalurus punctatus),又稱溝鲇,屬于鮎形目、鮰科魚類,原產于北美洲,是一種經濟價值較高的大型淡水魚[1]。斑點叉尾鮰具有抗病力強、生長迅速、肉味鮮美、風味獨特等優點,我國于1984年從美國將其引入湖北,近年來被大規模推廣養殖,特別是在湖北、湖南、江西、安徽等省,2007年產量達14萬噸左右,現已被農業部列為重點產業化開發對象[2]。
目前,我國斑點叉尾鮰的銷售市場主要是以加工冷凍鮰魚片出口為主,在加工過程中產生了大量的下腳料,包括魚頭、魚排、魚皮和內臟等,其中內臟平均達到魚體重的10%左右[3]。相對于海水魚而言,淡水魚的內臟體積大,組成復雜,易腐敗變質,但脂肪含量較高,因此可以對其進行高值化利用,從中提取可食用魚油,這樣不僅避免了環境污染,而且對于合理利用資源,提高水產品加工產業的附加值具有重要意義。
生產魚油的方法主要有壓榨法[4]、淡堿水解法[5]、溶劑法[6]、水法[7]、蒸煮法[8]、超臨界流體萃取[9]、水酶法[10]等。相比較而言,水酶法提取油脂的工藝條件較為溫和,不僅有利于增加油脂提取率和提高油脂的品質(即有利于提高油脂產量和減輕精煉過程的負擔),同時也能夠有效利用內臟中的蛋白質資源[11]。本研究以斑點叉尾鮰內臟為原料,對水酶法提取魚油的工藝路線進行研究,旨在為斑點叉尾鮰下腳料的綜合開發利用提供一定的理論參考。
1 材料與方法
1.1 材料與試劑
斑點叉尾鮰(一齡魚)內臟由明光市永言水產食品有限公司提供,先將內臟去除膽囊、鰾及腸道內消化物,在組織搗碎機中搗碎,然后分裝于封口袋中,-24℃冷凍貯藏備用。所用試劑均為分析純。
1.2 儀器與設備
CT15RT臺式高速冷凍離心機 上海天美生化儀器設備工程有限公司;FSH-2A可調高速勻漿機 江蘇金壇市榮華儀器制造有限公司;YB-1A真空恒溫干燥箱 天津市鑫洲科技有限公司;PHS-3C精密pH計 上海大普儀器有限公司;Saturn2200氣質聯用儀 美國Varian公司。
1.3 方法
1.3.1 水酶法提取魚油工藝
將一定量經過勻漿的斑點叉尾鮰內臟解凍后,放入具塞錐形瓶中,加水調整液料比(g/mL),用4mol/L的NaOH溶液或HCl溶液調節酶解液的初始pH值,然后加入一定量的蛋白酶,并向錐形瓶中填充氮氣(抗氧化),在一定的溫度條件下,保溫水解一段時間,隨后在5000×g的條件下趁熱離心10min,分離出上層魚油。

1.3.2 原料基本營養成分的測定
水分含量:直接干燥法,參照GB/T 5009.3—2003《食品中水分的測定》;灰分:灼燒稱重法,參照GB/T 5009.4—2003《食品中灰分的測定》;粗蛋白:凱氏定氮法,參照GB/T 5009.5—2003《食品中蛋白質的測定》;粗脂肪:索氏抽提法,參照GB/T 5009.6—2003《食品中脂肪的測定》,并將粗脂肪的含量定為原料中魚油的含量。
1.3.3 蛋白酶活力測定
蛋白酶活力的測定采用紫外分光光度法。酶活力定義:1g固體酶粉或1mL液體酶,在一定溫度和pH值條件下,1min水解酪蛋白產生1μg酪氨酸為1個活力單位,以U/g或U/mL表示[12]。
1.3.4 水解蛋白酶的篩選
由于不同蛋白酶的酶切位點不一致,在提取斑點叉尾鮰內臟油中的水解作用也不同,為了得到最佳的提取效果,有必要對蛋白酶進行篩選。在參考大量文獻的基礎上,本實驗選擇5種蛋白酶(中性蛋白酶、堿性蛋白酶、木瓜蛋白酶、風味蛋白酶、動物蛋白酶)對斑點叉尾鮰內臟分別進行酶解,同時也按照酶制劑產品的使用說明,確定蛋白酶的適宜水解條件見表1。
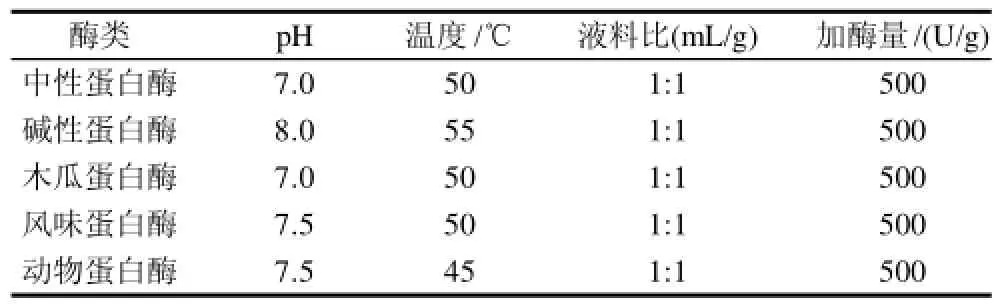
表1 各種蛋白酶的水解條件Table1 Hydrolysis conditions of various enzymes
1.3.5 魚油的理化性質測定
感官評定:參照SC/T 3502-2000《中華人民共和國水產行業標準:魚油》;水分及揮發物含量:參照GB/T 5528-2008《動植物油脂水分及揮發物含量測定》中的直接干燥法;不溶性雜質含量:參照GB/T 15688-2008《動植物油脂不溶性雜質含量的測定》中的坩堝式過濾器法;酸值:參照GB/T 5530-2005《動植物油脂酸值和酸度測定》中的熱乙醇測定法;碘值:參照GB/T 5532-2008《動植物油脂碘值的測定》中的硫代硫酸鈉滴定法;過氧化值:參照GB/T 5538-1995《油脂過氧化值測定》中的硫代硫酸鈉滴定法。
1.3.6 脂肪酸組成分析
樣品甲酯化[2]:稱取樣品0.5g置于具塞試管中,加入0.5mol/L氫氧化鉀-甲醇溶液4mL,置于60℃水浴鍋上皂化30min(油珠完全消失),冷卻后加入12.5%硫酸-甲醇溶液40mL,于60℃水浴上酯化5min,冷卻,將之倒入盛有45mL蒸餾水的分液漏斗中,加入正己烷2mL,放掉下層,用飽和氯化鈉水溶液2mL洗滌至少3次,取上清液再加入2g無水硫酸鈉,取上清液在3000~4000r/min條件下離心10min,用0.22μm微孔過濾膜過濾后,待GC-MS分析。
魚油脂肪酸組成的測定采用氣質聯用儀。GC條件:CP5860石英毛細管柱(30m×0.25mm);載氣:高純氦;流速:0.9mL/min;進樣口溫度:260℃;柱溫:起始溫度160℃,保持3min,以5℃/min升溫至200℃,再以10℃/min升溫至240℃,保持5min;MS條件:EI離子源,電離能量70eV;離子阱溫度150℃;傳輸線溫度280℃;電子倍增管電壓2400V。通過對NIST(2001版)譜庫檢索,對脂肪酸進行定性,并采用面積歸一化法確定其相對含量。
2 結果與分析
2.1 斑點叉尾鮰內臟基本組成
由表2可知,斑點叉尾鮰內臟中的粗蛋白含量僅占8.58%,而粗脂肪含量達到28.14%,因此斑點叉尾鮰內臟可以作為魚油提取的良好原料,而且魚油提取的廢液
中含有大量的氨基酸和活性多肽,今后也可以進一步加工利用。

表2 斑點叉尾鮰內臟的基本成分(x±s)Table2 Basic component of the viscera of channel catfish (x±s)
2.2 酪氨酸溶液最大吸收波長的確定
NE向斷裂組:這組斷裂在區內最為發育,帶內主要發育角礫巖或糜棱巖,該組斷裂被后期斷裂帶切穿,構成網格狀,帶內具有硅化、碳酸鹽化及弱鉀化,平面上呈舒緩波狀,產狀傾向60°~90°,傾角30°~60°。
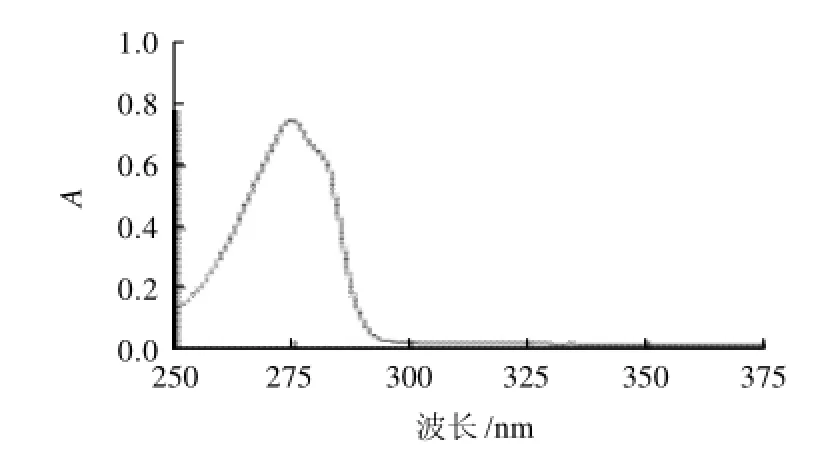
圖1 酪氨酸標準溶液的吸收光譜曲線Fig.1 UV absorbency spectrum of tyrosine standard solution
由于酪氨酸帶有芳香環側鏈,所以在近紫外區(200~400nm)內對一定波長的光具有選擇性吸收作用。取酪氨酸標準溶液,在250~375nm的范圍內掃描,得到吸收光譜曲線,見圖1。酪氨酸在275nm的紫外光下具有最大吸收峰,因此,選擇在波長275nm處測定不同濃度的酪氨酸溶液的吸光度,并繪制標準曲線。
2.3 蛋白酶的篩選
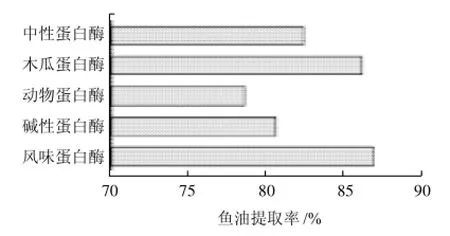
圖2 不同種類的酶對魚油提取率的影響Fig.2 Effect of enzyme on the extraction rate of fish oil
蛋白酶水解能力的差異主要是由蛋白酶對肽鍵的專一性不同引起的。將5種蛋白酶的添加量都確定在500U/g、酶解時間都選擇在3h,按表1條件進行酶解,從圖2對魚油提取率的影響可以看出,木瓜蛋白酶和風味蛋白酶的效果較好,其中風味蛋白酶的提油率最高,達到了86.81%左右,而木瓜蛋白酶的提油率也高達86.07%。相比之下,木瓜蛋白酶是一種純天然的生物酶制劑,且酶活相對較高、來源豐富、價格低廉,能充分滿足工業化生產的需要,因此本實驗選用木瓜蛋白酶作為鮰魚內臟魚油的提取酶。
2.4 單因素試驗
2.4.1 酶解時間的確定
以酶解時間為橫坐標、魚油提取率為縱坐標,繪制酶解時間與提取率值關系曲線,如圖3所示。隨酶解時間的延長(<1h),魚油提取率也隨之增加,這主要是酶解時間的增加,使得酶與底物的作用更加徹底,破壞了脂肪和蛋白質的關系,充分釋放出脂肪。但隨酶解時間延長(即加熱時間越長),魚油多不飽和脂肪酸氧化生成深色物質,魚油的顏色出現很大變化,由淡黃色變為紅棕色。當酶解時間大于1h后,延長酶解時間已不能大幅度提升魚油的提取率,因此綜合各方面條件,酶解時間選擇1 h。
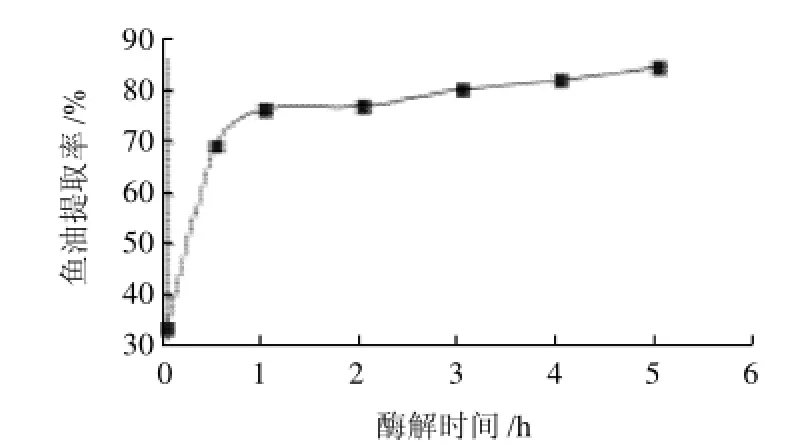
圖3 酶解時間對魚油提取率的影響Fig.3 Effect of hydrolysis time on the extraction rate of fish oil
2.4.2 初始pH值的確定
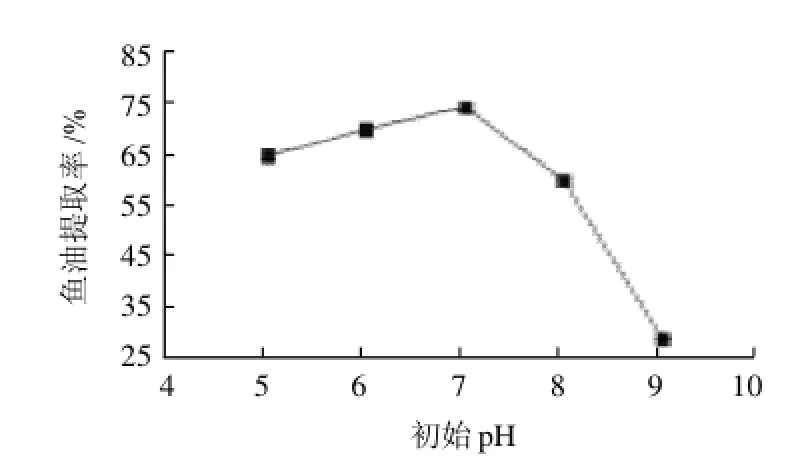
圖4 初始pH值對魚油提取率的影響Fig.4 Effect of initial pH on the extraction rate of fish oil
響,有時隨著底物種類和濃度的改變也會發生變化。從圖4可以看出,當初始pH值在7.0時,魚油提取率達到最大,因此,把水解液的最適初始pH值確定為7.0。
2.4.3 酶解溫度的確定
以酶解溫度為橫坐標、魚油提取率為縱坐標,繪制酶解溫度與魚油提取率關系曲線,如圖5所示。在酶解過程中,隨著溫度的逐漸升高,酶促反應速率加快,而且在溫度較高的情況下,有利于破乳,魚油容易分離。另一方面,當溫度繼續升高時,酶蛋白逐漸變性而失活,引起酶反應速率下降[13],而且溫度過高也不利于魚油的品質。由圖5可以看出,當酶解溫度在55℃時,魚油提取率最大,因此把酶解溫度確定在55℃。

圖5 酶解溫度對魚油提取率的影響Fig.5 Effect of hydrolysis temperature on the extraction rate of fish oil
2.4.4 加酶量的確定
以加酶量為橫坐標、魚油提取率為縱坐標,繪制加酶量與提油率的關系曲線,如圖6所示。隨著加酶量的增加,魚油提取率逐漸上升,當加酶量達到3000U/g以后,由于底物濃度的下降,魚油提取率增加趨于平緩。考慮到生產成本和反應速率等綜合因素,酶的添加量確定在3000U/g。
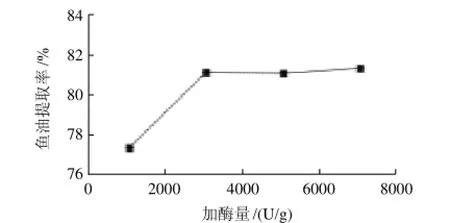
圖6 加酶量對魚油提取率的影響Fig.6 Effect of enzyme dosage on the extraction rate of fish oil
2.4.5 液料比的確定
以液料比為橫坐標、魚油提取率為縱坐標,繪制液料比與魚油提取率關系曲線,如圖7所示。當液料比較小時,底物濃度高,物料黏稠,分散不均勻,過多底物聚集于酶的活力中心,從而影響酶催化速度,使魚油提取率下降[14];液料比過大的話,導致酶和底物的濃度降低,不利于反應的進行,魚油提取率下降,而且增加后期離心分離的難度,因此將液料比確定為1:1。
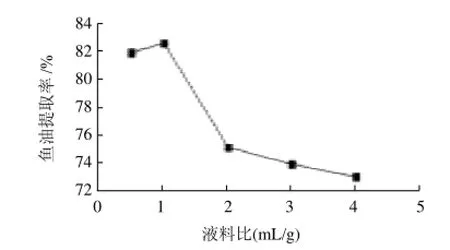
圖7 液料比對魚油提取率的影響Fig.7 Effect of water-to-material ratio on the extraction rate of fish oil
2.5 水酶法提油工藝條件的優化
在單因素試驗的基礎上,確定液料比為1:1,以魚油提取率為評價指標,采用L9(34) 正交試驗考察加酶量(A)、酶解時間(B)、酶解溫度(C)和初始pH值(D)4個因素對魚油提取率的影響,以確定最佳的提油工藝條件。正交試驗設計及結果分別見表3、4。
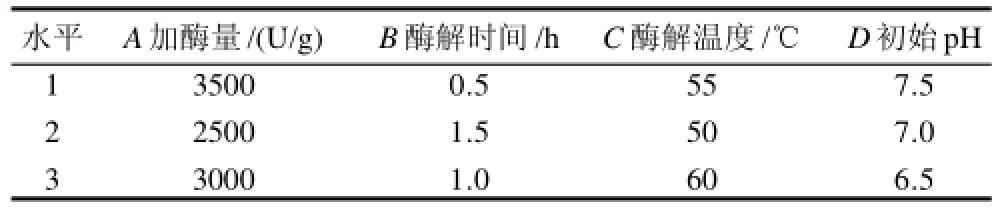
表3 工藝條件優化正交試驗因素水平表Table3 Factors and levels of orthogonal test
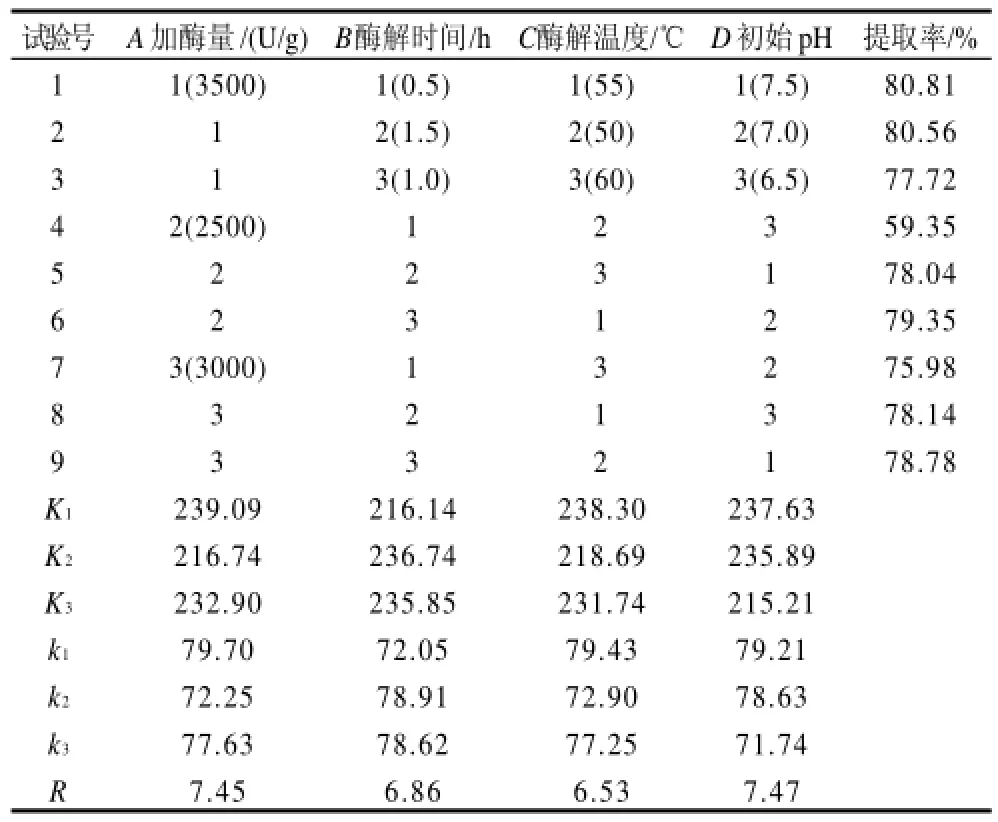
表4 工藝條件優化正交試驗結果與分析Table4 Results and analysis of orthogonal test
由正交試驗結果的極差分析(表4)可知,4因素對酶
法提取斑點叉尾鮰內臟油工藝的影響大小依次為初始pH值>加酶量>酶解時間>酶解溫度,極差分析得到的最優水平組合為A1B2C1D1,而由正交試驗的直接結果來看,最優水平組合是第一組A1B1C1D1。對A1B2C1D1和A1B1C1D1進行驗證對比實驗,驗證結果為:A1B2C1D1和A1B1C1D1的魚油提取率分別為84.47%和80.94%,兩者不存在顯著差異,但對比這兩種提取工藝,A1B2C1D1酶解時間較長(需要1.5h),而A1B1C1D1的酶解時間較短(僅需0.5h),因此從提高工藝能效和魚油質量的角度考慮,選擇最佳工藝條件為A1B1C1D1,即料液比為1:1、加酶量3500U/g、酶解時間0.5h、酶解溫度55℃,初始pH7.5。
2.6 粗魚油理化性質測定
最佳提取條件下得到的粗魚油外觀呈黃褐色,具有魚腥味和輕微的酸敗味,理化性質分析見表5。由表5可知,粗魚油的過氧化值較低,達到粗油的一級標準,但酸值相對較高(35.95mg/g),超出粗油的二級標準,可能是魚油提取過程中,部分魚油發生水解而導致酸值過大。另外,粗魚油中還含有一定量的水分,蛋白質、膽固醇及色素等非甘油酯成分,這些雜質成分不僅影響魚油的穩定性,而且還會影響魚油的深加工,因此還需要進一步通過精煉工藝(如脫膠、脫酸、脫色、脫臭和冬化等)進行精制,從而提高魚油的質量,以達到工業或食用的目的。

表5 鮰魚內臟粗魚油的理化性質Table5 Physics and chemistry indexes of crude fish oil from channel catfish
2.7 斑點叉尾鮰魚油脂肪酸組成分析
對提取的魚油進行氣相色譜分離,并采用質譜儀分析,結果見表6。斑點叉尾鮰內臟魚油主要由C14~C22,共19種脂肪酸組成,其中SFA(飽和脂肪酸)6種、MUFA (單不飽和脂肪酸)5種、PUFA(多不飽和脂肪酸)8種。粗魚油中的UFA(不飽和脂肪酸)含量較高,達到78.59%,其中PUFA含量達到16.83%,而EPA(二十碳五烯酸)和DHA(二十二碳六烯酸)含量較低,分別為0.63%、 0.93%,這主要是因為斑點叉尾鮰屬于一種淡水魚類(淡水魚體內EPA和DHA的含量一般均較低),此外其體內的EPA和DHA含量還與其生活的水體環境及攝食的飼料有關[15]。
海水魚油中的C18、C20、C22脂肪酸含量相對較高,而淡水魚油中的C20、C22不飽和脂肪酸較少,但含有較多的C16飽和脂肪酸和C18不飽和酸[16]。與之相似,斑點叉尾鮰內臟魚油中主要的脂肪酸種類是C16:0、C18:2n-7、C18:1n-9、C18:0,其含量分別為11.88%、13.24%、54.36%、5.86%。n-3系與n-6系多不飽和脂肪酸含量的比值(∑n-3/∑n-6)是比較魚油相對營養價值的一個重要指標,通常認為達到1:1以上為好[17],而斑點叉尾鮰內臟魚油中的∑n-3/∑n-6的比值達到3.63,遠高于鰱魚、草魚和羅非魚等其他淡水魚類[18]。

表6 斑點叉尾鮰魚油的脂肪酸組成Table6 Fatty acids composition of fish oil from channel catfish
3 結 論
斑點叉尾鮰內臟的粗蛋白含量僅為8.58%,而脂肪含量達到28.14%,是加工魚油的良好來源。酶法提取斑點叉尾鮰內臟油的最佳的工藝條件為初始pH7.5、料液比1:1、加酶量3500U/g、酶解溫度55℃、酶解時間
0.5h,在此條件下,魚油提取率達到80.94%。在最佳提取條件下得到的粗魚油外觀呈黃褐色,具有魚腥味和輕微的酸敗味,對其理化性質進行分析表明,酸值相對較高,因此還需要進一步的精煉,以達到工業化或食用的目的。經GC-MS檢測分析,酶法提取的粗魚油中至少含有19種脂肪酸,飽和脂肪酸和不飽和脂肪酸分別為19.42%和78.59%,單不飽和脂肪酸和多不飽和脂肪酸分別為61.76%和16.83%,EPA和DHA的含量分別為0.63%、0.93%,而∑n-3/∑n-6的值達到3.63。
[1]李承林. 魚類學[M]. 北京: 中國農業出版社, 2002: 148.
[2]張偉偉, 陸劍鋒, 焦道龍, 等. 鉀法提取斑點叉尾鮰內臟油的工藝研究[J]. 食品科學, 2009, 30(24): 42-46.
[3]SATHIVEL S, PRINYAWIWATKUL W, KING J M, et al. Oil production from catfish viscera[J]. Journal of the American oil Chemists Society, 2003, 80(4): 377-382.
[4]吳時敏. 功能性油脂[M]. 北京: 中國輕工業出版社, 2004: 145-146.
[5]楊官娥, 楊琦, 趙建濱, 等. 鉀法提取魚油工藝的研究[J]. 山西醫科大學學報, 2001, 32(1): 31-32.
[6]黃志斌. 水產品綜合利用工藝學[M]. 北京: 中國農業出版社, 1996: 89.
[7]陳英鄉. 水法提取魚油的生產工藝研究[J]. 食品科學, 1996, 17(3): 15-18.
[8]CHANTACHUM S, BENJAKUL S, SRIWIRAT N. Separation and quality of fish oil from precooked and non-precooked Tuna heads[J]. Food Chemistry, 2000, 69(3): 289-294.
[9]DAVARNEJAD R, KASSIM K M, ZAINAL A, et al. Extraction of fish oil by fractionation through supercritical carbon dioxide[J]. Journal of Chemical and Engineering Data, 2008, 53(9): 2128-2132.
[10]唐峰, 許學勤, 李玨. 水酶法提取鰱魚內臟油脂的工藝研究[J]. 食品科技, 2007, 23(11): 216-218.
[11]ROSENTHAL A, PYLE D L, NIRANJAN K. Aqueous and enzymatic processed for edible oil extraction[J]. Enzyme and Microbial Technology, 1996, 19(1): 402-420.
[12]張寒俊, 劉大川, 楊國燕. 紫外光譜法定量測定不同種蛋白酶活力的研究[J]. 糧食與飼料工業, 2004(9): 44-45.
[13]王鏡巖, 朱圣庚, 徐長法. 生物化學: 上冊[M]. 3版. 北京: 高等教育出版社, 2002: 378-379.
[14]粟桂嬌, 閻欲曉. 酶法制取羅非魚動物蛋白水解液的研究[J]. 食品研究與開發, 2004, 25(4): 70-73.
[15]郝記明, 劉書成, 張靜, 等. 利用羅非魚下腳料提取魚油的工藝研究[J]. 農產食品科技, 2008, 2(3): 14-16.
[16]林洪, 曹立民, 劉春娥, 等. 水產品資源有效利用[M]. 北京: 化學工業出版社, 2007: 59.
[17]SIMOPOULOS A P. Summary of the NATO advanced research workshop on dietaryω-3 andω-6 fatty acids: biological effects and nutritional essentiality[J]. Journal of Nutrition, 1989, 199(4): 521-528.
[18]張立堅, 楊會邦, 張俊杰, 等. 淡水魚油中脂肪酸的氣相色譜-質譜分析[J]. 質譜學報, 2009, 30(増刊1) : 181-182.
Aqueous Enzymatic Extraction of Fish Oil from Viscera of Channel Catfish (Ictalurus punctatus)
LU Jian-feng,LIN Lin,ZHANG Wei-wei,WENG Shi-bing,YE Ying-wang,JIANG Shao-tong
(College of Biotechnology and Food Engineering, Hefei University of Technology, Hefei 230009, China)
Fish oil was extracted from the viscera of channel catfish (Ictalurus punctatus) by aqueous enzymatic extraction method. The optimum extraction parameters were as follows: initial hydrolysis pH 7.5, ratio of viscera to water 1:1, amount of papain 3500 U/g, hydrolysis temperature 55 ℃, hydrolysis time 0.5 h. Under these conditions, the extraction ratio of fish oil was up to 80.94%. The extracted fish oil (namely crude fish oil) was yellow-brown in appearance with fishy smell and light rancidity odor, and it had a lower peroxide value and high acid value. The relative content of the saturated fatty acids accounted for 19.42% of the total fatty acids. The relative content of monounsaturated fatty acids and polyunsaturated fatty acids were 61.76% and 16.83%, respectively. The ratio of n-3 to n-6 polyunsaturated fatty acids is 3.63. The above results show that the viscera of channel catfish are a good resource for fish oil production.
Ictalurus punctatus;viscera;fish oil;aqueous enzymatic extraction method
TQ460.6
A
1002-6630(2010)22-0075-06
2010-07-15
安徽省重大科技攻關專項(08010301078);國家星火計劃項目(2008GA710021)
陸劍鋒(1976—),男,副研究員,博士,主要從事水生動物資源的保護和綜合利用研究。E-mail:lujf@sibs.ac.cn

