樣品保藏方式與時(shí)間對(duì)海洋底棲細(xì)菌及原生生物熒光計(jì)數(shù)效能的影響
孟昭翠,類(lèi)彥立和瑩瑩,徐奎棟
(1.中國(guó)科學(xué)院 海洋研究所海洋生物分類(lèi)與系統(tǒng)演化實(shí)驗(yàn)室,山東 青島 266071; 2.中國(guó)科學(xué)院 研究生院,北京 100039)
DAPI (4′,6-diamidino-2-phenylindole,4′,6-聯(lián)脒-2-苯基吲哚) 是一種靈敏度高、特異性強(qiáng)的熒光染料,對(duì)細(xì)胞核及染色體有很好的染色效果。它可與 DNA的 A-T 堿基結(jié)合形成 DAPI-DNA 復(fù)合物,該復(fù)合物在紫外激發(fā)光 (365nm) 下會(huì)發(fā)出藍(lán)色熒光。而福爾馬林固定的樣品經(jīng) DAPI 染色時(shí),甲醛可誘發(fā)蛋白質(zhì)中的芳香乙胺基團(tuán)轉(zhuǎn)化為熒光色團(tuán),從而使細(xì)胞質(zhì)熒光較強(qiáng),由此可見(jiàn)整個(gè)細(xì)胞的輪廓[1]。此外,細(xì)胞內(nèi)的色素體在綠色激發(fā)光下發(fā)出紅色熒光,可計(jì)數(shù)自養(yǎng)鞭毛蟲(chóng)。由此,DAPI 不僅用于細(xì)菌計(jì)數(shù),也可用于藍(lán)細(xì)菌、硅藻、自養(yǎng)和異養(yǎng)小鞭毛蟲(chóng)及纖毛蟲(chóng)等微型底棲生物計(jì)數(shù)。結(jié)合復(fù)染劑 Evans Blue的使用,可使染色后的細(xì)胞更容易辨認(rèn)[2]。
樣品的保藏方式及保存時(shí)間是影響 DAPI 熒光計(jì)數(shù)效能的重要因素。對(duì)海洋浮游細(xì)菌及鞭毛蟲(chóng)的研究發(fā)現(xiàn),固定后的樣品隨著保藏時(shí)間延長(zhǎng),可造成數(shù)量低估[3]。Daley 等[4]、Sherr 等[5]及 Kepner 等[6]發(fā)現(xiàn)經(jīng)福爾馬林固定的浮游樣品于 5℃下避光保存1~3 周后,對(duì)細(xì)菌的計(jì)數(shù)結(jié)果無(wú)差異。Porter 等[7]報(bào)道福爾馬林固定的浮游樣品經(jīng) DAPI 染色后封片,4℃下保存 24 周對(duì)細(xì)菌的計(jì)數(shù)結(jié)果無(wú)差異。但Hyun等[8]報(bào)道經(jīng)福爾馬林固定后的浮游樣品,貯藏于樣品瓶的計(jì)數(shù)結(jié)果優(yōu)于封片保存的。Turley 等[3,9]用戊二醛固定浮游樣品并經(jīng)常溫避光保藏,40 天后發(fā)現(xiàn)對(duì)細(xì)菌的計(jì)數(shù)數(shù)量平均減少了 39%,而經(jīng) DAPI染色封片并冷凍保存 70 d的細(xì)菌計(jì)數(shù)則無(wú)影響。而Pomroy[10]發(fā)現(xiàn)經(jīng)過(guò) Lugol’s 液固定的浮游樣品在室溫避光保存 4年未造成對(duì)細(xì)菌數(shù)量的低估,對(duì)鞭毛蟲(chóng)可保存10年甚至更長(zhǎng)而無(wú)數(shù)量變化。但是,上述研究均源自浮游樣品,對(duì)于底棲樣品則缺少系統(tǒng)的研究。僅Hamels 等[11,12]報(bào)道沉積物中的鞭毛蟲(chóng)經(jīng) DAPI 染色封片后可冷凍避光保存 1個(gè)月,而經(jīng) Percoll 液提取后的鞭毛蟲(chóng)經(jīng)同樣處理可保存2個(gè)月。
由于細(xì)菌及原生生物因可附著于其他生物體和/或沉積物顆粒表面 (如“海雪”),若不加處理直接以 DAPI 進(jìn)行熒光計(jì)數(shù),可對(duì)其數(shù)量乃重要性造成不同程度的低估[13~15]。目前最為有效的做法是首先利用超聲波等設(shè)備將底棲生物與沉積物分散開(kāi),然后再行染色計(jì)數(shù)。但在野外尤其是海上取樣時(shí),因取樣站位多、時(shí)間緊、超聲波分散儀及離心設(shè)備等現(xiàn)場(chǎng)無(wú)法使用,將樣品進(jìn)行保藏 (冷凍或冷藏) 后帶回室內(nèi)分析是較為可行的方法。保藏方式對(duì)于無(wú)細(xì)胞壁的原生生物尤為重要,如在冷凍保藏的凍融過(guò)程中,可因細(xì)胞膜的破裂而無(wú)法準(zhǔn)確計(jì)數(shù)。此外,出海采集常涉及大量樣品,樣品分析完成常需數(shù)周甚至數(shù)月。因此,測(cè)試不同保藏方式和保存時(shí)間對(duì)沉積物樣品定量分析的影響,是對(duì)數(shù)量進(jìn)行準(zhǔn)確估算的重要環(huán)節(jié)。
作者采用 DAPI 熒光染色計(jì)數(shù)法對(duì)海洋沉積物樣品中的細(xì)菌、藍(lán)細(xì)菌、自養(yǎng)小鞭毛蟲(chóng) (PNF) 和異養(yǎng)小鞭毛蟲(chóng) (HNF) 及硅藻進(jìn)行了冷藏與冷凍兩種保藏方式的比較分析,同時(shí)比較研究了不同保藏時(shí)間 (1 個(gè)月和 4 個(gè)月) 對(duì)這些微型底棲生物計(jì)數(shù)結(jié)果的影響。
1 材料與方法
1.1 研究站位和樣品采集
用內(nèi)徑 1.6 cm 的采樣管 (注射器改造),從未受擾動(dòng)的 0.1 m2改進(jìn)型 Gray-Ohara 箱式采泥器中,隨機(jī)采集 5 cm 長(zhǎng)芯樣 4 個(gè),每個(gè)芯樣按 0~2 cm、2~5 cm 分層移入 50 mL 離心管中,加入經(jīng)濾膜 (孔徑0.22 μm) 過(guò)濾的海水配制的 2.5% 甲醛溶液分別至 20 mL 和 30 mL 進(jìn)行固定。每個(gè)重復(fù)各取 10 mL 后合并共計(jì) 40 mL,一份于4℃避光冷藏保存,一份放置在冰柜-20 ℃ 避光冷凍保存。
冷凍和冷藏對(duì)比實(shí)驗(yàn)選取 2007年7月采集自黃海的編號(hào)為 3205 (32°N,124.5°E)、3403 (33.5°N,123°E)、4018 (33°N,122.5°E) 三個(gè)站位的 0~2 cm分層樣品; 保存時(shí)間實(shí)驗(yàn)選取 2008 年開(kāi)放共享航次編號(hào)為 3400-8(34°N,124°E)、3800-1(38°N,121.7°E)兩個(gè)站位的 0~2 cm、2~5 cm 分層的樣品 (圖 1)。沉積物粒度分析采用 Cilas (940L) 型激光粒度儀進(jìn)行測(cè)定。其他環(huán)境資料來(lái)自溫鹽深測(cè)定儀 (CTD) 現(xiàn)場(chǎng)測(cè)定。
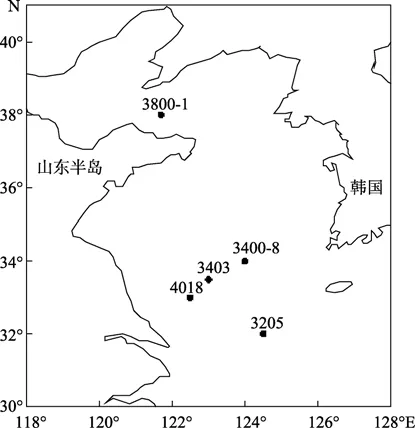
圖1 黃海采樣站位Fig.1 Sampling stations in the Yellow Sea
1.2 樣品分析方法
取適量樣品 (約 2mL) 加入焦磷酸四鈉 (f.c.1 mmol/L),常溫避光培育 15~30 min。經(jīng) JY92-II超聲波分散處理 180 s (振幅109 μm,50 W,6 mm Microtip),為避免樣品過(guò)熱,每超聲破碎處理 45 s,冷卻 1 min。取分樣后,根據(jù)鏡檢樣品中生物的密度,調(diào)節(jié)至適當(dāng)?shù)南♂尡堵?(細(xì)菌以每個(gè)視野 20~30個(gè)為宜,鞭毛蟲(chóng)以沉積物不遮擋生物為宜),加入DAPI (f.c.5 mg/L) 和復(fù)染劑 Evans Blue (f.c.10-6g/mL),低溫避光染色 10 min[1~3,9,13]。染色樣品經(jīng) Sartorius 真空過(guò)濾系統(tǒng)濃縮過(guò)濾到黑混合纖維素膜上。封片后置于 Zeiss Axioskop 2 plus HBO 100熒光顯微鏡油鏡下鏡檢計(jì)數(shù)。細(xì)菌的計(jì)數(shù)在紫外光激發(fā) (BP 365/12,FT 395,LP 397) 下,每片隨機(jī)計(jì)數(shù) 20~40 個(gè)視野,總計(jì) 500 個(gè)左右。鞭毛蟲(chóng)的計(jì)數(shù)根據(jù)其最長(zhǎng)粒徑劃分為 2~5 μm,5~10 μm,>10 μm三個(gè)粒級(jí),先在紫外激發(fā)光下每片隨機(jī)計(jì)數(shù)50個(gè)視野 (此為鞭毛蟲(chóng)總數(shù)),后轉(zhuǎn)換至綠色激發(fā)光 (BP 546/12,FT 580,LP 59) 下,每片快速隨機(jī)計(jì)數(shù)50個(gè)視野 (為自養(yǎng)小鞭毛蟲(chóng) (PNF) 總數(shù))[5,16]。異養(yǎng)小鞭毛蟲(chóng) (HNF) 的數(shù)目為鞭毛蟲(chóng)總數(shù)與自養(yǎng)小鞭毛蟲(chóng)數(shù)目的差值。根據(jù)視野面積以及樣品稀釋倍率換算各生物類(lèi)群的最終豐度。微型底棲生物豐度的計(jì)算按如下公式:
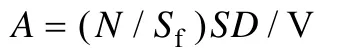
其中,A為豐度(個(gè)/mL);N為各視野平均數(shù)(個(gè));Sf為1000×下顯微鏡視野面積(cm2);S為濾膜實(shí)際過(guò)濾面積(cm2);D為稀釋倍數(shù);V為染色用的樣品體積(mL)。
文中采用如下縮寫(xiě):自養(yǎng)小鞭毛蟲(chóng) PNF (2~5 μm)、PNF (5~10 μm)、PNF (>10 μm); 異養(yǎng)小鞭毛蟲(chóng) HNF (2~5 μm)、HNF (5~10 μm)、HNF (>10 μm)。
1.3 數(shù)據(jù)統(tǒng)計(jì)分析
采用 SPSS 15.0 統(tǒng)計(jì)軟件進(jìn)行分析,將沉積物中各類(lèi)群豐度的不同處理進(jìn)行T-test 檢驗(yàn)。為使數(shù)據(jù)正態(tài)分布,將原始數(shù)據(jù)經(jīng)過(guò) log 轉(zhuǎn)化處理。
2 結(jié)果
2.1 站位基本情況
實(shí)驗(yàn)中 5 個(gè)站位 (3205、3403、4018、3400-8、3800-1) 的環(huán)境因子見(jiàn)表 1。

表1 五個(gè)站位 3205、3403、4018、3400-8、3800-1的環(huán)境因子Tab.1 Environmental factors of the five stations: 3205,3403,4018,3400-8,and 3800-1
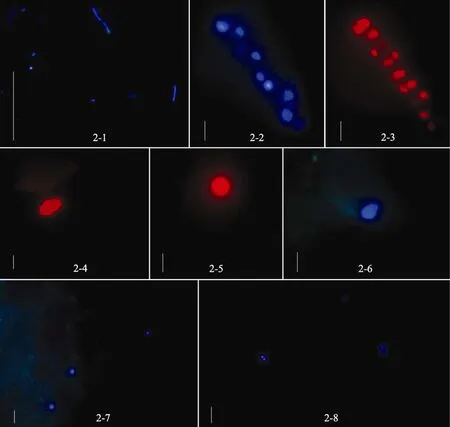
圖2 DAPI 染色后的細(xì)菌 (2-1)、硅藻 (2-2,2-3)、鞭毛蟲(chóng) (2-4~2-7) 及藍(lán)細(xì)菌 (2-8)Fig.2 Bacteria (2-1),diatoms (2-2 and2- 3),flagellates (2-4~2-7) and cyanobacteria (2-8) stained with DAPI
2.2 保藏方式實(shí)驗(yàn)
利用 DAPI 染色,對(duì)三站位 (3205、3403、4018)0~2 cm 分層的冷凍、冷藏樣品進(jìn)行分析。熒光鏡檢觀察到細(xì)菌及各種原生生物的形態(tài)如圖 2 所示,細(xì)菌大小約為 1~2 μm,常見(jiàn)為球菌、桿菌、弧形菌; 硅藻種類(lèi)多樣,有圓篩藻、曲舟藻、直鏈藻等,常見(jiàn)10 μm大小的直鏈藻; 鞭毛蟲(chóng)形態(tài)多種多樣,有球形,橢球形等,個(gè)體大小差異也較大; 藍(lán)細(xì)菌多為 2 個(gè)或 4個(gè)一組存在。
圖3 示 3205、3403、4018 站冷凍、冷藏兩種保藏方式下各類(lèi)群的豐度。三個(gè)站位冷凍樣品中細(xì)菌平均豐度為 8.69×108±2.92×108個(gè)/mL,較冷藏樣品低 25% (平均 1.16×109±0.31×109個(gè)/mL),2~5 μm 的鞭毛蟲(chóng)平均豐度為 4.00×106±0.97×106個(gè)/mL,較 冷 藏 樣 品 低 25% (平 均 5.39×106±1.92×106個(gè)/mL),5~10 μm 的鞭毛蟲(chóng)平均豐度為 5.07×105±3.06×105個(gè)/mL,較冷藏樣品低 23%(平均 6.61×105±3.06×105個(gè)/mL),>10 μm 的鞭毛蟲(chóng)平均豐度為4.50×104±4.82×104個(gè)/mL,較冷藏樣品低 79% (平均 2.18×105±1.38×105個(gè)/mL),硅 藻 平 均 豐 度 為8.35×104±7.71×104個(gè)/mL,較冷藏樣品低13% (平均9.63×104±13.9×104個(gè) /mL),藍(lán) 細(xì) 菌 平 均 豐 度 為2.56×106±0.75×106個(gè)/mL,較冷藏樣品高 9% (平均2.35×106±0.86×106個(gè)/mL)。沉積物中細(xì)菌在豐度(108~109) 上占絕對(duì)優(yōu)勢(shì) (冷藏冷凍樣品 98.84%~99.35%),冷藏保存下 4018 站的細(xì)菌豐度最高; 其次是自養(yǎng)小鞭毛蟲(chóng) (豐度占0.32%~0.57%)、藍(lán)細(xì)菌(豐度占 0.12%~0.40%)、異養(yǎng)小鞭毛蟲(chóng) (豐度占0.02%~0.25%),硅藻豐度所占比例最小 (0~0.02%)。三個(gè)站位沉積物樣品中相同粒級(jí)的自養(yǎng)小鞭毛蟲(chóng)的豐度均高于異養(yǎng)小鞭毛蟲(chóng)。自養(yǎng)小鞭毛蟲(chóng)豐度 4018站最高,其次是 3403 站、3205 站。按鞭毛蟲(chóng)大小看,2~5 μm 鞭毛蟲(chóng)的豐度最高,5~10 μm 鞭毛蟲(chóng)豐度次之,>10 μm 鞭毛蟲(chóng)豐度最小。
T-test 檢驗(yàn)結(jié)果表明,冷凍、冷藏兩種保藏方式下,3205 站和 3403 站的各測(cè)試對(duì)象:細(xì)菌、硅藻、藍(lán)細(xì)菌、自養(yǎng)小鞭毛蟲(chóng)、異養(yǎng)小鞭毛蟲(chóng)均無(wú)差異;4018 站的細(xì)菌、硅藻、藍(lán)細(xì)菌、異養(yǎng)小鞭毛蟲(chóng)及PNF(>10 μm) 均無(wú)差異,而 PNF (2~5 μm)、PNF (5~10 μm) 存在顯著差異 (P<0.05),PNF (2~5 μm) 冷藏樣品豐度顯著高于冷凍樣品 92.1%,PNF (5~10 μm)冷藏樣品豐度顯著高于冷凍樣品 89.5% (表 2)。
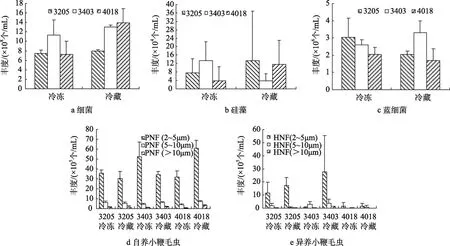
圖3 冷凍及冷藏兩種保藏方式下3個(gè)站位 (3205、3403、4018) 的細(xì)菌 (a)、硅藻 (b)、藍(lán)細(xì)菌 (c)、自養(yǎng)小鞭毛蟲(chóng) (d)和異養(yǎng)小鞭毛蟲(chóng) (e) 的豐度Fig.3 Abundances of bacteria (a),diatoms (b),cyanobacteria (c),PNF (d) and HNF (e) from Stations 3205,3403 and 4018,respectively.Samples that underwent either 4 °C or -20 °C storage were measured
2.3 保藏時(shí)間實(shí)驗(yàn)
為研究不同保藏時(shí)間對(duì)細(xì)菌及各原生生物類(lèi)群定量計(jì)數(shù)的影響,對(duì)來(lái)自黃海的兩個(gè)站位 (3400-8及 3800-1) 0~2 cm 及 2~5 cm 分層的樣品經(jīng)保存1 個(gè)月和 4 個(gè)月后的對(duì)比分析見(jiàn)表 3。兩個(gè)站位的各類(lèi)群中,細(xì)菌豐度均超過(guò) 99%,自養(yǎng)小鞭毛蟲(chóng)占0.42%,異養(yǎng)小鞭毛蟲(chóng)、藍(lán)細(xì)菌,硅藻所占比例最小。在保存 1 個(gè)月和 4 個(gè)月后各類(lèi)群所占的百分比基本保持穩(wěn)定。統(tǒng)計(jì)分析表明,不同保存時(shí)間下,3400-8 及 3800-1 站的兩個(gè)分層的細(xì)菌、藍(lán)細(xì)菌、PNF (5~10 μm)、PNF (>10 μm)、HNF (>10 μm) 和硅藻均無(wú)差異。3400-8 站兩個(gè)分層的 HNF (2~5 μm)均有顯著差異,保存 4 個(gè)月后鏡檢均未檢獲到; 而PNF (2~5 μm) 和 HNF (5~10 μm)均無(wú)差異。3800-1站 0~2 cm 分層的 PNF (2~5 μm)和 HNF (5~10 μm)均有顯著差異,保存4個(gè)月后PNF (2~5 μm) 的豐度比1個(gè)月時(shí)減少了47.4%,HNF (5~10 μm)未檢獲到;2~5 cm 分層的 PNF (2~5 μm)、HNF (2~5 μm)均有顯著差異,保存4個(gè)月后 PNF (2~5 μm)豐度比 1個(gè)月時(shí)減少了 59.6%,HNF (2~5 μm)未檢獲到 (表 3 和表4)。

表2 不同保藏方式下3205、3403、4018站位的0~2cm分層細(xì)菌,藍(lán)細(xì)菌及原生生物的T-Test檢驗(yàn)Tab.2 T-Test analyses of bacteria,cyanobacteria and protists in the 0~2 cm layer at Stations 3205,3403 and 4018 under two different preservations
3 討論
3.1 保藏方式對(duì)定量的影響
Porter等[7]報(bào)道福爾馬林固定后的浮游樣品經(jīng)DAPI 染色封片后,4℃保存24周,細(xì)菌計(jì)數(shù)結(jié)果無(wú)差異。Hyun等[8]研究發(fā)現(xiàn)浮游樣品采集后經(jīng)福爾馬林固定,一部分存于樣品瓶中,一部分現(xiàn)場(chǎng)染色封片,均冷凍保存90天。結(jié)果顯示存于樣品瓶后的細(xì)菌數(shù)量為原來(lái)的 95%,而封片中細(xì)菌數(shù)量為原來(lái)的80%,且反復(fù)凍融可造成細(xì)菌數(shù)量損失。但有關(guān)底棲樣品保藏后對(duì)實(shí)驗(yàn)結(jié)果的影響研究極少。本研究三個(gè)站位中,對(duì)于細(xì)菌、藍(lán)細(xì)菌、硅藻、三個(gè)粒級(jí)的異養(yǎng)小鞭毛蟲(chóng)以及大于10 μm的自養(yǎng)小鞭毛蟲(chóng),冷凍、冷藏兩種保藏方式無(wú)差異; 而對(duì)于 2~5 μm 與 5~10μm的自養(yǎng)小鞭毛蟲(chóng)來(lái)說(shuō),在一個(gè)站位呈現(xiàn)差異顯著,冷藏獲得的豐度高于冷凍保藏。原因可能在于冷凍樣品的解凍過(guò)程對(duì)細(xì)胞尤其是較大個(gè)體的細(xì)胞造成破碎,解凍對(duì)于細(xì)胞壁較為堅(jiān)實(shí)的細(xì)菌和藍(lán)細(xì)菌的影響較小,而對(duì)于細(xì)胞壁不太堅(jiān)實(shí)的鞭毛蟲(chóng)則影響較大。因此,對(duì)沉積物樣品短期內(nèi)宜采用避光冷藏保存。此外,沉積物類(lèi)型的不同,也會(huì)對(duì)定量計(jì)數(shù)造成影響:例如,含砂量較多的樣品過(guò)濾到黑膜上后,可造成細(xì)胞分布不均或鏡檢時(shí)焦距不同而影響計(jì)數(shù),而含泥較多則會(huì)遮掩部分細(xì)菌及小的原生生物。
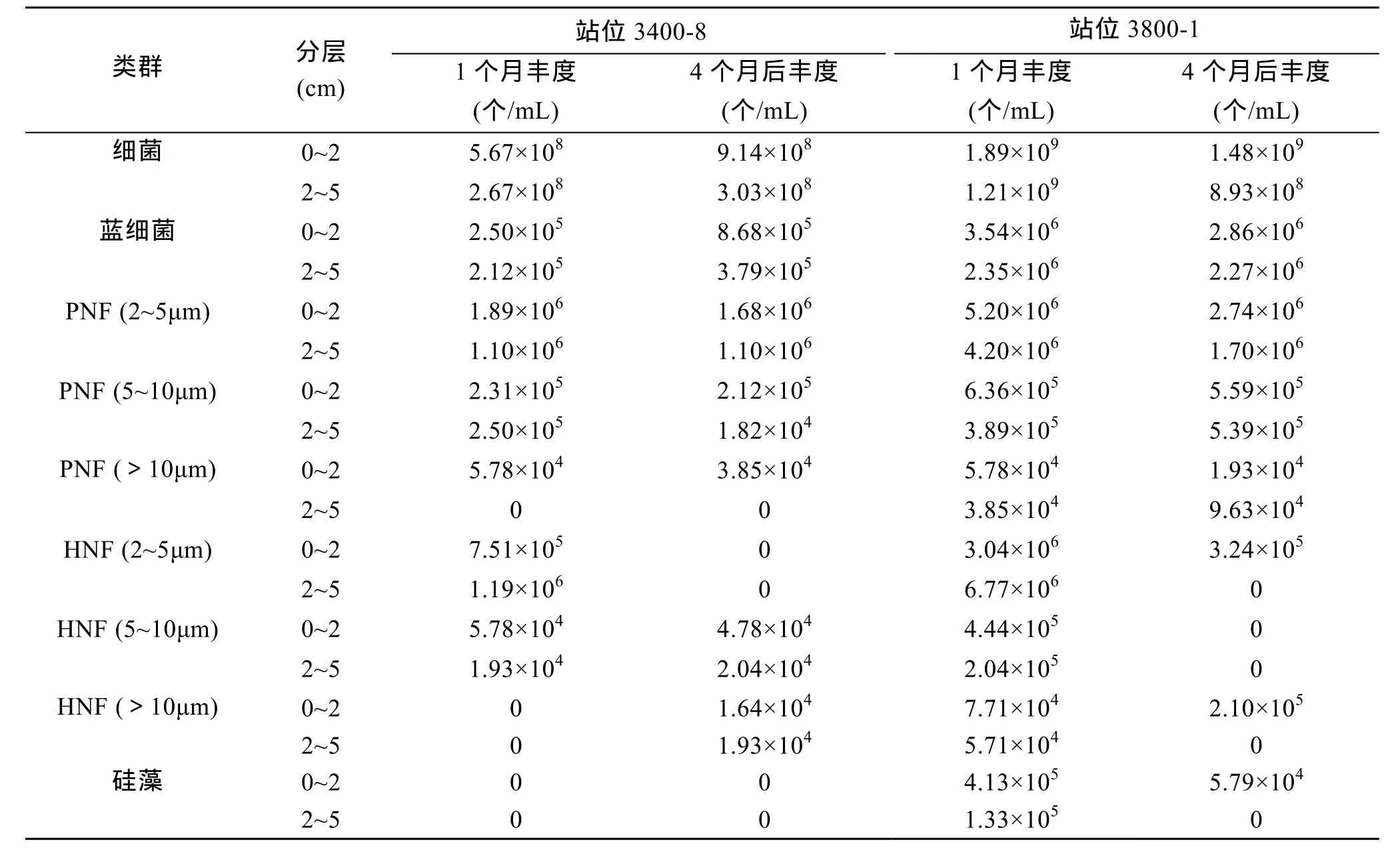
表3 兩站位(3400-8,3800-1)的0~2 cm及2~5 cm分層樣品在保存1個(gè)月和4個(gè)月后的細(xì)菌、藍(lán)細(xì)菌及原生生物的豐度Tab.3 Abundance of bacteria,cyanobacteria and protists in the 0~2 cm and 2~5cm layers of Stations 3400-8 and 3800-1 after 1 and 4 months
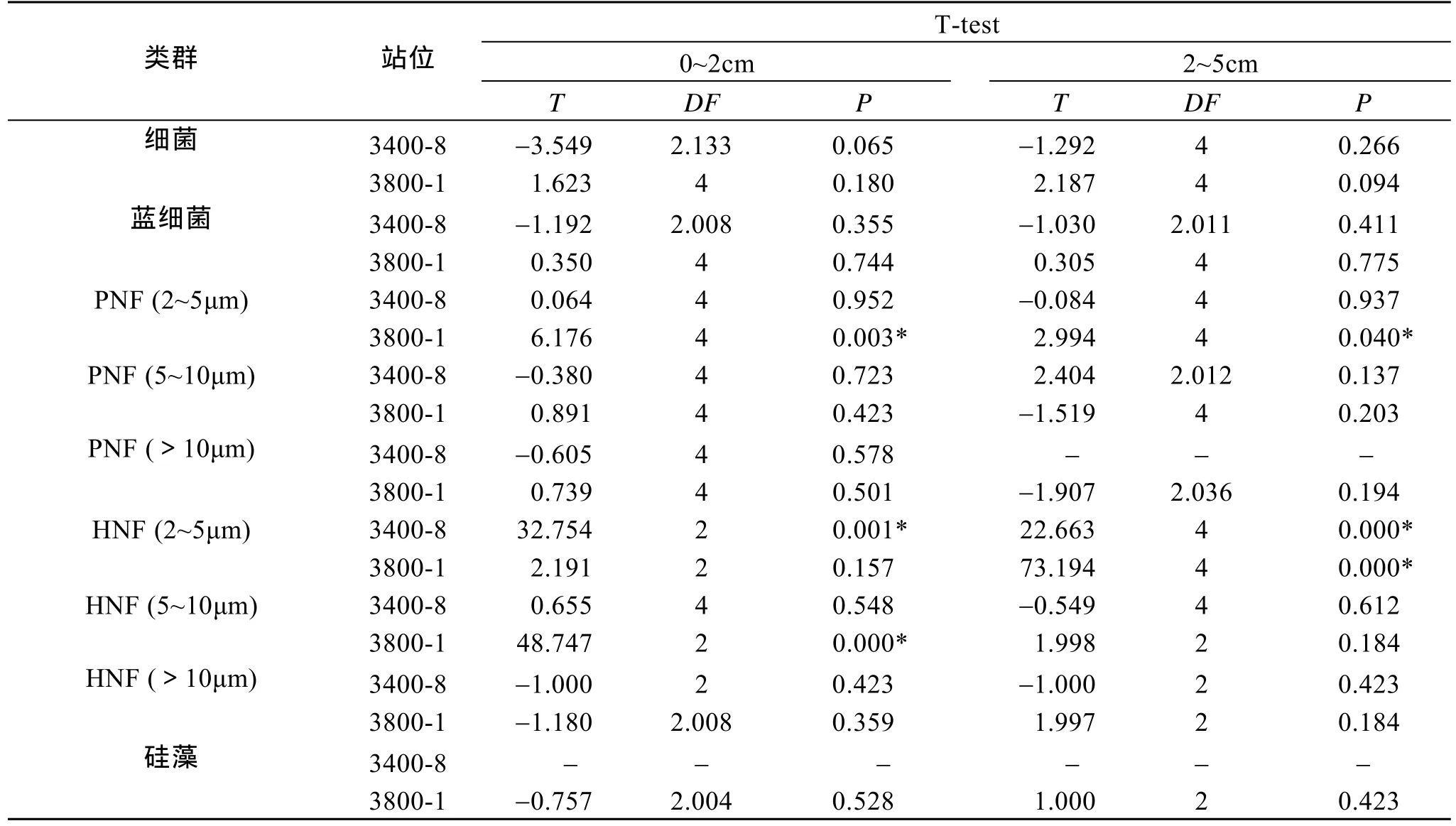
表4 兩站位(3400-8,3800-1)的0~2 cm及2~5 cm分層在保存1個(gè)月和4個(gè)月后的細(xì)菌及原生生物的T-Test檢驗(yàn)結(jié)果Tab.4 T-Test analyses of bacteria and protists in the 0~2 cm and 2~5cm layers of Stations 3400-8 and 3800-1 after 1 and 4 months
3.2 樣品保存時(shí)間對(duì)定量的影響
在樣品保存時(shí)間對(duì)底棲生物定量分析的影響方面,迄今尚無(wú)研究報(bào)道。Daley等[4]、Sherr等[5]及Kepner 等[6]發(fā)現(xiàn)經(jīng)福爾馬林固定的浮游樣品于 5℃下避光保存 1~2周后,對(duì)細(xì)菌的計(jì)數(shù)結(jié)果無(wú)差異。Turley[9]曾報(bào)道經(jīng)戊二醛固定后的浮游樣品常溫避光保藏,前 40天內(nèi)細(xì)胞數(shù)量平均減少39%,并證實(shí)無(wú)論以何種固定液 (戊二醛或甲醛)、樣品瓶 (無(wú)色或棕色瓶) 或染色劑 (AO或DAPI) 處理,均會(huì)造成細(xì)胞數(shù)量的低估。本研究表明樣品隨著保存時(shí)間的延長(zhǎng) (保藏 1個(gè)月和 4個(gè)月),對(duì)其定量計(jì)數(shù)依不同研究對(duì)象而有程度不同的影響:對(duì)于細(xì)菌、藍(lán)細(xì)菌、PNF (5~10 μm)、PNF (>10 μm)、HNF (>10 μm)、硅藻保存 4 個(gè)月后計(jì)數(shù)無(wú)影響; 而對(duì)于 PNF (2~5 μm)、HNF (2~5 μm)、HNF (5~10 μm) 的影響不同,例如樣品保存4個(gè)月后,在3800-1站0~2 cm分層的PNF (2~5 μm) 豐度比1個(gè)月時(shí)減少了47.4%,2~5 cm分層的豐度減少了 59.6%,而且統(tǒng)計(jì)分析存在差異的 HNF (2~5 μm)和 HNF (5~10 μm)在 4 個(gè)月后豐度降為0。可見(jiàn)樣品保藏時(shí)間對(duì)異養(yǎng)小鞭毛蟲(chóng)的影響比自養(yǎng)小鞭毛蟲(chóng)的影響大。總體上,樣品保藏4個(gè)月對(duì)細(xì)菌、藍(lán)細(xì)菌、硅藻均無(wú)影響,但對(duì)鞭毛蟲(chóng)有一定的影響,因此建議對(duì)鞭毛蟲(chóng)樣品在采集后宜盡快分析。
4 結(jié)語(yǔ)
冷凍和冷藏兩種保藏方式對(duì)于細(xì)菌、藍(lán)細(xì)菌和硅藻的影響未呈現(xiàn)明顯差異,但對(duì)于自養(yǎng)小鞭毛蟲(chóng)則冷藏優(yōu)于冷凍方式,故建議短期內(nèi)對(duì)沉積物樣品采取避光冷藏保存,并在采集后盡快完成樣品的定量分析。
致謝:本研究樣品源于“中國(guó)科學(xué)院海洋研究所2007 年度黃海冷水團(tuán)調(diào)查航次”。杜永芬、代仁海、詹子鋒協(xié)助采樣,李承春協(xié)助部分樣品處理,在此一并致謝。
[1]Sheer E B,Caron D A,Sheer B F.Staining of heterotrophic protists for visualization via epifluorescence microscopy [A].Kemp P F,Sherr B F,Sherr E B,et al.Handbook of methods in aquatic microbial ecology [C].London:Lewis Publishers,1993.213-227.
[2]Epstein S S,Rossel J.Enumeration of sandy sediment bacteria:search for optimal protocol [J].Marine Ecology Progress Series,1995,117:289-298.
[3]Turley C M.Direct estimates of bacteria numbers in seawater samples without incurring cell loss due to sample storage [A].Kemp P F,Sherr B F,Sherr E B,et al.Handbook of methods in aquatic microbial ecology[C].London:Lewis Publishers,1993.143-147.
[4]Daley R J,Hobble J E.Direct counts of aquatic bacteria by a modified epifluorescence technique [J].Limnology and Oceanography,1975,20:875-882.
[5]Sheer E B,Sheer B F.Preservation and storage of samples for enumeration of heterotrophic protists [A].Kemp P F,Sherr B F,Sherr E B,et al.Handbook of methods in aquatic microbial ecology [C].London:Lewis Publishers,1993.208-212.
[6]Kepner Jr R L,Pratt J.Use of fluorochromes for direct enumeration of total bacteria in environmental samples:past and present [J].Microbiology and Molecular Biology Reviews,1994,58(4):603-615.
[7]Porter K G,Feig K G.The use of DAPI for identifying and counting aquatic microflora [J].Limnology and Oceanography,1980,25 (5):943-948.
[8]Hyun J,Yang E.Freezing seawater for the long-term storage of bacterial cells for microscopic enumeration [J].The Journal of Microbiology,2003,41(3):262-265.
[9]Turley C M,Hughes D J.Effects of storage on direct estimates of bacterial numbers of preserved seawater samples [J].Deep-Sea Research,1992,39:375-394.
[10]Pomroy A J.Direct counting of bacteria preserved with Lugol iodine solution [J].Applied and Environmental Microbiology,1984,47(5):1191-1192.
[11]Hamels I,Muylaert K,Casteletn C,et al.Uncoupling of bacterial production and flagellate grazing in aquatic sediments:a case study from an intertidal flat [J].Aquatic Microbial Ecology,2001,25:31-42.
[12]Hamels I,Sabbe K,Muylaert K,et al.Quantitative importance,composition,and seasonal dynamics of protozoan communities in polyhaline versus freshwater intertidal sediments [J].Microbial Ecology,2004,47:18-29.
[13]Velji M I,Albright L J.Improved sample preparation for enumeration of aggregated aquatic substrate bacteria [A].Kemp P F,Sherr B F,Sherr E B,et al.Handbook of methods in aquatic microbial ecology [C].London:Lewis Publishers,1993.139-142.
[14]Schallenberg M,Kalff J,Rasmussen J B.Solutions to problems in enumerating sediment bacteria by direct counts [J].Applied and Environmental Microbiology,1989,55:1 214-1 219.
[15]Epstein S S,Alexander D,Cosman K,et al.Enumeration of sandy sediment bacteria:Are the counts quantitative or relative? [J].Marine Ecology Progress Series,1997,151:11-16.
[16]Maclsaac E A,Stockner J G.Enumeration of phototrophic picoplankton by autofluorescence microscopy [A].Kemp P F,Sherr B F,Sherr E B,et al.Handbook of methods in aquatic microbial ecology [C].London:Lewis Publishers,1993.187-197.
- 海洋科學(xué)的其它文章
- 條斑星鰈幼魚(yú)變態(tài)期間核酸及蛋白的變化
- 《中國(guó)海洋湖沼學(xué)報(bào)》(英文版, SCI-E收錄) Chinese Journal of Oceanology and Limnology 2010年第3期論文導(dǎo)讀
- 酶解海洋生物源蛋白制備活性肽研究進(jìn)展
- 第九屆國(guó)際海洋生物技術(shù)大會(huì)(9th International Marine Biotechnology Conference, 2010)
- 海岸帶系統(tǒng)科學(xué)學(xué)術(shù)研討會(huì)
- 從患病黑分離病原菌HV0811的鑒定及其系統(tǒng)發(fā)育分析

