協同催化光度法測定環境水樣中痕量汞研究
姜洪波
(黑龍江綏化學院化學與制藥工程系,黑龍江 綏化 152061)
汞對環境和人體健康的危害已引起世界各國的高度重視[1],研究表明含汞的廢水進入水體通過微生物的作用,可轉化為比無機汞毒性更大的甲基汞。而含汞的廢水和土壤可使汞累積在作物中,再通過食物鏈進入人體。汞進入人體后,可通過血液流動到全身及各器官組織與蛋白質等生命活性成分結合形成穩定的化合物,造成中樞神經異常,肝及腎臟的損傷,從而破壞人體正常生理活動。汞已作為環境污染指標,成為重點監測的重金屬元素之一。痕量汞的測定通常采用分光光度法[2-5],固相萃取光度法[6],所用時間長,準確度差。熒光法[7-8],價格昂貴,難以普及。催化褪色光度法測定痕量汞的報道較少[9],但方法的檢出限達到10-10g·mL-1數量級的并不多。本試驗研究發現,在酸性介質中,溴酸鉀協同過氧化氫氧化偶氮胂Ⅰ褪色,而超痕量汞對該反應又具有進一步的催化作用,據此建立了測定痕量汞的催化光度分析新方法,確定了Hg-KBrO3-H2O2-偶氮胂Ⅰ催化體系的最佳反應條件,方法具有較好的選擇性和較高的靈敏度。試驗研究了干擾離子的影響,該方法簡便快速,儀器簡單,本法可用于環境廢水中痕量汞的測定,結果滿意。
1 材料與方法
1.1 儀器與試劑
756紫外分光光度計(上海第二分析儀器廠);723型分光光度計(上海第三分析儀器廠);超極恒溫水浴(余姚市東方電工儀器);汞標準溶液:用優級純HgCl2按常規方法配制成濃度為1 g·L-1的儲備液,使用時逐級稀釋成所需工作溶液;偶氮胂Ⅰ溶液:稱取0.4021 g偶氮胂Ⅰ(上海試劑總廠第三分廠)于燒杯中加水溶解后轉入500mL的容量瓶中,用水稀釋至刻度;H2O2溶液:2.00×10-2mol·L-1;KBrO3溶液:1.00×10-2mol·L-1;H2SO4溶液:1.00×10-2mol·L-1。試劑均為分析純,水為二次蒸餾水。
1.2 方法
于兩支25mL比色管中分別加入適量Hg(Ⅱ)標準溶液(其中一只不加)加水稀至10mL,然后分別加入H2SO4溶液1.5mL;KBrO3溶液 1.5mL;H2O2溶液2mL;偶氮胂Ⅰ溶液1.2mL加水稀釋至刻度,搖勻后迅速放入700℃恒溫水洛中加熱反應10 min,取出后用流水冷卻至室溫,用1 cm比色皿以水為參比,在570nm波長處測定非催化體系的吸光度A0和催化體系的收光度A,計算Ig A0/A=0.086+1.06ρ。
2 結果與分析
2.1 吸收光譜
按試驗方法測定不同系列的吸收光譜(見圖1),曲線1.2表明偶氮胂Ⅰ與H2SO4及KBrO3無腿色反應,曲線3表明H2O2氧化偶氮胂稍有腿色,曲線4表明H2O2和KBrO3可以協同氧化偶氮胂Ⅰ褪色,曲線5表明汞可加速偶氮胂l褪色,但吸光度明顯降低,表明Hg對Hg-KBrO3-H2O2-偶氮胂Ⅰ體系褪色有強烈的催化作用。非催化體系和催化體系的吸收曲線在570nm處均有最大吸收,故本試驗選定測量波長為570nm。

圖1 配合物的吸收光譜Fig.1 Absorption spectrum of the complex
2.2 體系酸度和緩沖溶液用量的影響
按試驗方法,在不同酸性介質中進行顯色反應試驗,試驗了HCl、HNO3、H3PO4、HAC、H2SO4等不同介質對反應體系的影響。結果表明,在HCl介質中反應太快,靈敏度太低且反應條件不易控制;在HNO3、H3PO4、HAC中靈敏度較低且反應體系不穩定;而在H2SO4介質中體系的靈敏度最高,吸光度最大,體系的穩定性較好。選用H2SO4為反應介質,按試驗方法改變介質的用量,反應體系在H2SO4的加入量在0.5~2.5mL時,體系的吸光度最大且穩定,故選用H2SO4的用量為1.5mL(見圖 2)。
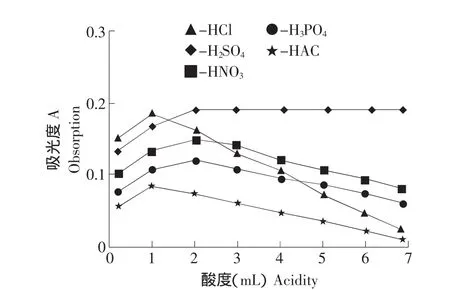
圖2 酸度對吸光度的影響Fig.2 Effect of acidity on absorbance
2.3 試劑用量的確定
固定反應溫度為900℃,反應時間為8 min,分別改變H2SO4、偶氮胂Ⅰ、KBrO3、H2O2的用量,按試驗方法進行試驗。結果表明,H2SO4用量在1.00~3.00mL;偶氮胂Ⅰ用量在0.50~1.80mL; KBrO3用量在 1.00~3.10mL;H2O2用量在 2.00~4.00mL。△A值較大且穩定,故試驗選用H2SO441.5mL、偶氮胂Ⅰ1.20mL、KBrO31.50mL、H2O22.00mL。
2.4 反應溫度和反應時間的影響
在選定的反應條件下,進行反應條件試驗,在600℃以下,△A值較小,隨溫度升高非催化體系和催化兩體系反應速度都有所增加,但催化體系反應速度增加較快,△A值增大。700℃以后△A值增加速度在900℃時達最大值,超過900℃△A值有所下降,試驗采用在900℃時加熱。取出冷卻至室溫終止反應,按試驗方法,測定900℃時不同反應時間的△A和A。試驗結果表明,隨反應時間的增長△A不斷變化,當反應時間在0~16 min范圍內時,△A-t呈線性,8 min時達最大值且穩定,結果見圖3、4。
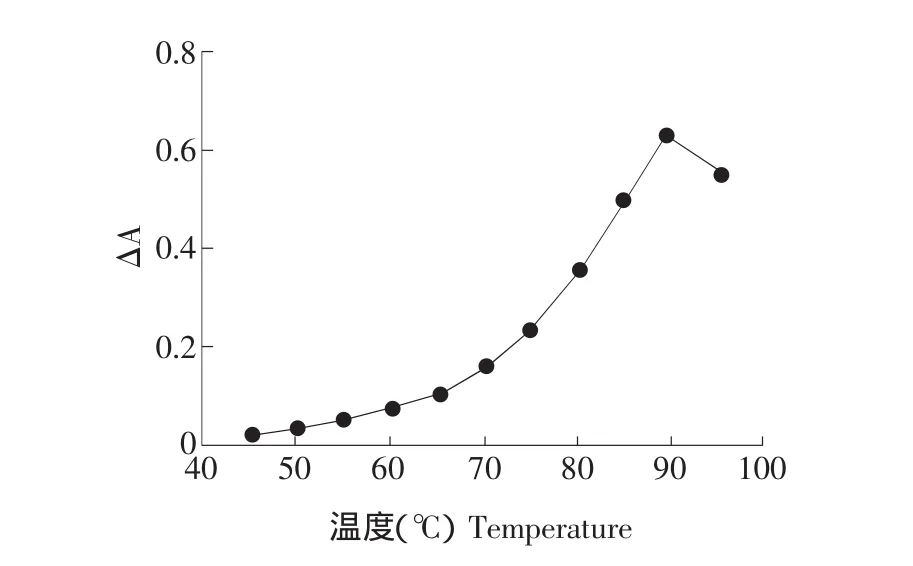
圖3 溫度曲線Fig.3 Temperature curve
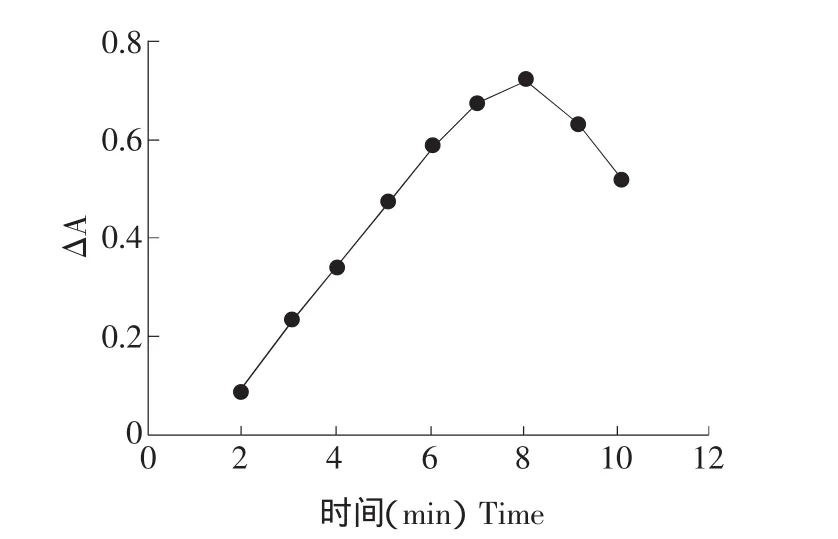
圖4 時間曲線Fig.4 Time curve
2.5 標準曲線
在試驗條件,分取不同量的汞標準溶液,測定其吸光度,繪制標準曲線,在 0~6.5μg·mL-1,范圍內線性良好,其線性回歸方程為IgA0/A=0.086+1.06ρ(μg·25mL-1)相關系數 r=0.9997,以 1.0μg 的Hg標準溶液為樣品,重復10次試驗測定其吸光度,檢查該工作曲線的精密度,RSD為2.98%。根據空白試驗值的標準偏差S=2.97×10-3(n=10),以及工作曲線的斜率N,按3S/N法計算該方法的撿出限為 7.26×10-10g·mL-1。
2.6 共存離子的影響
按試驗方法,在適宜反應條件下對常見共存離子進行干擾實驗,當測定的相對誤差≤±5%時,其共存離子的允許量(以μg計)Na+、K+、NH4+、Ca2+、Ba2+、Sr2+、Mg2+(300);Cr(Ⅵ)、F-、I-、Cl-、Zn2+(200);Mn2+(150);Ag+、Cd2+(100);Sb3+、Bi2+(30);Cu2+(10);Sn2+(5);SO42-、C2O4-、PO43-、NO3-、NO2-、Ac-、Ar-等離子不干擾測定。1mL 10 g·L-1檸檬酸可掩蔽0.8 mg的Al3+。0.5mL 2 g·L-1EDTA 可掩蔽0.2 mg Cu2+、0.02 mg Cr3+和 1.6 mg Fe3+。對測定中干擾離子較多的樣品可以用CCl4萃取和水進行反萃取后按試驗方法測定。從上述結果看,大多數離子不干擾測定,方法具有較好的選擇性。
2.7 樣品分析
樣品分析參照文獻[10]所示的方法,取電廠廢水、藥廠廢水、生活污水(未經環保處理)各一份,每份50mL,過濾,濾液放入100mL燒杯中進行消化處理,分別加入10mL濃HNO3蓋上表面皿,在低溫電熱板上加熱,待溶液的體積蒸至10mL左右時加入10mL 30%的H2O2,繼續在低溫電熱板上加熱,蒸至近干,然后加水溶解結晶鹽,并轉移溶液至25mL容量瓶中,定容。取5mL樣液于25mL容量瓶中,調制酸度近中性,按試驗方法測定并做回收試驗,結果見表1。
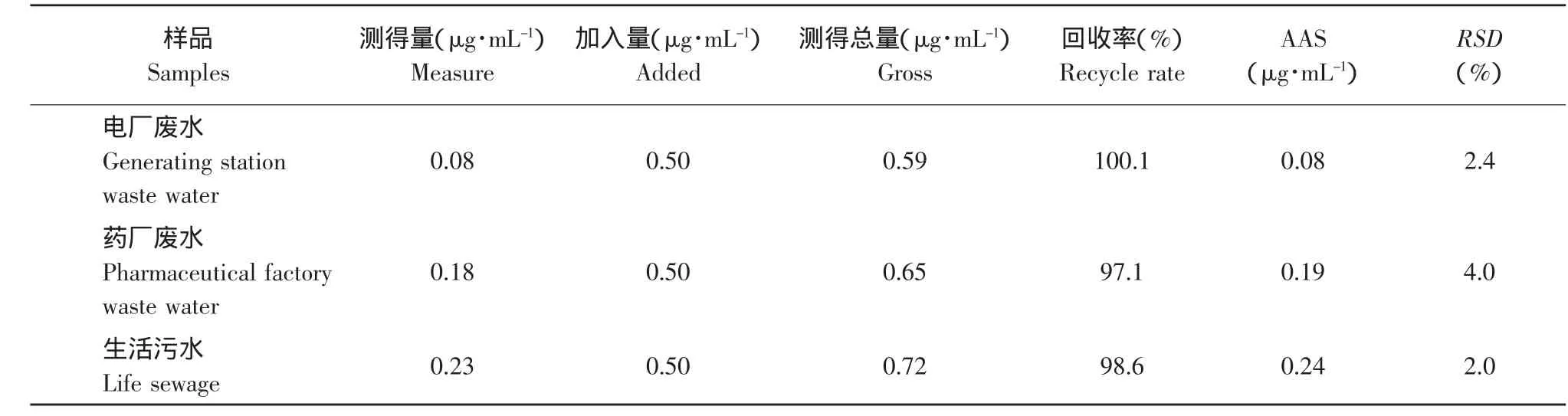
表1 樣品測定結果及回收實驗(n=6)Table1 Determination results and recovery of palladium in samples
依據我國污水排放標準,汞含量不能超過0.05 mg·L-1,而我國飲用水標準規定汞含量不得超過0.001 mg·L-1[10]。所以上述所測水樣符合污水排放標準,而不符合生活飲用水標準,本法結果(n=6)與原子吸收分光光度法(AAS)方法對照結果(n=6)之間不存在顯著性差異。
3 結論
本文研究了不同酸性介質,反應溫度,反應時間及干擾離子對試驗的影響。該方法簡便快速,儀器簡單,方法具有較好的選擇性和較高的靈敏度,檢出限為7.26×10-10g·mL-1,線性范圍為0~6.5μg·mL-1。本法可用于環境廢水中痕量汞的含量,結果滿意。
[1]姜洪波,張慧云.人類與環境保護[M].哈爾濱:哈爾濱地圖出版社,2005.
[2]姜洪波,張慧云,李應輝.汞與溴代氨基苯基熒光酮多元絡合物的光度研究及應用[J].現代儀器,2002,8(6):29.
[3]張其穎,潘教麥,李在均.新試劑2,6二甲基苯基重氮氨基偶氮苯測定化妝品中微量汞[J].分析試驗室,2004,23(3):19.
[4]徐斌,鄒欣平,吳微.安替比林基重氮氨基-2,4-二硝基苯與汞的顯色反應及應用[J].分析化學,1995,23(5):579.
[5]楊明華,鄭云法,陳愛新,等.新試劑1-(2,6-二溴-4-硝基苯)-3-(4-硝基苯)-三氮稀與汞的顯色反應及應用[J].理化檢驗-化學分冊,2002,38(8):415.
[6]胡秋芬,楊光宇,尹家元.對磺酸基苯亞甲基若丹寧固相萃取光度法測定水中的汞[J].分析試驗室,2002,21(4):93.
[7]侯明,李海云,殷輝安.汞(Ⅱ)-吖啶橙-十二烷基磺酸鈉熒光體系的研究及應用[J].分析試驗室,2005,24(8):14.
[8]羅兆福,左超,潘祖亭,等.熒光光譜法測定工業廢水中痕量汞的研究[J].分析試驗室,2000,19(2):187.
[9]黃泱,林艷琳.催化褪色光度法測定痕量汞[J].漳州師范學院學報:自然科學版,2003(4):77-80.
[10]魏復盛.水和廢水監測方法[M].北京:中國環境科學出版社,1998.

