日本腦炎病毒囊膜蛋白的基因原核表達及抗原性分析
張 寧,金洪濤,夏志平*,張瑞巖,劉 雯,李 勇,薛慧亮,李 丹,丁 壯*
(1.吉林大學動物科技學院,吉林長春130062;2.解放軍軍事醫學科學院軍事獸醫研究所,吉林長春130062)
日本腦炎(Japanese encephalitis,JE)是由日本腦炎病毒(Japanese encephalitis virus JEV)引起的一種嚴重的人畜共患蟲媒病毒性疾病,是人類中樞神經系統最常見的蟲媒病之一[1]。JEV可引起妊娠母豬發生流產和死胎,公豬表現為睪丸炎,育肥豬持續高熱,新生仔豬腦炎[2]。本病不但對養豬業造成了巨大的經濟損失,而且在世界許多國家廣泛存在。在中國,JEV分布于除新疆維吾爾自治區、青海、西藏外的所有省市自治區。由于日本腦炎疫苗的廣泛應用,使得疫情大幅度降低[3],但日本腦炎病毒仍然嚴重威脅著人類健康,因此,有必要及時的了解JEV的流行趨勢及建立綜合防控的技術措施和示范體系。
日本腦炎病毒屬黃病毒科(Flaviviridae),黃病毒屬(Flavivirus),病毒基因組為單股正鏈RNA,其基因組長度約為11 kb,其中5′端有Ⅰ型帽狀結構,3′端無polyA尾,病毒基因組僅含有一個開放閱讀框(open reading frame,ORF)編碼產物通過裂解和加工形成約10個蛋白,由5′端末端編碼,而3′端編碼非結構蛋白(nonstructural protein,NS)[4]。日本腦炎病毒包括3個結構蛋白基因,7個非結夠蛋白基因和2個非翻譯區,其中囊膜糖蛋白E表面有囊膜糖蛋白刺突[5]。因此基因工程重組表達的JEV E蛋白抗原有望成為標準化的診斷抗原。試驗對JEV E蛋白進行原核表達并對抗原性進行鑒定。
1 材料與方法
1.1 材料
1.1.1 病毒 日本腦炎弱毒株SA 14-14-2,為解放軍軍事醫學科學院軍事獸醫研究所基礎實驗室保存。
1.1.2 菌種和質粒 大腸埃希菌DH 5α、BL21(DE3)感受態為解放軍軍事醫學科學院軍事獸醫研究所基礎實驗室保存;克隆質粒pMD-18T為寶生物工程(大連)有限公司產品;pET-28a表達載體為本實保存。
1.1.3 試劑 限制性內切酶(XhoⅠ、Eco RⅠ)T4 DNA連接酶、AMV逆轉錄酶、DNA聚合酶、等為Takara公司產品;兔抗JEV多克隆抗體為解放軍軍事醫學科學院軍事獸醫研究所基礎實驗室自制;豬JEV陽性、陰性血清、辣根過氧化物酶標記羊抗豬IgG為深圳綠詩源公司產品;DNA回收試劑盒;金屬螯和親和層析介質(Ni-NTA)為Merck公司產品;IPTG、HRP標記羊抗兔IgG為Promega公司產品。
1.2 方法
1.2.1 病毒RNA提取 參照Trizol法提取病毒RNA,按照試劑盒說明書進行。
1.2.2 RT-PCR擴增JEV E基因及產物的回收取10μL RNA作為模板、2μL隨機引物,70℃水浴5min,冰浴5min,0.5μL RNA酶抑制劑、8μL 5×bu ffer、8μL dNTP、0.5μLAMV逆轉錄酶、加水補足至40μL體系,42℃水浴1 h。取2.0μL反轉錄產物為模板,以P1:5′-GCGAATTCTTACCATCCTCCTGCTGTTG-3′,P2:5′-ATCTCGAGCGCATCTCATCTCTTTTCTTGT-3′(P1、P2引物的5′端分別含有Eco RⅠ和XhoⅠⅠ內切酶識別位點)作為引物進行PCR擴增,反應條件為:94℃10 min;94℃1 min,58℃1 min,72℃2 m in,35個循環;最后72℃10min,擴增結束,將上述產物用10 g/L瓊脂糖凝膠電泳檢測,檢測正確后,純化回收PCR產物。
1.2.3 JEV E蛋白基因克隆載體pMD-18T-E的構建 取上述回收產物溶于20μL超純水,將目的片段連接到pMD-18T中。連接體系:5μL膠回收產物、4.5μL solutionⅠ、0.5μL pMD-18T,16℃過夜。然后將連接產物轉化感受態細菌DH 5α,涂布于含Ka+(50μg/mL)的LB平板上,37℃培養過夜,次日挑單菌落于5 mL LB中,37℃搖床振蕩(200 r/min)培養過夜。次日,堿裂解法提取質粒,并以Eco RⅠ和XhoⅠ酶切進行鑒定。
1.2.4 重組質粒的序列測定 由寶生物工程(大連)有限公司完成。
1.2.5 JEV E蛋白重組表達載體pET28a-E的構建 以Eco RⅠ+XhoⅠ酶切測序正確的質粒及pET-28a空載體質粒,將上述酶切產物用10 g/L瓊脂糖凝膠電泳鑒定,并回收目的片段E基因和載體片段(按照凝膠試劑盒說明書進行回收)。5μL E基因雙酶切膠回收產物,3.5μL pET-28a雙酶切膠回收產物,0.5μL T4 DNA連接酶,1μL T4緩沖液,16℃連接過夜,然后將連接產物轉化感受態細菌DH 5α,堿裂解法提取質粒,以Eco RⅠ+XhoⅠ酶切進行鑒定。
1.2.6 JEV E蛋白的誘導表達
1.2.6.1 JEV E蛋白表達產物的可溶性分析 將酶切正確的質粒轉化大腸埃希菌BL21(DE3),涂布于含Kan(50μg/mL)的LB平板上,37℃培養過夜,次日挑取單菌落,于5 mL LB液體培養基中,37℃搖床振蕩(200 r/min)培養過夜。以1∶100比例接種于新鮮的含Kan(50μg/mL)的LB培養基中,劇烈振蕩,待OD600約為0.4~0.6,加入IPTG誘導劑,終濃度為1.0 mmol/L,繼續在搖床37℃(200 r/m in),4 h后收集菌液。并設BL21誘導對照、未誘導的pET-28a(+)/BL21對照、pET-28a(+)/BL21誘導對照、未誘導的pET-E/BL21對照、pET-E/BL21誘導對照、各取1 mL,以6 000 r/min,4℃離心5 min,收菌,用PBS重懸,加入2×SDS-PAGE上樣緩沖液進行處理。另外離心收集菌體1mL,以細胞裂解液重懸菌體,超聲破菌。分別收集上清和沉淀,取上述各樣品做SDSPAGE電泳檢測表達情況。
1.2.6.2 不同濃度的IPTG對JEV E蛋白的誘導表達分析 將菌液按1∶100接種于5 mL含有Kan 50μg/mL)抗生素的LB液體培養基中,37℃振蕩培養至OD600為0.4~0.6時,加入IPTG至終濃度分別為0.1、0.2、0.4、0.8、1.0、1.5、2.0mmoL/L,37℃誘導表達4 h~5 h,收獲細菌,然后進行SDS-PAGE分析。
1.2.6.3 不同時間對JEV E蛋白的誘導表達分析將凍存菌液按1∶100擴大接種于5 mL含有Kan(50μg/mL)抗生素的LB液體培養基中,37℃振蕩培養至OD600為0.4~0.6時,加入IPTG至終濃度0.8mmol/L,37℃誘導表達1.0、2.0、3.0、4.0、5.0、6.0 h,收獲細菌,然后進行SDS-PAGE分析。
1.2.7 工程菌的大量制備及親和層析純化E蛋白
取凍存的陽性菌種,接種于5 mL含Kan(50μg/mL)的LB液體培養基中,37℃,200 r/m in震蕩培養過夜,次日,按1∶100轉接至100mL含Kan+(50μg/mL)的LB液體培養基中,至OD為0.6左右加入IPTG至終濃度為0.8 mmoL/L,37℃誘導表達6 h;4℃,5 000 r/m in離心15 m in,收集菌體;用10mL l×PBS緩沖液洗滌細菌1遍,然后再用10mL l×PBS緩沖液重懸,用超聲破碎重懸的細菌,冰浴超聲破碎:超聲4 s,停止9 s,15 min,功率為300 w,4℃條件下,以8 000 r/m in,離心15min,棄上清,2 mol/L尿素將沉淀溶解后,4℃條件下,以12 000 r/min離心10 min,棄上清,用8 mol/L尿素將剩下透明沉淀溶解,冰上1 h,4℃條件下,以12 000 r/min離心10 min,取上清。
參照M erck公司鎳離子親和層析柱(Ni-NTA)操作說明進行。將50%的Ni-NTA樹脂懸浮液1mL與一定量的清亮裂解上清于室溫輕柔混勻(100 r/m in搖60min)后,將混合液裝柱;收集穿過峰,留小樣進行SDS-PAGE;然后用不同變性緩沖液洗脫,收集洗脫液,取不同峰值樣品進行SDSPAGE分析。

圖1 JEV E基因PCR產物電泳圖Fig.1 PCR amplification products of JEVE gene
1.2.8 純化E蛋白的Western b lot鑒定 純化后的目的蛋白做SDS-PAGE,隨后將電泳蛋白轉移到NC膜上,用50 mL/L的脫脂奶封閉37℃1 h,用TBS°T洗膜3次,10 min/次,1∶800稀釋兔抗JEV多克隆抗體,4℃孵育過夜,然后用TBS°T洗膜3次,10 min/次,再用HRP標記羊抗兔IgG 37℃作用90min,TBS°T洗膜3次,10 min/次,DAB顯色。
1.2.9 純化E蛋白的ELISA鑒定 純化的E蛋白分別按1∶5、1∶10、1∶20、1∶40稀釋包被ELISA板,100μL/孔,4℃過夜;棄孔中液體,PBST洗板3次,3 min/次~5 min/次;封閉液200μL/孔,37℃孵育2 h;PBST洗板3次,3 min~5 min/次;分別加入1∶10、1∶20、1∶40、1∶80、1∶160、1∶320、1∶640稀釋的豬乙型腦炎陰、陽性血清,100μL/孔;37℃孵育1 h;棄孔中液體,洗板3次,5min/次,加入辣根過氧化物酶標記羊抗豬IgG作為二抗,100μL/孔,37℃孵育1 h;棄孔中液體,洗板3次5m in/次,各反應孔中加入OPD底物液,室溫孵育15 min,于各反應孔中加2 moL/L H2SO4終止液50μL,在酶標儀(492 nm)上進行檢測。
2 結果
2.1 JEV E蛋白基因片段的PCR擴增結果
將PCR擴增產物10μL在10 g/L的瓊脂糖上進行電泳,結果顯示擴增出約1 500 bp的片段,與目的基因的預期大小相符,擴增出了E蛋白基因(圖1)。
2.2 重組E蛋白克隆載體的構建和鑒定結果
獲得重組克隆質粒pMD-18T-E,經限制性內切酶Eco RⅠ/XhoⅠ雙酶切鑒定,切出了1.5 kb和2.7 kb的片段,與預期大小相符(圖2)。

圖2 pMD18-T-E質粒酶切鑒定Fig.2 Identification of plasm id pM D-18T-E digested by Eco RⅠ/XhoⅠ
2.3 重組E蛋白表達載體的構建和鑒定結果
重組原核表達載體pET28a-E經限制性內切酶Eco RⅠ/XhoⅠ雙酶切鑒定結果如下,切出了1.5 kb和5.4 kb片段,與預期大小相符(圖3)。
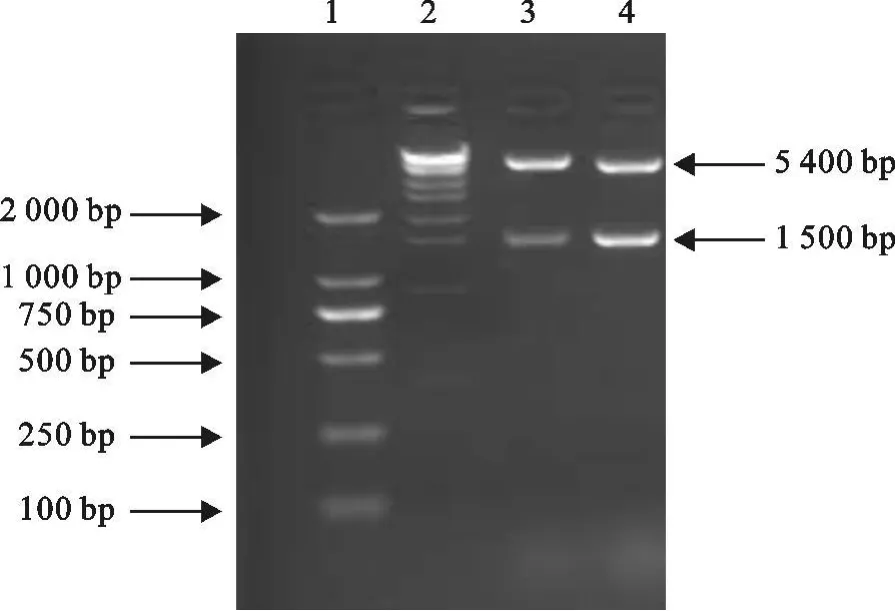
圖3 pET28a-E質粒的酶切鑒定Fig.3 Identification of plasmid pET28a-E digested by Eco RⅠ/XhoⅠ
2.4 JEV E蛋白基因核酸序列分析結果
借助Blast軟件,進行序列比較發現,該基因片段與減毒株SA 14-14-2、強毒株SA 14、標準強毒株JaOA rS982堿基序列同源性分別為100%、99%、98%,氨基酸序列同源性分別為100%、99%、98%。
2.5 E蛋白的表達及其可溶性分析
重組質粒經IPTG誘導后分別收集上清和沉淀,經SDS-PAGE檢測,在相對分子質量約56 ku處有明顯的條帶,與預期的結果大小相符,融和蛋白主要以包涵體形體存在于沉淀中,上清中也有少量的融和蛋白。誘導空菌,未誘導的和誘導的空載體及未誘導的重組載體對照均無目的蛋白表達(圖4)。

圖4 乙型腦炎E蛋白的表達及其可溶性分析Fig.4 Expression and solubility analysis of Japanese encephalitis E protein
2.6 不同濃度IPTG對JEV E蛋白的誘導表達分析
加入IPTG至終濃度分別為0.1、0.2、0.4、0.8、1、2 mmol/L,37℃誘導表達4 h收菌,然后進行SDS-PAGE分析。可見基因工程菌誘導加入IPTG至終濃度0.8mm ol/L后,目的蛋白表達量達高峰(圖5)。

圖5 不同濃度IPTG對JEV E蛋白的誘導表達分析Fig.5 Analysis of induced expression of JEV E protein by different IPTG con centrations
2.7 不同時間對JEV E蛋白的誘導表達分析
加入IPTG至終濃度0.8mmol/L,37℃誘導表達1、2、3、4、5、6 h后收獲細菌,然后進行SDSPAGE分析。可見基因工程菌誘導4 h后目的蛋白的表達量達高峰(圖6)。

圖6 不同時間對JEV E蛋白的表達分析Fig.6 Analysis of the JEV E protein expression at different time
2.8 JEV E蛋白的純化
利用Ni-NTA柱親和層析,從誘導表達菌體的沉淀中純化得到了6His E融合蛋白,SDS-PAGE的鑒定結果表明如下(圖7)。紫外光吸收法定量分析表明獲得蛋白的濃度約為1.722m g/mL。

圖7 JEV E蛋白純化結果 Fig.7 Purification results of JEV E protein
2.9 純化JEV E蛋白的Western blot鑒定
經純化后的E蛋白進行Western b lot分析,在預期大小處可見清晰條帶(圖8),表達的E蛋白較好地保持了與兔抗JEV多克隆抗體的結合活性,說明,目的蛋白具有較好的抗原性。
2.10 純化E蛋白的ELISA檢測結果
將重組表達并純化的JEV E蛋白包被于ELISA板上,用不同稀釋度的豬JEV陽性血清檢測包被于ELISA板上的蛋白,檢測結果如表1,結果P/N>2(表2),說明表達并純化后的蛋白具有較高的抗原性,可明顯地區分豬的陽性、陰性血清。

圖8 融合E蛋白與JEV多抗的Western blot結果Fig.8 Western blot analysis of E fusion protein with JEV polyclonal antibodies

表1 純化E蛋白的JEV多抗的ELISATable 1 ELISA of purified E protein with polyclonalantibody of JEV
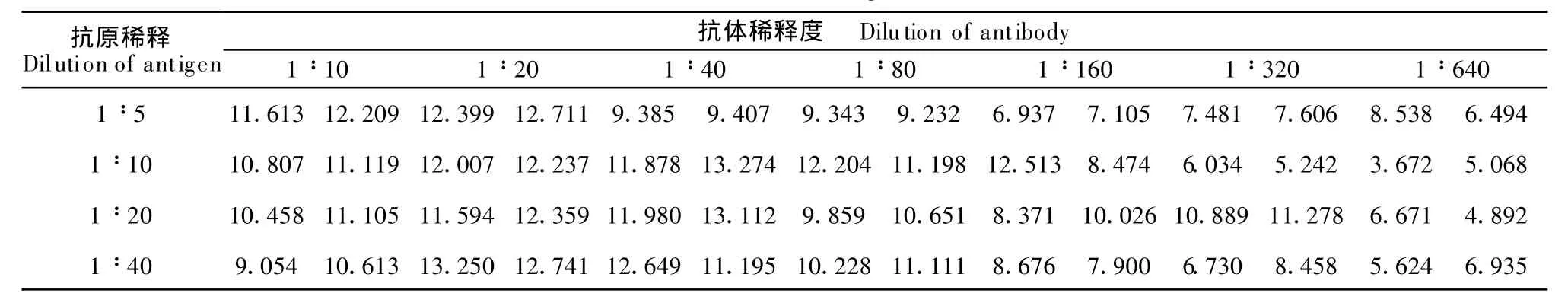
表2 P/N值Table 2 Positive number/negative number
3 討論
E蛋白是JEV的主要蛋白,基因大約1 500 bp,E結構蛋白基因含有病毒的抗原決定簇,是毒粒表面的重要成份,具有血凝活性和中和活性[6],E蛋白與病毒的毒力、宿主范圍、組織嗜性、膜融合保護性免疫、血凝反應和血清特異性有關,它能刺激機體產生中和抗體和血凝抑制抗體,為免疫原性蛋白[7]。因此,克隆乙型腦炎弱毒疫苗SA 14-14-2株E蛋白1 500 bp的基因片段,病毒的天然結構而使構象依賴型抗原表位得以正確呈現,使其更具有免疫原性,這樣才會有更高的使用價值,目前,針對乙型腦炎病毒的疫苗大多包含E蛋白中的抗原表位[8-10]。
pET-28a(+)是Novagen公司的一個融合表達載體,具有產物易于純化,表達效率高的等優點。pET28a-E(+)中的His°Tag融合標簽是高度可溶的多肽,可以增強一些蛋白的可溶性。本實驗采用pET-28a做為載體,提高了目的蛋白在大腸埃希菌中的表達。本文初步研究了不同濃度IPTG及誘導不同時間對表達的影響,其中以IPTG誘導終濃度為0.8 mmo l/L、37℃、誘導4 h的培養條件最佳,可獲得高效率的表達,誘導后目的蛋白主要是以包函體的形式存在,經過Ni-NTA親和層析法純化,獲得了高純度的目的蛋白。Western b lot檢測抗原性時,兔JEV多抗與目標蛋白結合,出現了目的條帶,說明目的蛋白具有抗原性。本文采用豬乙腦病毒抗體血清進行ELISA檢測純化的蛋白抗原性,結果表明抗原稀釋1∶40、血清稀釋1∶640時,P/N值仍大于2,可見表達的蛋白具有很好的抗原性,所以,本實驗制備的乙腦E蛋白可作為鑒別流行性乙型腦炎的實驗室診斷抗原,并為進一步研究診斷試劑盒及JEV E蛋白結構與功能奠定了基礎。
[1] Verma S K,Gupta N,Pattnaik P,et al.Antibodies against refolded recombinant envelope protein(domain III)of Japanese encephalitis virus inhibit the JEV infection to porcine stable kidney cells[J].Protein PeptLett,2009,16(11):1334-1341.
[2] 呂曉麗,崔保安,陳紅英,等.復合RT-PCR檢測豬乙腦病毒和豬流感病毒方法的建立[J].華南農業大學學報,2008,29(4):79-82.
[3] Wang H,Li Y,Liang X,et al.Japanese encephalitis in mainland China[J].Jpn J infect Dis,2009,62(5):331-336.
[4] Lin CW,Wu SC.A functional epitope determinant on domain III of the Japaneseencephalitis virusenvelope protein interacted with neutralizing-antibody combining site[J].Virology,2003,77(4):2600-2606.
[5] Verma S K,Kumar S,Gupta N,et al.Bacterially expressed recombinant envelope protein domain III of Japanese encephalitis virus(rJEV-DIII)elicits Th1 type of immune response in BA LB/cm ice[J].Vaccine,2009,27(49):6905-6909.
[6] 鄧淑珍,張海林,李金梅.流行性乙型腦炎病毒研究進展[J].中國熱帶醫學,2008(2):306-309.
[7] 湯德元,郭萬柱.日本腦炎病毒及其疫苗的研究[J].中國獸醫學報,2005,25(2):217-221.
[8] Feng G H,Liu N,Zhou Y,et al.Immunologic analysis induced by DNA vaccine encoding E protein of Beijing-1 strain derived from Japanese encephalitis virus[J].Int Virol,2007,50(2):93-98.
[9] Li Y,Ye J,Cao S,et al.Immunization with pseudotype baculovirusexpressing envelope protein of Japanese encephalitis virus elicits protective immunity in mice[J].JGene Med,2009,11(1):57-65.
[10] Li P,Zheng Q S,Wang Q,et al.Immune responses of recombinant adenoviruses expressing immunodomiant epitopes against Japanese encephalitis virus[J].Vaccine,2008,26(46):5802-5807.

