不同運動強度對男子賽艇運動員紅細胞內(nèi)皮型一氧化氮合酶的影響
黃紅梅,屈金亭,劉 濤
內(nèi)源性一氧化氮(NO)是由左旋精氨酸(L-A rg)在一氧化氮合成酶(NOS)的作用下產(chǎn)生的,是一種化學性質(zhì)活躍的氣體自由基,亦是一種重要的生物信號分子。在心血管系統(tǒng)中,NO具有擴張血管,抑制血小板黏附和聚集,抑制血管平滑肌細胞和淋巴細胞增殖,以及影響心臟舒縮周期和收縮力等功效[4]。大量研究表明,心血管系統(tǒng)NOSNO系統(tǒng)功能與機體運動形式、強度及持續(xù)時間密切相關(guān)[19]。NOS是調(diào)節(jié)NO合成的關(guān)鍵酶,已確認有3種同工酶:神經(jīng)元型(nNOS)、內(nèi)皮型(eNOS)和誘導型(iNOS),它們分布的部位、生物效應(yīng)及調(diào)控機制各不相同。研究表明,心血管系統(tǒng)NO主要是由血管內(nèi)皮細胞中內(nèi)皮型一氧化氮合成酶(eNOS)催化合成[17]。最近,Kleinbongard等發(fā)現(xiàn),eNOS亦存在于紅細胞漿膜,表明紅細胞也是心血管系統(tǒng)內(nèi)NO的主要來源之一[7]。本研究擬觀察不同負荷運動對男子賽艇運動員紅細胞eNOS蛋白表達量/活性和磷酸化水平,以及血漿中 NO含量的變化,以探討紅細胞eNOS-NO系統(tǒng)對于運動刺激的應(yīng)答及可能機制。
1 研究對象與方法
1.1 研究對象
專業(yè)賽艇運動員10名(一級和健將級),年齡21.6± 1.9歲,身高1.89±0.05 m,體重80.5±7.9 kg,訓練年限5.8±1.9年。所有參加實驗的運動員均身體健康,無器質(zhì)性疾病,實驗前48 h內(nèi)受試者均未進行過劇烈運動。
1.2 測試方案
受試者于清晨(6:30~7:30)靜臥15 min,空腹,肘靜脈采血5mL。然后進行劃船測功儀(CONCEPTⅡ,美國)遞增負荷測試來測定受試者的 ˙VO2max,測試前以16槳/ min負荷做5min準備活動,準備活動后休息5min并佩戴好呼吸面罩,起始負荷為20槳/min,每3 min增加2槳,直至力竭。用運動心肺測試系統(tǒng)(Cortex MetaLyzerⅡ,德國)測定耗氧量(˙VO2)、CO2呼出量(VCO2)、呼吸交換律(RER =VCO 2/˙VO2)、每分通氣量(VE)等,用遙測心率表(Polar A 3,芬蘭)記錄心率。受試者休息1周后,進行1次60% ˙VO2max強度的運動(劃船測功儀),時間為20min,運動結(jié)束后即刻肘靜脈采血5 mL;休息2天后,進行1次75% ˙VO2max強度的運動,再休息2天,進行1次90%˙VO2max強度的運動,其運動方式、運動時間以及取血量與第1次相同。
1.3 紅細胞的制備
所有血液樣品均加入38 g/L枸櫞酸鈉(體積比1∶9)抗凝,1 400 g離心10 min,去上清。加入4倍體積 Hank’s平衡鹽溶液(M HBSS)中反復離心3遍,清洗后取紅細胞懸浮于等體積 Hank’s平衡鹽溶液中待測。
1.4 紅細胞eNOS活性及血漿NO-2/NO-3含量測定
依照試劑盒(南京建成生物公司)說明,紫外分光光度計測量紅細胞 eNOS活性,自動生化分析儀測定血漿NO-2/NO-3含量。
1.5 紅細胞eNOS蛋白總量及eNOS磷酸化水平測定
制備紅細胞組織勻漿,考馬斯亮藍法測定蛋白含量。蛋白樣品經(jīng)15%SDS-PAGE分離轉(zhuǎn)移于PVDF膜。一抗(Santacruz公司)孵育過夜,HRP標記二抗(TBD公司)孵育1 h,ECL顯影。采用凝膠系統(tǒng)分析軟件(上海天能科技公司),掃描各條帶灰度值,以安靜狀態(tài)為100%,其他3組與安靜時比值,即其相對表達量(%)。Actin作為內(nèi)參蛋白。
1.6 統(tǒng)計方法
所有數(shù)據(jù)均用SPSS 15.0統(tǒng)計軟件包進行處理,結(jié)果用平均數(shù)±標準差表示,各組比較采用單因素方差分析,P <0.05為顯著性水平,P<0.01為非常顯著水平。
2 研究結(jié)果
2.1 不同運動強度對血漿NO-2/NO-3含量的影響
圖1顯示,與安靜狀態(tài)比較,運動強度為60%和75% ˙VO2max時,血漿 NO-2/NO-3含量顯著升高(均為 P< 0.05),運動強度為90%˙VO2max時,血漿NO-2/NO-3含量顯著降低(P<0.05)。
2.2 不同負荷運動對紅細胞eNOS活性的影響
圖2顯示,與安靜狀態(tài)比較,運動強度為60%和75% ˙VO2max時,紅細胞eNOS活性顯著升高(分別為 P<0.05和 P<0.01)。運動強度為90%˙VO2max時,紅細胞eNOS活性顯著降低(P<0.01)。
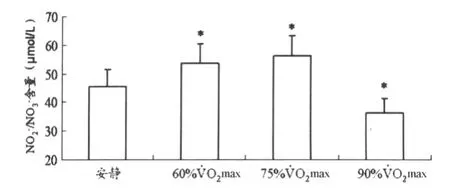
圖1 不同運動強度對血漿NO2-/NO3-含量的影響示意圖
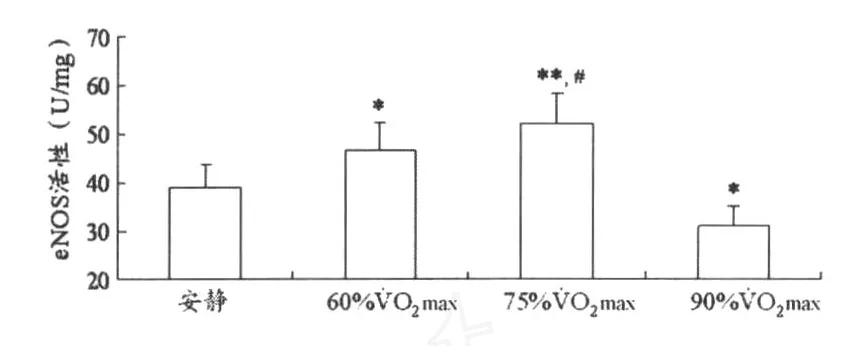
圖2 不同運動強度對紅細胞eNOS活性的影響示意圖
2.3 不同運動強度對紅細胞eNOS蛋白總量及eNOS磷酸化水平
圖3顯示,與安靜狀態(tài)比較,運動強度為60%和75% ˙VO2max時,紅細胞eNOS蛋白總量和 Thr495磷酸化eNOS蛋白量無明顯變化,Ser1177磷酸化eNOS蛋白量顯著升高(分別為 P<0.05和 P<0.01)。運動強度為90% ˙VO2max時,紅細胞eNOS蛋白總量和Ser1177磷酸化eNOS蛋白量顯著降低(均為 P<0.05),Thr495磷酸化eNOS蛋白量無明顯變化。
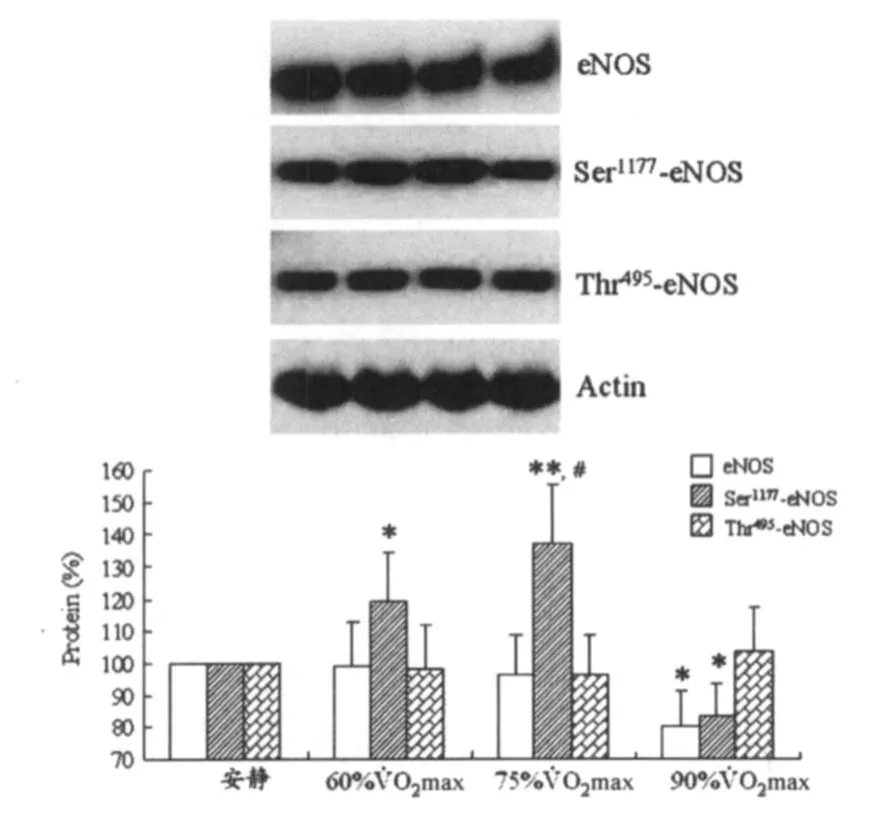
圖3 不同運動強度對紅細胞eNOS蛋白總量及eNOS磷酸化水平的影響示意圖
3 討論
NO作為重要的信號分子,與運動關(guān)系十分密切。研究表明,運動過程中,血液中一定水平的NO可通過環(huán)鳥苷酸通路提高心肌和骨骼肌收縮力;可增加運動中組織氧攝入量和氧消耗量;可通過舒張血管調(diào)節(jié)運動中機體各器官血液重新分布;也可通過刺激 GLU-4轉(zhuǎn)位促進組織葡萄糖轉(zhuǎn)運等[10]。此外,NO還可通過調(diào)控紅細胞變形性影響運動中紅細胞的功能[8]。Sun等報道,大鼠運動前服用一定劑量L-A rg,可改善機體的運動能力,明顯延長遞增負荷運動的力竭時間,推遲疲勞發(fā)生[14]。而注射了NOS抑制劑N-硝基左旋精氨酸(L-NAM E)的人骨骼肌最大收縮速度及輸出功率明顯降低[6]。這表明,運動中維持一定水平的NO可正性調(diào)控機體運動能力。目前的研究主要關(guān)注于運動刺激血管內(nèi)皮細胞以及骨骼肌產(chǎn)生NO的影響,最近發(fā)現(xiàn),紅細胞亦是心血管系統(tǒng)中NO的主要來源,這與定位于紅細胞漿膜的eNOS密切相關(guān)[7]。研究表明,不同運動強度對紅細胞膜流動性及脂質(zhì)組成的作用效應(yīng)不同[16]。因而,不同運動強度對紅細胞eNOS功能及NO產(chǎn)生也會產(chǎn)生差異性作用,從而影響心血管系統(tǒng)中NO的穩(wěn)態(tài)及生物效應(yīng)。
本研究中,在運動強度為60%和75%˙VO2max時,紅細胞eNOS活性顯著升高,且隨著運動強度的增加而增加,而eNOS總蛋白表達量無明顯變化。當運動強度增加為90%˙VO2max時,紅細胞eNOS蛋白表達量及活性均明顯降低,甚至低于運動前安靜狀態(tài)時的水平。血漿NO含量的變化趨勢與紅細胞eNOS基本一致,提示運動過程中,紅細胞產(chǎn)生的NO是血漿NO總量的重要組成部分。Rassaf等發(fā)現(xiàn),前臂分別進行20%、30%和40%的最大握力強度運動,前臂靜脈血漿中NO和血流量與運動強度呈正向的線性關(guān)系;而當強度增加至50%和60%時,上述指標與運動強度呈負相關(guān)線性關(guān)系[12]。Copp等報道,短期急性跑臺訓練可使大鼠后肢血管內(nèi)皮細胞eNOS活性及血漿NO含量急劇增加,而力竭運動使上述指標顯著降低,運動后恢復24 h仍然低于安靜對照組[2]。我們認為,低強度和中等強度負荷運動可刺激紅細胞等組織中eNOS表達量及活性升高,舒張血管,增加血流量,以代償運動造成的組織血液供應(yīng)相對不足;而當運動強度進一步增加時,eNOS-NO生物效應(yīng)反而受到抑制,這可能與運動疲勞的形成相關(guān)。
運動可使血流加速,產(chǎn)生搏動性血流并增加血管內(nèi)血流切應(yīng)力,且血流切應(yīng)力隨著運動強度的增加而增加。研究證實,血流切應(yīng)力是運動促血管內(nèi)皮細胞釋放NO的主要生理刺激。Fischer等在體外循環(huán)中發(fā)現(xiàn),高血流切應(yīng)力亦可顯著激活紅細胞中eNOS[3]。最近,Suhr等的研究表明,短暫的高血流切應(yīng)力可增加紅細胞eNOS的活性,而高頻反復的高血流切應(yīng)力反而會抑制 eNOS的活化[13]。Temiz等發(fā)現(xiàn),在低水平血流切應(yīng)力下,紅細胞膜呈彈性固態(tài),而在高水平切應(yīng)力下,紅細胞膜呈液態(tài)[15]。因而,不同運動強度可能通過影響改變血流切應(yīng)力影響紅細胞膜狀態(tài),從而動態(tài)調(diào)控位于紅細胞漿膜eNOS的穩(wěn)定性及活性。此外,Petibois等發(fā)現(xiàn),大強度運動可加速紅細胞膜蛋白質(zhì)的脫失與降解[11],這可能與90%˙VO2max強度運動造成的eNOS表達量快速減少有關(guān)。
除了蛋白表達量的變化,特定氨基酸的磷酸化也決定了eNOS的活性。eNOS主要有 3個磷酸化位點:Ser116、Thr495和 Ser1177,其中,Ser1177磷酸化使eNOS活性增強,而Ser116和 Thr495磷酸化則使eNOS活性減弱。本研究中,我們發(fā)現(xiàn),60%和 75%˙VO2max的運動強度可使 eNOS (Ser1177)磷酸化水平增加,且隨著運動強度增加而增加。而在運動強度為90%˙VO2max時,eNOS(Ser1177)磷酸化水平降低,eNOS(Thr495)磷酸化水平在各種運動強度中均維持于運動前安靜狀態(tài)水平。研究表明,血管中的血流切應(yīng)力可以激活紅細胞中磷脂酰肌醇-3激酶(PI3K)-絲氨酸/蘇氨酸蛋白激酶(Akt)信號通路,從而上調(diào)紅細胞eNOS Ser1177磷酸化水平和NO產(chǎn)量[5]。因而我們推測,低強度和中等強度運動可能通過PI3 K-Akt通路上調(diào)eNOS Ser1177磷酸化水平,從而增加其活性和NO產(chǎn)量。而大強度運動導致的eNOS Ser1177磷酸化水平降低可能與紅細胞eNOS蛋白總量減少有關(guān),或有其他的抑制機制發(fā)生,其具體調(diào)控機制有待進一步研究。
4 結(jié)論
1.當運動強度適量時,紅細胞eNOS蛋白表達、活化磷酸化水平以及NO產(chǎn)生隨著運動強度增加而增加,可能是機體對運動應(yīng)激的一種適應(yīng)機制。
2.當運動強度過大時,紅細胞eNOS蛋白表達、活化磷酸化水平以及NO產(chǎn)生受到抑制,可能與運動疲勞的發(fā)生相關(guān)。
[1]夏志,徐飛,劉艷,舒宗禮.一氧化氮與運動[J].中國臨床康復, 2006,10(10):152-154.
[2]COPP SW,D M H IRA I,K S HAGEMAN,et al.Nitric oxide synthase inhibition during treadmill exercise reveals fiber-type specific vascular control in the rat hindlimb[J].Am J Physiol Regul Integr Comp Physiol,2010,298:R478-485.
[3]FISCHER U M,R SCH INDLER,K BRIXIUS,et al.Extracorporeal circulation activates endothelial nitric oxide synthase in erythrocytes[J].Ann Tho rac Surg,2007,84:2000-2003.
[4]HEUSCH G,K BOENGLER,R SCHULZ.Cardiop rotection:nitric oxide,p rotein kinases,and mitochondria[J].Circulation, 2008,118:1915-1919.
[5]INOUE T,Y SUZUKI,T YOSH IMARU,et al.Nitric oxide p rotectsmast cells from activation-induced cell death:the role of the phosphatidylinositol-3 kinase-A kt-endothelial nitric oxide synthase pathway[J].J Leukoc Biol,2008,83:1218-1229.
[6]JONES A M,D PW ILKERSON,I T CAMPBELL.Nitric oxide synthase inhibition with L-NAM E reducesmaximal oxygen uptake but not gasexchange threshold during incremental cycle exercise in man[J].J Physiol,2004.560:329-338.
[7]KLEINBONGARD P,R SCHULZ,T RASSAF,et al.Red blood cells exp ress a functional endothelial nitric oxide synthase[J]. Blood,2006,107:2943-2951.
[8]M.BOR-KUCU KA TA Y,R B WENBY,H J MEISELMAN,O. K.B.Effects of nitric oxide on red blood cell defo rmability[J]. Am J Physiol Heart Circ.Physiol,2003,284:H1577-H1584.
[9]M ERRY T L,G KMCCONELL.Skeletalmuscle glucose up take during exercise:a focus on reactive oxygen species and nitric oxide signaling[J].IUBMB Life,2009,61:479-484.
[10]M ERRY T L,G K MCCONELL.Skeletal muscle glucose uptake during exercise:a focuson reactive oxygen species and nitric oxide signaling[J].IUBMB Life,2009,61:479-484.
[11]PETIBOIS C,G DELERIS.Evidence that erythrocytes are highly susceptible to exercise oxidative stress:FT-IR spectrometric studies at the molecular level[J].Cell Biol Int,2005, 29:709-716.
[12]RASSAF T,T LAUER,C HEISS,et al.Nitric oxide synthasederived plasma nitrite p redicts exercise capacity[J].Br J Sports Med,2007,41:669-73.
[13]SUHR F,S PORTEN,T HERTRICH,et al.Intensive exercise induces changes of endothelial nitric oxide synthase pattern in human erythrocytes[J].Nitric Oxide,2009,20:95-103.
[14]SUN M W,M F ZHONG,J GU,et al.Effectsof different levels of exercise volume on endothelium-dependent vasodilation: roles of nitric oxide synthase and heme oxygenase[J].Hypertens Res,2008,31:805-816.
[15]TEM IZA A,M A KH ISAROGLU,Z SERCAN,et al.Adhesion of erythrocytes to endothelial cells after acute exercise:differences in red blood cells from juvenile and adult rats[J].Physiol Res,2006,55:381-388.
[16]TSUDA K,A YOSH IKAWA,K KIMURA,et al.Effects of mild aerobic physical exercise on membrane fluidity of erythrocytes in essential hypertension[J].Clin Exp Pharmacol Physiol,2003,30:382-386.
[17]ZHAO X,Y R CHEN,G HE,et al.Endothelial nitric oxide synthase(NOS3)knockout decreases NOS2 induction,limiting hyperoxygenation and conferring p rotection in the postischemic heart[J].Am J Physiol Heart Circ Physiol,2007,292:H1541-1550.

