山羊角膜緣干細胞熒光蛋白 (Venus) 細胞株的建立及角膜上皮植片構建
殷吉慶,劉文強,劉超,趙貴民,張翊華,劉維帥,華進聯,竇忠英,雷安民
1 西北農林科技大學動物醫學院 陜西省干細胞工程技術研究中心,楊凌 712100
2 楊凌示范區醫院病理科,楊凌 712100
角膜緣干細胞 (LSCs) 是角膜上皮再生和修復的源泉,在眼表重建中起著極為重要的作用[1-3]。1986年,Schermer等[4]首次通過實驗證明角膜緣干細胞位于角膜緣基底層“Vogt”柵欄區的乳頭狀結構中。角膜緣干細胞具有成體干細胞的生物學特性,即慢周期性和高增殖潛能[1,5],此外,LSCs是角膜上皮組織中體積最小的細胞,這一特征有助于角膜緣干細胞的分離與純化[6-7]。
角膜上皮增生過程為:角膜緣干細胞 (Limbal Stem Cells,角膜緣基底部最基層)→短暫擴充細胞(Transcient amplifying cell,角膜緣基底部)→有絲分裂后細胞 (Post mitotic cell,角膜上皮大多數非表面區域)→終末分化細胞 (Terminally differentiated cell,角膜淺表上皮細胞)。現認為,角膜上皮的更新是通過垂直向上運動和水平向心運動共同作用實現的,而其再生的最終源泉則是LSCs[8]。
角膜緣干細胞缺陷癥 (LSCD) 主要是由先天性疾病引起,后天疾病包括熱損傷或化學損傷,Stevens Johnson 綜合癥等[9-11]。由于角膜緣干細胞的缺失,角膜周邊的結膜細胞和血管會向角膜內長入,角膜混濁,致使患者視力下降,嚴重時會導致角膜盲[12]。
Kenyon等[13]首先將角膜緣干細胞移植應用于臨床。近年來,隨著人們對角膜緣干細胞研究的不斷深入,角膜緣干細胞的移植在臨床上的應用逐漸得到推廣。1997年,Pellegrini等[14]首次提出角膜緣干細胞體外擴增移植技術,緩解了治療嚴重角膜病供體角膜缺乏、免疫排斥、自體移植損傷健眼等問題[15]。
據統計,通過角膜緣干細胞體外移植方法治愈角膜緣干細胞缺陷癥成功率可達75%[16]。盡管角膜緣干細胞移植術日見成熟,但術后角膜緣干細胞修復受損機體的作用情況并不明確。彌勝利等[17]通過檢測供體細胞 sry基因研究角膜緣干細胞是否長期存在于雌性受體眼表。在人工角膜移植后的2個月,一只受體母羊角膜組織中可檢測到sry基因存在;12個月后,盡管病理模型的損傷角膜已經得到修復,但檢測不到sry基因存在。這就給我們留下了疑問,即移植到病理模型上的供體角膜緣干細胞究竟是如何對損傷角膜進行修復的?是否存在角膜外周細胞經轉分化參與修復,或是外周血中的干細胞通過體內循環參與了角膜的修復。本研究篩選 Venus熒光蛋白標記的山羊角膜緣干細胞并建立轉基因細胞株,以其為種子細胞構建人工熒光角膜上皮植片,為后期動態監測供體角膜緣干細胞移行變化提供實驗基礎。
1 材料
1.1 實驗材料
2~12月齡關中奶山羊眼球由楊凌某屠宰場提供。羊膜由楊凌某醫院提供。
1.2 質粒
pVenus質粒 (帶黃色熒光蛋白) 由英國紐卡斯爾大學分子與細胞研究所惠贈。
1.3 主要試劑
DMEM/F12,Trizol,Opti-DMEM,新霉素(G418),脂質體LipofectamineTM2000均購自Invitrogen公司;表皮生長因子 (EGF) 購自 peprotech公司;氫化可的松、三甲碘原氨酸、腺氨酸、四型膠原(Collagen IV)、Dispase II酶、胰島素、胰蛋白酶、二甲基亞砜 (DMSO)、Integrinβ1單克隆抗體均購自Sigma公司;P63單克隆抗體購自Millipore公司;免疫熒光二抗 cy3購自碧云天生物技術公司;胎牛血清 (FBS)、兩性霉素B、EDTA購自Hyclone公司;谷氨酰胺購自 Merck公司;噻唑藍 (MTT) 購自Amersco公司;PrimeScriptTMRT reagent試劑盒購自TaKaRa公司;Golden Easy PCR system、DNA marker購自 Tiangen公司;培養皿、培養板均購自Corning公司。
2 方法
2.1 山羊角膜緣干細胞原代分離與培養
2.1.1 角膜緣組織的取材
在無菌條件下摘除山羊眼球,用含青霉素(100 IU/mL)、鏈霉素 (100 IU/mL)、兩性霉素 B (2.5 μg/mL) 的無鈣鎂的PBS反復沖洗血污,環形剪取角膜緣外1 mm、角膜緣和角膜緣內2 mm的角膜上皮組織,再將組織剪成若干個1 cm左右組織條,浸洗數次,每次15 min。
2.1.2 角膜緣上皮干細胞富集培養
將角膜緣組織條置于 1.2 IU DispaseII酶中,37℃消化90 min,而后在體視顯微鏡下,將其上皮層與基底層鈍性剝離,并收集角膜緣上皮層,剪碎。用含0.125%胰蛋白酶及0.02% EDTA消化液37℃消化角膜緣上皮5~7 min,以含10%新生牛血清培養液終止消化,吹打、分散細胞。收集的細胞使用Collagen IV 20 min快速粘附法富集角膜緣干細胞[18]。簡言之,以5×104個/mL細胞接種于100 μg/mL Collagen IV包被過的培養皿,培養20 min后將培養液移出,加入角膜緣干細胞條件培養液,37℃、5% CO2培養箱中培養,隔日換液。待到細胞生長融合至 70%~80%滿皿時傳代培養,每次傳代使用Collogen IV 20 min粘附富集角膜緣干細胞,在倒置顯微鏡下觀察其生長特性。
2.2 角膜緣干細胞的熒光標記
2.2.1 G418最優濃度篩選試驗
將第3代純化的角膜緣干細胞以1×105個/孔接種在24孔板中,加入含100~800 μg/mL不同濃度的G418的培養液,以100 μg/mL遞增,培養10~14 d,每天顯微鏡觀察細胞死亡情況,確定殺死全部角膜干細胞的G418最低濃度為最優濃度。
2.2.2 pVenus質粒轉染角膜緣干細胞
將原代角膜緣干細胞20 min Collagen IV快速富集培養,待細胞融合至70%~80%,按LipofectamineTM2000說明書步驟進行轉染。轉染細胞培養24 h后,以1×104個/mL細胞接種于60 mm培養皿中,待細胞貼壁后換為含 500 μg/mL G418的培養液培養 1個月以殺死未轉染細胞。在熒光顯微鏡下挑取帶有綠色熒光的陽性細胞克隆,并擴增培養。
2.3 熒光角膜緣干細胞株的相關檢測
2.3.1 熒光角膜緣干細胞生長狀態觀察
Leica熒光倒置顯微鏡下觀察G418篩選細胞的形態及熒光表達情況。
2.3.2 免疫熒光染色檢測
將熒光標記角膜緣干細胞懸液以 5×103個/mL細胞接種于48孔培養板培養5 d后,對G418篩選后的角膜緣上皮干細胞的陽性標記物P63和Integrin β1進行免疫熒光檢測。培養細胞先用 PBS漂洗5 min,重復3次,用4%多聚甲醛固定5~10 min,PBS漂洗3次,每次5 min。加入0.2% Trixon-100室溫作用10 min,PBS漂洗3次,每次5 min (僅核內表達 P63進行該步驟)。加入封閉液室溫作用30 min后,滴加一抗,4℃過夜。PBS漂洗5 min,重復3次。滴加紅色熒光二抗體cyc3稀釋液,37℃孵育1 h。PBS漂洗5 min,重復3次。使用熒光染料Hoechst 33342染細胞核,熒光倒置顯微鏡下觀察細胞狀態及熒光表達情況,照相。以PBS代替單克隆一抗為陰性對照組。
2.3.3 半定量RT-PCR檢測
分別提取生長狀態良好的第6代轉染及未轉染角膜緣干細胞總RNA,并于260 nm波長測定其濃度。按PrimeScriptTMRT reagent試劑盒說明書分別取0.5 μg總RNA合成cDNA。為了確保兩種不同細胞的基因表達量處于指數期,先以倍比量的cDNA為模板,分別對β-actin、p63、pcna、venus基因進行PCR,分析PCR產物表達量關系,篩選相對基因引物的最佳循環數。簡言之,將4 μg/μL cDNA,倍比逐步稀釋為2 μg/μL、1 μg/μL、0.5 μg/μL四種濃度,分別取0.2 μL相對應濃度的cDNA為模板,以38個循環次數為起點逐步降低2個循環數,直至基因的 4種表達量也是倍比關系,循環數最多的即最佳循環數。然后以β-actin為內參,按照其相應退火溫度及最佳循環數 (表1) 進行PCR,然后取5 μL樣品在 2%瓊脂糖凝膠上電泳檢測,紫外照相系統照相,并分析目的條帶的表達量。
2.3.4 生長曲線制作及群體倍增時間測定
將生長狀態良好的第 3代轉染的角膜緣干細胞,以100個/孔細胞接種于96孔板中,每代細胞接70個孔。從細胞培養第2天起,每24 h檢測5孔細胞,每個待測孔加5 mg/mL MTT液20 μL,繼續培養4 h,待藍紫色復合物形成后,吸棄培養液加150 μL DMSO振蕩10 min,藍色顆粒充分溶解后,于酶聯免疫檢測儀上測定490 nm、650 nm處每孔OD值,每天以未接種細胞孔為空白組。計算均值,共計8個時間點。以培養時間為橫軸,每日OD值的平均值為縱軸,繪制生長曲線,以同代未轉染細胞為對照。分別在潛伏期后和進入平臺期前的一段角膜緣干細胞生長曲線隨機取 1個點,并分別標記對應橫軸,縱軸上的時間點 (T0) 和OD值,然后在縱軸選定該OD值得2倍數值,并在曲線上選定對應該值的點及相應時間點 (Tt)。細胞群體倍增時間(h) = Tt?T0,共設4個重復。
2.4 熒光角膜上皮植片的構建
2.4.1 羊膜支架的制備
常規制備和保存羊膜[19]。37℃解凍羊膜30 min,PBS反復沖洗。加入0.1% EDTA 37℃消化40 min后,用細胞刮刀刮去羊膜上皮細胞,PBS清洗數次。將處理后羊膜基底面向上平鋪于培養皿內,準備好的硝酸纖維素膜附于其上,然后翻轉,放入一新皿內,細胞培養箱中孵育30~60 min,待用。
2.4.2 羊膜角膜上皮植片的構建
將GLSC-V以1×106個細胞/mL的濃度,用微量吸管小心滴加到羊膜上皮基底膜上,37℃恒溫操作臺上靜置20 min后,加入少量角膜緣干細胞條件培養液,移入培養箱過夜。第 2天待細胞粘附于羊膜上開始增殖時,再補加適量培養液培養。隔日換液,培養至5~7 d,再降低培養液面[20],氣液交界面繼續培養10~15 d,細胞呈復層生長,表面有細胞開始脫落時,停止培養。
2.5 熒光角膜上皮植片的相關檢測
2.5.1 生物學觀察
Leica倒置熒光顯微鏡下觀察細胞的生長狀態及熒光表達情況。
2.5.2 組織結構的觀察
將分層角膜上皮植片固定于 4%的多聚甲醛溶液中。石蠟包埋、連續切片、HE染色、封片后在光學顯微鏡進行組織結構的觀察并照相。取正常角膜上皮作為對照。

表1 角膜緣干細胞標記基因的相關信息Table 1 The information of corresponding genes of LSCs
2.5.3 免疫化學檢測
常規方法制作熒光角膜緣上皮組織的冰凍切片,以抗角膜緣干細胞P63的單克隆抗體對培養獲得的復合上皮組織進行免疫熒光染色,以不加一抗作為陰性對照。
3 結果
3.1 山羊角膜緣干細胞生長特性觀察
經Collagen IV 20 min粘附原代山羊角膜緣干細胞貼壁后以圓形居多,48 h后細胞數量明顯增多,大約1周后形成大量的片狀克隆 (圖1A),克隆團中的細胞以鋪路石樣的多角形細胞為主,細胞間界限分明,細胞核仁明顯且大,常為2~3個 (圖1B)。細胞融合連生形成致密細胞單層,如果不傳代連續培養,細胞可以聚集生長,形成類似于胚胎干細胞的細胞集落。
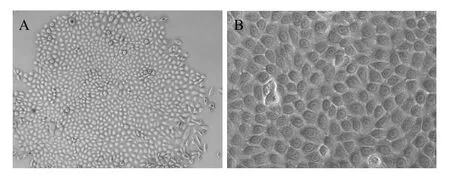
圖1 山羊角膜緣干細胞形態觀察Fig. 1 The morphology of GLSCs. (A) The GLSCs formed holoclone (50×). (B) The GLSCs developed the typical polygon shaped phenotype (200×).
3.2 熒光角膜緣干細胞株的篩選
轉染 venus的角膜緣干細胞經 G418最佳濃度(500 μg/mL) 培養液篩選4周。熒光顯微鏡下觀察,培養皿中有若干個帶有綠色熒光的細胞克隆。將陽性克隆株在無菌條件下挑取出來,擴增培養。在光鏡下觀察細胞形態仍以多角形為主。熒光顯微鏡下觀察,熒光蛋白在整個細胞中都表達 (圖2A,2B)。
3.3 熒光角膜緣干細胞株的生物學特性檢測
3.3.1 免疫熒光檢測
GLSC-V在熒光鏡下觀察表達綠色熒光 (圖3A,3B)。免疫熒光檢測GLSC-V細胞P63、Integrinβ1的表達情況。結果顯示,該細胞中 P63、Integrinβ1都呈陽性表達,其中P63主要在核內表達 (圖3C),Integrin β1在胞質內表達 (圖3D)。Hoechst 33342 染色細胞核呈藍色熒光 (圖3E,3F)。
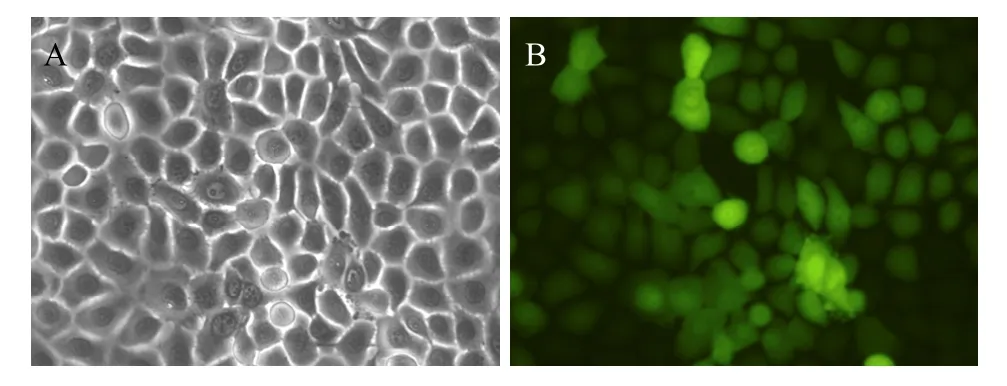
圖2 轉染venus角膜緣干細胞熒光觀察Fig. 2 GLSC-V showed green fluorescence. (A) Light microscope image of GLSC-V (200×). (B) Fluorescent microscope image of GLSC-V (200×).
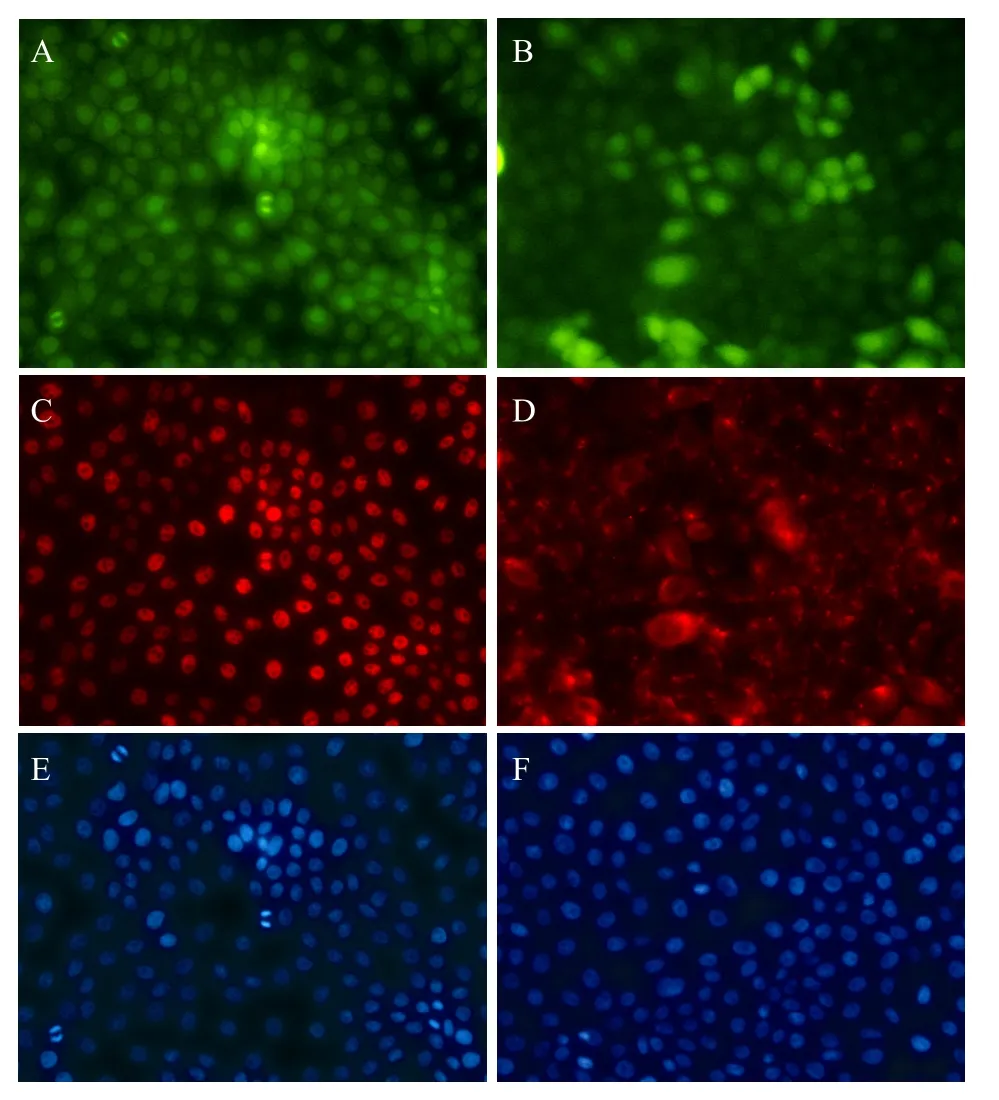
圖3 GLSC-V免疫熒光檢測Fig. 3 Immunofluorescent staining of GLSC-V. (A, B) GLSC-V showed green fluorescence (200×); (C) GLSC-V were identified by immunofluorescence using a cy3-conjugated antibody against P63 protein (Red); (D) GLSC-V were identified by immunofluorescence using a cy3-conjugated antibody against Integrinβ1 protein (Red); (E, F) GLSC-V were mounted with Hoechst 33342 to mark the nuclei of all cells (Blue).
3.3.2 相關基因半定量RT-PCR檢測
對第 6代 GLSC-V與 GLSCs進行半定量RT-PCR檢測。從電泳結果看 (圖4),兩種細胞的內參β-actin表達量一致。GLSC-V中p63及pcna表達較GLSCs略有上調,兩種細胞的k3、k12均未見表達,GLSC-V中的venus熒光基因表達,GLSCs細
胞無venus表達。
3.3.3 生長曲線繪制及群體倍增時間
觀察第4代GLSC-V與GLSCs生長曲線 (圖5),前 3天,兩種細胞的細胞增殖差異不明顯;在第 5天時兩種細胞進入對數增長期,第 6天細胞增殖走勢緩慢;第 7天細胞開始衰退。GLSC-V群體倍增時間為 (18±0.5) h,GLSCs為 (19±0.5) h。
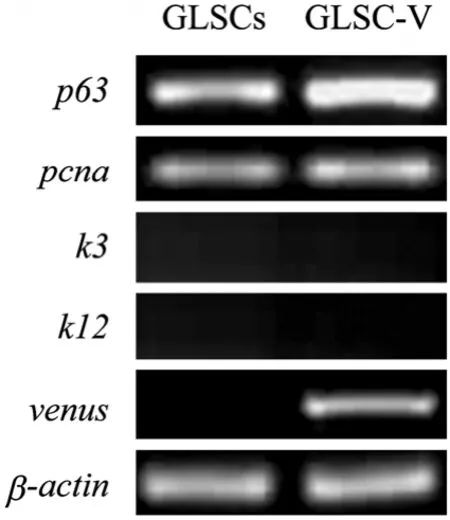
圖4 GLSC-V與GLSCs基因的半定量RT-PCR分析Fig. 4 Semiquantitative RT-PCR analysis of GLSC-V and GLSCs. Representative semiquantitative RT-PCR profles showing mRNA expression of p63 (440 bp), pcna (154 bp), k3 (145 bp), k12 (150 bp), venus (495 bp), β-actin (157 bp) by GLSCs and GLSC-V.
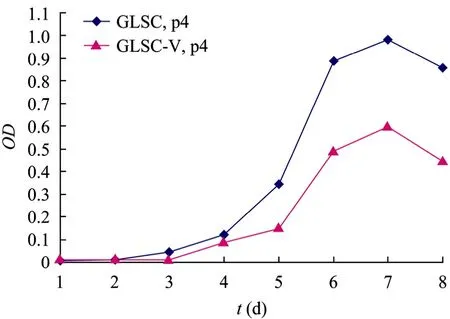
圖5 GLSC-V與GLSCs細胞生長曲線Fig. 5 Growth curves of GLSC-V and GLSCs.
3.4 熒光角膜上皮植片的檢測
3.4.1 生物學特征觀察
GLSC-V細胞接種20 min后就幾乎貼附于去上皮羊膜,細胞多呈圓柱樣,少有不規則多角形。4~5 d后細胞已匯合呈單層,熒光倒置顯微鏡下,幾乎所有細胞表達綠色熒光 (圖 6A,6B),降低培養液平面后細胞逐漸分層。通過光鏡觀察最上層細胞體積變大,呈扁平狀。
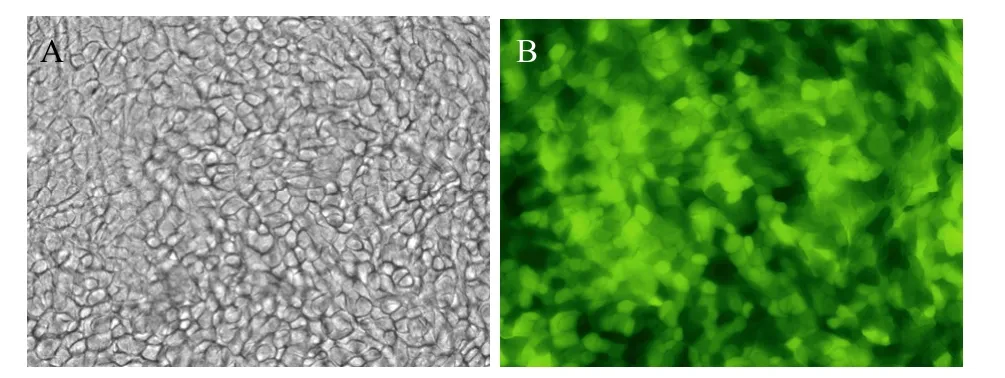
圖6 GLSC-V在羊膜上匯合成片Fig. 6 The GLSC-V were confluent on denued AM. (A) Light microscope image of GLSC-V on denude AM (50×). (B) Fluorescent microscope image of GLSC-V on denude AM (50×).
3.4.2 組織結構觀察
常規組織切片 HE染色顯示熒光角膜上皮復合組織共 5~6層細胞連續貼附于羊膜基底膜上 (圖7A),正常角膜上皮細胞有5~10層左右 (圖7B);兩種上皮組織的上表2~3層細胞體積較大且呈扁平狀(圖7黑色箭頭所指部分);基底部細胞較為密集,而且有一小部分體積小且立方狀的細胞 (圖 7紅色箭頭所指部分)。
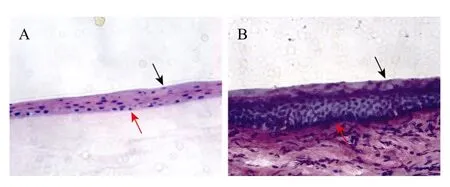
圖7 熒光角膜及正常角膜上皮組織觀察Fig. 7 Histological observation of artificial and normal corneal epithelium using HE staining. (A) Artificial fluorescent corneal epithelium (200×). (B) Normal corneal epithelium (200×). Note a few smaller and cuber shape of cells (red arrow) compared to other epithelial cells, the superficial epithelial cells (black arrow) were flattened and larger size shown in (A, B).
3.4.3 免疫化學檢測
將人工角膜在熒光倒置顯微鏡下觀察,可見綠色熒光標記的細胞層 (圖8A)。P63免疫熒光檢測顯示角膜上皮植片中僅基底部最下一層致密細胞表達P63,其余細胞都不表達P63,這符合角膜緣干細胞位于角膜緣基底層的結構特點 (圖 8B)。通過Hoechst 33342標記角膜上皮細胞核顯示人工角膜上皮共有5~6層構成 (圖8C)。
4 討論
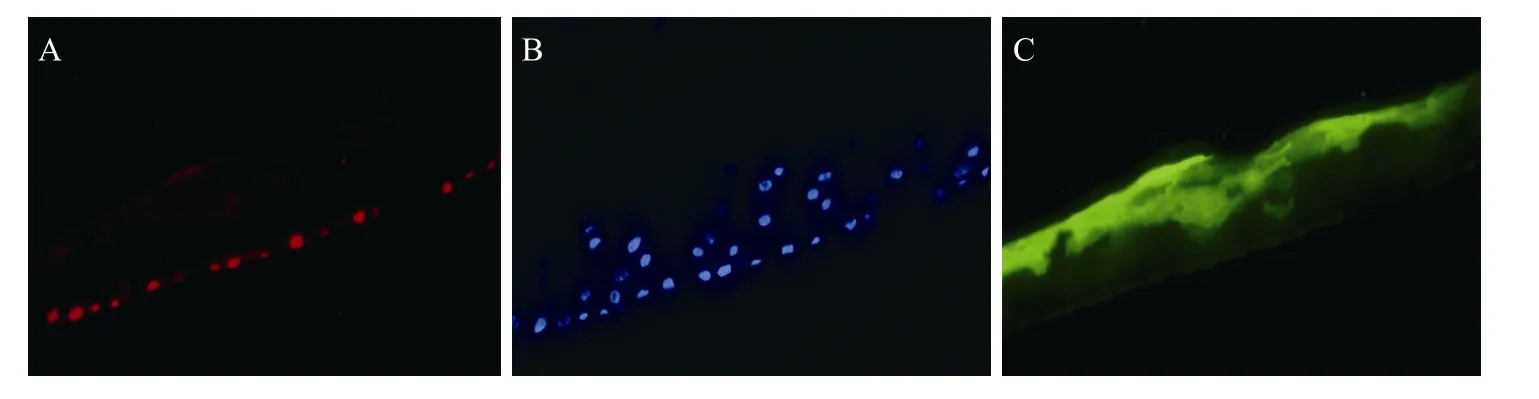
圖8 熒光常角膜上皮免疫熒光檢測Fig. 8 Immunofluorescent staining of fluorescent corneal epithelium. (A) The artificial corneal epithelium showed green fluorescence. (B) The lowest basal cells of fluorescent corneal epithelium expressed P63 (Red). (C) The fluorescent corneal epithelium with pVenus were mounted with Hoechst 33342 to mark the nuclei of all cells (Blue).
隨著角膜緣干細胞研究報道日漸增多,LSC的定位、分離、培養問題已基本得到解決。目前,關于眼表疾病的基礎研究主要致力于LSC微環境調控其增殖、分化的機制及LSC移植受損機體后的細胞移行、黏附、增殖和分化能力的變化[8]。并且 LSC作為組織工程角膜上皮的種子細胞,為臨床眼科疾病用藥物篩選提供細胞模型為眼表面重建及各種眼表疾病的治療開辟廣闊的前景。
許多研究者通過使用釉基質基因探針技術、特異性 DNA 探針技術、熒光原位雜交技術、限制性片段長度多態性分析和X、Y 染色體等方法追蹤供體細胞長期存活情況[21]。Henderson等用 DNA 指紋技術檢測 5位病人在進行異體角膜緣干細胞移植3~5年后供體來源干細胞的存活情況,結果發現在病人眼表檢測不到供體來源干細胞[22]。盡管使用分子手段檢測供體細胞具有簡便靈敏度高等優點,但并不能實現供體角膜細胞的實時觀察及檢測。故本研究選用黃色熒光蛋白 Venus標記角膜緣干細胞,長期追蹤供體細胞存在情況。相比 GFP、Venus產生的熒光更強,靈敏度更高,并且 Venus對 pH和Cl?有較強的耐受性,對細胞毒害作用小,在細胞中表達穩定,其獨特的優勢已成為細胞生物學示蹤劑研究中的重要工具[23]。
目前還沒有公認的標準來確定某種蛋白或某些蛋白可以作為LSCs的標志物。根據對比未分化細胞表達的標志性因子研究看,認為可作為角膜緣干細胞的陽性標記物有:ABCG2、K19、Integrin-α9、Integrin-β1、P63、Vimentin等;角膜緣干細胞陰性標記物有:K3、K12、Cx43、Involucrin、P-cadherin等[24]。經免疫化學檢測,Venus熒光標記的角膜緣干細胞P63、Integrin β1呈陽性表達,說明轉染細胞具有低分化能力。p63是抑癌基因家族成員之一,其對于表皮發育的再生性增殖起關鍵作用,是公認的角膜緣干細胞的核轉錄因子[25-26]。pcna是評價細胞增殖狀態的指標之一。GLSC-V與GLSCs半定量RT-PCR結果發現,GLSC-V中p63表達量是GLSCs的1.5倍,GLSC-V中pcna表達量是GLSCs的1.2倍。兩種細胞中 p63、pcna表達差異,可能是由于挑取選擇得到的綠色熒光陽性克隆來源于原始干細胞,故 GLSC-V的陽性標記物表達量較 GLSCs更高。GLSC-V與GLSCs中k3及k12均無表達,說明GLSC-V并未分化,仍然維持干細胞活性。從第4代GLSC-V與GLSCs生長曲線趨勢圖來看 (圖5),第4代GLSC-V前5天活力較GLSCs差,可能是由于脂質體轉染細胞后,脂質體對細胞有一定的毒害作用,而且每次傳代后G418的篩選作用,也可能會影響細胞活力,隨著轉染細胞逐漸適應,細胞活力趨于穩定;并且GLSC-V與GLSCs的群體倍增時間無差異,說明轉染后細胞經培養篩選穩定后,增殖能力并未下降。
目前角膜緣干細胞移植的手術方式主要包括:自體角膜緣干細胞移植;異體角膜緣干細胞移植;體外培養自體角膜緣干細胞或異體角膜緣干細胞移植。角膜緣干細胞體外培養移植所需的角膜緣組織少,避免對健眼的傷害,并且經體外培養角膜組織相容性抗原-DR (HLA-DR) 陽性朗格罕氏細胞減少,降低了同種異體角膜緣干細胞移植的免疫排斥[27]。體外培養和移植角膜緣上皮細胞首選載體就是人羊膜,羊膜具有低抗原性、促進上皮化、抑制炎癥和新生血管的形成、抑制成纖維化、減少瘢痕形成等優點[28-29],許多研究者通過使用羊膜治療眼表疾病。
本研究先將 Venus標記角膜緣干細胞接種在去上皮羊膜上培養形成細胞單層,再進行氣液界面培養。角膜上皮細胞同皮膚表皮細胞相似,生理環境下暴露于空氣中,使用氣液界面對于上皮細胞的生長、分化起了極為重要的作用。角膜上皮細胞層由5~10層細胞構成,位于無血管的透明結締組織表面。上皮細胞層自前向后可分為表層、中層、深層和基底膜,表層為多邊形鱗狀上皮細胞;中層為翼狀細胞層;深層即基底細胞層為單層的柱狀上皮細胞,角膜緣干細胞就位于上皮細胞基底層底部。對正常和熒光角膜上皮組織進行 HE病理染色發現,兩種上皮組織的上表2~3層細胞體積較大且呈扁平狀,是典型的分化角膜上皮細胞,隨著細胞層數增多,細胞數目增多,而且在基底部一小部分區域還可以觀察到體積小、立方狀的細胞,這種細胞形態與角膜緣干細胞形態一致。此外,經免疫熒光檢測 P63結果發現,熒光人工角膜上皮組織中僅基底部最下一層致密細胞表達 P63,這是符合角膜緣干細胞分布在上皮基底部最基層的特點。
綜上所述,本研究建立的山羊角膜緣干細胞熒光蛋白 (Venus) 細胞株仍具備正常角膜緣干細胞的生理特性,可作為組織工程化種子細胞;并且體外構建的熒光角膜上皮具有與正常角膜上皮相似結構特征,可用于角膜上皮移植實驗,為今后研究角膜緣干細胞移植修復機理提供重要的實驗材料。
REFERENCES
[1] Cotsarelis G, Cheng SZ, Dong G, et al. Existence of slow-cycling limbal epithelial basal cells that can be preferentially stimulated to proliferate: implications on epithelial stem cells. Cell, 1989, 57(2): 201–209.
[2] Pellegrini G, Golisano O, Paterna P, et al. Location and clonal analysis of stem cells and their differentiated progeny in the human ocular surface. J Cell Biol, 1999, 145(4): 769–782.
[3] Chen JJ, Tseng SC. Abnormal corneal epithelial wound healing in partial-thickness removal of limbal epithelium. Invest Ophthalmol Vis Sci, 1991, 32(8): 2219–2233.
[4] Schemer A, Galvin S, Sun TT. Differentiation-related expression of a major 64K corneal keratin in vivo and in culture suggests limbal location of corneal epithelial stem cells. J Cell Biol, 1986, 103(1): 49–62.
[5] Zieske JD. Perpetuation of stem cells in the eye. Eye, 1994, 8(Pt 2): 163–169.
[6] De Paiva CS, Pflugfelder SC, Li DQ. Cell size correlates with phenotype and proliferative capacity in human corneal epithelial cells. Stem Cells, 2006, 24(2): 368–375.
[7] Romano AC, Espana EM, Yoo SH, et al. Different cell sizes in human limbal and central corneal basal epithelia measured by confocal microscopy and flow cytometry. Invest Ophthalmol Vis Sci, 2003, 44(12): 5125–5129.
[8] Liu ZG. Advance in the study of limbal stem cells. Bull Med Res, 2005, 34(3): 2–4.劉祖國. 角膜緣干細胞研究進展. 醫學研究通訊, 2005, 34(3): 2–4.
[9] Holland EJ, Djalilian AR, Schwartz GS. Management of aniridic keratopathy with keratolimbal allograft: a limbal stem cell transplantation technique. Ophthalmology, 2003, 110(1): 125–130.
[10] Gomes JA, Santos MS, Ventura AS, et al. Amniotic membrane with living related corneal limbal/conjunctival allograft for ocular surface reconstruction in Stevens-J ohnson syndrome. Arch Ophthalmol, 2003, 121(10): 1369–1374.
[11] Dua HS, Saini JS, Azuara-Blanco A, et al. Limbal stem cell deficiency: concept, aetiology, clinical presentation, diagnosis and management. Indian J Ophthalmol, 2000, 48(2): 83–92.
[12] Daniels JT, Harris AR, Mason C. Corneal epithelial stem cells in health and disease. Stem Cell Rev, 2007, 2(3): 247–254.
[13] Kenyon KR, Tseng SC. Limbal autograft transplantation for ocular surface disorder. Ophthalmology, 1989, 96(5): 709–723.
[14] Pellegrini G, Traverso CE, Franzi AT, et al. Long-term restoration of damaged corneal surfaces with autologous cultivated human epithelium. Lancet, 1997, 349(9057): 990–993.
[15] Jenkins C, Tuft S, Liu C, et al. Limbal transplantation in the management of chronic contact lens-associated epitheliopathy. Eye, 1993, 7(Pt 5): 629–633.
[16] Shortt AJ, Secker GA, Notara MD. et al. Transplantation of ex-vivo cultured limbal epithelial stem cells: a review of current techniques and clinical results. Surv Ophthalmol, 2007, 52(5): 483–502.
[17] Mi SL, Yang XY, Zhao QM, et al. Reconstruction of corneal epithelium with cryopreserved corneal limbal stem cells in a goat model. Mol Reprod Dev, 2008, 75(11): 1607–1616.
[18] Li DQ, Chen Z, Song XJ, et al. Partial enrichment of a population of human limbal epithelial cells with putative stem cell properties based on collagen type IV adhesiveness. Exp Eye Res, 2005, 80(4): 581–590.
[19] Qu L, Yang XY, Wang X, et al. Reconstruction of corneal epithelium with cryopreserved corneal limbal stem cells in a rabbit model. Vet J, 2009, 179(3): 392–400.
[20] Koizumi N, Cooper LJ, Fullwood NJ, et al. An evaluation of cultivated corneal limbal epithelial cells using cell suspension culture. Invest Ophthalmol Vis Sci, 2002, 43(7): 2114–2121.
[21] Yi JL, Zhong WX. Current situation in the study of limbal stem cells allografts. Jiangxi Med J, 2003, 38(4): 297–302.易敬林, 鐘文賢. 異體角膜緣干細胞研究現狀. 江西醫藥, 2003, 38(4): 297–302.
[22] Henderson TRM, Coster DJ, Williams KA. The long term outcome of limbal allografts: the search for surviving cells. Br J Ophthalmol, 2001, 85(5): 604–609.
[23] Nagai T, Ibata K, Park ES, et al. A variant of yellow fluorescent protein with fast and efficient maturation for cell-biological applications. Nat Biotechnol, 2002, 20(1): 87–90.
[24] Schl?tzer-Schrehardt U, Kruse FE. Identifcation and characterization of limbal stem cells. Exp Eye Res, 2005, 81(3): 247–264.
[25] Koster MI, Kim S, Mills AA, et al. p63 is the molecular switch for initiation of an epithelial stratification program. Genes Dev, 2004, 18(2): 126–131.
[26] Pellegrini G, Dellambra E, Golisano O, et al. p63 identifies keratinocyte stem cells. Proc Natl Acad Sci USA, 2001, 98(6): 3156–3161.
[27] Ardjomand N, Komericki P, Radner H, et al. Corneal Langerhans cells. Behavior during storage in organ culture. Ophthalmology, 1997, 94(10): 703–706.
[28] Grueterich M, Espana E, Tseng SCG. Connexin43 expression and proliferation of human limbal epithelium on intact and denuded amniotic membrane. Invest Ophthalmol Vis Sci, 2002, 43(1): 63–71.
[29] Gomes JA, Romano A, Santos MS, et al. Amniotic membrane use in ophthalmology. Curr Opin Ophthalmol, 2005, 16(4): 233–240.

