Lewis肺癌細胞通過TLR9對CD4+CD25+Treg細胞影響的研究
李 欣 付海英 張佳倫 李 一 (吉林大學白求恩醫學院免疫學教研室,長春 130021)
Lewis肺癌細胞通過TLR9對CD4+CD25+Treg細胞影響的研究
李 欣①付海英 張佳倫 李 一 (吉林大學白求恩醫學院免疫學教研室,長春 130021)
①長春中醫藥大學微生物與免疫學教研室,長春130021
目的:本研究以Lewis肺癌細胞為研究對象,探討腫瘤細胞通過TLRs對CD4+CD25+Treg細胞的影響。方法:我們采用流式細胞術檢測了Lewis肺癌細胞與脾淋巴細胞共培養系統中CD4+CD25+Treg細胞數量變化;通過RT-PCR方法檢測了共培養對Foxp3和TLR1-9mRNA表達的影響;采用TLR9受體阻斷劑氯喹阻斷Lewis肺癌TLR9的表達。結果:與對照組相比,共培養組CD4+CD25+Treg細胞數量及Foxp3mRNA表達均明顯增高(P<0.05);Lewis肺癌細胞與淋巴細胞共培養后可影響多種TLRs表達,其中TLR9mRNA表達與對照組相比明顯增高(P<0.05),阻斷Lewis肺癌細胞TLR9可明顯降低CD4+CD25+Treg細胞數量及Foxp3mRNA表達(P<0.05)。結論:Lewis肺癌細胞可通過TLR9促進CD4+CD25+Treg細胞產生及功能增強,參與誘導腫瘤的免疫耐受,從而促進腫瘤的發生和發展。
CD4+CD25+Treg細胞;Foxp3;TLRs;腫瘤免疫
免疫系統的功能之一免疫監視在清除腫瘤細胞方面發揮著重要作用,但不斷上升的臨床腫瘤發生率使人們對免疫監視功能的存在、效應及影響因素開始重新審視。腫瘤細胞可通過某些機制誘導腫瘤細胞的耐受,逃避免疫監視而在機體內生長、轉移。其中CD4+CD25+Treg細胞在腫瘤免疫中作用尤為引人關注[1,2],是影響體內抗腫瘤效果的主要因素,對其深入研究有助于揭開人體腫瘤免疫之謎。CD4+CD25+Treg細胞可通過細胞接觸依賴機制或抑制性細胞因子依賴機制主動抑制自身反應性T細胞的活化,由CD4+CD25+Treg細胞介導的對自身反應性細胞的調節是自身免疫耐受建立的重要機制之一。由于腫瘤抗原是自身抗原量或質的改變,因此,推測CD4+CD25+Treg細胞在維持自身耐受的同時,也可能在腫瘤耐受中發揮作用。
Toll樣受體(Toll-like receptors,TLRs)是一種重要的模式識別受體,作為天然免疫的重要組成部分及連接獲得性免疫與天然免疫的“橋梁”,主要通過識別病原相關分子模式來啟動免疫應答。目前研究發現抗原提呈細胞(Antigen present cell,APC)上TLR9表達增強,可誘導CD4+CD25+Treg細胞的產生及功能增強。有研究報道腫瘤細胞也可以表達多種TLRs[3],在腫瘤發生發展過程中發揮作用。我們推測表達在腫瘤細胞表面的TLRs是否與APC上TLRs作用相似,可通過影響CD4+CD25+Treg細胞功能,在腫瘤耐受、逃避免疫監視中發揮作用。因此,本研究以Lewis肺癌細胞為研究對象,探討腫瘤細胞通過TLRs對CD4+CD25+Treg細胞的影響,為腫瘤免疫逃逸機制提供依據。
1 材料與方法
1.1 材料
1.1.1 實驗動物 近交系C57BL/6小鼠,體重18~22克,4~6周齡,由吉林大學實驗動物中心提供。
1.1.2 細胞 小鼠Lewis肺癌細胞株,由教研室傳代保存。
1.1.3 試劑 IMDM干粉培養基購自Gibco公司;新生小牛血清購自杭州四季清公司;小鼠PE-anti-CD25+及FITC-anti-CD4+抗體購于BD公司;PE-anti-TLR9抗體購于Imagnix公司;Trizol試劑購自Gibco公司;AMV逆轉錄酶、RNasin與Ex Tag DNA聚合酶均購自TaKaRa公司;氯喹(CQ)購自上海中西制藥有限公司。
1.2 方法
1.2.1 Lewis肺癌細胞與淋巴細胞共培養體系的建立 將5×105個Lewis肺癌細胞與1×106個小鼠脾淋巴細胞共培養于6孔板,共培養48小時后用于檢測,脾淋巴細胞單獨培養作為對照。
1.2.2 共培養后CD4+CD25+Treg細胞含量的測定
取共培養及阻斷TLR9后共培養上清1×106個細胞(100μl體積),加入 PE-anti-CD4+和 FITC-anti-CD25+抗體,用流式細胞儀檢測脾臟CD4+CD25+Treg細胞數量,以CD4+CD25+T細胞占CD4+T細胞百分比反映CD4+CD25+Treg細胞含量。
1.2.3 TLR9受體阻斷劑氯喹(CQ)阻斷后TLR9含量的測定 Lewis肺癌細胞貼壁4小時后加100μg/m lCQ,每孔 1 ml,繼續培養1小時;將上清吸棄,Hanks液洗兩遍,將CQ除去;流式檢測阻斷 1、2、24小時后TLR9含量。
1.2.4 共培養后Foxp3和TLRsmRNA表達的檢測
用Trizol試劑提取共培養后淋巴細胞總RNA,并進行逆轉錄反應。cDNA的逆轉錄采用TaKaRa的AMV RTase,按說明書進行操作。通過預實驗確定PCR反應條件和最適循環數,以保證PCR產物量與起始cDNA量呈線性相關,引物序列見表1。選取βactin為內參照,取5μl PCR產物用1.5%的普通瓊脂糖凝膠電泳后,凝膠電泳成像系統觀測成像情況。
2 結果
2.1 Lewis肺癌細胞與淋巴細胞共培養對CD4+CD25+Treg細胞數量和功能影響 為了探討腫瘤免疫微環境中腫瘤細胞與免疫細胞相互作用對CD4+CD25+Treg細胞數量和功能的影響,我們采用FACS檢測了Lewis肺癌細胞與淋巴細胞共培養后CD4+CD25+Treg細胞數量變化;轉錄因子Foxp3特異性高表達于CD4+CD25+Treg細胞,可作為CD4+CD25+Treg細胞較特異的標志,而且還與CD4+CD25+Treg細胞分化及功能密切相關,因此常作為CD4+CD25+Treg細胞功能指標之一,為進一步研究腫瘤細胞對CD4+CD25+Treg細胞功能影響,我們采用RT-PCR方法檢測了共培養后收集的淋巴細胞的Foxp3 mRNA表達水平。結果顯示:Lewis肺癌細胞與淋巴細胞共培養后,可明顯提高CD4+CD25+Treg細胞數量,共培養組與對照組CD4+CD25+Treg細胞含量分別為10.8±1.45、3.8±1.69,差異具有顯著性P<0.05,見圖1;共培養后Foxp3 mRNA表達水平明顯提高,共培養組與對照組Foxp3 mRNA表達水平分別為0.35±0.10、0.23±0.15,差異具有顯著性P<0.05,見圖2。結果提示腫瘤細胞可能通過某種機制影響CD4+CD25+Treg細胞。

表1 引物序列Tab.1 Primer sequences
2.2 Lewis肺癌細胞與淋巴細胞共培養后TLRs表達變化 已有研究發現腫瘤細胞可表達TLRs,可能參與腫瘤的免疫逃逸,為探討TLRs在腫瘤免疫中的作用,我們采用RT-PCR方法檢測了Lewis肺癌細胞與淋巴細胞共培養,TLRs表達變化。結果顯示Lewis肺癌細胞與淋巴細胞共培養48小時后,TLR4、TLR5有所增高,TLR9增高明顯,TLR7、8不表達,其他TLRs變化不明顯,見圖3。結果表明TLRs在腫瘤細胞與淋巴細胞共培養后表達不同,推測其可能在CD4+CD25+Treg細胞的誘導中發揮作用。
2.3 Lewis肺癌細胞表達的TLR9對CD4+CD25+Treg數量和功能影響
2.3.1 TLR9受體阻斷劑氯喹(CQ)阻斷效果檢測為了研究Lewis肺癌細胞TLR9功能,我們選擇氯喹(CQ)作為其阻斷劑,首先驗證CQ阻斷效果,采用流式細胞術檢測CQ阻斷后TLR9表達變化,結果顯示100μg/ml CQ阻斷后可明顯降低TLR9蛋白表達,并隨時間延長阻斷效果越明顯,見圖4。結果提示100 μg/ml CQ可作為TLR9阻斷劑進行下一步實驗。
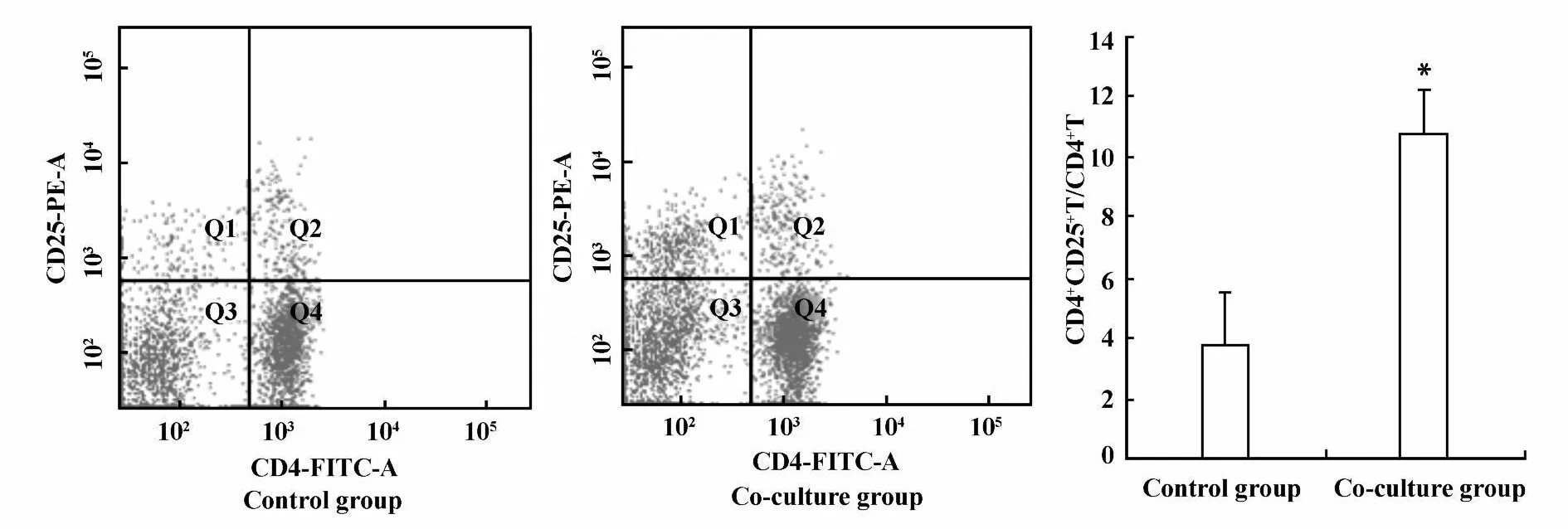
圖1 Lewis肺癌細胞與淋巴細胞共培養后Treg細胞數量變化Fig.1 The changes of CD4+CD25+T cells number after Lewis lung cancer cells co-cu lture with lymphocyte
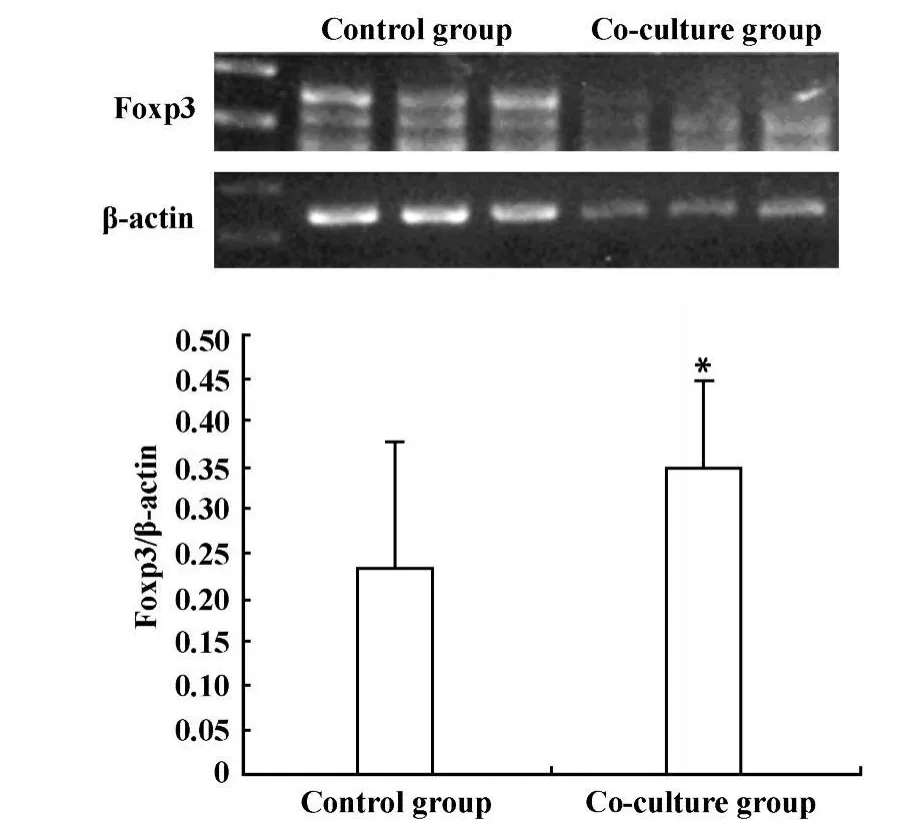
圖2 Lewis肺癌細胞與淋巴細胞共培養后Foxp3m RNA變化Fig.2 The expressionsof Foxp3mRNA after Lewis lung cancer cells co-culture with lymphocyte
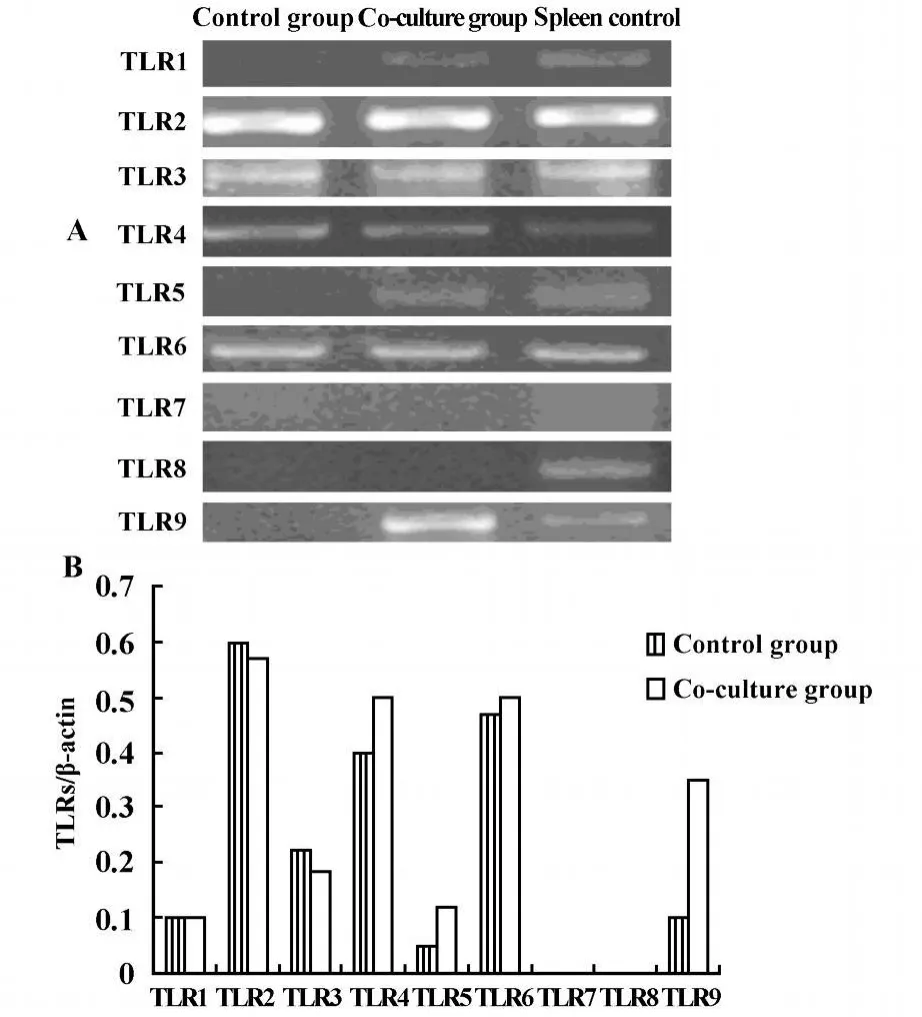
圖3 Lewis肺癌細胞與淋巴細胞共培養后TLRsmRNA變化Fig.3 The expressions of TLRsmRNA after Lewis lung cancer cells co-culture with lymphocyte
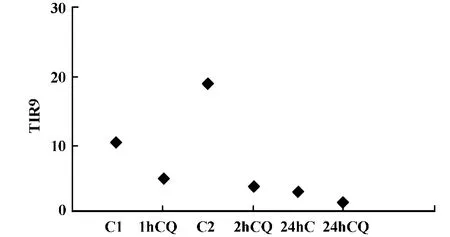
圖4 CQ阻斷后TLR9表達Fig.4 The expressions of TLR9 after CQ blocking
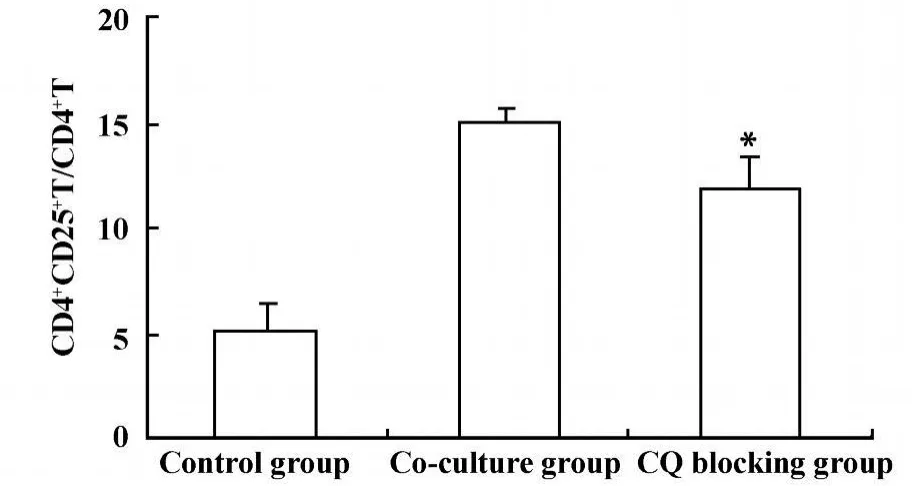
圖5 CQ阻斷后TLR9后 CD4+CD25+Treg細胞數量變化Fig.5 The comparison the CD4+CD25+Treg cells frequency after CQ b locking
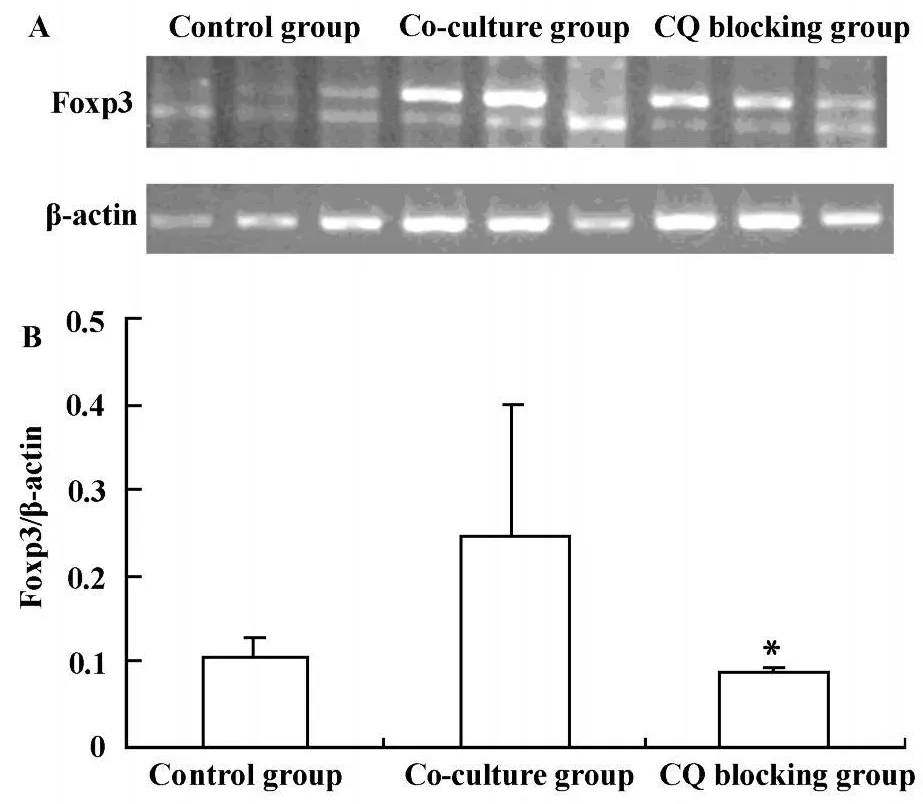
圖6 CQ阻斷后TLR9后Foxp3 mRNA變化Fig.6 The expressions of Foxp3mRNA after CQ blocking
2.3.2 氯喹(CQ)阻斷TLR9后Lewis肺癌細胞對CD4+CD25+Treg數量和功能的影響 為了進一步探討Lewis肺癌細胞TLR9對CD4+CD25+Treg細胞的影響,我們采用 FACS檢測CQ阻斷 TLR9后,CD4+CD25+Treg細胞數量變化,采用RT-PCR方法檢測CQ阻斷TLR9后Foxp3mRNA的變化,間接反映CD4+CD25+Treg細胞功能變化。結果顯示CQ阻斷TLR9后可降低CD4+CD25+Treg細胞數量,共培養組、CQ阻斷組及對照組CD4+CD25+Treg細胞數量分別為 15%±0.78%、12%±1.46%、5.1%±1.41%,差異具有顯著性(P<0.05),見圖5;CQ阻斷TLR9后可明顯降低Foxp3mRNA表達,共培養組、CQ阻斷組及對照組Foxp3 mRNA表達分別為0.247±0.158、0.084±0.008、0.103 ±0.029,差異具有顯著性(P<0.05),見圖6。結果提示腫瘤細胞可能通過TLR9誘導CD4+CD25+Treg細胞,參與維持腫瘤免疫耐受,從而促進腫瘤的發生和發展。
3 討論
自1995年Sakaguchi等人首先提出CD4+CD25+調節性T細胞(Regulatory T cells,Treg)之后,引起了免疫學界越來越多的關注,先后對其進行了廣泛的研究[4]。CD4+CD25+Treg細胞主要在機體免疫系統中發揮負向調節作用,既能抑制不恰當的免疫應答,又能限定免疫應答的范圍、程度及作用時間,對效應細胞的增殖、免疫活性的發揮起抑制作用。由于腫瘤抗原是自身抗原量或質的改變,因此,CD4+CD25+Treg細胞在維持自身耐受的同時,也可能抑制腫瘤免疫應答的發生。有研究報道卵巢癌、肺癌、乳腺癌、胰腺癌、結腸癌等多種腫瘤患者的外周血及腫瘤局部Treg細胞比例增加[5-7],在腫瘤動物模型中亦發現在腫瘤外周及腫瘤局部Treg細胞比例增加,功能增強[8],因此,由腫瘤細胞所引起的CD4+CD25+Treg細胞產生及功能增強可能是腫瘤逃避免疫監視機制之一。
腫瘤局部免疫微環境中,可見大量的免疫細胞聚集,這些聚集在腫瘤局部的免疫細胞一方面在腫瘤清除的免疫監視中發揮重要作用;另一方面,有些免疫細胞如調節性T細胞很可能在腫瘤的免疫逃逸中發揮作用,但其具體機制還不清楚。因此,本文我們以Lewis肺癌細胞與淋巴細胞共培養系統為研究對象,探討了腫瘤細胞對CD4+CD25+Treg細胞的影響及其可能機制。結果顯示,雖然Lewis肺癌細胞與淋巴細胞共培養體系中,脾淋巴細胞可對Lewis肺癌細胞有自然殺傷作用,但本研究發現Lewis肺癌細胞可促進CD4+CD25+Treg數量增加,功能增強,提示腫瘤細胞可能通過某種機制影響CD4+CD25+Treg細胞,參與誘導腫瘤免疫耐受,從而逃避免疫系統的攻擊。
Toll樣受體(Toll-like receptors,TLRs)作為一類重要模式識別受體(Pattern recognition receptor,PRR),主要表達于免疫細胞尤其是巨噬細胞和樹突狀細胞上。其功能主要是識別存在于細菌、真菌、病毒和原蟲等病原微生物中的病原相關分子模式(Pathogen associated molecular patterns,PAMPs),在免疫系統對病原微生物的識別和啟動免疫應答過程中發揮了重要的作用。有研究發現抗原提呈細胞(Antigen presenting cells,APC)上TLR9表達增強,可誘導CD4+CD25+Treg細胞的產生及功能增強[3,9]。因此,TLRs不但參與免疫應答的啟動,還可以通過影響CD4+CD25+Treg細胞參與免疫應答的負調節。
近年來,在人們對免疫系統中的TLRs研究的過程中,還發現了腫瘤細胞也可以表達多種TLRs,在腫瘤發生發展過程中發揮著重要的作用。有研究報道人乳腺癌Cama-1[10]和黑色素瘤Me260[11]表達的TLR3可以促進腫瘤細胞的凋亡,小鼠結腸癌MC26[12]表達的TLR4可以促進腫瘤的耐受,鼠乳腺癌D2F2表達的TLR5在早期促進腫瘤生長,而晚期抑制腫瘤生長。所以,腫瘤細胞的TLRs的表達可能在一定程度上參與了腫瘤的發生發展。因此,我們首先研究了Lewis肺癌細胞與淋巴細胞共培養后TLRs表達變化。研究發現Lewis肺癌細胞與淋巴細胞共培養后TLR9表達升高明顯。腫瘤細胞表達TLR9是否與APC表達TLR9具有相同影響CD4+CD25+Treg細胞的功能呢?為此,我們利用氯喹(CQ)阻斷 Lewis肺癌細胞 TLR9后,觀察 CD4+CD25+Treg細胞的數量和功能。結果顯示阻斷Lewis肺癌細胞TLR9,可降低CD4+CD25+Treg細胞數量和功能,提示腫瘤細胞可能通過TLR9直接或間接誘導CD4+CD25+Treg細胞的產生和功能增強,參與腫瘤免疫耐受的誘導與維持。
綜上,我們研究發現在體外Lewis肺癌細胞可促進CD4+CD25+Treg細胞數量增加,功能增強;Lewis肺癌細胞可表達多種TLRs,并參與促進CD4+CD25+Treg細胞的產生及功能增強,從而在腫瘤免疫耐受中發揮重要作用。本研究初步探討了TLRs在腫瘤發生發展中的作用,為以通過TLRs調控CD4+CD25+Treg細胞為靶點的腫瘤免疫治療提供了新的思路。
1 Nizar S,Copier J,Meyer Betal.T-regulatory cellmodulation:the future of cancer immunotherapy?[J].Br JCancer,2009;100(11):1697-1703.
2 BeyerM,Schultze J L.Regulatory T cells:major players in the tumormicroenvironment[J].Curr Pharm Des,2009;15(16):1879-1892.
3 Moseman E A,Liang X,Daw son A Jetal.Human plasmacytoid dendritic cells activated by CpG oligodeoxynucleotides induce the generation of CD4+CD25+regulatory T cells[J].J Immunol,2004;173(7):4433-4442.
4 Sakaguchi S,Sakaguchi N,Asano Metal.Immunologic self-tolerance maintained by activated T cells expressing IL-2 receptor alpha-chains(CD25):breakdown ofa singlemechanism of self-tolerance causesvarious autoimmune diseases[J].J Immunol,1995;155:1151-1164.
5 Liyanage UK,Moore T T,JooH Getal.Prevalenceof regulatory T cells is increased in peripheral blood and tumor microenvironment of patientswith pancreas orbreast adenocarcinoma[J].J Immunol,2002;169(5):2756-2761.
6 Wolf AM,Wolf D,Steurer Metal.Increase of regulatory T cells in the peripheralblood of cancer patients[J].Clin Cancer Res,2003;9(2):606-612.
7 崔永生,李 欣,于春雷etal.肺癌和乳腺癌患者外周血中CD4+CD25+T細胞及 foxp3mRNA的變化特點及臨床意義[J].吉林大學學報醫學版,2006;32(5):843-846.
8 李 欣,崔永生,王 炎etal.CD4+CD25+調節性T細胞在Lewis肺癌移植鼠中的檢測及臨床意義[J].現代腫瘤醫學,2007;15(4):454-457.
9 Mellor A L,Baban B,Chandler P Retal.Cutting edge:CpG oligonucleotides induce splenic CD19 dendritic cells to acquire potent indoleamine 2,3-dioxygenase-dependent T cell regulatory functions via IFN type 1 signaling[J].J Immunol,2005;175:5601-5605.
10 Bruno S,Isabelle C,Marie-Clotilde Retal.TLR3 can directly trigger apoptosis in human cancer cells[J].J Immunol,2006;176:4894-4901.
11 Bruno S,Serge L,Sampsa Metal.Toll-like receptor 3 expressed by melanoma cellsas a target for therapy[J].Clin Cancer Res,2007;13(15):4565-4574.
12 Lucia S,Anna R,Dario Betal.Antitumor activity of the TLR-5 ligand flagellin in mousemodels of cancer[J].J Immunol,2006;176:6624-6630.
[收稿2009-07-18 修回2009-09-09]
(編輯 張曉舟)
Lew is lung cancer cells affect CD4+CD25+Treg cells via TLR9
LIXin,FUHai-Ying,ZHANGJia-Lun,LIYi.DepartmentofImmunology,BethuneMedicalCollege,JilinUniversity,Changchun130021,China
Objective:To explore the influence of tumor cells on CD4+CD25+Treg cells via TLRs.Methods:The numbers changes of CD4+CD25+Treg cells in the co-culture system of Lewis lung cancer cells and splenic lymphocyteswere detected by flow cytometry;The expression of Foxp3 and TLR1-9mRNA after co-cu lturewere detected by RT-PCR;TLR9 expression on Lewis lung cancer cellswas blocked by TLR9 receptor antagonist chloroquine.Results:Compared with control group,the number of CD4+CD25+Treg cells and Foxp3mRNA expression were significantly increased in the co-culturegroup(P<0.05).The expression of a variety of TLRswere affected by the co-culture of lymphocyteswith Lewis lung cancer cells,and TLR9mRNA expression was significantly increased comparedwith thatof the control group(P<0.05);Blocking TLR9 of Lewis lung cancer cells significantly reduce CD4+CD25+Treg cells and Foxp3 mRNA(P<0.05).Conclusion:Lewis lung cancer cells could increase both number and function of CD4+CD25+Treg cells through inducing TLR9 expression in immunocells.Thismightbe one ofmechanisms of tumor-induced immune tolerance,and by which to contribute to the occurrence and p rogression of tumors.
CD4+CD25+Treg cells;Foxp3;TLRs;Tumor immunity
R392
A
1000-484X(2010)02-0124-05
李 欣(1979年-),女,在讀博士,主要從事腫瘤免疫耐受研究;
及指導教師:李 一(1961年-),女,教授,博士生導師,主要從事自身免疫耐受研究。

