HIV-1 Vif的克隆、表達(dá)與活性檢測(cè)
覃曉琳,劉朝奇,劉徽婷,汪龔澤
HIV-1 Vif的克隆、表達(dá)與活性檢測(cè)
覃曉琳,劉朝奇,劉徽婷,汪龔澤
目的 克隆 H IV-1 Vif基因,構(gòu)建原核表達(dá)質(zhì)粒,進(jìn)行蛋白的表達(dá)及其生物學(xué)活性的檢測(cè)。方法PCR擴(kuò)增Vif基因,并將其克隆到原核表達(dá)載體p ET28a(+)中,構(gòu)建原核表達(dá)質(zhì)粒p ET28a(+)/Vif,進(jìn)行雙酶切及測(cè)序鑒定。獲得的陽(yáng)性質(zhì)粒轉(zhuǎn)化大腸桿菌BL21(DE3)中進(jìn)行表達(dá),對(duì)表達(dá)產(chǎn)物進(jìn)行SDS-PAGE電泳和Western blot檢測(cè)分析,利用親和層析方法純化Vif蛋白。利用Pull-Dow n方法檢測(cè) H IV-1 Vif與SH3(HCK)特異性結(jié)合活性。結(jié)果通過(guò)酶切和測(cè)序,結(jié)果表明重組質(zhì)粒p ET28a(+)/Vif構(gòu)建正確。SDS-PAGE和Western blot結(jié)果鑒定了原核表達(dá)的Vif重組蛋白大小正確。純化了蛋白Vif、SH3和 GST。GST pull-dow n試驗(yàn)說(shuō)明Vif和SH3蛋白具有體外特異性結(jié)合活性。結(jié)論成功地克隆、表達(dá)和純化了Vif蛋白,Vif與SH3蛋白具有結(jié)合活性,為進(jìn)一步研究針對(duì)Vif與SH3結(jié)合的藥物篩選提供實(shí)驗(yàn)依據(jù)。
H IV-1 Vif;SH3(HCK);結(jié)合
H IV-1Vif基因是 H IV病毒編碼的6個(gè)輔助蛋白或調(diào)控蛋白(accesso ry protein)之一,是一個(gè)非常保守的病毒基因,廣泛存在于反轉(zhuǎn)錄病毒科中所有的靈長(zhǎng)類慢病毒及非靈長(zhǎng)類慢病毒中(除馬傳染性貧血病毒)。含有192個(gè)氨基酸,分子量約為23kD,在產(chǎn)生感染性病毒顆粒的過(guò)程中起著至關(guān)重要的作用。因此,人們根據(jù)這個(gè)特點(diǎn)將其命名為病毒感染因子(Viral infectivity facto r,Vif)〔1-4〕。Src 酪氨酸家族成員 Hck和Fyn酪氨酸激酶可抑制 H IV-1的復(fù)制,但當(dāng) H IV-1 Vif與 Hck和 Fyn激酶的 SH3結(jié)構(gòu)域直接作用以后,不僅可以抑制激酶活性,同時(shí)可以促進(jìn)病毒的復(fù)制〔5-7〕。可見(jiàn)Vif與 SH3結(jié)構(gòu)域的結(jié)合在Vif發(fā)揮促進(jìn)病毒感染功能中發(fā)揮了非常重要的作用。
本研究構(gòu)建了 H IV-1Vif的原核表達(dá)載體,并純化了Vif蛋白,體外檢測(cè)了原核表達(dá)的Vif蛋白與SH 3(HCK)蛋白的特異性結(jié)合活性,為進(jìn)一步研究針對(duì)Vif與SH3的靶向治療藥物的篩選奠定實(shí)驗(yàn)基礎(chǔ)。
1 材料與方法
1.1 材料 菌株 E.coli DH5α、E.coli BL21(DE3)、帶6x His標(biāo)簽的質(zhì)粒p ET28a(+)、帶谷胱甘肽S-轉(zhuǎn)移酶(GST)標(biāo)簽的質(zhì)粒p GEX-4T-1和重組質(zhì)粒p GEX-4T-1/SH3由本研究所保存。限制性核酸內(nèi)切酶、Taq DNA聚合酶、T4 DNA連接酶、dN TPs、PCR試劑盒由 Fermentas公司提供,DNA純化試劑盒購(gòu)自O(shè)mega公司。兔源 GST多克隆抗體購(gòu)自 eBioscience公司,鼠源 His單克隆抗體、HRP標(biāo)記的羊抗鼠 IgG、HRP標(biāo)記的羊抗兔 IgG均購(gòu)自北京中杉金橋生物技術(shù)有限公司,其它化學(xué)試劑由 Sigma等公司提供。N TA樹(shù)脂、Glutathione Sepharose 4B、GSTrap FF和蛋白純化儀KTAp rime購(gòu)自 GE Healthcare Bioscience公司;PCR引物合成及DNA測(cè)序均由上海生工公司完成。
1.2 方法
1.2.1 H IV-1 Vif原核表達(dá)載體的構(gòu)建 以 H IV-1HBX2為模板,PCR擴(kuò)增Vif基因序列。Vif引物(5′端分別引入限制性內(nèi)切酶 Bam H I和 Eco RI酶切位點(diǎn)),上游引物 5′-GCGGA TCC A TGGAAAACAGA TGGCA G-3′(Bam H I), 下 游 引 物 5′-GCAGAATTC CTAGTGTCCATTCATTGTGTG-3′
(Eco RI)。PCR反應(yīng)體系體積為50μL,以2μL的第1鏈cDNA為模板,PCR擴(kuò)增條件為:94℃預(yù)變性2 m in后,94℃變性30 s,55℃退火30 s,72℃延伸45 s,30個(gè)循環(huán)后,再于72℃延伸10 min結(jié)束擴(kuò)增,PCR產(chǎn)物用純化試劑盒進(jìn)行純化。用Bam H I和 Eco RI雙酶切質(zhì)粒p ET28a(+)和純化后的PCR產(chǎn)物,將 PCR產(chǎn)物與質(zhì)粒載體p ET28a(+)混合,加入 T4連接酶于16 ℃連接過(guò)夜,構(gòu)建含有 Vif基因的重組質(zhì)粒 p ET28a(+)/Vif,用CaCl2法轉(zhuǎn)化宿主菌 E.coli DH5α。進(jìn)行雙酶切鑒定并送測(cè)序鑒定陽(yáng)性克隆。
1.2.2 Vif蛋白的原核表達(dá)與純化 將構(gòu)建正確的重組質(zhì)粒p ET28a(+)/Vif轉(zhuǎn)化宿主菌BL 21(DE3),挑單克隆接種于含卡那霉素的LB液體培養(yǎng)基,37℃振蕩培養(yǎng)至A600nm≈0.6~0.8時(shí),加入IPTG(1.0 mmol/L)誘導(dǎo)表達(dá)4 h。離心收集菌體,菌體重懸于Buffer A中(0.5mo l/L NaCl,20 mmol/L Tris-HCl,p H 8.0),在冰浴中以超聲波破碎菌體,離心后收集沉淀,8mol/L尿素溶解沉淀,將N TA樹(shù)脂裝入層析柱,通過(guò)Vif蛋白上的 His標(biāo)簽與鎳結(jié)合的特點(diǎn)進(jìn)行親和層析。層析用10倍N TA體積的N TA-washing Buffer洗滌。將樣品加到N TA層析柱中,流速控制在15 m L/h左右,收集穿透部分,然后分別用5倍N TA體積的N TA-p H8.0,N TA-p H6.8,N TA-p H5.6,N TA-p H4.5 Buffer洗脫,收集洗脫液,透析方法進(jìn)行復(fù)性,儲(chǔ)存于-40℃。
1.2.3 SH3和 GST蛋白的原核表達(dá)與純化 將本實(shí)驗(yàn)室保存的質(zhì)粒p GEX-4T-1和重組質(zhì)粒p GEX-4T-1/SH3分別轉(zhuǎn)化宿主菌BL 21(DE3),次日各挑單克隆接種于含氨芐青霉素的LB液體培養(yǎng)基,37℃振蕩培養(yǎng)至 A600nm≈0.6~0.8時(shí),加入IPTG(1.0 mmol/L)誘導(dǎo)表達(dá)4 h。分別離心收集菌體,菌體用PBS洗滌1次,用適量 PBS重懸沉淀,超聲波裂解,應(yīng)用 GSTrap FF親和層析柱在?KTAp rime蛋白純化儀純化 GST和 SH3蛋白,SDS-PAGE和Western blot鑒定。
1.3 GST pull-dow n檢測(cè)V if/SH3的結(jié)合活性取適量 Glutathione Sepharose 4B beads,分別加入純化的 GST蛋白或SH3蛋白,混勻,室溫緩慢搖動(dòng)作用1 h,使 GST標(biāo)簽蛋白與beads特異性結(jié)合,PBS洗滌3次。在各管中加入等量純化的V if蛋白,室溫緩慢搖動(dòng)1 h,用PBS洗滌3次,將未結(jié)合的V if蛋白洗滌。加入1×加樣緩沖液,煮沸5 min,取上清按常規(guī)方法進(jìn)行12%SDS-PAGE,同時(shí),以直接上樣純化Vif或者 GST蛋白作為陽(yáng)性對(duì)照。產(chǎn)物電轉(zhuǎn)移至PVDF膜,5 g/L脫脂奶粉封閉2 h,加入 His抗體(1∶3 000),室溫作用 1 h,用TBST洗膜3次后加入 HRP標(biāo)記的羊抗鼠 IgG(1∶5 000),37℃孵育1 h,TBST洗膜3次后 ECL顯色。Stripping緩沖液于50℃處理上述 PVDF膜30 min,TBST洗滌3次,再以5 g/L脫脂奶粉室溫封閉2 h后,加入1∶2 000稀釋的GST兔源多克隆抗體,室溫孵育1h,TBST洗膜3次后加入 HRP標(biāo)記的羊抗兔IgG(1∶3 000),37℃孵育1 h,TBST洗膜3次后ECL顯色。
2 結(jié) 果
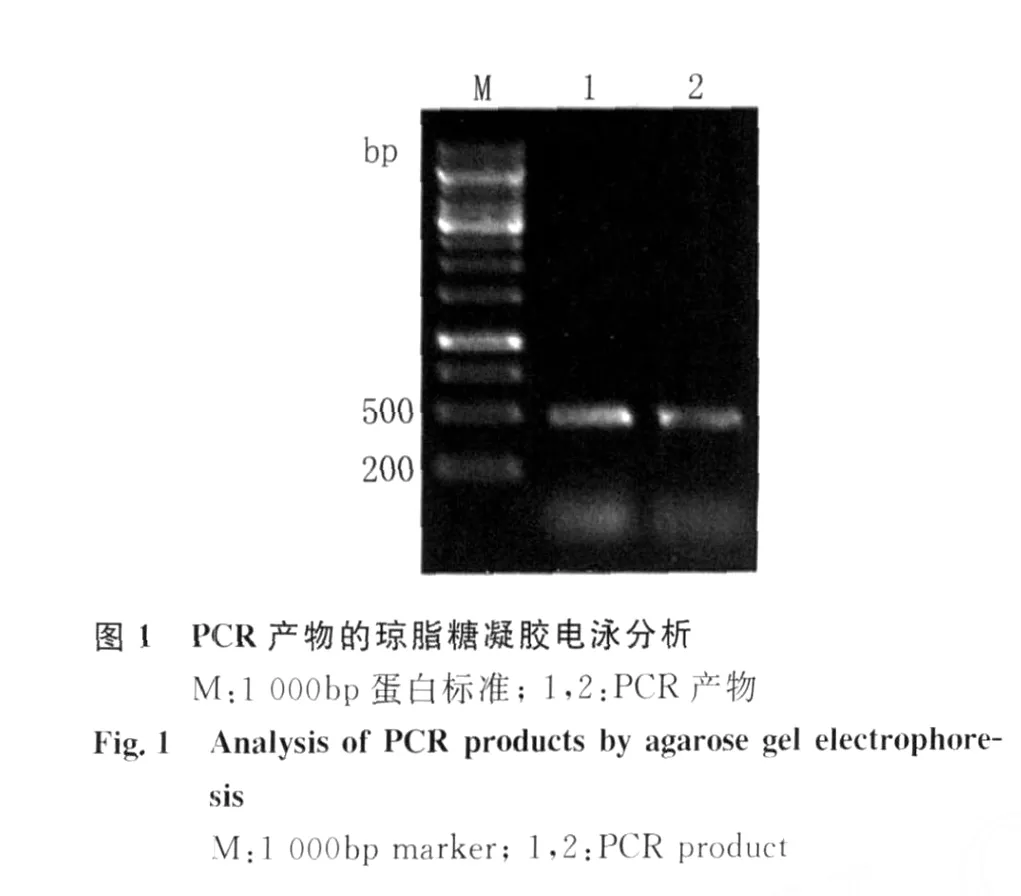
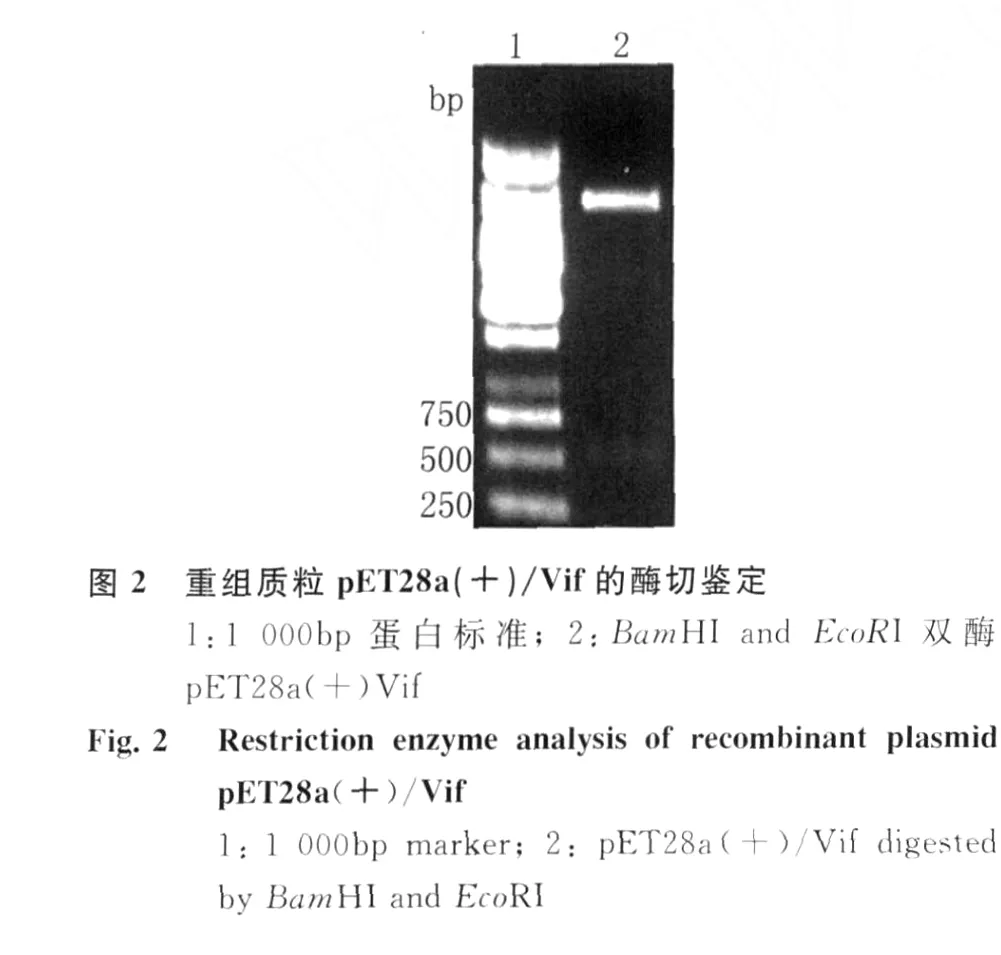
2.1 H IV-1 Vif重組質(zhì)粒的構(gòu)建 以 H IV-1 HBX2質(zhì)粒為模板,經(jīng)PCR擴(kuò)增 H IV-1 Vif基因片段,擴(kuò)增產(chǎn)物經(jīng)10 g/L瓊脂糖凝膠電泳,可見(jiàn)大小約為580 bp的目的條帶見(jiàn)圖1。將此PCR產(chǎn)物連接到p ET28a(+)質(zhì)粒中,經(jīng)過(guò)酶切、連接和轉(zhuǎn)化,獲得重組質(zhì)粒 p ET28a(+)/Vif,經(jīng) Bam H I和Eco RI雙酶切鑒定,獲得的插入片段大小與預(yù)期結(jié)果一致,10 g/L瓊脂糖凝膠電泳結(jié)果見(jiàn)圖2。DNA測(cè)序結(jié)果顯示Vif編碼區(qū)序列讀碼框正確,表明重組質(zhì)粒p ET28a(+)/Vif構(gòu)建成功。
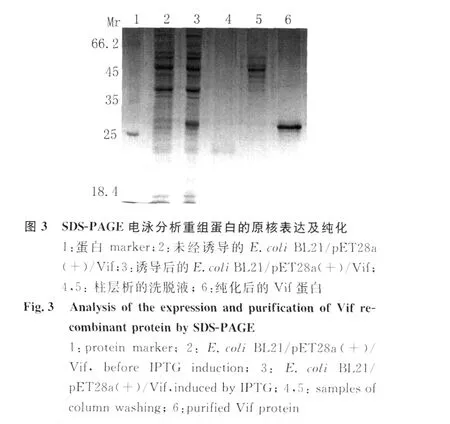
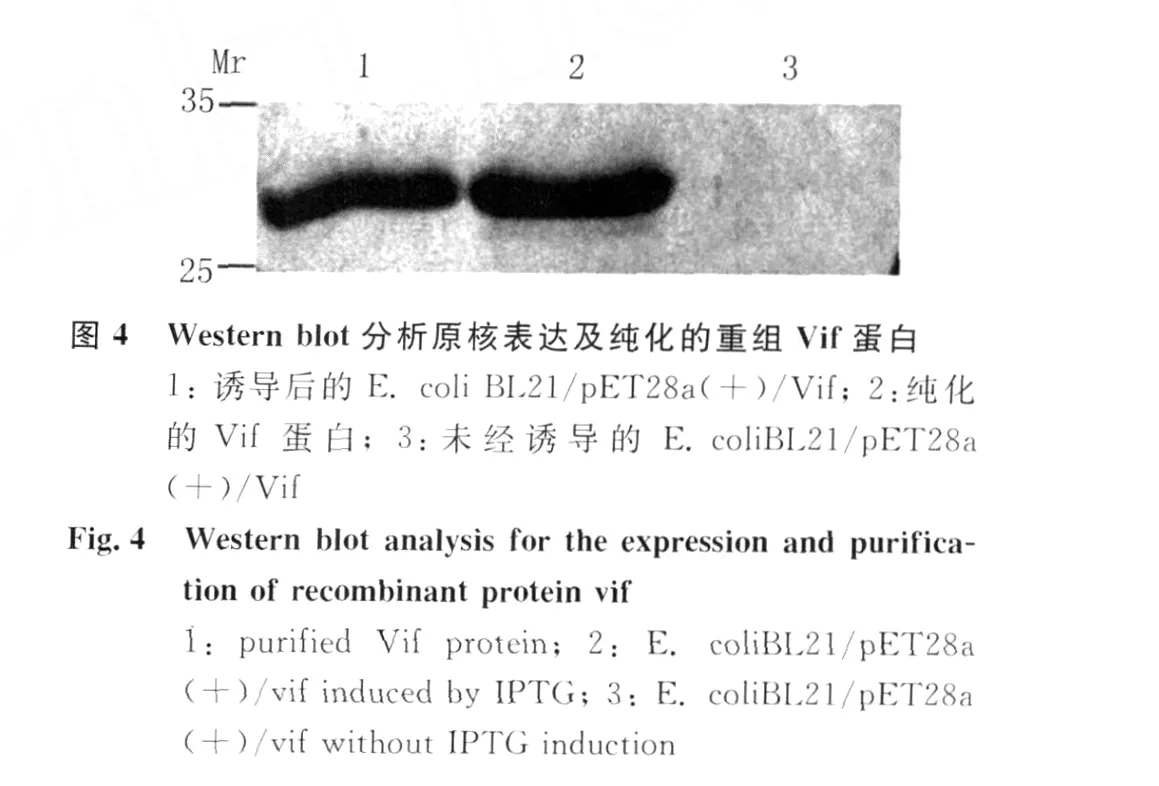
2.2 V if蛋白的原核表達(dá)與純化 用1.0mmol/L IPTG對(duì)轉(zhuǎn)化p ET28a(+)/Vif質(zhì)粒的細(xì)菌進(jìn)行誘導(dǎo)表達(dá),SDS-PAGE電泳顯示誘導(dǎo)后的細(xì)菌中有一新生的蛋白帶,表觀分子量與Vif蛋白預(yù)期結(jié)果相符。大量誘導(dǎo)目的蛋白表達(dá),經(jīng)尿素溶解包涵體,N TA柱層析得到純化的V if蛋白見(jiàn)圖3。電泳分離的蛋白轉(zhuǎn)移到 PVDF膜與 His單克隆抗體結(jié)合后,M r約30kD處可檢測(cè)到Vif蛋白的 Western blot顯色帶見(jiàn)圖 4,表明 p ET28a(+)/Vif表達(dá)正確。
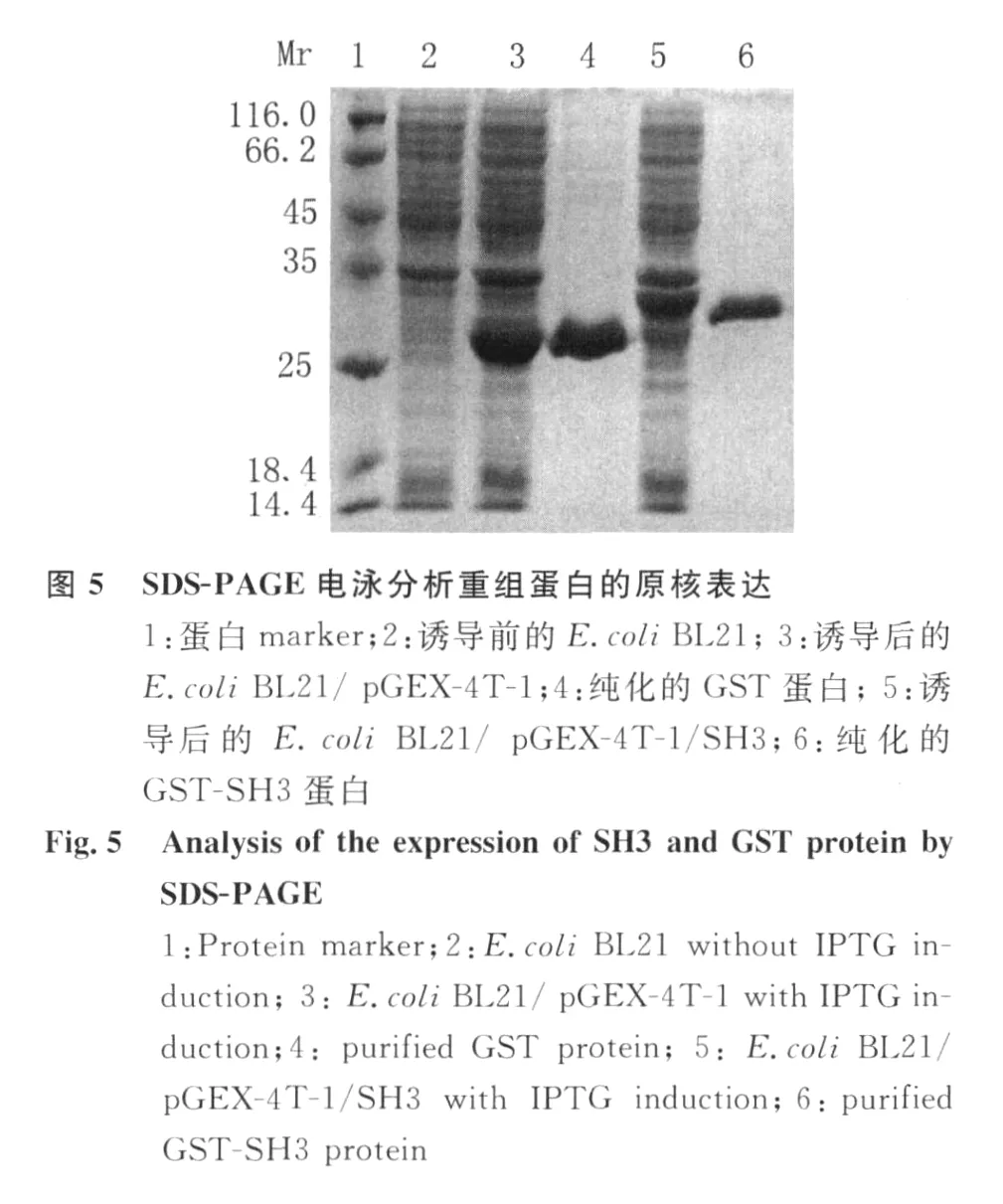
2.3 SH3和 GST蛋白的原核表達(dá)與純化 用1.0 mmol/L IPTG對(duì)轉(zhuǎn)化質(zhì)粒p GEX-4T-1和p GEX-4T-1/SH 3的細(xì)菌進(jìn)行誘導(dǎo)表達(dá) 4~6h,SDSPA GE電泳顯示誘導(dǎo)后的細(xì)菌中,分別有一條大小約為26 kD的 GST蛋白和大小約32 kD的重組GST-SH3蛋白帶,表觀分子量與預(yù)期結(jié)果相符。大量誘導(dǎo)目的蛋白表達(dá),經(jīng) SDS-PAGE電泳,過(guò)柱獲得純化的 GST-SH3和 GST蛋白,見(jiàn)圖5。
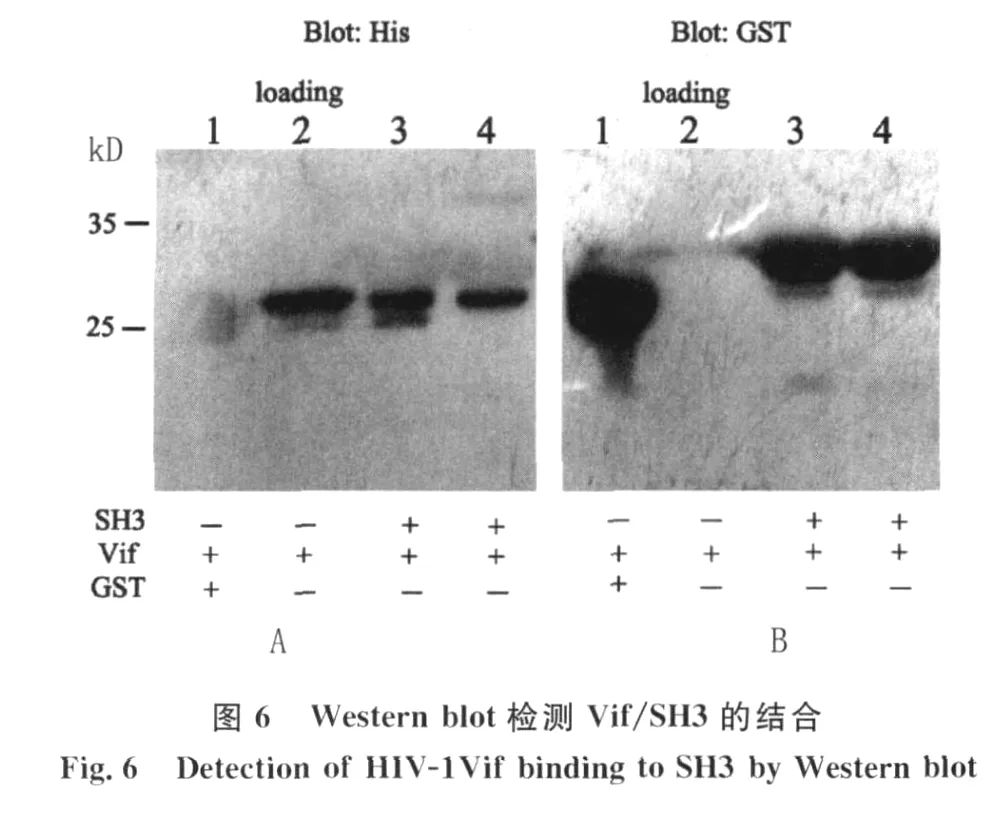
2.4 GST pull-dow n檢測(cè)Vif/SH3的結(jié)合活性GST蛋白能與 Glutathione Sepharose 4B beads特異性結(jié)合,形成 GST-beads和 GST-SH3 beads,加入V if蛋白(含 His標(biāo)簽),通過(guò)離心的方式可以使GST-beads沉淀,由于Vif/SH3結(jié)合從而使Vif也滯留于沉淀中。圖6 A是以 His單抗為一抗的Western blot結(jié)果,3#和4#可檢測(cè)到一條相對(duì)分子質(zhì)量約30kD的Vif蛋白陽(yáng)性帶,而1#的 GST未見(jiàn)條帶為陰性,2#為直接上樣的純化Vif蛋白作為陽(yáng)性對(duì)照。為了驗(yàn)證 Glutathione Sepharose 4B beads與 GST-SH3或者 GST特異性結(jié)合,上述PVDF膜經(jīng)stripping緩沖液處理后,將 His抗體洗滌,再以 GST抗體為一抗進(jìn)行 Western blot檢測(cè),圖6B結(jié)果顯示1#的 GST(26kD)和 3#、4#的GST-SH3(32kD)條帶位置正確,而直接上樣的Vif蛋白孔(2#)為陰性。結(jié)果證實(shí)原核表達(dá)的Vif能與 HCK的SH3結(jié)構(gòu)域特異性結(jié)合。
3 討 論
H IV-1的Vif蛋白可抑制宿主細(xì)胞蛋白APOBEC3G介導(dǎo)的抗病毒途徑,從而影響 H IV-1病毒顆粒的包裝,引起病毒的持續(xù)感染〔9〕。有研究發(fā)現(xiàn),細(xì)胞內(nèi) Fyn和 Hck激酶具有調(diào)節(jié)A POBEC3G的功能,而Vif蛋白可直接與細(xì)胞內(nèi) Fyn和 Hck的SH3結(jié)構(gòu)域結(jié)合,從而降低激酶的催化活性〔6-8〕,進(jìn)而降低APOBEC3G的抗病毒作用。因此 H IV-1 Vif蛋白與 Hck SH3結(jié)合成為抗病毒的潛在靶點(diǎn),而建立有效的高通量分子篩選模型用于靶向分子的藥物篩選具有非常重要的意義。
本實(shí)驗(yàn)成功構(gòu)建了原核重組質(zhì)粒p ET28a(+)/Vif,表達(dá)并純化了Vif蛋白。應(yīng)用親和層析方法可以有效的純化 His-Vif蛋白及 GST-SH3蛋白。應(yīng)用經(jīng)典的 GST pull-dow n實(shí)驗(yàn),建立了原核表達(dá)的Vif蛋白與SH3蛋白特異性結(jié)合的分子模型,為研究針對(duì)Vif與SH3結(jié)合的靶向藥物的篩選提供了實(shí)驗(yàn)基礎(chǔ)〔10-12〕。
〔1〕Walker RC Jr,Khan MA,Kao S,et al.Identification of dominant negative human immunodeficiency virus type 1 Vif mutants that interfere with the functional inactivation of APOBEC3G by virus-encoded Vif〔J〕.J Virol,2010,84(10):5201-5211.
〔2〕Sheehy AM,Gaddis NC,Choi JD,et al.Isolation of a human gene that inhibits H IV-1 infection and is supp ressed by the viral Vif protein〔J〕.Nature,2002,418(6898):646-650.
〔3〕Niew iadom ska AM,Yu XF.Host restriction of H IV-1 by APOBEC3 and viral evasion through Vif〔J〕.Curr Top Microbiol Immunol,2009,339:1-25.
〔4〕Yamashita T,Nomaguchi M,Miyake A,et al.Status of APOBEC3G/F in cells and p rogeny virions modulated by Vif determines H IV-1 infectivity〔J〕.Microbes Infect,2010,12(2):166-171.
〔5〕Guiet R,Poincloux R,Castandet J,et al.Hematopoietic cell kinase(Hck)isoforms and phagocyte duties-from signaling and actin reorganization to migration and phagocytosis〔J〕.Eur J Cell Biol,2008,87(8-9):527-542.
〔6〕Douaisi M,Dussart S,Courcoul M,et al.The tyrosine kinases Fyn and Hck favo r the recruitment of tyrosine-phospho rylated APOBEC3G into vif-defective H IV-1 particles〔J〕.Biochemical and Biophysical Research Communications,2005,(329):917-924.
〔7〕Hassaine G,Courcoul M,Bessou G,et al.The tyrosine kinase Hck is an inhibitor of H IV-1 replication counteracted by the viral vif protein〔J〕.JBiol Chem,2001,(276):16885-16893.
〔8〕Dang Y,Davis RW,York IA,et al.Identification of 81LGxGxx IxW 89 and 171EDRW 174 domains from human immunodeficiency virus type 1 Vif that regulate APOBEC3G and APOBEC3F neutralizing activity〔J〕.J Virol,2010,84(11):5741-5750.
〔9〕Iwatani Y,Chan DS,Liu L,et al.H IV-1 Vif-mediated ubiquitination/degradation of APOBEC3G involves four critical lysine residues in its C-term inal domain〔J〕.Proc Natl Acad Sci U SA,2009,106(46):19539-19544.
〔10〕MezeiM,Minarovits J.Reversalof HIV drug resistance and novel strategies to curb HIV infection:the viral in fectivity factor Vif as a target and tool of therapy〔J〕.Curr Drug Targets,2006,7(7):881-885.
〔11〕Nowotny B,Schneider T,Pradel G,et al.Inducible APOBEC3G-Vif double stable cell line as a high-throughput screening platform to identify antiviral compounds〔J〕.Antimicrob A-gents Chemother,2010,54(1):78-87.
〔12〕Emert-Sedlak L,Kodama T,Lerner EC,et al.Chemical library screens targeting an H IV-1 accessory facto r/host cell kinase complex identify novel antiretroviral compounds〔J〕.ACSChem Biol,2009,4(11):939-947.
Clon ing and expressing of HIV-1 Vif gene in prokaryotic cells,and evaluation of its bioactivity
Q IN Xiao-lin,L IU Chao-qi,L IU Hui-ting,WANG Gong-ze
(Institute of Molecular Biology,Three Gorges University,Yichang 443002,China)
In order to clone H IV-1 Vif gene,construct prokaryotic expression plasmid and detect itsexpression and biological activity,H IV-1 Vif gene wasobtained by PCR and cloned into the vector p ET28a(+)to construct p rokaryotic expression plasmid p ET28a(+)/Vif.The positive plasmid was identified by double enzyme digestion and sequencing.Positive plasmid was transformed to E.coli BL 21(DE3)and the expressed product was identified by SDS-PAGE electropho resis and western blot analysis.Vif protein was expressed and purified,and its biological activity was assayed.Results indicated that the plasmid p ET28a(+)/Vif was correctly constructed.Through transformation of p ET28a(+)/Vif into E.coli BL21(DE3),the Vif protein was expressed and purified.The renatured protein showed that Vif could bind into SH3(HCK)domain in the pulldown assay.It’s concluded that the successful cloning,expression and purification of Vif protein provide the basis for further studieson the functions of the protein.
H IV-1 Vif;SH3(HCK);binding
R392.11
A
1002-2694(2010)12-1141-04
劉朝奇,Email:zqliu@ctgu.edu.cn,qinaiaolin200810@163.com
三峽大學(xué)分子生物學(xué)研究所,宜昌 443002
2010-07-10;
2010-09-23

