氧濃度變化對銅綠假單胞菌生物被膜生成的影響
崔冬清孫鐵英黎 建黃秀清
1中國醫學科學院 北京協和醫學院研究生院,北京 100730
2衛生部北京醫院呼吸內科,北京 100730 3衛生部北京醫院老年病研究所,北京 100730
氧濃度變化對銅綠假單胞菌生物被膜生成的影響
崔冬清1,孫鐵英2,黎 建3,黃秀清3
1中國醫學科學院 北京協和醫學院研究生院,北京 100730
2衛生部北京醫院呼吸內科,北京 1007303衛生部北京醫院老年病研究所,北京 100730
目的研究氧濃度變化對銅綠假單胞菌生物被膜產生量的影響,探討密度感應系統在生物被膜調控中的作用以及Ⅲ型分泌系統表達和生物被膜形成的關系。方法將 23株銅綠假單胞菌臨床菌株在不同氧濃度環境下連續培養3 d,檢測生物被膜和藻酸鹽產生量,銀染色法觀察 ATCC27853產生胞外多糖的時間窗,實時定量多聚酶鏈反應(PCR)測定密度感應系統中調控基因LasI和RhlI的表達,Western blot方法觀察Ⅲ型分泌系統的代表毒素胞外酶 S分泌情況。結果銅綠假單胞菌的生物被膜產生量 (R=0.455,P=0.000)及藻酸鹽產生量 (R=0.367,P=0.000)均與氧濃度變化呈顯著正相關。銀染色法結果顯示,高氧條件下胞外多糖合成時間縮短。實時定量 PCR結果顯示,LasI、RhlI的相對表達量與氧濃度 (R=0.025,P=0.794;R=-0.044,P=0.653)、生物被膜產生量 (R=0.001,P=0.990;R=0.011,P=0.909)和藻酸鹽產生量 (R=0.029,P=0.770;R=0.193,P=0.064)間無明顯相關性。Western blot結果表明,銅綠假單胞菌在氧濃度為 10%~30%條件下可分泌胞外酶 S,在高氧條件下不分泌胞外酶 S。結論高氧可促進銅綠假單胞菌生物被膜的產生。Las系統和 Rhl系統可能因為菌群數量處于低水平而未在生物被膜形成早期階段參與生物被膜的調控過程。生物被膜的產生增多可能抑制Ⅲ型分泌系統的表達,使該菌毒力發揮受到限制。
銅綠假單胞菌;生物被膜;氧濃度;密度感應系統;Ⅲ型分泌系統
DO I:10.3881/j.issn.1000-503X.2010.03.015
銅綠假單胞菌是院內獲得性感染的重要致病菌之一,流行病學統計資料表明該菌院內獲得性感染發病率遠高于社區獲得性感染[1-3],推測其原因可能與院內患者免疫力低下及使用廣譜抗生素有關[4]。然而,單純的外源性因素并不能完全解釋銅綠假單胞菌院內感染高發的原因,可產生生物被膜被認為是銅綠假單胞菌耐藥和逃避人體免疫攻擊的重要手段。藻酸鹽是生物被膜的重要組成成分,具有抑制中性粒細胞活性、保護銅綠假單胞菌的作用[5]。密度感應系統是細菌協調群體生物學效應的一種有效手段,但其在生物被膜形成中的調控作用目前爭議頗多。Ⅲ型分泌系統是銅綠假單胞菌主要的毒力因素之一,在急性感染中可發揮重要作用,對于Ⅲ型分泌系統和生物被膜形成這兩種生物學行為的關系目前學術界也存在一些分歧。本研究觀察了氧濃度變化對銅綠假單胞菌生物被膜及藻酸鹽產生量的影響,探討了密度感應系統在生物被膜調控中的作用以及Ⅲ型分泌系統表達和生物被膜形成的關系。
材料和方法
銅綠假單胞菌菌株的來源 23株銅綠假單胞菌臨床株和標準菌株 ATCC27853由衛生部北京醫院檢驗科細菌室提供,臨床株均為呼吸內科等臨床科室住院患者痰標本培養分離得來。所有菌株均經隨機擴增 DNA多態性基因分型法 (random amplified polymorphic DNA,RAPD)證實來源于不同克隆[6]。
菌株培養 采用改良的微板法培養菌株,具體為:過夜培養的菌液經分光光度計 (UV-1601,日本島津)測定 570 nm吸光度,LB培養液調定菌液濃度為 0.1OD,24孔培養板中每孔加入 200μl菌液、1張無菌特氟龍濾膜 (PTFE,北京北化黎明分離技術公司)和 1 ml LB培養液,放入密閉培養箱中連續培養 3 d[7]。每次培養持續通入 1種氧濃度的混合氣體 (含有氧氣和氮氣),氧氣濃度分別為 0、10%、20%、30%、40%、50%、60%。
被膜菌總蛋白量的測定 細菌連續培養 3 d后,PBS清洗濾膜上的浮游菌,加入細胞裂解液裂解細菌 20 min,超聲 6 s,12 000 g、4℃低溫離心 15 min,取上清用 Bradford法檢測細菌總蛋白量。
生物被膜產生量的檢測 細菌連續培養 3 d后,PBS清洗濾膜上的浮游菌,結晶紫染液 (法國梅里埃公司)染色濾膜 20 min,去離子水漂洗后加入 95%酒精脫色 10 min,脫色液用分光光度計測定 570 nm的吸光度,再用每株菌的總蛋白量校正生物被膜吸光度。
藻酸鹽產生量的測定 細菌連續培養 3 d后,PBS清洗濾膜上的浮游菌,加入 1.2 ml硫酸 /硼酸鈉混合物,100℃煮沸 5 min,加入 20μl 1%對-羥基聯苯溶液顯色,分光光度計測定 520 nm吸光度,通過藻酸鹽 (美國 Sigma公司)標準曲線換算黏附在濾膜上的藻酸鹽量,即為每株菌產生的藻酸鹽總量,最后用被膜菌總蛋白量校正。
不同氧濃度下菌株 ATCC27853胞外多糖產生時間窗的觀察 過夜培養菌株 ATCC27853,LB培養液調定菌液濃度至 0.1OD值。6孔培養板中每孔加入3 ml LB培養液和 1張無菌蓋玻片 (20 mm×20 mm×0.7 mm),并加入 200μl菌液放入 37℃孵箱孵育,每次持續通入含 1種氧濃度的混合氣體。每隔 1 h取出 1張蓋玻片進行 5%硝酸銀溶液染色。光學顯微鏡下若見灰黑色斑片狀,則可鑒定為細菌合成的胞外多糖。
不同氧濃度下 LasI和 RhlI表達的測定 將 23株銅綠假單胞菌臨床株以相同濃度的初始菌液分別在不同氧濃度環境下連續孵育 8 h,離心,留沉淀。采用 Trizol(美國 Invitrogen公司)法提取 RNA,再反轉錄為 cDNA,以管家基因Rpsl為內對照,熒光實時定量聚合酶鏈反應 (Real time polymerase chain reaction,Real time PCR)檢測LasI和RhlI表達。PCR體系、擴增參數參照 Power SYBR Green試劑盒 (美國 AB I公司)說明書。擴增LasI基因上游引物序列為 5-CAAGTTGCGTGCTCAAGTGT-3,下游序列為 5-GGGAAGGTGTTCTTCAGCAT-3;RhlI上游引物序列為 5-CTTGGTCATGATCGAATTGCTC-3,下游序列為5-ACGGCTGACGACCTCACAC-3;管家基因Rpsl上游引物序列為 5-CGGCACTGCGTAAGGTATGC-3,下游序列為 5-CCCGGAAGGTCCTTTACAC-3。采用相對定量公式 2-ΔΔCt計算各目的基因LasI和RhlI的 mRNA相對表達量:目的基因的量 =2-ΔΔCt,其中 Δ ΔCt=ΔCt(目的基因)-ΔCt(管家基因Rpsl)。
不同氧濃度下胞外酶 S分泌的測定 將 23株銅綠假單胞菌臨床株以相同濃度的初始菌液分別在不同氧濃度環境下連續孵育8 h,離心,取上清。蛋白經高溫變性后,采用聚丙烯酰胺凝膠電泳分離約 1 h,300 V、低溫 1 h轉至 PVDF膜,室溫封閉 1 h。分別與 1∶2 500雞抗 Exoenzyme S單克隆抗體 (英國 Abcam公司)4℃孵育過夜,漂洗后加入 1∶2 500 HRP標記的兔抗雞 IgG相關抗原抗體 (北京友誼中聯公司),室溫孵育 1 h,漂洗后于暗室中加入混合 ECL發光緩沖液,壓 X-Ray膠片,顯影、定影、膠片掃描。
統計學處理 采用 SPSS13.0統計軟件,相關性分析采用 Spearman檢驗,組間差異性分析采用雙向方差分析,P<0.05為差異有統計學意義。
結 果
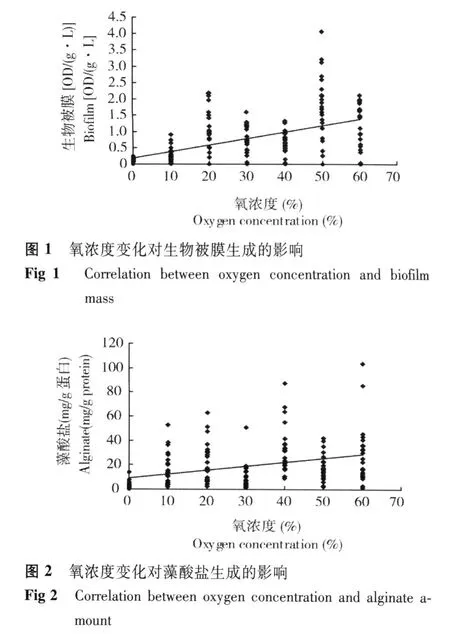
不同氧濃度條件下銅綠假單胞菌生物被膜產生量 當氧濃度為 50%時,生物被膜產生量達最高值[4.05 OD/(g·L)];趨勢性分析結果表明,隨著氧濃度升高,生物被膜產生量逐漸上升 (圖 1)。相關性分析結果顯示,銅綠假單胞菌的生物被膜產生量與氧濃度呈顯著正相關 (R=0.455,P=0.000)。差異性分析結果顯示,不同氧濃度下銅綠假單胞菌的生物被膜產生量間差異有統計學意義 (F=3.934,P=0.000)。
不同氧濃度條件下銅綠假單胞菌藻酸鹽產生量當氧濃度為 60%時,藻酸鹽產生量達最高值(85.22 mg/g蛋白);趨勢性分析結果表明,隨著氧濃度升高,藻酸鹽產生量逐漸升高 (圖 2)。相關性分析結果顯示,銅綠假單胞菌的藻酸鹽產生量與氧濃度呈顯著正相關 (R=0.367,P=0.000)。差異性分析結果顯示,不同氧濃度下銅綠假單胞菌的藻酸鹽產生量間差異有統計學意義 (F=5.905,P=0.000)。
不同氧濃度條件下 ATCC27853產生胞外多糖的時間窗 氧濃度為 40%、50%或 60%時,ATCC27853培養 1 h即可出現銀染的胞外多糖;氧濃度分別為20%、30%時,菌株需培養 2 h以上才出現胞外多糖;氧濃度為 10%時,胞外多糖最早出現時間為 4 h;無氧培養條件下,菌株培養 8 h出現胞外多糖。
LasI和 RhlI表達與氧濃度、生物被膜產生量和藻酸鹽產生量之間的關系 相關性分析結果表明,LasI的相對表達量與氧濃度 (R=0.025,P=0.794)、生物被膜產生量 (R=0.001,P=0.990)和藻酸鹽產生量 (R=0.029,P=0.770)間無顯著相關性;RhlI的相對表達量與氧濃度 (R=-0.044,P=0.653)、生物被膜產生量 (R=0.011,P=0.909)和藻酸鹽產生量 (R=0.193,P=0.064)間也無顯著相關性。
不同氧濃度下胞外酶 S的分泌情況 當氧濃度為 10%時,菌株 15、16能夠分泌胞外酶 S(圖3A);在氧濃度為 20%時,菌株 1~5、7~10、15、16、19、23能夠分泌胞外酶 S(圖 3B、C、D);當氧濃度為 30%時,菌株 1、2、4、5、9、10、15能夠分泌胞外酶 S(圖 3E、F);當氧濃度為 0、40%、50%和 60%時,無菌株分泌胞外酶 S。
討 論
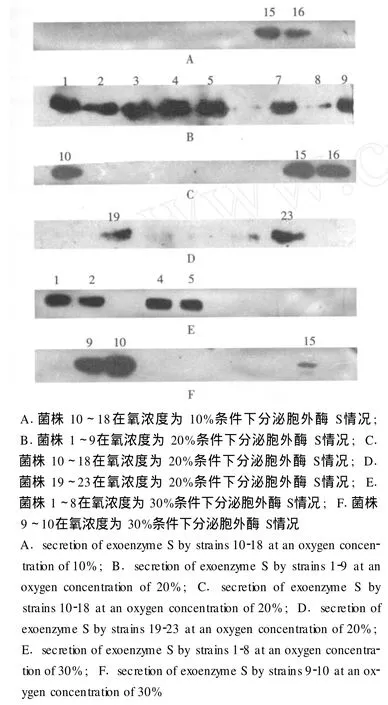
圖 3 不同氧濃度下胞外酶 S的分泌情況Fig 3 The secretions of exoenzyme S under different levels of environmental oxygen
生物被膜是細菌分泌的一種多糖復合物,覆蓋在細菌表面,可保護細菌免受人體免疫細胞的攻擊,并可通過限制抗生素的滲透等作用提高細菌耐藥性。細菌在人體內產生生物被膜,導致細菌不易被清除而造成的反復感染被稱為生物被膜病,目前臨床上對于生物被膜病的治療方法十分有限[5]。藻酸鹽是生物被膜的重要組成成分,可增強細菌黏附性,促進生物被膜形成,提高細菌的耐藥性;并可直接抑制中性粒細胞和巨噬細胞的趨化及吞噬作用,對細菌同樣能起到保護作用[8]。
銅綠假單胞菌以往被認為是需氧菌。1986年,Bazylinski等[9]發現該菌在無氧條件下可利用含氮化合物進行脫氮作用產能并生長。Worlitzsch等[10]對比了在無氧和空氣氧條件下銅綠假單胞菌產生藻酸鹽量的差異,發現銅綠假單胞菌在無氧條件下產生的藻酸鹽更多。本研究則觀察了不同濃度氧對銅綠假單胞菌生物被膜及藻酸鹽產生量的影響,結果顯示,銅綠假單胞菌的生物被膜產生量及藻酸鹽產生量均與氧濃度變化呈顯著正相關;當氧濃度為 50%時,生物被膜產生量達最高值;當氧濃度為 60%時,藻酸鹽產生量達最高值;提示高氧環境促進了生物被膜和藻酸鹽的產生。本研究中使用的高氧濃度分別為 30%、40%、50%、60%,最高氧濃度之所以選擇 60%,是因為臨床上氧療的安全范圍低于 60%,更高濃度的氧療容易導致氧中毒。此外,本研究還采用銀染色法光鏡下觀察了不同氧濃度條件下銅綠假單胞菌生成胞外多糖的時間窗,結果發現,越高氧濃度環境下合成胞外多糖所需要的時間越短,提示高氧可促進胞外多糖的合成,有利于生物被膜的形成。
為了探查密度感應系統在生物被膜形成中的作用,本研究采用實時定量 PCR方法測定不同氧濃度條件下銅綠假單胞菌臨床株 Las系統和 Rhl系統中信號分子合成酶基因LasI和RhlI的表達情況,結果顯示LasI和RhlI的相對表達量與對應菌株在同一條件下生物被膜和藻酸鹽產生量無顯著相關性。分析其原因可能是本研究是將 23株臨床菌株培養 8 h后提取 RNA、反轉錄,再進行實時定量 PCR測定目的基因表達,由于 8 h的時間段是處于生物被膜形成過程的早期,而密度感應系統作用的發揮需要有一定數量菌群才能產生級聯放大效應,所以對于生物被膜形成的早期,由于菌體數量處于低水平,此時密度感應系統可能不發揮主要作用。
為了觀察Ⅲ型分泌系統和生物被膜產生量的關系,本研究在不同氧濃度環境下培養了銅綠假單胞菌臨床株,并分離上清,檢測菌株分泌Ⅲ型分泌系統的代表毒素——胞外酶 S的能力,結果顯示,23株銅綠假單胞菌臨床株只有在氧濃度為 10%~30%的條件下分泌胞外酶 S。推測低氧環境下可能菌體處于低代謝狀態,導致胞外酶 S分泌下調;而高氧環境雖然有利于生物被膜產生,但并不利于胞外酶 S分泌,提示當銅綠假單胞菌大量合成生物被膜時,Ⅲ型分泌系統表達受到抑制,侵襲力下降。
綜上所述,本研究結果顯示高氧環境有利于銅綠假單胞菌生長及其生物被膜和藻酸鹽產生,故筆者推測醫源性氧療可能促進了銅綠假單胞菌產生生物被膜和藻酸鹽,導致該菌在人體內的耐藥和寄植,而這可能就是銅綠假單胞菌院內高感染的原因之一。建議針對有銅綠假單胞菌感染高危因素的患者應避免過高濃度的氧療,以免造成有利于銅綠假單胞菌寄植的環境。
[1] WeberDJ,Rutala WA,Sickbert-Bennett EE,et al.Microbiology of ventilator-associated pneumonia compared with that of hospital-acquired pneumonia[J].Infect Control Hosp Epidemiol,2007,28(7):825-831.
[2] DriscollJA,Brody SL,KollefMH.The epidemiology,pathogenesis and treatment of pseudomonas aeruginosa infections[J].Drugs,2007,67(3):351-368.
[3] Kollef MH,Shorr A,Tabak YP,et al.Epidemiology and outcomes of health-care-associated pneumonia:results from a large US database of culture-positive pneumonia[J].Chest,2005,128(6):3854-3862
[4] Koulenti D,Rello J.Gram-negative bacterial pneumonia:aetiology and management[J].Curr Opin Pulm Med,2006,12(3):198-204.
[5] Kobayashi H.Airway biofilms:implications for pathogenesis and therapy of respiratory tract infections[J].Treat Respir Med,2005,4(4):241-253.
[6] Giske CG,Libisch B,Colinon C,et al.Establishing clonal relationships between V IM-1-like metallo-beta-lactamase-producing Pseudomonas aeruginosa strains from four European countries by multilocus sequence typing[J].J Clin Microbiol,2006,44(12):4309-4315.
[7] Knezevic P,Petrovic O.A colorimetric microtiter plate method for assessment of phage effect on Pseudomonas aeruginosa biofilm[J].J MicrobiolMethods,2008,74(2-3):114-118.
[8] Leid JG,W illson CJ,Shirtliff ME,et al.The exopolysaccharide alginate protects Pseudomonas aeruginosa biofilm bacteria from IFN-gamma-mediated macrophage killing[J].J Immunol,2005,175(11):7512-7518.
[9] BazylinskiDA,Soohoo CK,Hollocher TC.Growth of Pseudomonas aeruginosa on nitrous oxide[J].Appl EnvironMicrobiol,1986,51(6):1239-1246.
[10] Worlitzsch D,Tarran R,UlrichM,et al.Effects of reduced mucus oxygen concentration in airway Pseudomonas infections of cystic fibrosis patients[J].J Clin Invest,2002,109(3):317-325.
Effect of D ifferentLevels of Environmental Oxygen on the Biofilm Production ofPseudom onas aeruginosa
CU IDong-qing1,SUN Tie-ying2,L I Jian3,HUANG Xiu-qing3
1Graduate School,CAMS and PUMC,Beijing 100730,China2Department of RespiratoryMedicine,Beijing Hospital,Ministry of Health,Beijing 100730,China3National Institute of Geriatrics,Beijing Hospital,Ministry of Health,Beijing 100730,China
SUN Tie-ying Tel:010-85136242,E-mail:suntieying3@hotmail.com
ObjectiveTo investigate the relationship among oxygen concentration,quorum sensing system,typeⅢsecretion system,and biofilm production ofPseudomonas aeruginosa.M ethods A total of 23 clinical strains ofPseudomonas aeruginosawere cultured at different levels of environmental oxygen for three days.Then biofilm mass and alginate were quantified.The expression levels ofLasIandRhlIwere detected by real time polymerase chain reaction(PCR).The secretion of exoenzyme Swas examined byWestern blot.ResultsBoth the biofilm mass(R=0.455,P=0.000)and alginate(R=0.367,P=0.000)were positively correlated with oxygen concentration.Real time PCR showed that the expression levels ofLasIandRhlIwere not significantly correlated with oxygen concentration(R=0.025,P=0.794;R=-0.044,P=0.653),the production of biofilm(R=0.001,P=0.990;R=0.011,P=0.909),or alginate(R=0.029,P=0.770;R=0.193,P=0.064).Western blot showed that the optimal oxygen concentration range for exoenzyme S secretion ofPseudom onas aeruginosaranged 10%to 30%.Conclusions Hyperoxia can promote the production of biofilm and alginate byPseudom onas aeruginosa.Las/Rhl system may not participate in biofilm production at the early stage due to the low bacteria amount.The increased production of biofilm may inhibit the expression of TypeⅢSecretion system and thus inhibit bacterial virulence.
Pseudomonas aeruginosa;biofilm;oxygen concentration;quorum sensing system;typeⅢsecretion system
Acta Acad M ed Sin,2010,32(3):310-314
孫鐵英 電話:010-85136242,電子郵件:suntieying3@hotmail.com
R378.99+1
A
1000-503X(2010)03-0310-05
2009-05-19)
·論 著·
- 中國醫學科學院學報的其它文章
- 膠原模擬多肽三螺旋結構的熱變性過程

