葛根素預處理在大鼠肝臟缺血再灌注損傷中的抗氧化作用
雒光強
【摘要】 目的 觀察葛根素預處理對大鼠肝臟缺血再灌注損傷的防護作用。方法 雄性SD大鼠,建立肝臟缺血再灌注模型(HIR)。隨機分為假手術組、HIR組和HIR-葛根素預處理組。黃嘌呤氧化酶法、硫代巴比妥酸比色法分別測定肝組織中丙二醛(MDA)含量和超氧化物歧化酶(SOD)活性的變化,同時分析NO含量的改變。結果 肝臟缺血再灌注損傷后,與假手術組比較,肝組織中MDA活性及NO含量均顯著增加,而SOD活性顯著降低;經40 mg/kg劑量的葛根素預處理7 d后,與模型組相比,肝組織中MDA活性及NO含量顯著降低,而SOD活性增高。結論 葛根素預處理對大鼠缺血再灌注肝臟損傷有一定的保護作用。
【關鍵詞】 葛根素;缺血再灌注;肝臟;抗氧化
お
The antioxidation effect of kakkonein on hepatic ischemia reperfusion injury in rats
LUO Guang-qiang,Xian 630 Hospital, Xian, Shanxi 710000,China
【Abstract】 Objective To investigate the antioxidation effect of kakkonein on hepatic ischemia reperfusion injury in rats. Methods Male Sprague-Dawley rats were randomly divided into three groups: pseudo-operation normal control group, hepatic ischemia reperfusion injury model group, kakkonein group. After hepatic ischemia and reperfusion, to analysis the level of MDA, SOD and NO activity. Results After hepatic ischemia reperfusion, the MDA and NO level increased, and the SOD activity decreased obviously comparing with the normal group; Comparing to the hepatic ischemia reperfusion injury model group, the MDA and NO level decreased, and the SOD activity increased. Conclusions The apigenin have a prominent protective effect on hepatic ischemia reperfusion injury in rats.
【Key words】Kakkonein; Ischemia reperfusion; Liver; Antioxidation
肝臟缺血再灌注損傷是肝臟缺血后重獲血流灌注或氧供后,引起或加重肝臟缺血缺氧造成的損傷,是臨床肝臟手術過程中常見的一種病理生理變化,可產生氧自由基,引起鈣超載等改變,損傷肝細胞超微結構,影響肝臟的功能[1]。因此,如何減輕或防治肝臟缺血再灌注損傷的程度,是目前臨床肝臟手術中研究的熱點。NO能與含Fe2+血紅素基團的蛋白質相結合,產生較穩定的亞硝酰基血紅素蛋白復合物。NO與超氧自由基反應生成的過氧亞硝酸根離子,能使各種含鐵-硫酶失活,阻斷細胞內能量合成及DNA復制,影響細胞的線粒體功能,產生細胞毒性作用[2]。葛根素是一種天然多酚類化合物,結構類似雌二醇,具有某些雌激素樣作用,研究發現它是一種天然的抗氧化劑,具有明顯的抗氧化作用,可消除體內過多的自由基,保護細胞膜的結構[3]。本實驗通過建立大鼠肝臟局部缺血再灌注模型,經葛根素預處理,觀察肝組織中丙二醛(MDA) 含量和超氧化物歧化酶(SOD)的活性及NO含量的改變,從而探討葛根素對大鼠缺血再灌注肝臟損傷的保護作用。
1資料與方法
1.1 資料 雄性SD大鼠,體質量190~210 g,由西安交通大學醫學院實驗動物中心提供;MDA、SOD和NO試劑盒由南京建成生物工程研究所提供;葛根素購自中國藥品生物制品檢定所。
1.2 動物分組與模型建立 大鼠肝臟缺血再灌注模型建立方法[4]:實驗動物,術前24 h禁食,自由飲水,乙醚吸入麻醉,腹正中切口,暴露十二指腸韌帶及肝門部,分別夾閉肝動脈和門靜脈,造成70%肝臟缺血,70 min后去除血管夾,恢復肝臟血流。
實驗動物隨機分為3組:① 假手術組,大鼠給予開腹及暴露肝蒂處理,不阻斷肝臟血流;② 模型組,夾閉肝動脈和門靜脈,缺血70 min后,再灌注120 min;③ 葛根素預處理組,術前7 d,每天口服灌胃40 mg/kg的葛根素,按上述方法建立大鼠肝臟缺血再灌注模型,阻斷肝動脈和門靜脈,缺血70 min后,再灌注120 min。
1.3 肝臟組織中MDA、SOD活性及NO含量的變化 取出肝臟組織,冰浴中操作,加入1 mol/L的HCl,碾磨制成組織勻漿,低溫離心機,離心15 min,3000轉/min,取上清液。參照按試劑盒說明,分別用黃嘌呤氧化酶法測定SOD、硫代巴比妥酸比色法測定MDA的活性變化,通過硝酸還原酶法檢測的NO含量。
1.4 統計學方法 計量資料以均數±標準差(x±s)表示,采用t檢驗,采用SPSS 11.0軟件包進行統計學處理。以P<0.05為差異有統計學意義。
2 結果
2.1 肝組織中NO含量的變化 大鼠肝臟缺血再灌注后,通過硝酸還原酶法檢測的NO含量,肝組織中NO含量顯著增加;大鼠經40 mg/kg劑量的葛根素預處理7 d后,同缺血再灌注組動物相比,NO含量降低(表1)。
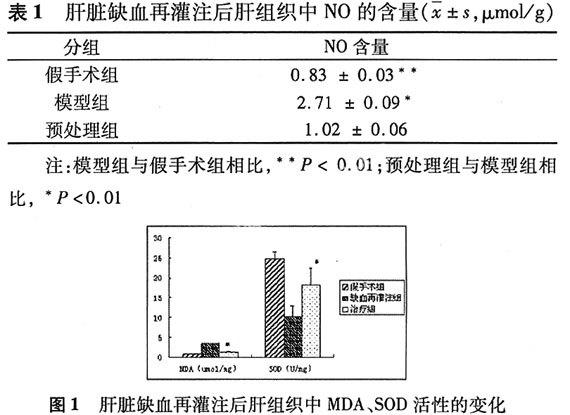
2.2 肝組織中SOD、MDA活性的變化 大鼠缺血再灌注后,通過黃嘌呤氧化酶法測定,肝組織中SOD活性顯著降低;硫代巴比妥酸比色法測定,肝組織中MDA含量顯著增加;大鼠經40 mg/kg劑量的葛根素預處理7 d后,同缺血再灌注組動物相比,SOD活性明顯增加,MDA含量降低(圖1)。
3 討論
目前的研究表明,氧自由基和脂質過氧化在肝臟缺血再灌注損傷的過程中起著重要的作用。在肝臟缺血再灌注過程中,發生超氧化物陰離子自由基反應,可產生大量氧自由基,導致脂質過氧化反應,造成肝細胞腫脹、變性、壞死[5]。MDA能反映細胞膜脂質過氧化的程度,間接反映出細胞損傷的程度。氧自由基清除劑SOD,可以間接的反映體內氧自由基水平及脂質過氧化的損傷程度[6]。NO與含血紅素的鳥苷酸環化酶(GC)結合,激活的GC使細胞產生大量環磷酸鳥苷(cGMP),發揮生物效應。NO與超氧自由基反應,生成過氧亞硝酸根離子,可以造成腦細胞膜脂質過氧化,ATP酶活性降低,細胞蛋白質損傷[7]。葛根素是一種異黃酮衍生物,屬植物雌激素類,在4位和7位各有一個羥基,4位羥基可與雌激素受體(ER)相結合,可以增強雌激素促甲狀腺釋放降鈣素的作用,具有抗自由基損傷、抑制血小板活化與聚集、擴張心血管、降低心肌耗氧、改善心肌代謝和心臟功能等眾多藥理作用,對內皮細胞也具有一定的保護作用[8]。
肝臟缺血再灌注后,機體清除自由基的能力下降,氧自由基生成增加,肝臟細胞受到了自由基的攻擊,造成肝組織中MDA活性及NO含量均顯著增加,而SOD活性顯著的降低;經40 mg/kg劑量的葛根素預處理7 d后,肝組織中MDA活性及NO含量均降低,而SOD活性增高,表明葛根素可以抑制肝臟缺血再灌注后SOD的失活,降低細胞內氧自由基含量,使MDA生成下降,從而抑制大鼠肝組織的脂質過氧化反應。
本研究結果表明,葛根素可通過降低氧自由基水平、減輕脂質過氧化反應,有效地防治缺血再灌注所造成的肝臟損傷。此外,葛根素尚可通過提高機體NO水平,降低內皮素水平,間接抑制PMN黏附、聚集,從而保護肝組織的功能,為臨床中缺血再灌注損傷性疾病的防治提供新的思路。
參考文獻
[1] Henderson JM. Liver transplantation and rejection: an overview. Hepato-Gastroenterol, 1999,46 (2): 1482-1484.
[2] Wink DA,Mitchell JB.Chemical biology of NO:Insights into regulatory,cytotoxic,and cytoprotective mechanisms of NO.Free Radic Blot Med,1998,25:434-456.
[3] Boue SM, Wiese TE, Nehls S, et al. Evaluation of the estrogenic effects of legume extracts containing phytoestrogens. J Agric Food Chem, 2003,51(8):2193-2199.
[4] Murata R,Hamada N,Nakamura N. Serotonin activity and liver dysfunction following hepatic ischemia and reperfusion.In Vivo,2003,l 7(6):567-572.
[5] Kobayashi H,Nonami T,Kurokawa T.Mechanism and prevention of ischemia-repefusion-induced liver injury in rats.J Sung Res,1991,51:240-244.
[6] Shibuya H,Ohkohchi N,Tsukamoto S.Tumoumecrosis factorinduced superoxid-mediated neutrophil accumulation in cold ischemia/repedusion in rat liver.Hepatology,1997,26:113-120.
[7] Mitchell JB, Cook JA,Krishna MC,et al.Badiation sensitisation by nitri oxide releasing agents.Br J Cancer,1996,74(27):181-184.
[8] Chen G, Zhang J, Jiannong Y. Determination of puerarin, daidzein and rutin in Pueraria lobata (Wild.) Ohwi by capillary electrophoresis with electrochemical detection. J Chromatogr A,2001 ,923(1-2):255-262.

