新麥草獨腳金內酯合成相關基因CCD7的克隆及表達分析


摘要:植物CCD7基因參與合成獨腳金內酯。為研究新麥草[Psathyrostachys juncea (Fisch.)Nevski]CCD7基因的功能,本研究以多分蘗型新麥草和少分蘗型新麥草的分蘗節為材料,通過RNA-seq及熒光定量PCR分析CCD7基因在新麥草中的表達量,通過構建pcambia1300-cYFP-CCD7過表達載體,分析新麥草CCD7基因在煙草葉片中的亞細胞定位;通過生物信息學分析預測CCD7基因的基本功能。結果顯示,新麥草CCD7基因序列克隆全長為1638 bp,亞細胞定位新麥草CCD7基因在煙草葉片細胞的葉綠體中表達;表達量分析表明新麥草的分蘗數量與該基因的表達量呈現負相關關系。預測新麥草CCD7保守結構域的范圍是第13到第544個氨基酸,該基因在9個近緣物種中功能保守,編碼蛋白性質相近,新麥草CCD7蛋白的絲氨酸磷酸化位點最有可能是蛋白發揮功能的磷酸化位點。
關鍵詞:新麥草;CCD7;過表達載體;亞細胞定位;基因克隆
中圖分類號:S543.9" " " " 文獻標識碼:A" " " " 文章編號:1007-0435(2025)02-0382-09
Cloning and Expression Analysis of CCD7 Gene Related to Strigolactone Synthesis in Psathyrostachys juncea
AI Qian1, YUN Lan1,2*, REN Xiao-min1, YAO Na1
(1.College of Grassland Resource and Environment, Inner Mongolia Agricultural University, Hohhot, Inner Mongolia 010018, China;
2.Key Laboratory of Grassland Resources of Education Ministry, Hohhot, Inner Mongolia 010011, China)
Abstract:Plant CCD7 gene is involved in the synthesis of strigolactones. In order to study the function of CCD7 gene in Psathyrostachys juncea, the tillering nodes of multi-tillering Psathyrostachys juncea and less-tillering P. juncea were used as materials. The expression of CCD7 gene in P. juncea was analyzed by RNA-seq and fluorescence quantitative PCR. The subcellular localization of CCD7 gene in tobacco leaves was analyzed by constructing pcambia 1300-cYFP-CCD7 overexpression vector. The basic functions of CCD7 gene were predicted by bioinformatics analysis.The results showed that the full length of P. juncea CCD7 gene sequence was 1 638 bp, and the subcellular localization of P. juncea CCD7 gene test found it was expressed in the chloroplast of tobacco leaf cells. The expression analysis showed that the tiller number of P. juncea was negatively correlated with the high expression of the gene. It was predicted that the conserved domain of CCD7 in P. juncea ranged from 13 to 544 amino acids. The gene was conserved in 9 closely related species, and the protein properties were similar. The serine phosphorylation site of CCD7 protein in P. juncea was most likely to be the phosphorylation site of protein function.
Key words:Psathyrostachys juncea;CCD7;Over expression vector;subcellular localization;Gene cloning
類胡蘿卜素裂解雙加氧酶家族(carotenoid cleavage dioxygenases,CCDs)是一個相對較小的基因家族,這個基因家族主要在植物的分枝中起作用,CCDs主要參與新型植物激素獨腳金內酯(Strigolactone,SL)的合成。CCDs基因家族分為兩類,一類是CCD亞家族,另一個則是9-順式-環氧類胡蘿卜素雙加氧酶基因(9-cis epoxycarotenoid dioxygenases,NCEDs)亞家族[1]。目前已經發現了12個CCD基因家族的成員,其中CCD亞家族有五個成員,NCED亞家族有七個成員[2]。近年來,通過對多種模式植物和作物多分支突變體的生理生化和基因組學深入研究,已經克隆出了一些參與分枝調控的基因[3-5],并且這些基因已經被證實參與了獨腳金內酯的合成。目前報道的獨腳金內酯生物合成基因包括擬南芥(Arabidopsis thaliana)多腋芽分枝MAX3(More axial branching 3)[6]和水稻(Oryza sativa)矮多分蘗HTD1/D17(High tillering dwarf 1)[7]。它們分別編碼CCD7,D10[8]和CCD8。前人大量研究表明,獨腳金內酯是一種新的植物激素,主要在根內合成,由下向上運輸,抑制植物分蘗芽的生長[9-10]。
新麥草[Psathyrostachys juncea (Fisch.)Nevski]是禾本科多年生異花授粉植物,原產于西伯利亞及中亞地區,在我國的新疆也有分布[11]。新麥草具有抗逆性強、對寒冷干旱氣候適應性好等優點。同時新麥草具有返青早、青綠期長、再生性強及適口性好的特點,是一種刈割放牧兼用型的冷季牧草[12]。新麥草也是小麥等麥類作物的近緣物種,因此研究新麥草對我國牧草種質資源的利用和麥類作物的遺傳改良有著重要的意義。
前期研究發現,新麥草中獨腳金內酯的合成會減少新麥草分蘗的數量。分蘗數直接影響著新麥草的飼草產量及種子產量,而CCD7是參與調控獨腳金內酯合成的重要基因[13]。目前未見對于新麥草的CCD7基因的相關研究。因此,本研究通過qRT-PCR、生物信息學分析、亞細胞定位分析等,明確CCD7在新麥草及新麥草的近緣物種中的表達特性,為該基因在新麥草中功能驗證和遺傳轉化提供理論依據。
1 材料與方法
1.1 材料
材料取自內蒙古自治區呼和浩特市內蒙古農業大學牧草資源圃的30株多分蘗型新麥草草單株(DT)和30株少分蘗型單株(ST),取其分蘗節提取RNA,利用q-PCR比較表達量,以生長一個月左右的煙草幼苗為侵染材料。植物過表達載體為pcambia1300-cYFP,轉化菌株為Dh5α,侵染菌株為農桿菌感受態GV3101,所用抗生素為卡那霉素(Kan)和利福平(Rif)。
1.2 方法
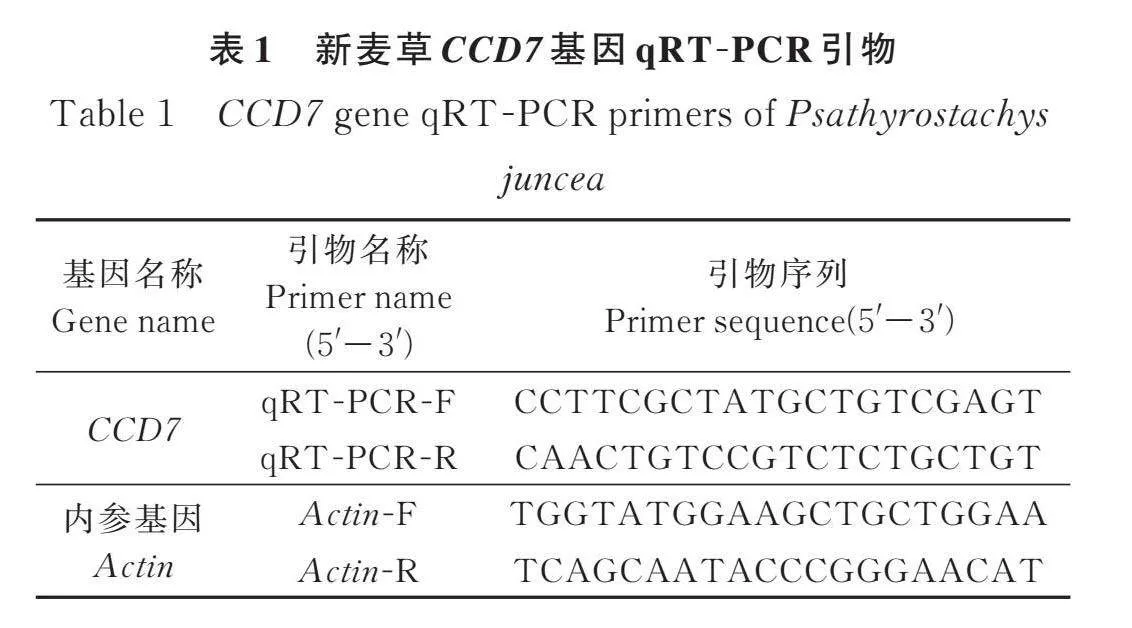
1.2.1 CCD7基因表達量分析 基于Ge Norm,Norm Finder和Best Keeper三個內參基因穩定性評估軟件對RNA-seq數據進行分析,將表達穩定的CCD7基因篩選出來,用NCBI(https://www.ncbi.nlm.nih.gov/)設計CCD7(SUB14441471 CCD7 PP789591)定量PCR引物(表1);通過SPASS Statistics 23對qPCR結果進行分析,用 2-ΔΔCT 法計算CCD7在多分蘗型新麥草和少分蘗型新麥草中的表達量,并用GraphPad Prism軟件作圖。
1.2.2 CCD7基因克隆及過表達載體構建 用snapgene設計RT-PCR引物及過表達載體1300連接和測序引物(表2)。取多分蘗型新麥草分蘗節,用天根RNA提取試劑盒提取總RNA,微量核酸檢測儀測量RNA濃度,使用天根一步法去除基因組DNA(gDNA)試劑盒,將RNA反轉錄為cDNA。以反轉錄的cDNA為模板,進行RT-PCR擴增。反應結束后,PCR產物進行瓊脂糖凝膠電泳,用天根膠回收試劑盒對目的條帶進行回收;用全式金Blunt基因克隆試劑盒將膠回收產物與克隆載體連接轉化并將菌液涂抹至LB培養基上過夜培養;挑取培養基上的單菌落進行菌落PCR,選取陽性菌液加入到5 mL的1×LB液體培養基(Kan 50 μg?mL-1)中37℃過夜搖菌。用天根質粒小提試劑盒提取質粒測量質粒濃度,并選取濃度較高的質粒送上海生工測序。選擇測序正確的CCD7質粒為模板,將目的片段連接到載體后,送至上海生工測序。
1.2.3 pcambia1300-cYFP-CCD7過表達載體農桿菌轉化 將GV3101農桿菌感受態細胞分裝至1.5 mL離心管中,加入連接產物后混勻,冰上靜置20 min、冰浴1 min、37℃熱激5 min,將離心管取出在超凈臺中加入1 mL的1×LB(1×Luria-Bertani)后放入搖床內30℃ 200 r?min-1復蘇2 h,離心30 min(4000 r?min-1)倒出部分上清液;將離心管內的菌體重懸后涂抹至1×LB固體培養基(Kan、Rif)上30℃培養2 d。挑取菌落至5 mL的1×LB液體培養基(含Kan和Rif)內搖菌(30℃,200 r?min-1)12h,離心10 min(4000 r?min-1),倒去上清液后加入2mL的侵染液(1 mol?L-1 MgCl2 500 μL,1 mol?L-1, MES 500 μL, 200 mmol?L-1乙酰丁香酮50 μL),重懸后調整菌液OD600值(0.5~0.6)。
1.2.4 煙草侵染及亞細胞定位 將調好OD600值的菌液吸入1 mL的注射器中,打入煙草的葉片背面,注射完的煙草在培養室內培養一天后放到尼康A1R共聚焦顯微鏡下觀察載體熒光。
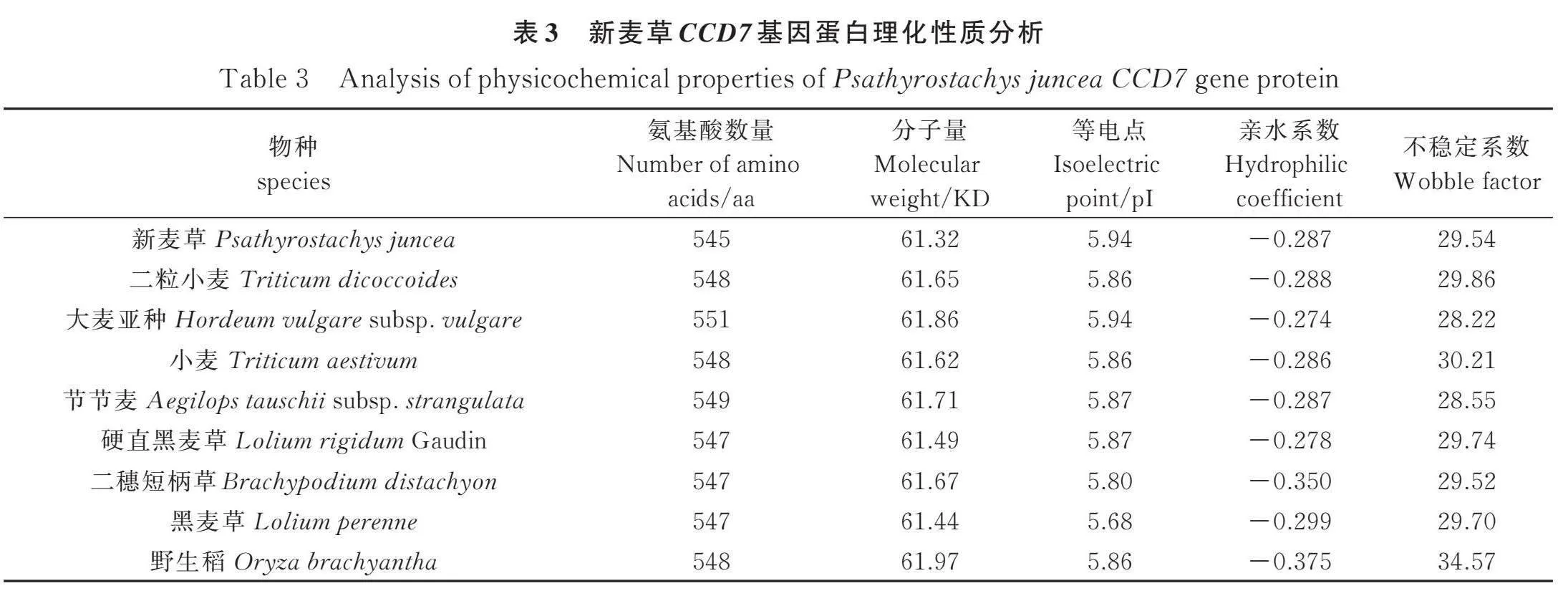
1.2.5 CCD7基因生物信息學分析 以克隆出的CCD7序列為模板,在NCBI上進行同源比對分析及保守結構域預測(https://blast.ncbi.nlm.nih.gov/Blast.cgi),在GSDS上預測新麥草CCD7基因的內含子及外顯子(https://gsds.gao-lab.org/),用DNAMAN對新麥草CCD7基因及其近緣物種多序列比對,利用MEGA11軟件繪制新麥草及其近緣物種CCD7基因的系統發育樹,用ExPASy(https: //web.expasy.org/protparam/)預測新麥草及其近緣物種CCD7基因的等電點(Isoelectric point)、氨基酸數量(Number of amino acids)、分子量(Molecular weight)、親水系數及不穩定系數。
2 結果與分析
2.1 新麥草CCD7基因在不同時期的表達量及轉錄組數據分析
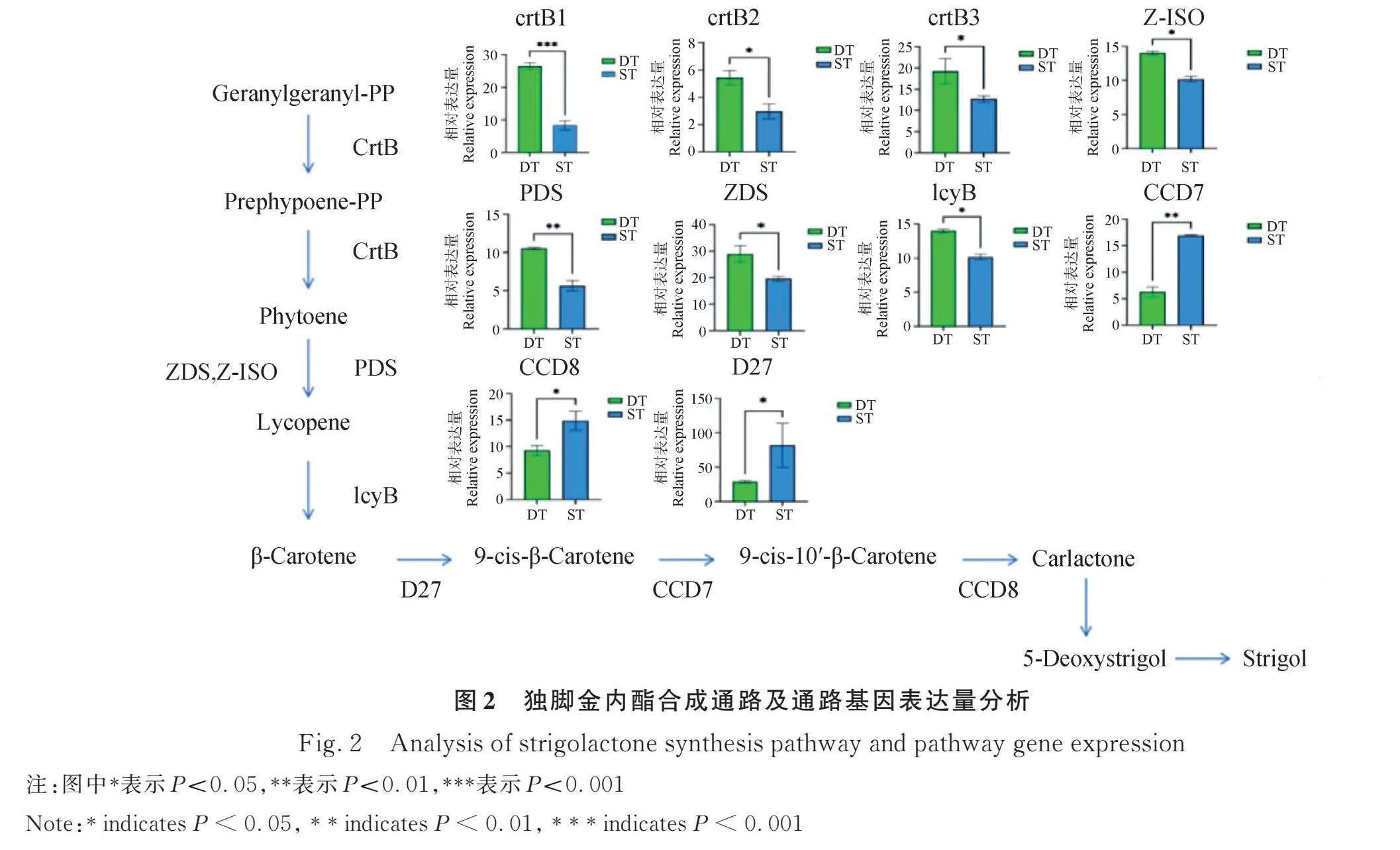
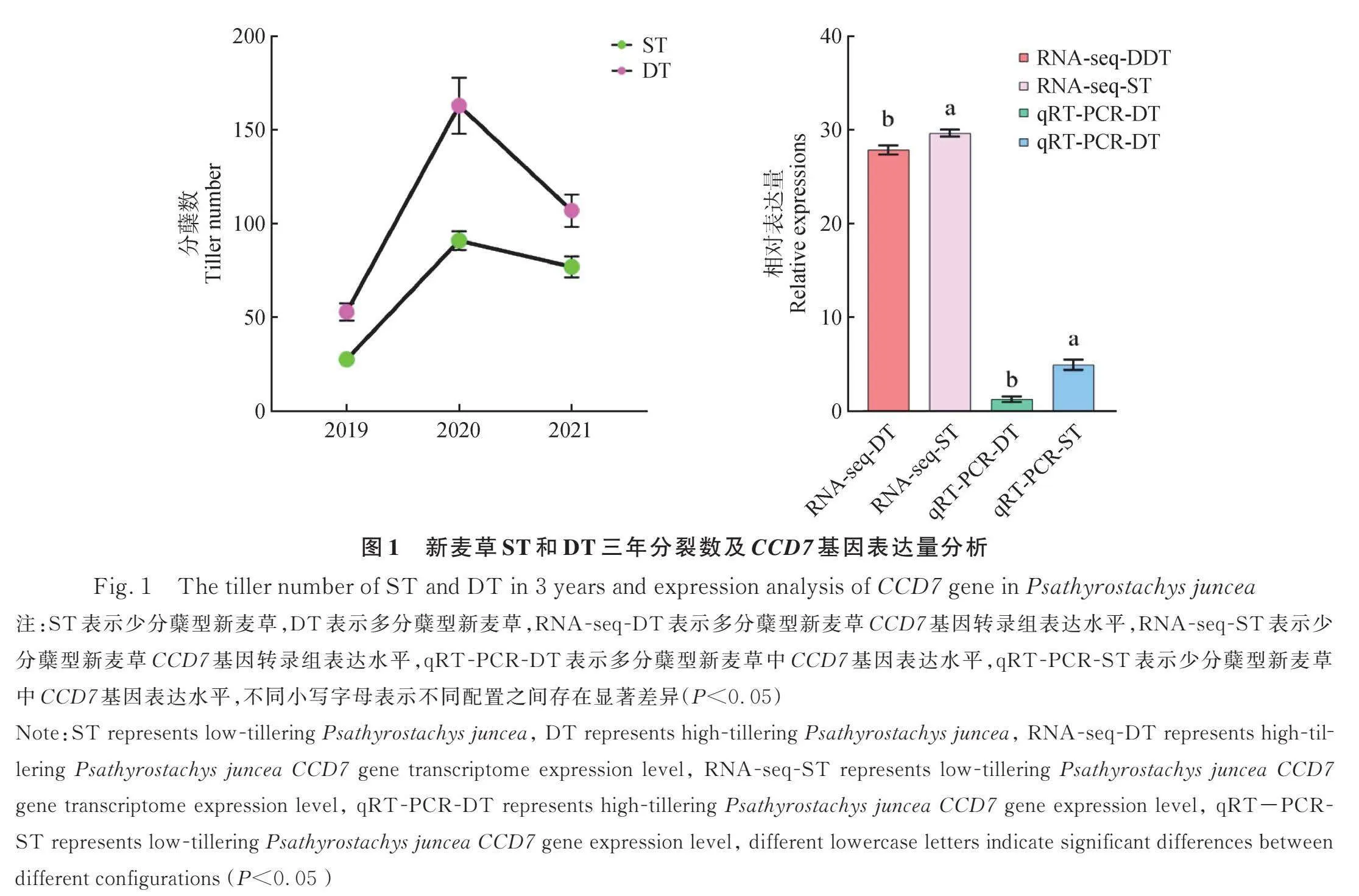
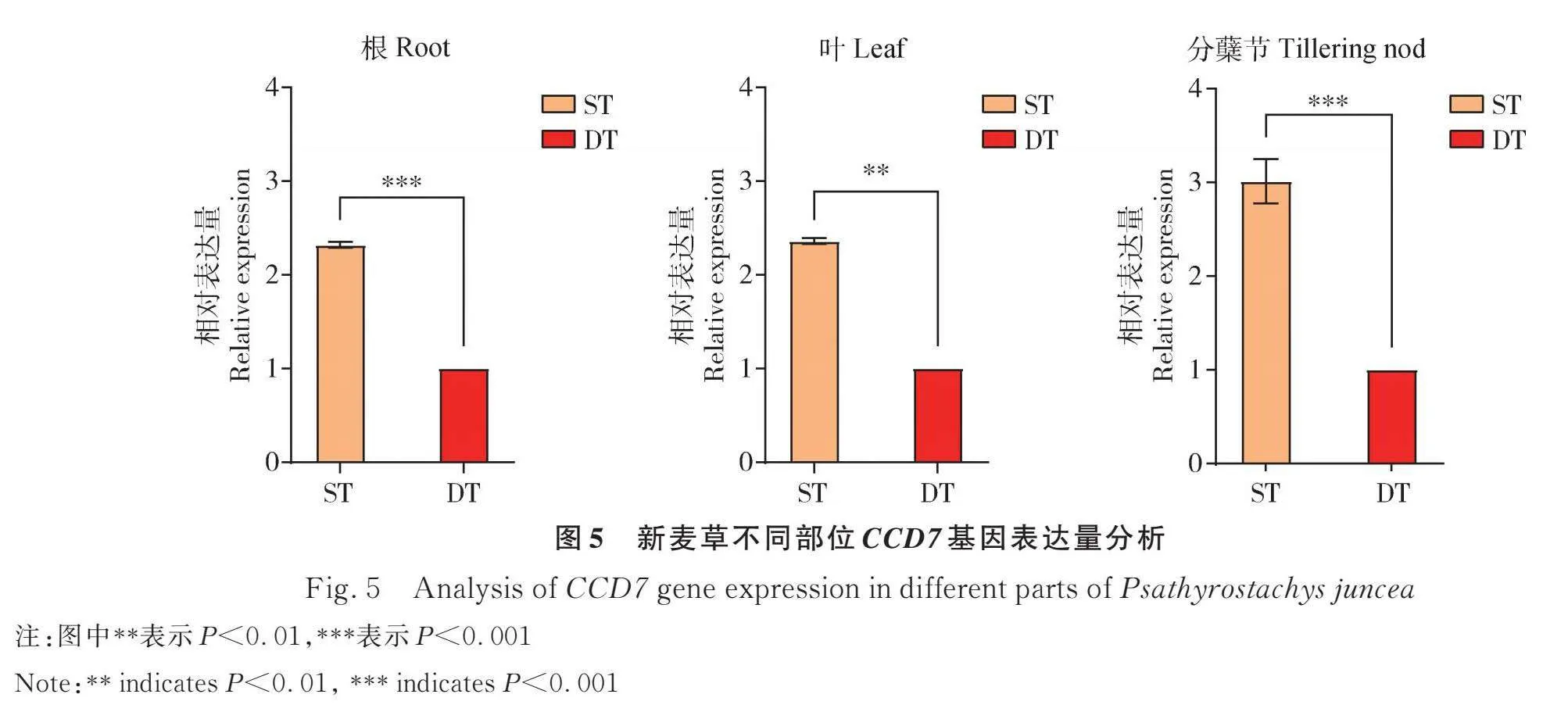
多分蘗型新麥草DT在三年中每年增加的分蘗數均多于少分蘗型新麥草,且兩者之間存在顯著差異(Plt;0.05),RNA-seq分析結果顯示DT中CCD7基因的表達量要顯著低于ST(圖1)。獨腳金內酯和生長素抑制分蘗芽的形成,細胞分裂素促進分蘗芽的形成,因此比較了獨腳金內酯的合成途徑。研究發現(圖2),首先,香葉基香葉基焦磷酸(Geranylgeranyl pyrophosphate)通過15-順式植物烯合成酶(15-cis-Phytoene synthase)的作用轉化為植物烯;然后,植物烯通過15-順式植物烯去飽和酶(15-cis-Phytoene Synthase)、ζ-胡蘿卜素去飽和酶(ζ-carotene desaturase)和ζ-胡蘿卜素異構酶(ζ-carotene isomerase)的作用轉化為番茄紅素,番茄紅素通過番茄紅素β環化酶(Lycopene β-cyclase)的作用轉化為β-胡蘿卜素,最后通過β-胡蘿卜素異構酶(DWARF27)、9-順式-β-胡蘿卜素9′、10′-裂解雙加氧酶(Carotenoid dioxygenase 7)、類胡蘿卜素裂解雙加氧酶8 (Carotenoid dioxygenase 8)等3種酶4步轉化為獨腳金內酯。其中編碼15-順式植物烯合成酶(15-cis-Phytoene Synthase)、ζ-胡蘿卜素去飽和酶(ζ-carotene desaturase)、ζ-胡蘿卜素異構酶(ζ-carotene isomerase)和番茄紅素β -環化酶(lycopene beta-cyclase)的差異表達基因在DT中被上調;編碼β-胡蘿卜素異構酶(DWARF27)、9-順式-β-胡蘿卜素9′、10′-裂解雙加氧酶(CCD7)和類胡蘿卜素裂解雙加氧酶8 (CCD8)的差異表達基因在DT中被下調。
2.2 新麥草CCD7基因序列分析及克隆
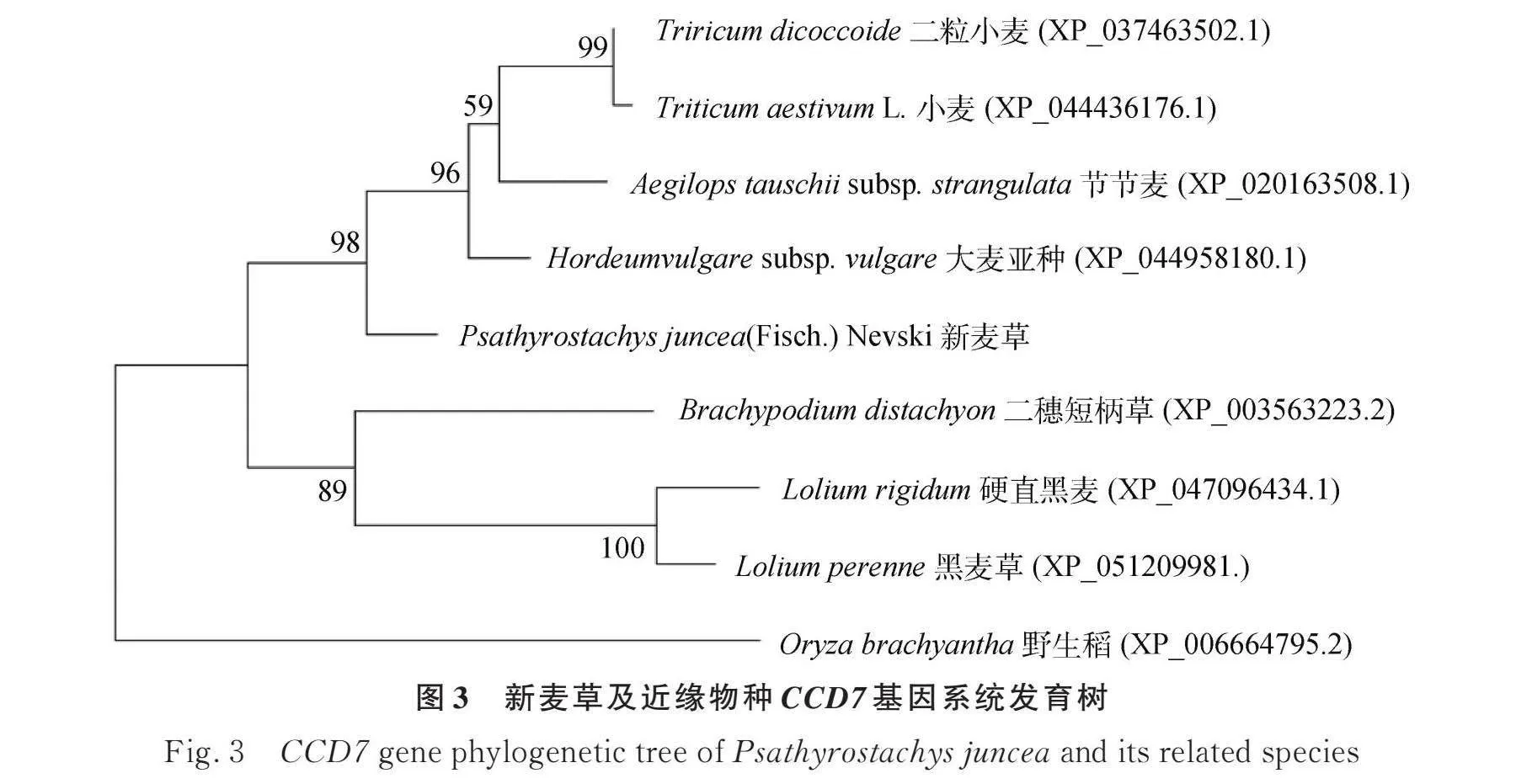
用MEGA11軟件繪制新麥草CCD7基因及其近緣物種的系統發育樹(圖3)。結果顯示CCD基因編碼蛋白分為兩類,野生稻為一類,其余8個物種的CCD7基因編碼的蛋白則為另一類;8個物種的CCD7基因編碼的蛋白可分為兩個亞類,新麥草與大麥亞種、節節麥、小麥和二粒小麥親緣關系最近。新麥草CCD7基因沒有內含子,用NCBI對新麥草CCD7基因的保守結構域進行預測,結果發現新麥草的CCD7基因屬于RPE65超級基因家族。用DNAMAN比對了新麥草及其它8個物種的氨基酸序列,發現雖然他們的保守結構域起始位置不同,但是他們之間的保守結構域均為類胡蘿卜素裂解雙加氧酶結構域(PLN02491)(圖4),這說明在這些近緣物種中的CCD7基因的功能與新麥草中CCD7基因的功能相近。
新麥草CCD7基因表達量分析(圖5)顯示,在新麥草ST植株的根、葉和分蘗節中CCD7基因的表達量顯著高于新麥草DT植株。以DT新麥草的分蘗節為材料提取總RNA后將其反轉錄為cDNA,以cDNA為模板克隆,瓊脂糖凝膠電泳顯示在1000~2000 bp區域成功克隆出了目的片段,經測序新麥草CCD7基因大小為1638 bp,與轉錄組測序結果一致,以測序后的質粒為模板,構建了pcambia1300-cYFP-CCD7過表達載體。
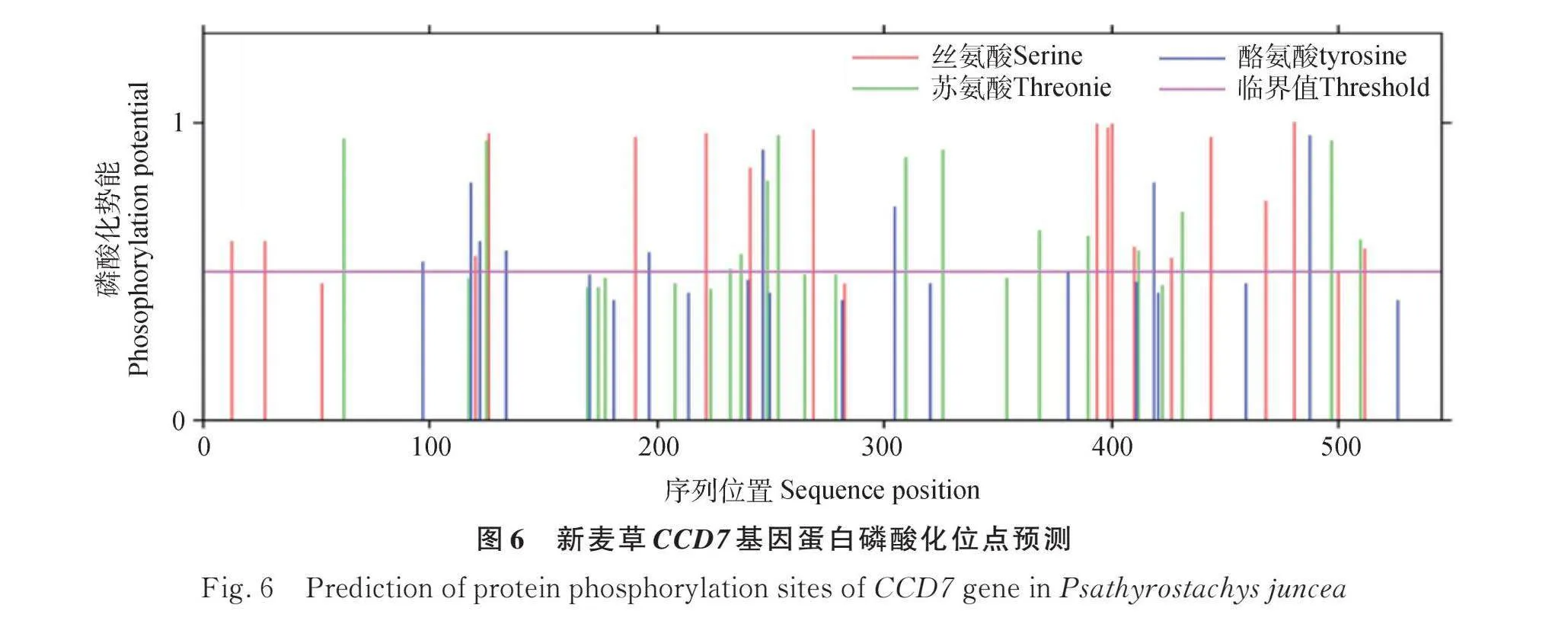
2.3 新麥草CCD7基因編碼蛋白磷酸化位點預測
磷酸化位點分析結果顯示(圖6),CCD7蛋白共有60個磷酸化位點,其中絲氨酸有27個,蘇氨酸有22個,酪氨酸有11個。絲氨酸的磷酸化位點最有可能是潛在的磷酸化位點,它們的值遠遠高于臨界值0.5,表明該蛋白可能通過調控相應的磷酸化位點發揮功能。
2.4 新麥草近緣物種CCD7基因蛋白理化性質分析
9個近緣物種蛋白序列最短的含有545個氨基酸,最長則為551個,蛋白質分子量為61.32~61.97 KD,且均為酸性蛋白。表中各物種的CCD7基因的親水系數均為負數,這表明9個物種的CCD7蛋白均為親水蛋白。新麥草及其近緣物種的CCD7基因蛋白的不穩定系數均小于40,都是不穩定蛋白(表3)。
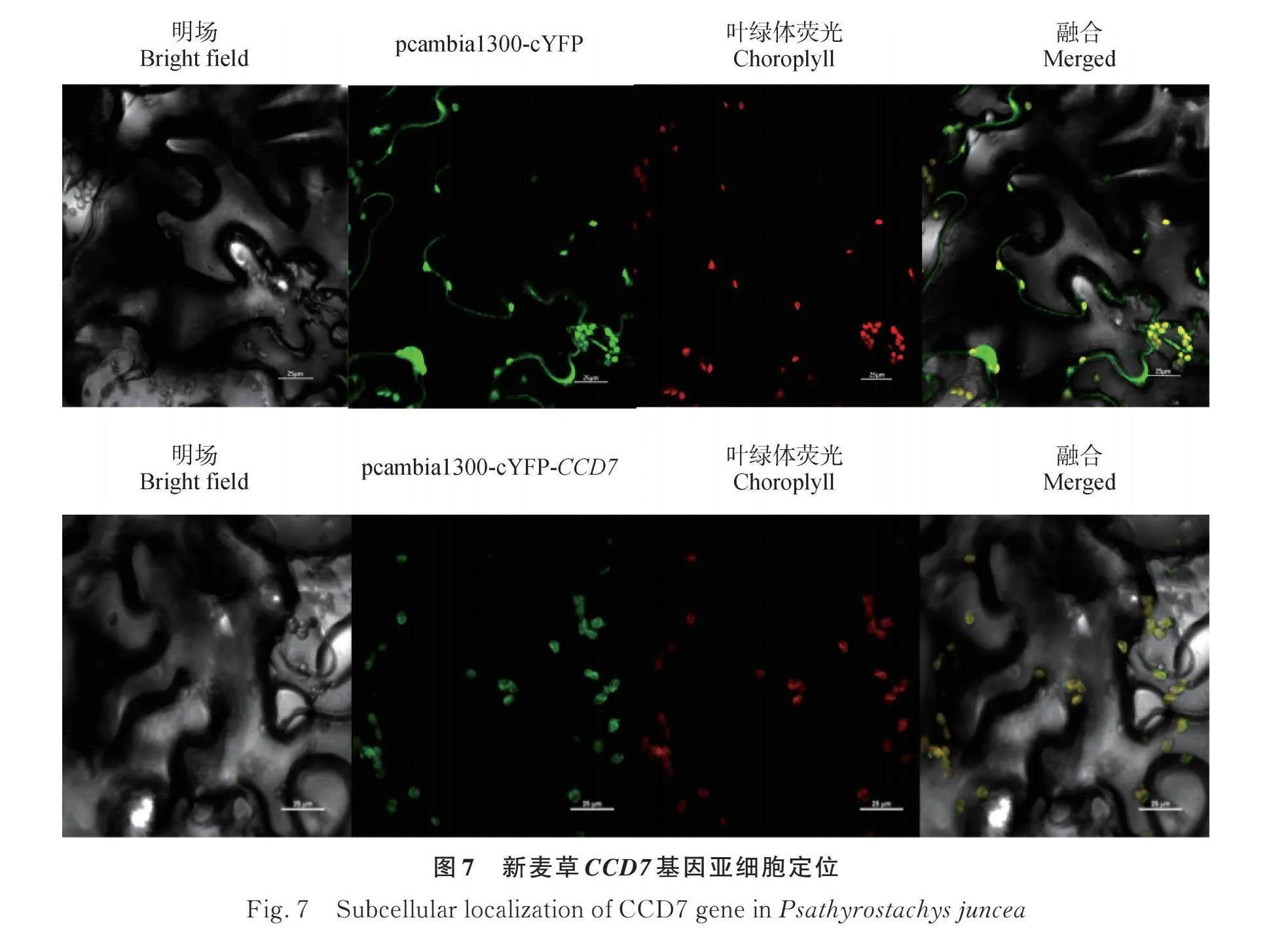
2.5 新麥草pcambia1300-cYFP-CCD7亞細胞定位
將構建成功的pcambia1300-cYFP-CCD7過表達載體和pcambia1300-cYFP空載打入GV3101農桿菌感受態中轉化,用針管將菌液注射進煙草葉片中,用尼康A1R共聚焦顯微鏡觀察新麥草CCD7基因的表達情況,結果顯示pcambia1300-cYFP空載在煙草葉片細胞中可以正常表達,新麥草CCD7基因主要在煙草葉片細胞中葉綠體內表達(圖7)。
3 討論
植物的分蘗是一個非常復雜的過程,受到多種內部因素和外部因素的影響,分蘗芽的生長與營養密切相關。當植物營養充足時,能促進分蘗芽的生長,其中氮能調節分蘗數[14]。
本文用PCR法克隆出了新麥草CCD7基因,并進行同源比對及保守結構域分析,發現新麥草的CCD7基因屬于RPE65超級基因家族,保守結構域為類胡蘿卜素裂解雙加氧酶結構域(PLN02491),這與新麥草的幾個近緣物種CCD7基因的保守結構域相同。在系統進化樹分析中發現,新麥草CCD7基因與許多禾本科牧草及作物親緣關系較近,且在蛋白理化性質上新麥草CCD7基因蛋白理化性質也與其他禾本科植物相近,這表明了他們的基因功能相同。徐慶華等[15] 發現RPE65蛋白和植物中的NCED蛋白都隸屬CCD蛋白家族,因此推測新麥草的CCD7蛋白也屬于CCDs蛋白家族。在一些研究中發現毛楊果、紅皮柳和擬南芥等植物的CCD7基因與新麥草的CCD7基因都具有REP65基因家族的典型特征。但這些基因之間也存在一些差異。CCD7基因的第一個結構域在草本植物中是缺失的,而在木本植物中則存在。這種差異可能意味著該結構域是木本植物特有的[16]。一些研究認為,生長素(IAA)、獨腳金內酯(SLs)和脫落酸(ABA)可抑制分蘗芽的生長發育[17-19],而細胞分裂素(CTK)可促進分蘗芽的生長[20]。CCD7將9-順式-β-胡蘿卜素裂解為9-順式-β-apo-100 -胡蘿卜素,形成內酯,然后由細胞色素P450加氧酶MAX1催化生成獨腳金內酯(SLs)[21- 24]。因此,CCD7通過控制獨腳金內酯的生物合成抑制腋芽的生長并抑制分蘗[6,25]。CCD7作為獨腳金內酯生物合成的關鍵酶,已在擬南芥[20]、豌豆(P. sativum L.)[26]、水稻[24]、矮牽牛[27]等多種植物中被研究,CCD7基因的缺失會導致分枝增加。Vogel等發現,SlCCD7反義番茄(Solanum lycopersicum L.)品系由于SLs水平降低而表現出分枝大量增加的情況[23]。Wang等發現,編碼CCD7的HTD1部分功能缺失等位基因(HTD1HZ)可以增加水稻分蘗數和提高種子產量[28]。孫倩發現通過CRISPR/cas9基因編輯獲得的番茄CCD7突變體具有側枝增加和植株矮化的表型[29]。Galili等人也發現了CCD7M14編碼蛋白,導致鷹嘴豆出現典型的獨腳金內酯缺陷表型,分支增加,株高降低[30]。以上研究均表明了CCD7基因通過影響獨腳金內酯的合成來影響植株分蘗性狀。
在有機體中,磷酸化是蛋白翻譯后修飾中最廣泛的共價形式,同時也是原核生物和真核生物中最重要的調控修飾形式。新麥草的CCD7基因磷酸化的修飾位點主要是絲氨酸磷酸化位點。Agrawal等[31]對油菜花的磷酸化蛋白質進行了大規模的定量分析發現了已鑒定的磷酸化蛋白中有44%以上的酶參與了各種代謝途徑。這說明了CCD7蛋白磷酸化可能對獨腳金內酯的形成起到調控作用,從而影響新麥草的分蘗性狀。RNA-seq結果顯示,多分蘗型新麥草中CCD7基因的表達量要顯著少于少分蘗型新麥草,這與后續的qPCR結果一致。
亞細胞定位可以直觀地反映基因位于細胞的表達位置,這與其生物學功能具有很強的相關性,研究新麥草的CCD7基因的亞細胞定位為后續CCD7基因功能的深入研究提供很大的幫助。本研究在煙草瞬時轉染的葉片中觀察到CCD7基因主要在葉綠體中表達,這與一些在線網站的預測結果一致,也與前人研究植物CCD7基因并將其定位于葉綠體中的預測一致[32-33]。本研究CCD7是調控獨腳金內酯合成通路下游的關鍵基因,即通過9-順式- β-胡蘿卜素-9′、10′-裂解雙加氧酶催化β-胡蘿卜素轉化為獨腳金內酯前體物質,而β-胡蘿卜素一般存在于葉綠體的類囊體薄膜上,故推測獨腳金內酯的合成部位與葉綠體有關。
4 結論
前人報道類胡蘿卜素裂解雙加氧酶基因CCD參與獨腳金內酯合成并可能調控植物分枝。本研究成功克隆出了新麥草CCD7基因,基因大小為1638 bp。表達量分析表明新麥草的分蘗數量與該基因的表達量呈現負相關關系。亞細胞定位觀察到新麥草CCD7基因在煙草葉片細胞中葉綠體內表達。預測新麥草CCD7保守結構域的范圍是第13到第544個氨基酸,該基因在9個近緣物種中功能保守,編碼蛋白性質相近。該基因的克隆為后續研究CCD7基因調控新麥草分蘗的機理及新麥草分蘗性狀的改良奠定理論基礎。
參 考 文 獻
[1] AHRAZEM O,RUBIO-MORAGA A,BERMAN J,et al. The carotenoid cleavage dioxygenase CCD2 catalysing the synthesis of crocetin in spring crocuses and saffron is a plastidial enzyme[J]. New Phytol,209(2):650-663
[2] 劉玉成,張超,董彬,等. 高等植物CCD亞家族基因研究進展[J]. 農業生物技術學報,2019,27(4): 720-734
[3] LEYSER O. Strigolactones and shoot branching:A new trick for a young dog [J]. Developmental Cell,2008,15(3):337-338
[4] BEVERIDGE C A,KYOZUKA J. New genes in the strigolactone-related shoot branching pathway[J]. Current Opinion in Plant Biology,2010,13(1):34-39
[5] GOULET C,KLEE H J. Climbing the branches of the strigolactones pathway one discovery at a time[J]. Plant Physiology,2010,154(2):493-496
[6] BOOKER J ,AULDRIDGE M ,WILLS S,et al. MAX3/CCD7 is a carotenoid cleavage dioxygenase required for the synthesis of a novel plant signaling molecule [J]. Current Biology,2004,14(14):1232-1238
[7] ZOU J H,ZHANG S Y,ZHANG W P,et al. The rice HIGH-TILLERING DWARF1 encoding an ortholog of Arabidopsis MAX3 is required for negative regulation of the outgrowth of axillary buds[J]. The Plant Journal,2006,48(5):687-698
[8] ARITE T,IWATA H,OHSHIMA K,et al. DWARF10,an RMS1/MAX4/DAD1 ortholog, controls lateral bud outgrowth in rice[J]. The Plant Journal,2007,51(6):1019-1029
[9] AL-BABILI S,BOUWMEESTER H J. Strigolactones,a novel carotenoid-derived plant hormone[J]. Annual Review of Plant Biology,2015,66(1):161-186
[10] WATERS M T,GUTJAHR C,BENNETT T,et al. Strigolactone signaling and evolution[J]. Annual Review of Plant Biology,2017,68(1):291-322
[11] 張晨,云嵐,李珍,等. 新麥草種質的SSR遺傳多樣性及群體結構分析[J]. 植物遺傳資源學報,2019,20(1):48-59
[12] WEI J Z,CAMPBELL W F,SCOLES G J,et al. Cytological identification of some trisomics of Russian wildrye (Psathyrostachys juncea)[J]. Genome,1995,38(6):1271-1278
[13] LI Z,YUN L,REN X M,et al. Analysis of controlling genes for tiller growth of Psathyrostachys juncea based on transcriptome sequencing technology[J]. BMC Plant Biology,2022,22(1):456
[14] BAUER B,VON WIRéN N. Modulating tiller formation in cereal crops by the signalling function of fertilizer nitrogen forms[J]. Scientific Reports,2020,10(1):20504
[15] 徐慶華,胡寶忠. 黃瓜CsCCD7基因的核酸和蛋白質序列分析[J]. 中國農學通報,2011,27(8):172-180
[16] 金娜. 沙柳SpsCCD7和SpsCCD8基因克隆及組織特異性表達分析[D]. 呼和浩特:內蒙古農業大學,2021:4-6
[17] CHOI M S,KOH E B,WOO M O,et al. Tiller formation in rice is altered by overexpression of OsIAGLU gene encoding an IAA-conjugating enzyme or exogenous treatment of free IAA[J]. Journal of Plant Biology,2012,55(6):429-435
[18] 蔡鐵,徐海成,尹燕枰,等. 外源IAA、GA3和ABA影響不同穗型小麥分蘗發生的機制[J]. 作物學報,2013,39(10):1835-1842
[19] WANG H W,CHEN W X,EGGERT K,et al. Abscisic acid influences tillering by modulation of strigolactones in barley[J]. Journal of Experimental Botany,2018,69(16):3883-3898
[20] RAMEAU C,BERTHELOOT J,LEDUC N,et al. Multiple pathways regulate shoot branching[J]. Frontiers in Plant Science,2015,5:741
[21] BOOKER J,SIEBERER T,WRIGHT W,et al. MAX1 encodes a cytochrome P450 family member that acts downstream of MAX3/4 to produce a carotenoid-derived branch-inhibiting hormone[J]. Developmental Cell,2005,8(3):443-449
[22] ALDER A,JAMIL M,MARZORATI M,et al. The path from β-carotene to carlactone, a strigolactone-like plant hormone[J]. Science,2012,335 (6074):1348-1351
[23] VOGEL J T,WALTER M H,GIAVALISCO P,et al. SlCCD7 controls strigolactone biosynthesis, shoot branching and mycorrhiza-induced apocarotenoid formation in tomato[J]. The Plant Journal,2010,61(2):300-311
[24] BRUNO M,HOFMANN M,VERMATHEN M,et al. On the substrate- and stereospecificity of the plant carotenoid cleavage dioxygenase 7[J]. FEBS Letters,2014,588(9):1802-1807
[25] PAN X Y,ZHENG H Y,ZHAO J Y,et al. ZmCCD7/ZpCCD7 encodes a carotenoid cleavage dioxygenase mediating shoot branching[J]. Planta,2016,243(6):1407-1418
[26] JOHNSON X,BRCICH T,DUN E A,et al. Branching genes are conserved across species. Genes controlling a novel signal in pea are coregulated by other long-distance signals[J]. Plant Physiology,2006,142(3):1014-1026
[27] DRUMMOND R S M,MARTíNEZ-SáNCHEZ N M,JANSSEN B J,et al. Petunia hybrida CAROTENOID CLEAVAGE DIOXYGENASE7 is involved in the production of negative and positive branching signals in Petunia[J]. Plant Physiology,2009,151(4):1867-1877
[28] WANG Y X,SHANG L G,YU H,et al. A strigolactone biosynthesis gene contributed to the green revolution in rice[J]. Molecular Plant,2020,13 (6):923-932
[29] 孫倩. 獨腳金內酯調控番茄側枝生長的功能研究[D]. 杭州:浙江大學,2020:33-34
[30] GALILI S,HERSHENHORN J,SMIRNOV E,et al. Characterization of a chickpea mutant resistant to Phelipanche aegyptiaca pers. and Orobanche crenata forsk[J]. Plants,2021,10(12):2552
[31] AGRAWAL G K,THELEN J J. Large scale identification and quantitative profiling of phosphoproteins expressed during seed filling in oilseed rape[J]. Molecular and Cellular Proteomics,2006,5(11):2044-2059
[32] 劉淑蘭,李進,馬永慧,等. 獨腳金內酯對干旱脅迫下黑果枸杞種子萌發和幼苗生理變化的影響[J]. 草地學報,2023,31(1):130-139
[33] 檀鵬輝,李俊,陳小云,等. 草地早熟禾PpGA2ox基因的克隆、亞細胞定位及表達分析[J]. 中國草地學報,2017,39(3):8-14,30
(責任編輯" 閔芝智)

