燕麥AsDof6.5基因的克隆及其在低氮脅迫下的表達分析



摘要:為篩選與燕麥(Avena sativa L.)耐低氮相關的Dof類基因,本研究以燕麥耐低氮品種‘加燕2號’和不耐低氮品種‘青永久016’為試驗材料,在低氮脅迫下進行轉錄組測序獲得一個與耐低氮相關的差異表達基因AsDof6.5。通過PCR擴增獲得AsDof6.5基因編碼區無內含子、開放閱讀框含有858 bp和編碼285個氨基酸,理論等電點為8.63和蛋白分子量為29 550.01 Da,并獲得AsDof6.5基因啟動子區域序列2227 bp。啟動子分析預測表明,該區段包含脫落酸、茉莉酸以及防御應激反應等與逆境脅迫相關的多個順式作用元件。蛋白質序列分析表明,AsDof6.5具有高度保守的zf-Dof結構域,屬于AsDof基因家族成員。系統進化樹及同源比對表明,燕麥AsDof6.5蛋白與黑麥草(Lolium rigidum L.)和多年生黑麥草(Lolium perenne L.)同源蛋白親緣關系最近,且與其他禾本科植物Dof蛋白同源比較一致性為73.99%,但zf-Dof結構域一致性高達99.50%,具有高度保守性,說明可能具有類似的功能。亞細胞定位結果顯示AsDof6.5蛋白定位在細胞核和細胞膜中。熒光定量PCR(RT-qPCR)結果表明,低氮脅迫下AsDof6.5基因的表達量極顯著下降(Plt;0.01),且根中幾乎不表達,葉中的表達量是根中的100倍左右。因此推測,在燕麥耐低氮過程中,AsDof6.5基因可能在細胞核和細胞膜中發揮重要作用,為探索AsDof6.5基因的功能及調控機制奠定基礎。
關鍵詞:燕麥;低氮脅迫;AsDof6.5;基因表達
中圖分類號:S544.9" " " " 文獻標識碼:A" " " " 文章編號:1007-0435(2025)02-0360-10
Isolation and Expression of AsDof6.5 Gene in Oat under Low Nitrogen Stress
WANG Yue1,2, GUO jing1,2, ZHANG Yin-cui1,2, LI Jing1,2, QI Cun-ying1,2, ZHOU Tong-yong1,2*
(1.School of Ecology and Environmental Science, Qinghai Institution of Technology, Xining, Qinghai Province 810016, China;
2.Qinghai Provincial Key Laboratory of Plateau Climate Change and Corresponding Ecological and Environmental Effects, Xining, Qinghai
Province 810016, China)
Abstract:In order to explore Dof genes related to low nitrogen stress in oat, we obtained a differentially expressed AsDof6.5 gene from strong tolerance to the low N stress variety ‘Jiayan 2’ and poor tolerance to the low N stress variety ‘Qingyongjiu 016’ through the transcriptional sequencing in low nitrogen stress. Promoters and coding regions of AsDof6.5 gene were amplified using sequencing PCR. Bioinformatics analysis showed that the length of the AsDof6.5 gene contained an 858 bp open reading frame, encoded 285 amino acids, had a theoretical isoelectric point of 8.63 and a predicted molecular weight of 29 550.01 Da. The results showed that the AsDof6.5 promoter region contained cis-acting elements which were related to adversity stress, such as abscisic acid, jasmonic acid, and defense against stress response. Protein sequence alignment showed that AsDof6.5 was highly conserved structural domains of zf-Dof, belonging to Dof gene family. Phylogenetic tree and protein sequence alignment analysis showed that the AsDof6.5 protein was relatively the closest to LrDof4 and LpDof4, and the homology comparison concordance with other Poaceae Dof proteins was 73.99%, but the concordance of the zf-Dof structural domain was as high as 99.50%, suggesting that it might have a similar function. Subcellular localization results showed that AsDof6.5 was localized in the nucleus and cell membrane. Quantitative PCR results showed that the expression of AsDof6.5 gene significantly decreased (Plt;0.01) under low-nitrogen stress in strong tolerance to the low N stress variety ‘Jiayan 2’ and poor tolerance to the low N stress variety ‘Qingyongjiu 016’, it was almost not expressed in roots, and the expression in leaves was about 100 times higher than that in roots. Therefore, it hypothesized that AsDof6.5 gene might play an important role in the cell nucleus and cell membrane during the process of low nitrogen tolerance in oats, which laid a foundation for exploring the function and regulatory mechanism of AsDof6.5 gene.
Key words:Oat;Low nitrogen stress;AsDof6.5;Gene expression
燕麥(Avena sativa L.)屬禾本科燕麥屬,具有二倍體,四倍體和六倍體體質,是一種在生態條件脆弱的地區不可替代的糧飼兼用型作物,具有耐貧瘠、耐鹽堿、耐旱、耐寒等特點[1-3]。燕麥是一種生長迅速,可口、多汁、有營養的冬季飼料作物,含有豐富的蛋白質、碳水化合物和微量元素,能增強牛羊體質和品質[4-5]。燕麥也被用作藥用植物,可以增強身體免疫力,穩定糖尿病時的血糖水平,在心臟病方面也顯示出治療效果,具有抗癌活性[6-7]。
氮是植物三大營養元素中最重要的大量元素之一,對植物的生長發育至關重要,直接影響作物的產量和品質 [8-10]。為提高農作物產量,我國化肥施用量增長迅速,是世界使用氮肥最多的國家,占全球氮肥用量30%左右,遠遠超于世界平均水平[10-11]。然而,過度施用氮肥也會造成糧食產量增長緩慢、易倒伏和出現中毒現象,不僅影響農業可持續發展,而且也引發了過量氮污染引起的水生態環境安全問題[12-13]。目前,中國氮肥利用效率平均是25%~35 %,在中國發達和不發達的城市之間氮肥利用效率的差距達到70 %左右,且與世界其他主要地區氮肥利用效率52%~67 %仍然存在很大的差距[14]。為了滿足氮肥需求并最大限度地減少環境問題,需要在生產過程中提高氮肥的利用效率[15]。因此,減少化肥使用量,提高作物生產效率,優先保護生態環境,促進高質量發展,創造高品質生活,在作物種植區發展生態農業具有重要意義。
Dof基因是植物特異性轉錄因子,廣泛響應生物和非生物脅迫,對植物的生長發育起重要調控作用。其中,第一個被鑒定出來的Dof轉錄因子是來自玉米(Zea mays L.)的ZmDof1,參與光調節過程[16]。研究表明,耐低氮相關基因的挖掘及功能分析報道較多[8, 17-19]。Huang等人[17]在水稻(Oryza sativa L.)中發現OsDof11基因促進幼苗植株和有效葉片對氮素的吸收,并在開花期保持了植株的鮮干比。OsDof11基因通過糖的分配影響氮素代謝,為水稻協同碳、氮平衡維持生長發育提供了新的思路。低氮脅迫下,與野生型擬南芥(Arabidopsis thaliana)相比,過表達dof1植株長勢較好,未出現缺氮表型[18],且和 GS 蛋白的結合可能會改善低氮條件下氮營養的吸收和利用[8]。郝青南等人通過對大豆[Glycine max (L.) Merr.]耐低氮品種‘坡黃’和不耐低氮品種‘84-70’進行RNA-Seq分析,從中篩選出兩個大豆耐低氮相關候選基因Gmduf-cbs和Gmdof1.4;將這兩個基因分別轉化擬南芥后發現轉基因擬南芥在低氮水平的條件下有更高效的氮利用率[19]。然而,目前關于燕麥在低氮脅迫下的分子機制研究仍相對匱乏。
本研究通過分析耐低氮與不耐低氮燕麥品種在不同氮處理下根和葉的轉錄組測序結果,系統鑒定與燕麥耐低氮相關的差異mRNAs,獲得差異表達的AsDof類基因。利用PCR技術在耐低氮品種‘加燕2號’中克隆了AsDof6.5基因,并采用生物信息學分析軟件預測其序列的結構、生理生化特性;同時分析AsDof6.5蛋白與其他禾本科植物蛋白的同源比對及系統進化關系等。為進一步研究AsDof6.5基因的功能,對其進行啟動子分析、亞細胞定位和該基因在不同氮水平下的表達模式分析。研究結果將有助于解析耐低氮AsDof6.5基因在燕麥氮脅迫時的調控作用,為探討燕麥耐低氮分子育種提供理論依據。
1 材料與方法
1.1 試驗材料
耐低氮品種‘加燕2號’和不耐低氮品種‘青永久016’[20],均由青海大學畜牧獸醫科學院劉文輝課題組提供。
1.2 燕麥不同氮處理下DNA提取、總RNA的提取及cDNA合成
利用TaKaRa公司植物DNA和RNA提取試劑盒分別提取不同氮處理下‘加燕2號’和‘青永久016’葉和根中的DNA及RNA,同時參考姚曉華等[21]文中測定青稞DNA及RNA濃度和純度的方法,將提取完整的RNA合成cDNA,用于克隆AsDof6.5基因CDS區,并調整cDNA濃度均為500 ng?μL-1作為燕麥在不同氮處理下表達模式分析的模板。
1.3 燕麥耐低氮相關AsDof6.5基因CDS區及啟動子區的克隆
利用Primer 5.0軟件設計AsDof6.5基因CDS區及其啟動子區的擴增引物分別為AsDof6.5-F/R和Promoter-AsDof6.5-F/R(詳見表1),以耐低氮品種‘加燕2號’葉片總RNA反轉錄獲得的cDNA為模板進行PCR擴增(諾唯贊高保真酶P515-01)。PCR擴增體系150 μL,其中2×Phanta Max Master Mix緩沖液75 μL,AsDof6.5-F/R各6 μL(10 μmol?L-1)、PCR Enhancer(諾唯贊P021-01)15 μL,cDNA模板6 μL,ddH2O補足至150 μL平均分裝到12聯排管中用于后續試驗做梯度PCR。PCR反應條件:98℃ 5 min,(98℃ 15 s, 50℃~62℃ 30 s, 72℃ 1 min)35個循環,72℃ 5 min。目的片段切膠回收、載體構建參考姚曉華等[21]文中方法,并進行菌落PCR驗證,選取陽性克隆測序,其中菌落PCR擴增體系(諾唯贊P112-01):2×Taq Master Mix 10 μL,AsDof6.5-F/R,挑取單菌落,加ddH2O至20 μL;菌落PCR擴增反應條件:95℃ 5 min,(95℃ 30 s,56℃ 30 s,72℃ 1 min)35個循環,72℃ 5 min。AsDof6.5基因啟動子區域PCR擴增過程參考CDS區擴增,擴增引物Promoter-AsDof6.5-F/R詳見表1。
1.4 燕麥耐低氮相關AsDof6.5基因的生物信息學分析
利用在線軟件ExPASY,NetPhos,SignalP和TMHMM預測AsDof6.5蛋白質的理化性質、磷酸化位點、蛋白信號肽結構和蛋白跨膜結構;利用PSIPRED (http://bioinf.cs.ucl.ac.uk/psipred/amp;uuid=49527a56-bbfc-11ed-acea-00163e100d53)軟件分析AsDof6.5蛋白質的二級結構;采用ESMFold對AsDof6.5進行蛋白建模,PyMOL 3.0軟件對蛋白建模結果進行分析。AsDof6.5基因的蛋白序列在NCBI中Blastp查詢與AsDof6.5蛋白同源的其他物種蛋白序列,用DNAMAN6.0進行多序列比對,MEGA 7構建進化樹。利用NCBI Batch CD-search(https://www.ncbi.nlm.nih.gov/Structure/bwrpsb/bwrpsb.cgi)分析測序成功的燕麥AsDof6.5蛋白的結構域。用MEGA 7構建燕麥AsDofs和水稻OsDofs蛋白家族的系統進化樹,確定AsDof6.5蛋白與水稻同源蛋白為OsDof4。通過在線軟件STRING 9.0(http://string.embl.de/)進行OsDof4蛋白互作網絡分析并預測與AsDof6.5蛋白互作的蛋白。PCR擴增獲得的AsDof6.5基因啟動子區域分析參考吳瑞等人[22]文中方法。
1.5 燕麥耐低氮相關AsDof6.5基因表達模式分析
1.5.1 燕麥耐低氮相關AsDof6.5亞細胞定位載體構建 AsDof6.5基因亞細胞定位載體構建采用Gateway技術[23-24],設計帶有attB位點的PCR引物attBAsDof6.5-F/R(詳見表1)進行目的片段PCR擴增、切膠回收、酶切-連接反應,重組質粒轉化,菌落PCR檢測,質粒抽提等一些列過程,最后通過BP和LR反應完成AsDof6.5基因亞細胞定位載體構建[24]。并參考吳瑞等[22]文中方法將構建好的載體轉入農桿菌并制備重懸液,利用1 mL去針頭的醫用注射器將制備好的重懸液注射本氏煙草葉片底部,并把注射本氏煙草的范圍用記號筆圈出來做好標記,放置黑暗條件,25℃左右處理2~3 d,在青海大學國家重點實驗室中利用尼康(NIKON)激光共聚焦顯微鏡觀察拍照。
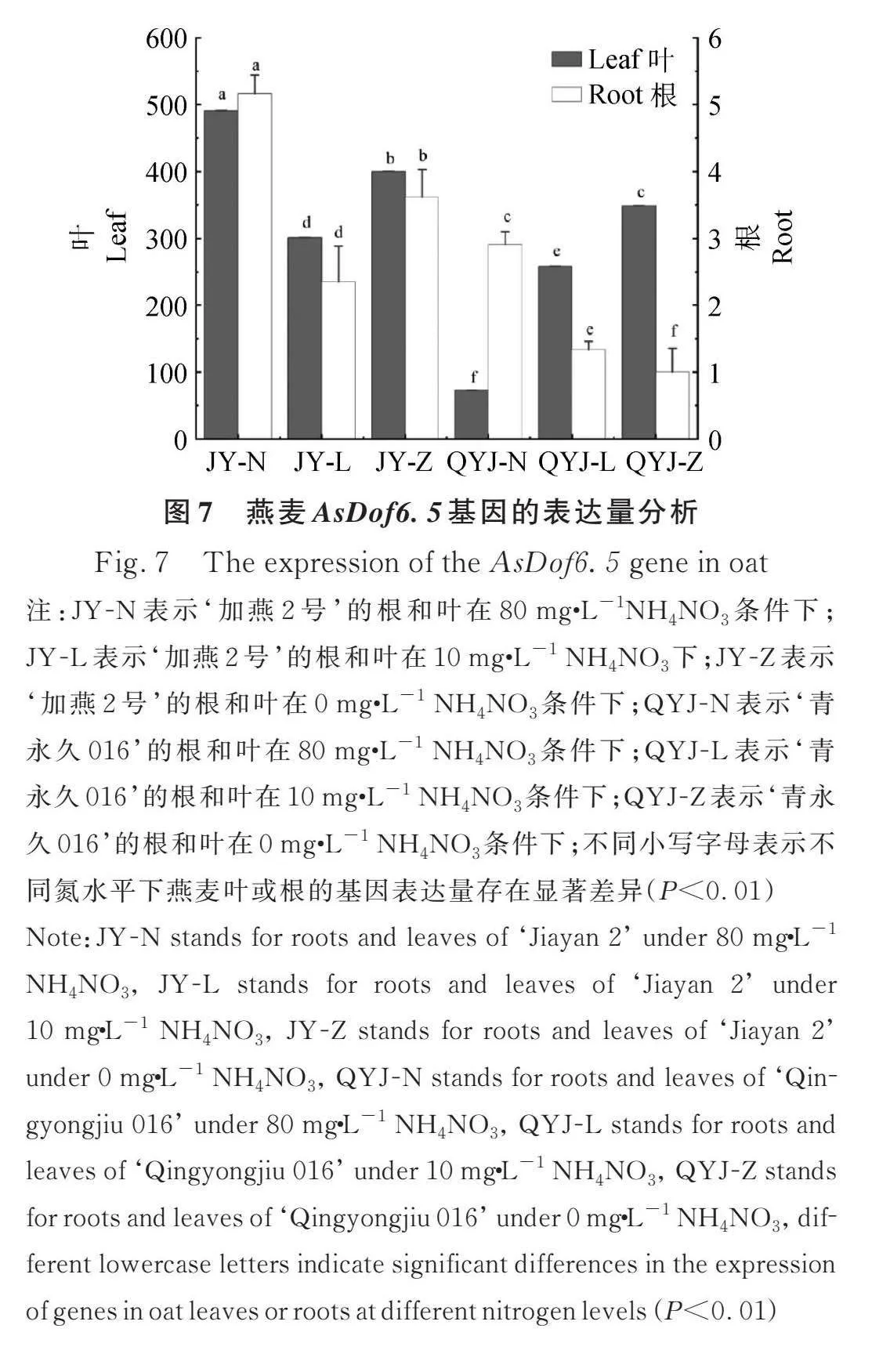
1.5.2 燕麥耐低氮相關AsDof6.5基因表達量檢測 利用水培方法,取適量大小一致的耐低氮品種‘加燕2號’和不耐低氮品種‘青永久016’燕麥種子,氮處理濃度采用正常氮80 mg·L-1 NH4NO3(硝酸銨)、低氮10 mg·L-1 NH4NO3和無氮0 mg·L-1 NH4NO3,其中燕麥長至三葉期時進行低氮和無氮脅迫處理,15 d后采樣。根據擴增獲得的燕麥耐低氮相關AsDof6.5基因序列,利用在線軟件genscript(https://www.genscript.com/tools/real-time-pcr-taqman-primer-design-tool)設計AsDof6.5基因定量引物qPCR-AsDof6.5-F/R(詳見表1)。以AsActin-F/R為內參基因(引物序列詳見表1),利用TB Green? Premix Ex Taq?(TaKaRa公司)試劑進行RT-qPCR驗證。實驗結果應用2–ΔΔCt法計算AsDof6.5基因在不同氮處理下的相對表達量[25],利用SPSS軟件進行顯著性檢測。
2 結果與分析
2.1 燕麥AsDof6.5基因的克隆與序列分析
以燕麥耐低氮品種‘加燕2號’葉片總RNA反轉錄的cDNA為模板,以AsDof6.5-F/R為引物(詳見表1), 擴增獲得一條約900 bp的CDS目的條帶。測序結果拼接完成后,AsDof6.5基因的核苷酸序列與燕麥參考基因組核苷酸序列長度相同均為858 bp,其中有8個堿基不同,一致性99.07%;AsDof6.5蛋白序列與燕麥參考基因組蛋白序列長度相同為285個氨基酸,其中有4個氨基酸不同,一致性98.6%。利用NCBI Batch CD-search在線工具對285個氨基酸序列進行保守結構域預測,發現該基因具有典型的zf-Dof結構域(氨基酸位置47~97),屬于Dof轉錄因子家族。
2.2 燕麥AsDof6.5蛋白理化性質分析及結構預測
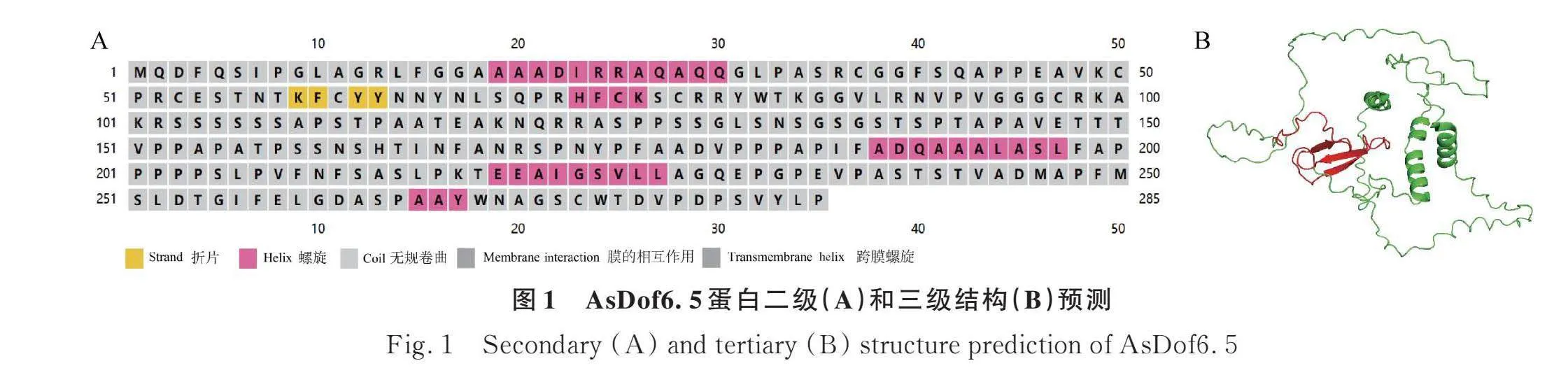
燕麥AsDof6.5蛋白理化性質分析表明,該基因編碼285個氨基酸、蛋白分子量為29 550.01 Da、總原子數為4078、蛋白分子式為C1298H1999N365O405S11、親水系數為-0.327、理論等電點為8.63、不穩定指數為72.04(不穩定蛋白)、脂溶性指數為56.00。信號肽及跨膜預測分析發現,AsDof6.5蛋白都不具有信號肽結構且不具有跨膜結構。通過對AsDof蛋白的二級結構預測,結果表明該蛋白二級結構包含α螺旋、擴展長鏈、β-轉角和無規則卷曲四種結構,分別含有49,36,18,182個氨基酸殘基(圖1A)。對AsDof6.5蛋白進行建模發現該蛋白的zf-Dof結構域主要由無規則卷曲和β-折疊構成(圖1B)。可見該基因及其結構域是以無規則卷曲為主,在蛋白行使功能時可能發揮重要作用。
2.3 燕麥AsDof6.5與其他禾本科植物Dof蛋白同源比較及系統進化分析
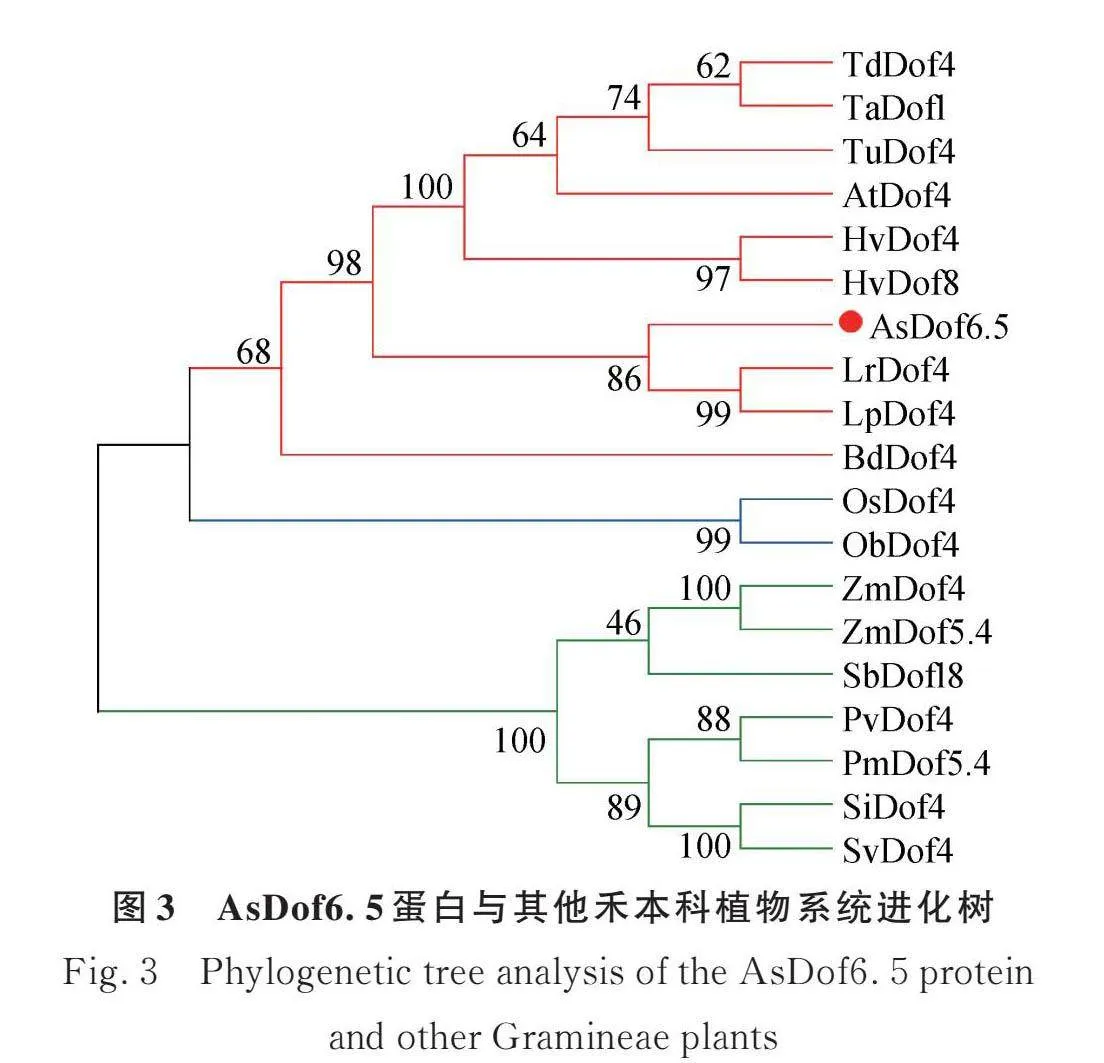
燕麥AsDof6.5與黑麥草(Lolium rigidum)、節節麥(Aegilops tauschii)、大麥(Hordeum vulgare)、二粒小麥(Triticum dicoccoides)、小麥(Triticum aestivum)、烏拉爾圖小麥(Triticum urartu)、短花藥野生稻(Oryza brachyantha)、柳枝稷(Panicum virgatum)、多年生黑麥草(Lolium perenne)、水稻(日本晴,Oryza sativa),黍(Panicum miliaceum)、粟(Setaria italica)、玉米(Zea mays)、狗尾草(Setaria viridis)、高粱(Sorghum bicolor)和二穗短柄草(Brachypodium distachyon)的Dof蛋白序列相似性為73.99%,這些序列都具有高度保守的zf-Dof結構域(圖2)。系統進化樹表明,17種禾本科植物共聚為3類,其中燕麥AsDof6.5蛋白與黑麥草和多年生黑麥草親緣關系最近(圖3)。
2.4 燕麥AsDof蛋白互作預測分析
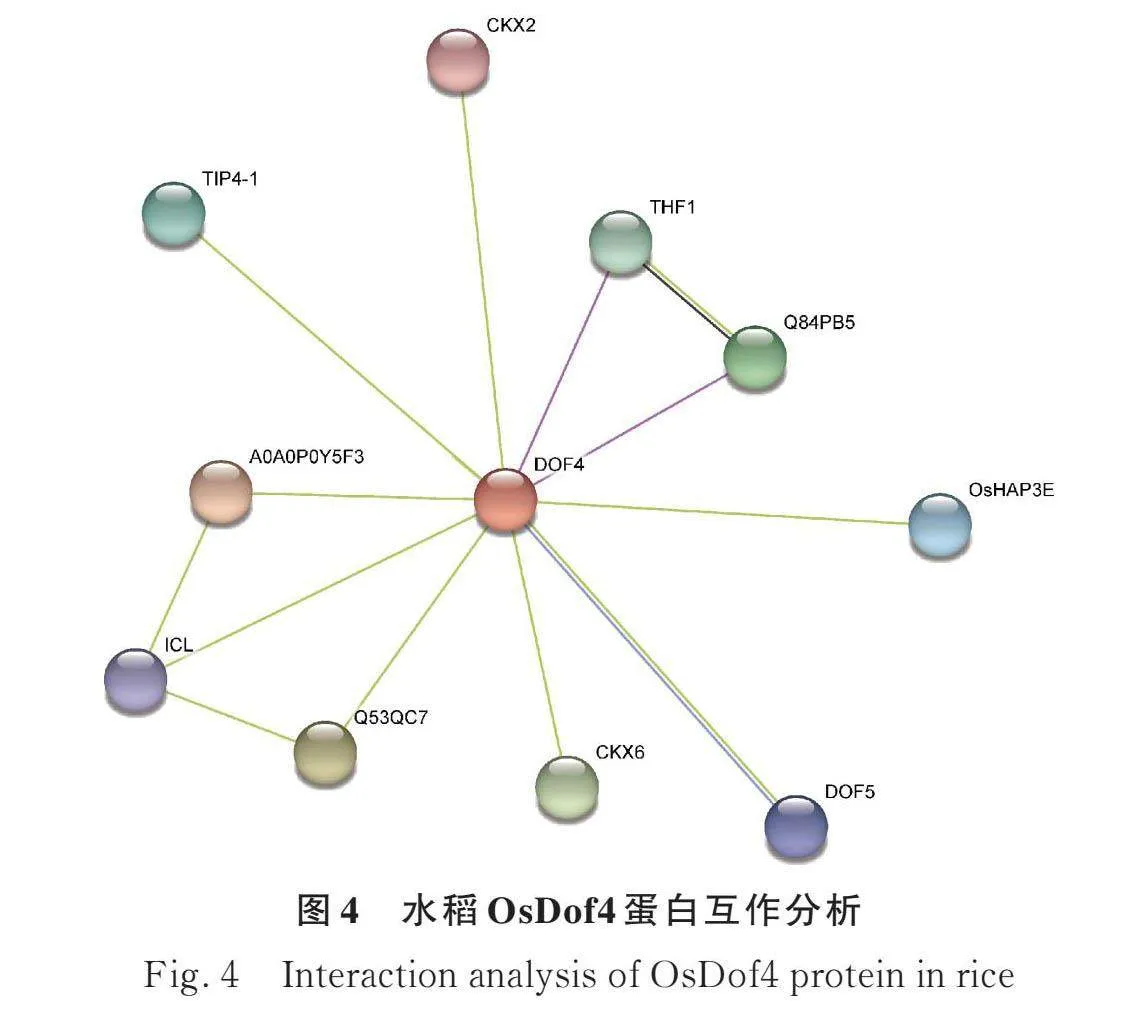
通過構建燕麥AsDof與水稻OsDof蛋白家族進化關系,發現AsDof6.5蛋白與水稻OsDof蛋白家族同源的蛋白為DOF4(基因ID:Os02g0726300),并利用在線軟件STRING預測與水稻DOF4互作的潛在互作蛋白(圖4),圖中節點和線的含義參考姚曉華等[21]和王越等[26]文中解釋。將水稻中與DOF4互作的蛋白序列調取出來利用在線軟件UniProt預測蛋白結構及在燕麥轉錄組測序的序列比對,最終確定AsWRKY51,AsWRKY3,AsDof5.10,AsCKX2和AsCKX6基因(基因ID:AVESA.00001b.r3.2Cg0001569,AVESA.00001b.r3.2Ag0000859,AVESA.00001b.r3.5Dg0000828、AVESA.00001b.r3.3Cg0001961和novel.19137)編碼的蛋白可能與燕麥AsDof6.5蛋白互作。
2.5 燕麥氮脅迫相關基因AsDof6.5表達模式分析
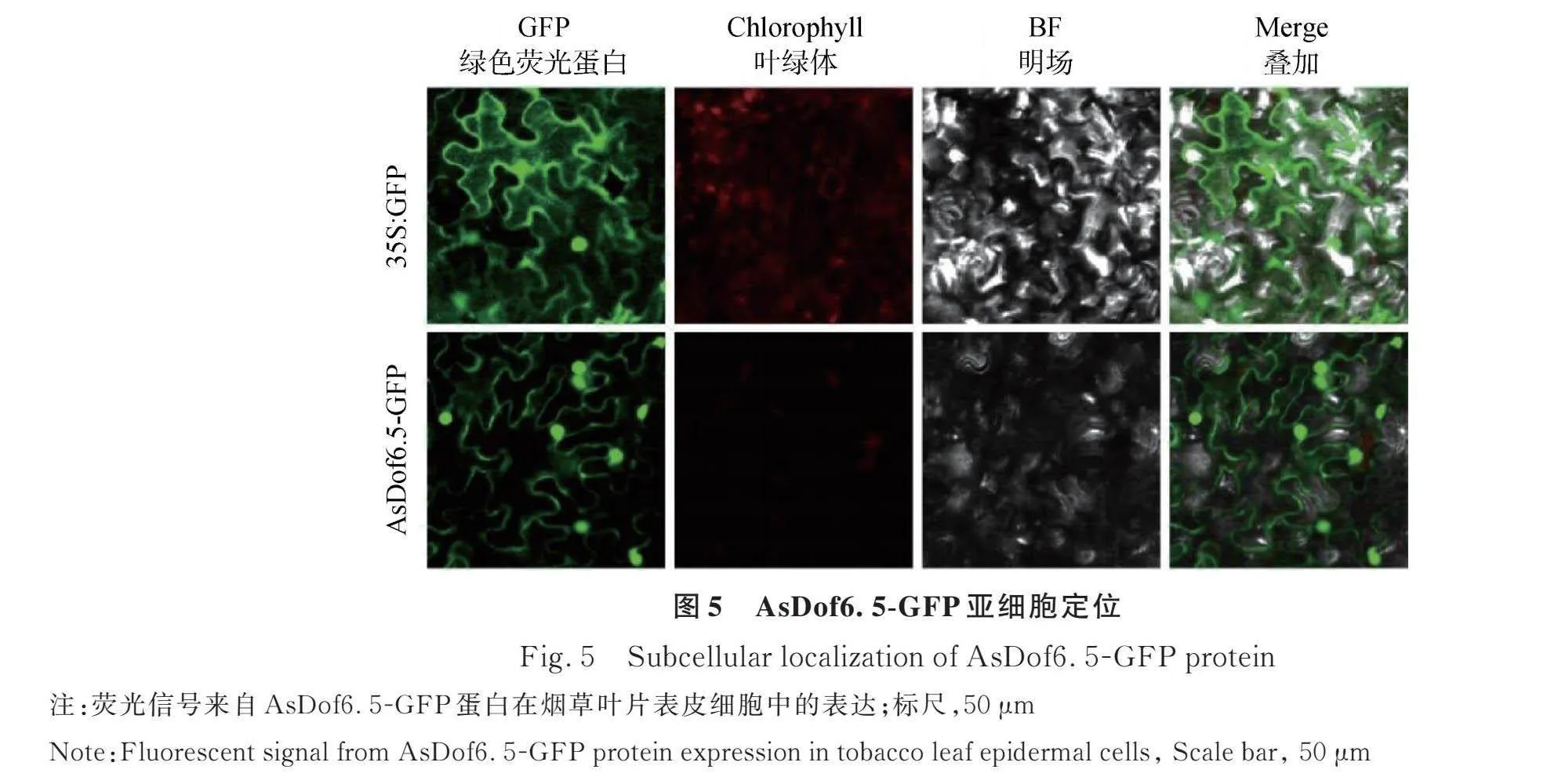
2.5.1 AsDof6.5亞細胞定位研究 將帶有綠色熒光信號載體的農桿菌EHA105注射本氏煙草葉片中,利用激光共聚焦顯微鏡觀察發現AsDof6.5蛋白在細胞核和細胞膜中發現綠色熒光信號,最終判定AsDof6.5蛋白定位于細胞核和細胞膜中(圖5)。
2.5.2 AsDof6.5基因啟動子分析 利用PCR擴增技術獲得一條約2227 bp的目的條帶。經測序鑒定后通過在線軟件PlantCARE對AsDof6.5基因的順式作用元件進行分析,結果表明,AsDof6.5基因啟動子區域包含22種類型85個順式作用元件,其中7個脫落酸(ABRE)、4個茉莉酸甲酯響應元件(TGACG-motif)和1個防御應激反應(TC-rich repeats)均與逆境脅迫相關。此外還有與分生組織表達、生長素和光響應等相關的其他作用元件(圖6)。
2.5.3 燕麥AsDof6.5基因表達分析 通過RT-qPCR分析檢測燕麥AsDof6.5基因在不同氮處理(正常、低氮和無氮)下的表達量變化(圖7),結果表明,燕麥AsDof6.5基因在根中幾乎不表達,葉中的表達量是根中的100倍左右。‘加燕2號’隨著氮濃度的降低,葉中AsDof6.5基因表達量出現先降低后增加的趨勢;‘青永久016’隨著氮濃度的降低,葉中AsDof6.5基因表達量顯著上升。
3 討論
研究表明,轉錄因子在調節植物基因表達、應激反應和進化過程中發揮著重要作用[27],其中,Dof轉錄因子家族主要參與光調控、植物激素、植物生長發育和防御反應等[28-30]。第一個被鑒定出來的Dof轉錄因子是來自玉米的ZmDof1,參與光調節過程[16];因此,燕麥AsDof6.5蛋白可能參與了調控植物的生長發育、光調控和抗逆性等[27-28]。本研究AsDof6.5蛋白具有典型的鋅指結構域,包含CX2CX21CX2C基序(氨基酸位置49~99位置),屬于Dof轉錄因子家族一員[31-32]。AsDof6.5亞細胞定位研究發現該蛋白定位在細胞核和細胞膜中,由此推測在燕麥耐低氮過程中,轉錄因子AsDof6.5在細胞核和細胞膜內發揮重要作用。燕麥AsDof6.5與禾本科其他植物Dof蛋白一致性為73.99%,但是Dof結構域的一致性為99.50%,高度保守的結構域可能在調控功能基因的表達中起重要作用,這與Dof轉錄因子的保守區域與基因的上游啟動子區域結合調控下游基因的表達,增強或抑制植物的生物和非生物脅迫相一致[33]。但Dof基因家族高度保守的結構域是否在燕麥耐低氮中發揮作用有待進一步研究。系統進化分析表明,燕麥AsDof6.5與黑麥草LrDof4和多年生黑麥草LpDof4親緣關系最近,且Dof基因的功能在禾本科植物中的抗逆機制都有報道[34-35]。
在真核細胞中,轉錄調控是基因表達的主要決定因素,它是在特定DNA序列(順式調控元件)的控制下進行的,順式和反式作用調控元件的鑒定為基因表達控制提供了重要的機制[36]。順式調控元件是轉錄調控的重要分子開關,控制著植物許多種生物及非生物脅迫,如生長發育、激素應答、非生物和生物脅迫等[37]。例如,ABRE 是啟動子區域的一個保守順式作用元件,脫落酸通過它激活下游基因的表達[38]。在菠菜中,通過順式作用元件預測分析SoDofs基因啟動子區域可能與下游結構基因結合參與了植物的生長發育、植物激素和脅迫反應[35]。此外,富含TC-rich repeats元件是公認的與植物防御和逆境有關的順式作用元件[39]。本研究AsDof6.5基因啟動子區域上也具有非生物和生物脅迫等的多種表達元件,如ABRE,TC-rich repeats等可能具有不同的抗逆功能。總之,這些結果有助于我們更好的理解燕麥AsDof6.5基因在抗逆中發揮的潛在作用。
在植物生長發育過程中,大多數植物都發展出了一些適應非生物脅迫的機制[40]。氮是植物需求量最大的礦質養分,也是限制植物生長發育的主要因素,其應用已被證明是農業生產的關鍵[41-42]。氮缺乏是農業生產中最常見的問題之一,限制作物的生長和生產,影響作物的品質[43]。從綠藻到被子植物,Dof蛋白在植物中普遍存在,是一類獨特的具有雙功能結合活性的轉錄因子,與DNA和蛋白質均可結合,以調節植物細胞中復雜的轉錄機制[44],且已經被證明可以與其他蛋白互作[45-48]。本研究獲得的AsDof6.5又與水稻OsDof4聚為一類在功能發揮中可能存在類似的作用。通過預測水稻OsDof4的互作蛋白進行序列比對預測確定燕麥AsDof6.5蛋白與AsWRKY51,AsWRKY3,AsDof5.10,AsCKX2和AsCKX6蛋白互作。前人研究表明,在水稻中OsDof11能夠直接調節細胞分裂素降解基因OsCKX4,進而調控植株組織細胞分裂素含量,同時細胞分裂素又能夠誘導OsDof11的轉錄表達[49]。但OsDof11的缺失表現為冠根數量減少,氮同化活性降低,細胞分裂素和生長素含量降低[50],而作物應對氮素缺乏的一個重要的適應策略是根部伸長,從而獲得更多的土壤空間和氮素資源[51]。因此,推測燕麥耐低氮過程中AsDof6.5蛋白與AsCKX2和AsCKX6蛋白互作共同調控燕麥耐低氮過程。以上研究結果與本研究中燕麥耐低氮品種‘加燕2號’與不耐低氮品種‘青永久016’在低氮脅迫下AsDof6.5基因葉中表達量上升和根中表達量下降且耐低氮品種表達量顯著高于不耐低氮品種研究結果類似,推測其有類似的耐低氮機制。綜上該研究結果為探索AsDof6.5基因調控燕麥耐低氮機制奠定基礎,并為進一步研究燕麥耐低氮品種選育提供借鑒和支持。
4 結論
本研究在不同氮水平下從‘加燕2號’和‘青永久016’的 RNA-seq結果中獲得一個差異表達的基因AsDof6.5。該基因編碼258個氨基酸,具有典型的zf-Dof結構域,屬于Dof家族成員。亞細胞定位結果顯示AsDof6.5蛋白定位在細胞核和細胞膜中。RT-qPCR結果顯示,燕麥AsDof6.5基因在不同氮水平下根中表達量幾乎為0,葉中的表達量是根中的100倍左右;低氮脅迫后‘加燕2號’葉中AsDof6.5基因表達量出現先降低后增加的趨勢;‘青永久016’隨著氮濃度的降低,葉中AsDof6.5基因表達量顯著上升。推測AsDof6.5基因在燕麥耐低氮過程中發揮重要作用。
參考文獻
[1] ZHANG M X,BAI R,NAN M,et al. Evaluation of salt tolerance of oat cultivars and the mechanism of adaptation to salinity[J]. Journal of Plant Physiology,2022,273:153708
[2] KAMAL N,RENHULDT N T,BENTZER J,et al. The mosaic oat genome gives insights into a uniquely healthy cereal crop[J]. Nature,2022,606(7912):113-119
[3] BAI J Q,YAN W K,WANG Y Q,et al. Screening oat genotypes for tolerance to salinity and alkalinity[J]. Frontiers in Plant Science,2018,9:1302
[4] LI H P,GUAN H,JIA Z F,et al. Freeze-thaw condition limits the fermentation process and accelerates the aerobic deterioration of oat (Avena sativa) silage in the Qinghai-Tibet Plateau[J]. Frontiers Microbiology,2022,13:944945
[5] LI P,TANG X L,LIAO C,et al. effects of additives on silage fermentation characteristic and in vitro digestibility of perennial oat at different maturity stages on the Qinghai Tibetan[J]. Microorganisms,2021,9(11):2403
[6] 朱婷,謝晶,邵則淮,等. 燕麥β-葡聚糖降血糖性能研究進展[J]. 麥類作物學報,2020,40(3):381-386
[7] MENON R,GONZALEZ T,FERRUZZI M,et al. Oats-from farm to fork[J]. Advances in Food and Nutrition Research,2016,77:1-55
[8] WANG Y L,FU B,PAN L F,et al. Overexpression of Arabidopsis Dof1, GS1 and GS2 enhanced nitrogen assimilation in transgenic tobacco grown under low-nitrogen conditions[J]. Plant Molecular Biology Reporter,2013,31(4):886-900
[9] ESVELT KLOS K,YIMER B A,HOWARTH C J,et al. The genetic architecture of milling quality in spring oat lines of the collaborative oat research enterprise[J]. Foods,2021,10(10):2479
[10] 張衛峰,馬林,黃高強,等. 中國氮肥發展、貢獻和挑戰[J]. 中國農業科學,2013,46(15):3161-3171
[11] MARTINS M R,JANTALIA C P,POLIDORO J C,et al. Nitrous oxide and ammonia emissions from N fertilization of maize crop under no-till in a Cerrado soil[J]. Soil and Tillage Research,2015,151:75-81
[12] KHAEMBAH E N,CICHOTA R,VOGELER I. Simulation of management strategies to mitigate nitrogen losses from crop rotations in Southland, New Zealand[J]. Journal of Agriculture and Food Sciences,2021,101(10):4241-4249
[13] GAO Y H,XU Z P,ZHANG L J,et al. MYB61 is regulated by GRF4 and promotes nitrogen utilization and biomass production in rice[J]. Nature Communications,2020,11(1):5219
[14] CAI S,ZHAO X,PITTELKOW C M,et al. Optimal nitrogen rate strategy for sustainable rice production in China[J]. Nature,2023,615(7950):73-79
[15] MOSIER A R,SYERS J K,FRENEY J R. Global assessment of nitrogen fertilizer: the SCOPE/IGBP nitrogen fertilizer rapid assessment project[J]. Science China-Life Sciences,2005,48(Sup2):759-66
[16] YANAGISAWA S,IZUI K. Molecular cloning of two DNA-binding proteins of maize that are structurally different but interact with the same sequence motif[J]. Journal of Biological Chemistry,1993,268(21):16028-16036
[17] HUANG X,ZHANG Y,WANG L,et al. OsDOF11 affects nitrogen metabolism by sucrose transport signaling in rice (Oryza sativa L.)[J]. Frontiers Plant Science,2021,12:703034
[18] YANAGISAWA S,AKIYAMA A,KISAKA H,et al. Metabolic engineering with Dof1 transcription factor in plants improved nitrogen assimilation and growth under low-nitrogen conditions[J]. PNAS,2004,101(20):7833-7838
[19] 郝青南. 大豆氮素利用效率相關基因的克隆及功能驗證[D]. 北京:中國農業科學院,2013:120
[20] WANG Y,LIU K Q,LIANG G L,et al. Comprehensive evaluation of low nitrogen tolerance in oat (Avena sativa L.) Seedlings[J]. Agronomy,2023,13(2):604
[21] 姚曉華,王越,姚有華,等. 青稞新基因HvMEL1 AGO的克隆和條紋病脅迫下的表達[J]. 作物學報,2022,48(5): 1181-1190
[22] 吳瑞,劉文輝,梁國玲,等.燕麥AsGRAS36基因的克隆與表達分析[J].草地學報,2024,32(11):3371-3382
[23] KATZEN F. Gateway(?) recombinational cloning: a biological operating system[J]. Expert Opinion Drug Discovery,2007,2(4):571-589
[24] GRUET A,LONGHI S,BIGNON C. One-step generation of error-prone PCR libraries using Gateway? technology[J]. Microbial Cell Factories,2012,11:14
[25] LIVAK K J,SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) Method[J]. Methods,2001,25(4):402-408
[26] 王越. 基于miRNA的青稞抗條紋病基因的挖掘及功能驗證[D]. 西寧:青海大學,2019:49
[27] KHAN I,KHAN S,ZHANG Y,et al. Genome-wide analysis and functional characterization of the Dof transcription factor family in rice (Oryza sativa L.)[J]. Planta,2021,253(5):101
[28] SHU Y J,SONG L L,ZHANG J,et al. Genome-wide identification and characterization of the Dof gene family in Medicago truncatula[J]. Genetics and Molecular Research,2015,14(3):10645-10657
[29] SONG A,GAO T,LI P,et al. Transcriptome-wide identification and expression profiling of the DOF transcription factor gene family in Chrysanthemum morifolium[J]. Frontiers Plant Science,2016,7:199
[30] GUPTA S,PATHAK R K,GUPTA S M,et al. Identification and molecular characterization of Dof transcription factor gene family preferentially expressed in developing spikes of Eleusine coracana L[J]. 3 Biotech,2018,8(2):82
[31] WANG P P,LI J,GAO X Y,et al. Genome-Wide screening and characterization of the Dof gene family in physic nut (Jatropha curcas L.)[J]. International Journal of Molecular Sciences,2018,19(6):1598
[32] LUO T,SONG Y N,GAO H L,et al. Genome-wide identification and functional analysis of Dof transcription factor family in Camelina sativa[J]. BMC Genomics,2022,23(1):812
[33] ZOU X,SUN H. DOF transcription factors: Specific regulators of plant biological processes[J]. Frontiers Plant Science,2023,14:1044918
[34] LIU J,MENG Q L,XIANG H L,et al. Genome-wide analysis of Dof transcription factors and their response to cold stress in rice (Oryza sativa L.)[J]. BMC Genomics,2021,22(1):800
[35] YU H Y,MA Y Y,LU Y J,et al. Expression profiling of the Dof gene family under abiotic stresses in spinach[J]. Science Report, 2021,11(1):14429
[36] SHERMAN C T,BRASIER A R. A nalysis of transcriptional control mechanisms i: techniques for characterization ofcis-regulatory elements[J]. Methods in Molecular Medicine,2001,51:107-125
[37] ZHAO J P,JIANG X L,ZHANG B Y,et al. Involvement of microRNA-mediated gene expression regulation in the pathological development of stem canker disease in Populus trichocarpa[J]. PLoS One,2012,7(9):e44968
[38] FUJITA Y,FUJITA M,SATOH R,et al. AREB1 is a transcription activator of novel ABRE-dependent ABA signaling that enhances drought stress tolerance in Arabidopsis[J]. Plant Cell,2005,17(12):3470-3488
[39] KLOTZ K L,LAGRIMINI L M. Phytohormone control of the tobacco anionic peroxidase promoter[J]. Plant Molecular Biology,1996,31(3):565-573
[40] LI H,HUANG W,LIU Z W,et al. Transcriptome-Based analysis of Dof family transcription factors and their responses to abiotic stress in Tea Plant (Camellia sinensis)[J]. International Journal of Genomics,2016:5614142
[41] 段連學,馬祥,琚澤亮,等.高寒地區氮肥減量分期施用對燕麥生物量及氮肥利用率的影響[J].草地學報, 2024,32(10):3185-3193
[42] KRAISER T,GRAS D E,GUTIéRREZ A G,et al. A holistic view of nitrogen acquisition in plants[J]. Journal of Experimental Botany,2011,62(4):1455-1466
[43] NONG H T,TATEISHI R,SURIYASAK C,et al. Effect of seedling nitrogen condition on subsequent vegetative growth stages and its relationship to the expression of nitrogen transporter genes in rice[J]. Plants,2020,9(7):861
[44] GUPTA S,MALVIYA N,KUSHWAHA H,et al. Insights into structural and functional diversity of Dof (DNA binding with one finger) transcription factor[J]. Planta,2015,241(3):549-562
[45] LI D,YANG C,LI X,et al. Functional characterization of rice OsDof12[J]. Planta,2009,229(6):1159-1169
[46] WU J,CHEN L,CHEN M,et al. The DOF-Domain transcription factor ZmDOF36 positively regulates starch synthesis in transgenic maize[J]. Frontiers in Plant Science,2019,10:465
[47] MOLINA-HIDALGO F J,MEDINA-PUCHE L,CA?ETE-GóMEZ C,et al. The fruit-specific transcription factor FaDOF2 regulates the production of eugenol in ripe fruit receptacles[J]. Journal of Experimental Botany,2017,68(16):4529-4543
[48] FENG B H,HAN Y C,XIAO Y Y,et al. The banana fruit Dof transcription factor MaDof23 acts as a repressor and interacts with MaERF9 in regulating ripening-related genes[J]. Journal of Experimental Botany,2016,67(8):2263-2275
[49] WU Y,WANG L,ANSAH E O,et al. The sucrose transport regulator OsDOF11 mediates cytokinin degradation during rice development[J]. Plant Physiology,2022,189(2):1083-1094
[50] DONG X Y,ZENG M Y,HU W X,et al. OsDOF11 promotes crown root formation via cytokinin in Oryza Sativa[J]. Frontiers Bioscience (Landmark Ed),2022,27(8):248
[51] SUN X C,CHEN F J,YUAN L X,et al. The physiological mechanism underlying root elongation in response to nitrogen deficiency in crop plants[J]. Planta,2020,251(4):84
(責任編輯" 付宸)

