福爾馬林固定石蠟包埋組織樣本的蛋白質組制備技術研究



關鍵詞 福爾馬林固定石蠟包埋樣本;樣本制備;蛋白質組;質譜;液相色譜-串聯質譜聯用
基于質譜的蛋白質組學技術在發現疾病診斷生物標志物和指導疾病分類治療方面發揮了重要的作用[1-3]。離體組織樣本可能喪失生物功能和結構,為便于長期保存和分析,常采用福爾馬林固定劑處理,將其制備成福爾馬林固定石蠟包埋(FFPE)組織樣本[4-5]。FFPE 組織樣本關聯大量的臨床信息,對疾病研究至關重要。然而,組織樣本經過甲醛固定和封蠟處理后,給后續的蛋白質組學樣本制備帶來了挑戰:組織樣本經石蠟包裹,與外界完全隔離,經甲醛固定后,樣本的蛋白質與蛋白質之間或蛋白質與核酸之間會發生交聯反應,降低蛋白質的溶解性和酶解效率[6-7],同時,樣本的蛋白質產生位置修飾,影響蛋白質組鑒定的準確性。
二甲苯(Xylene)常用于溶解石蠟[8],但由于其具有揮發性和毒性,被世界衛生組織列為致癌物質。為降低對研究人員健康的影響, Triton X-100 被開發用于替代二甲苯脫蠟[9]。FFPE 組織樣本蛋白提取過程中常用的裂解液包括RapiGest、三氟乙醇(TFE)和12 烷基硫酸鈉(SDS)。SDS 雖為強效細胞裂解劑,但與質譜儀器不兼容,限制了其應用[10-11]。相比之下, RapiGest 和TFE 具備有效的蛋白裂解能力,并與質譜儀器具有較好的兼容性。Coscia 等[12]以50% TFE/300 mmol/L Tris-HCl 為裂解液,完成了卵巢癌患者FFPE 蛋白質組樣本的制備,通過質譜分析共鑒定出4588 種蛋白質,體現了TFE 在蛋白質組樣本制備中的有效性。RapiGest 是一種與質譜兼容的酸不穩定性表面活性劑,能夠增加疏水性蛋白或肽段的溶解度,提升蛋白質酶解的效率[13-14]。Wu 等[15]建立了NanoTPOT 微量樣本制備方案,該方案在60 ℃條件下使用0.1% RapiGest 裂解細胞,從0.5 μg Hela 蛋白中鑒定出5474 種蛋白質。目前,常使用的蛋白酶切方案包括過濾輔助樣品制備(FASP)技術[16]、原位酶切(iST)技術[17]和單體系固相增強樣品制備(SP3)技術[18-19]。FASP 酶切方案根據濾膜分子量大小截留蛋白質,適用于各種裂解液提取的蛋白質,但操作較繁瑣,在微量樣本中的效果可能有限。iST 和SP3 實驗方案都是在單一容器內完成樣本制備,簡化了操作步驟,適用于微量樣本的蛋白質組樣本制備。
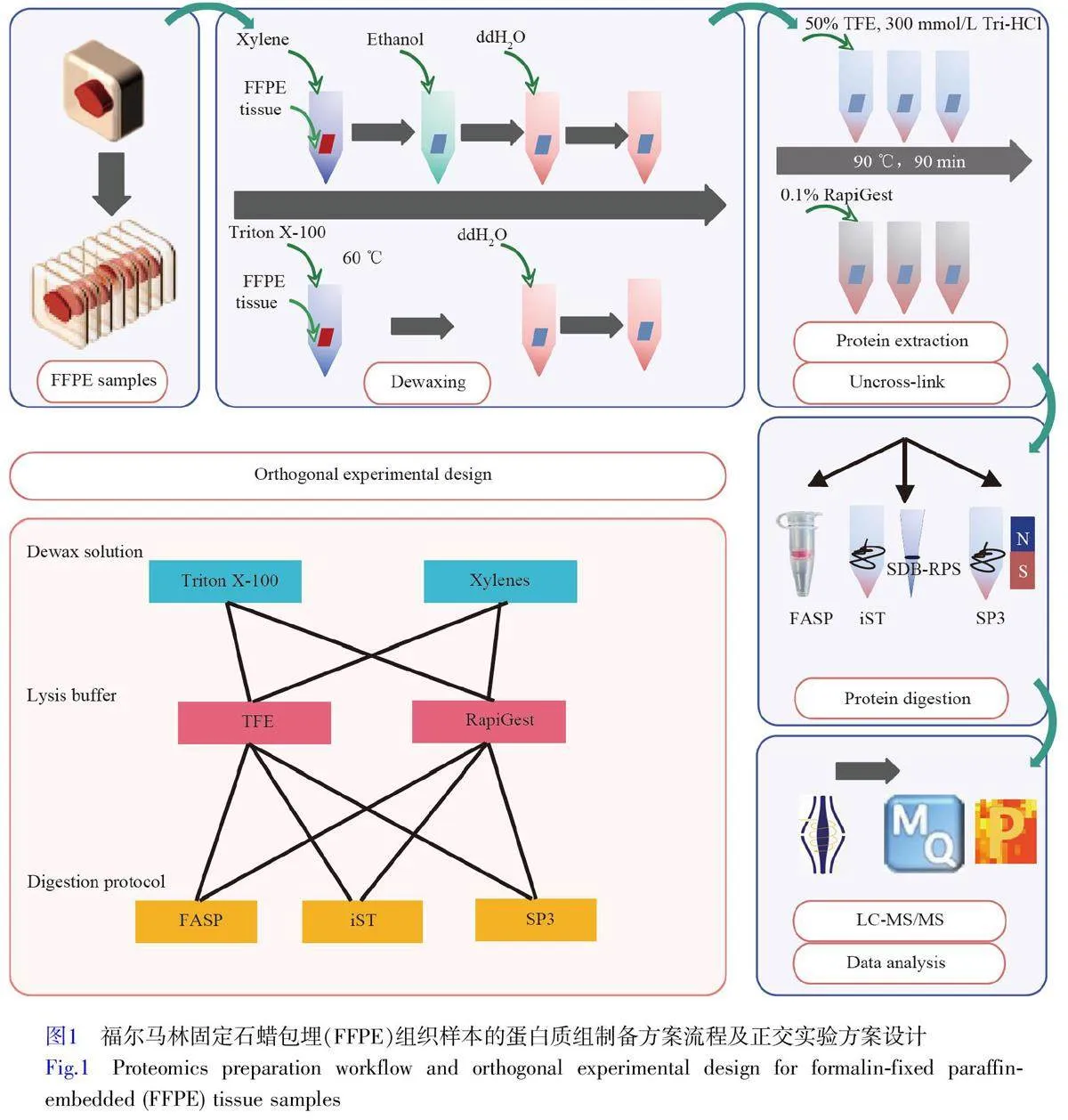
為了探索FFPE 蛋白質組樣本的最佳制備條件,本研究選擇2 種脫蠟液(Triton X-100 和Xylene)、2 種裂解液(TFE 和RapiGest)以及3 種酶切方案(iST、SP3 和FASP)作為技術基礎,通過正交實驗設計了12 種樣本制備方案,分別為TTF(Triton-TFE-FASP)、TTI(Triton-TFE-iST)、TTS(Triton-TFE-SP3)、TRF(Triton-RapiGest-FASP)、TRI(Triton-RapiGest-iST)、TRS(Triton-RapiGest-SP3)、XTF(Xylene-TFEFASP)、XTI(Xylene-TFE-iST)、XTS(Xylene-TFE-SP3)、XRF(Xylene-RapiGest-FASP)、XRI(Xylene-RapiGest-iST)和XRS(Xylene-RapiGest-SP3)。從蛋白質和肽段的鑒定深度、鑒定穩定性和蛋白豐度的定量水平等方面對各方案進行了系統性評估。結果顯示, TTI 技術方案在所有測試條件中表現最好,具有突出的鑒定重復性和穩定性,同時在蛋白質鑒定數量上也表現最佳。本研究為FFPE 組織樣本的蛋白質組學分析提供了技術參考。
1 實驗部分
1.1 儀器與試劑
Easy-nLC 1200 納升級液相色譜儀、Orbitrap Fusion Lumos Tribrid 質譜儀、NanoDrop OneC 微量紫外分光光度計和ThermoMixer C 金屬浴(美國Thermo Scientific 公司);Vacufuge Plus 真空離心濃縮儀(德國Eppendorf 公司);JY92-IIN 超聲波細胞粉碎機(寧波新芝生物科技公司);電熱恒溫培養箱(上海一恒科技有限公司)。
Triton X-100非離子表面活性劑(≥99%)、TFE(≥90%)、氯乙酰胺(CAA,≥98%)和氨水(≥99%)(美國Sigma Aldrich 公司);二甲苯(≥99%,上海阿拉丁生化科技股份有限公司);RepiGest 表面活性劑(≥98%,美國Waters 公司);Tris-HCl(≥99%, pH 8.0)、三(2-羧乙基)膦(TCEP,≥97%)、三氟乙酸(TFA,≥99%)、甲酸(FA,gt;99%)、乙醇和乙腈(質譜純)(美國Thermo Scientific 公司);測序級胰蛋白酶(Trypsin,質譜純,北京酶知源生物科技有限公司);SDB-RPS 固相萃取盤(色譜純,美國3M 公司)。
1.2 樣本信息
本研究使用的FFPE 組織切片樣本均來自中國醫學科學院腫瘤醫院,并已得到該醫院倫理委員會的批準(審批編號:NCC2020C-209)。參與此項研究的個體已簽署知情同意書,確保研究的倫理合規性。
所采用的樣本均來自同一患者的肝細胞癌FFPE 組織切片,切片大小約為5 mm×5 mm,厚度為5 μm。
1.3 FFPE 組織樣本的脫蠟與解交聯
Triton X-100 脫蠟流程[9] (1)將FFPE 組織切片在60 ℃恒溫箱中處理10 min;(2)將切片轉移至1% Triton X-100 中(60 ℃),浸泡15 min,重復1 次;(3)用去離子水洗滌切片,每次浸泡5 min,重復2 次。
二甲苯脫蠟流程[8] (1)FFPE 切片在60 ℃恒溫箱中處理10 min;(2)將切片轉移至二甲苯中,室溫浸泡10 min,重復1 次;(3)依次使用100%、95%、85%和75%乙醇溶液浸泡切片,其中前兩個濃度各重復2 次,每次浸泡時間為5 min;(4)將切片轉移至去離子水中浸泡5 min,重復2 次。
蛋白質提取和解交聯流程[12] (1)向樣品中加入50% TFE/300 mmol/L Tris-HCl 或0.1% RapiGest,進行水浴超聲處理1 h;(2)樣品置于90 ℃金屬浴中加熱90 min;(3)再次進行水浴超聲處理1 h。
1.4 蛋白質酶切和肽段脫鹽
FASP 酶切方案 (1)將樣品轉入截留分子量為30 kDa 的超濾離心管中,加入TCEP(5 mmol/L)和CAA(25 mmol/L)混合液至終體積為200 μL,置于37 ℃金屬浴中孵育1 h;(2)以16000 r/min 離心15 min,棄去濾過液,并更換套管;(3)加入1 μg Trypsin,在37 ℃金屬浴中酶切16 h,轉速為1500 r/min;(4)離心,收集酶切液。
iST 酶切方案 (1)將蛋白樣品轉移至EP 管中,加入TCEP(5 mmol/L)和CAA(25 mmol/L)至終體積為200 μL,在37 ℃金屬浴中孵育1 h;(2)將液體樣品置于真空干燥機中,干燥至約20 μL;(3)加入1 μg Trypsin,在37 ℃金屬浴中酶切16 h,轉速為1500 r/min;(4)離心,收集上清液。
SP3 酶切方案 (1)在蛋白樣品中加入TCEP(5 mmol/L)和CAA(25 mmol/L)至終體積為200 μL,在37 ℃金屬浴中孵育1 h;(2)加入經去離子水清洗過的磁珠,再加入純乙醇,使乙醇含量超過50%,在24 ℃金屬浴中孵育5 min,轉速為1000 r/min;(3)17000 r/min 離心5 min,再置于磁力架上吸附磁珠,去除上清液;(4)加入200 μL 乙醇-水(80∶20, V/V)洗滌2 次;(5)加入1 μg Trypsin,在37 ℃金屬浴中孵育16 h,轉速為1500 r/min;(6)離心,然后再用磁力架吸附磁珠,收集上清液。在收集的各樣品酶切液中加入TFA 至終濃度為1%,待脫鹽。
SDB-RPS-Tip 脫鹽 (1)將2 層SDB-RPS 膜轉移至100 μL 移液頭中,并用0.2% TFA 洗滌1 次;(2)將酶切液加至SDB-RPS-Tip 柱中,離心(4000 r/min, 1 min)去除廢液;(3)采用0.2% TFA 洗滌3 次;(4)采用5%氨水的ACN-ddH2O(80∶20,V/V)洗脫肽段。收集的肽段在真空離心濃縮儀中熱干,于–80 ℃保存,供LC-MS/MS 分析。
1.5 LC-MS/MS分析
使用EASY-nLC 1200系統與Orbitrap Fusion Lumos Tribrid 質譜儀進行分析。肽段在自制的C18 柱(內徑為100 μm,柱長為30 cm)上分離。流動相A 為0.1% FA,流動相B 為80% ACN/0.1% FA。肽段以600 nL/min 的流速在135 min 內洗脫。梯度洗脫程序如下:0~13 min, 3%~10% B;13~99 min, 10%~22% B;99~120 min, 22%~30% B;120~123 min, 35%~90% B;123~135 min, 90% B。MS1 和MS2 均使用Orbitrap 質量分析器分析。MS1 掃描范圍為m/z 350~1550,分辨率為120000。全掃描的自動增益控制(AGC)目標設定為4×105,最大離子注入時間(MIT)為60 ms。選擇用于MS/MS 的前體離子的離子隔離寬度為m/z 1.6,在30%的標準化碰撞能量下進行碎裂。MS2 分辨率設定為15000, AGC 為5×104, MIT 為30 ms。前體離子的動態排除時間為18s。
1.6 數據分析
質譜原始數據使用MaxQuant 軟件(版本號:2.0.3)[20]進行分析,在Uniprot 下載用于人類蛋白質組檢索數據庫。MaxQuant 設置參數如下:蛋白水解酶為Trypsin,最大漏切位點為2;母離子質量偏差為20 ppm (10–6),子離子質量偏差為4.5 ppm;Carbamidomethyl (C)被選為固定修飾,可變修飾選擇甲硫氨酸氧化和N-乙酰化;錯誤發現率(FDR)lt;1%,其它設置參數選擇默認值。基因本體(GO)富集分析使用R 語言的ClusterProfiler 軟件包[21]完成,顯著信號通路的選擇標準為plt;0.05。數據分析與可視化使用Perseus、Excel 和GraphPad Prism 等工具軟件完成。
2 結果與討論
2.1 實驗方案設計
本研究設計了一套正交實驗方案,系統地評價了不同前處理方案對FFPE 組織樣本蛋白質組定性與定量分析結果的影響(圖1)。此方案包括2 種脫蠟方案(Triton X-100,標記為T;二甲苯,標記為X),2種裂解液(TFE,同樣標記為T;RapiGest,標記為R),以及3種酶切方案(FASP,標記為F;iST,標記為I;SP3,標記為S)。以上元素組合形成12種不同的處理組合,分別為TTF、TTI、TTS、TRF、TRI、TRS、XTF、XTI、XTS、XRF、XRI 和XRS。每種組合方式進行3次重復實驗,以確保實驗結果可靠。
2.2 12種制備方案的蛋白質組對比分析結果
12種制備方案的平均蛋白質鑒定數量范圍在1906~3194 之間,其中TTI 方案的平均蛋白質鑒定數量最多,達到3194 種蛋白質,比鑒定數最少的XRF 方案提升了1.68 倍(圖2)。在3 種酶切方案中, iST 酶切方案(–I)鑒定的蛋白質數量和肽段數量均明顯優于SP3(–S)和FASP(–F)酶切方案,其中, FASP 酶切方案鑒定的蛋白質數量最少。觀察到TTI-TTS-TTF、TRI-TRS-TTF、XTI-XTS-XTF 和XRI-XRS-XTF 這4 種比較組合中趨勢一致, –I 組的蛋白質鑒定數量和肽段鑒定數量都優于–S 組和–F 組, –F 組最低(圖2A)。同時,觀察到使用TFE(T)作為裂解液的效果明顯優于RapiGest(R),例如,在TTI 與TRI、TTS 與TRS 等的對比中,選用TFE(-T-)的組合普遍優于RapiGest(-R-)。此外,無論選擇Triton X-100 還是二甲苯作為脫蠟液,對FFPE 組織樣本的蛋白質組分析結果影響較小,如TTI 與XTI、TTS 與XTS 等的比較顯示,蛋白質和肽段鑒定數量之間的差異較小。
2.3 12 種制備方案的蛋白鑒定情況對比分析結果
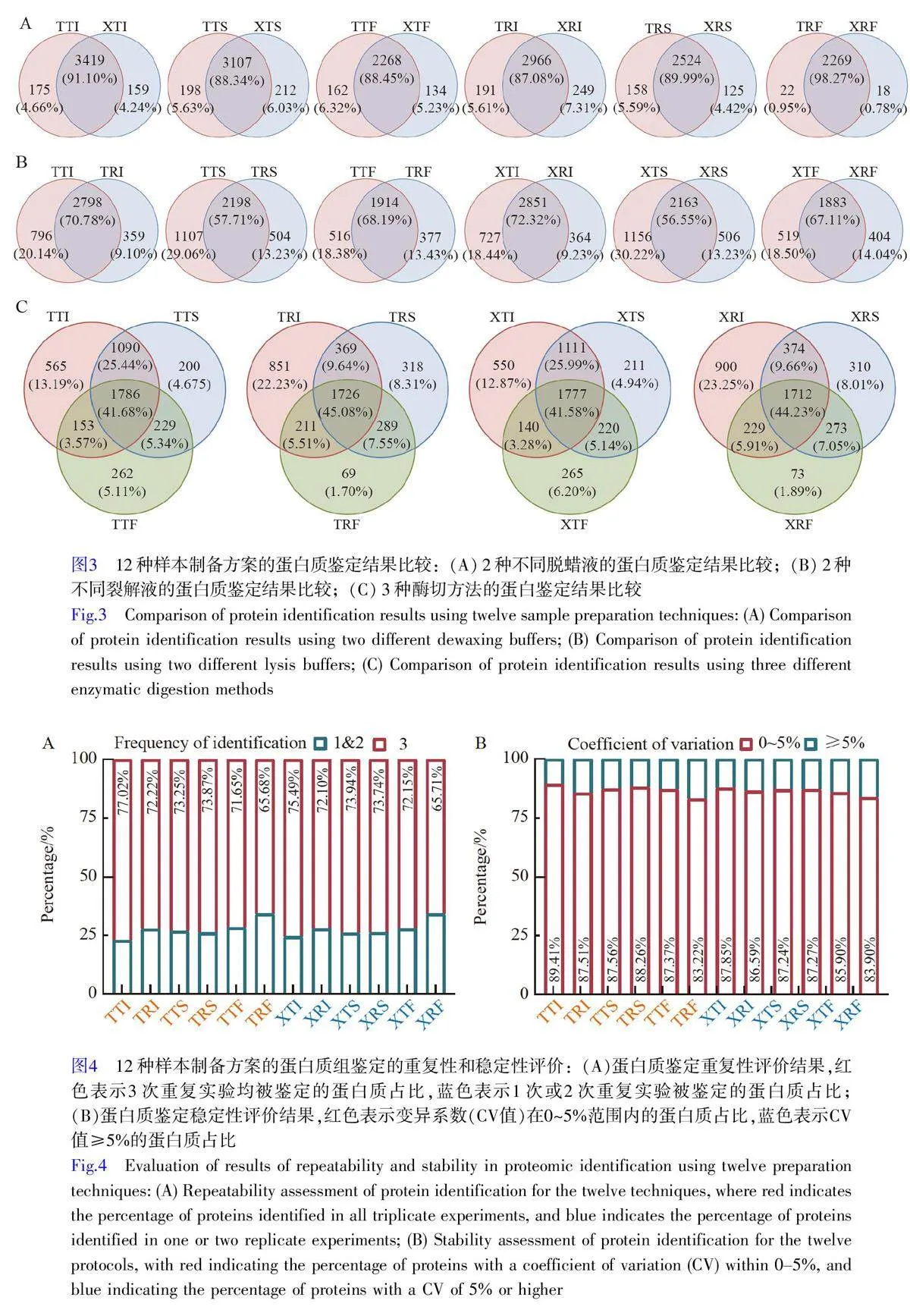
通過韋恩圖對比分析,對12 種制備方案的蛋白鑒定情況進行了系統研究。研究結果表明,使用Triton X-100 (T–)和二甲苯(X–)作為脫蠟液的差異較小,在各組配對方案中,如TTI-XTI 和TTS-XTS 等,不同脫蠟液特異性鑒定的蛋白質數量占比通常低于7%,表明2 種脫蠟方法之間的差異不顯著(圖3A)。相比之下, 2種不同的裂解液TFE(-T-)和RapiGest(-R-)之間的差異較為明顯。在配對組,如TTI-TRI 和TTS-TRS 中,特異性鑒定蛋白質的占比大部分超過13%,其中, RapiGest(-R-)組的特異性鑒定蛋白質占比在9.10%~14.40%之間,而TFE(-T-)組在18.38%~30.22%之間(圖3B)。上述結果表明, TFE 裂解液(-T-)在蛋白質組鑒定中具有明顯優勢。同時,在保持裂解液和脫蠟方式不變的情況下, iST(–I)酶切方案的特異性鑒定的蛋白質數量顯著高于SP3(–S)和FASP(–F)酶切方案(圖3C)。綜上, TFE 和iST 酶切技術可顯著提升FFPE 組織樣本的蛋白質組鑒定效果,而脫蠟方式對蛋白質組鑒定的影響較小。
2.4 蛋白質定性結果的重復性和穩定性評估
對12種制備方案的重復性和穩定性進行了評估。采用各制備方案中3 次重復實驗均能鑒定到的蛋白質的占比作為評估制備方案重復性的關鍵指標。在12 種方案中, 10 種方案的蛋白質鑒定重復占比超過70%,表現出較高的重復性(圖4A)。然而, XRF 和TRF 方案的重復性較低,分別只有65.71%和65.68%。在所有方案中, TTI 和XTI 方案表現最佳, 3 次重復實驗的鑒定百分比分別為77.02%和75.49%(圖4A)。以鑒定蛋白質的變異系數(CV)衡量各制備方案的穩定性,除TRF 和XRF 方案外,其它方案的CVlt;5%的蛋白質占比均超過85%,顯示出較高的穩定性(圖4B)。特別是TTI 方案,其CVlt;5%的蛋白質占比高達89.41%,顯示出極高的穩定性(圖4B)。以上結果表明,絕大部分制備方案不僅具備良好的重復性,還展現出高度的穩定性,其中, TTI 方案的表現最優。
2.5 蛋白質定量檢測結果的穩定性評估
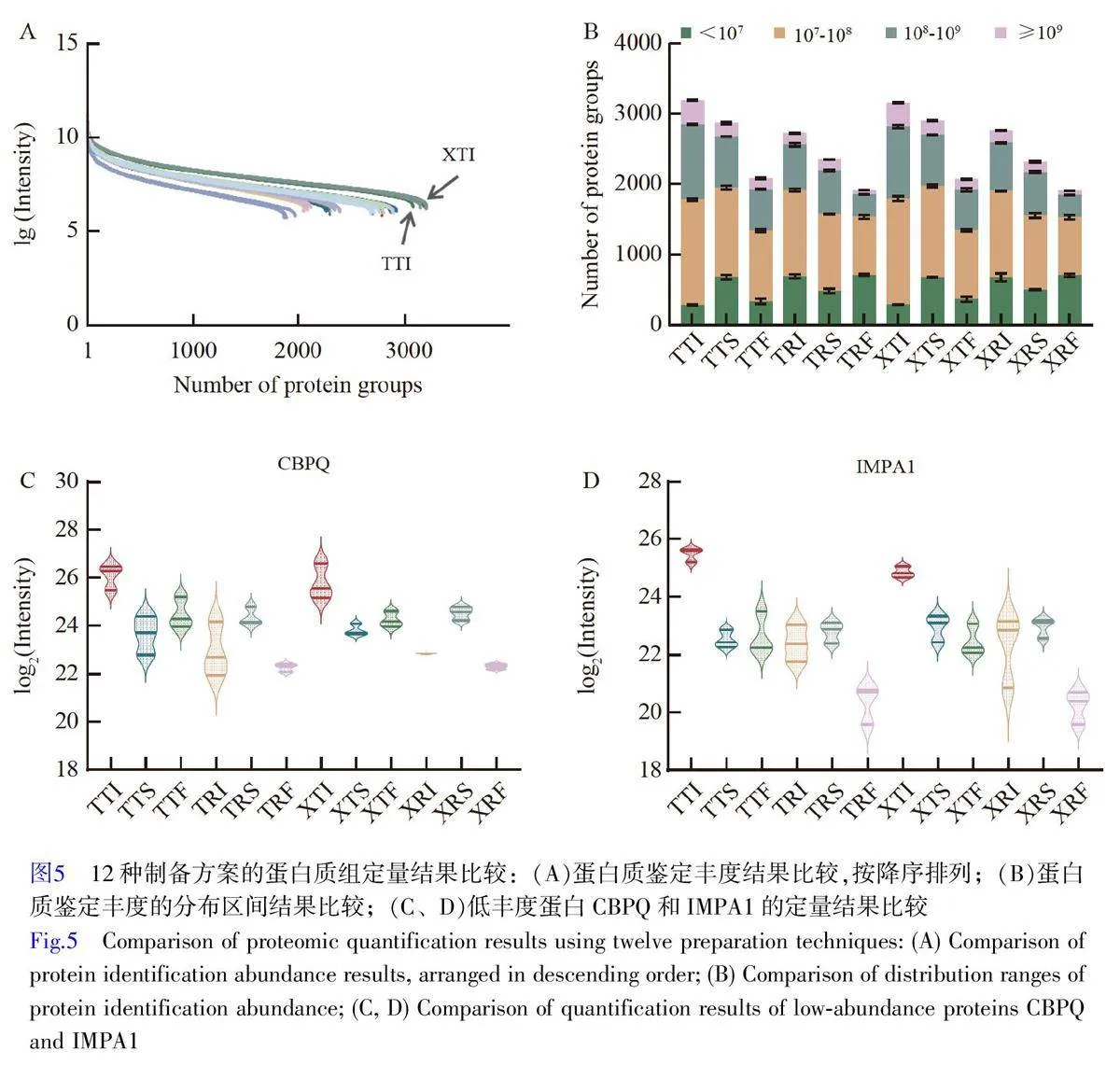
按照蛋白質定量豐度對12 種制備方案進行降序排列。TTI 和XTI 方案鑒定的蛋白質豐度明顯優于其它方案,尤其在低豐度蛋白質鑒定方面表現尤為突出(圖5A)。將蛋白質豐度劃分為4個區間:lt;107,107~108, 108~109和≥109。與其它方案相比, TTI 和XTI 在lt;107 區間的蛋白質較少,在107~109 區間的蛋白質數量顯著增多,表明這2種方案可以提高對低豐度蛋白質的鑒定水平,有助于增加蛋白質鑒定數量和提高定量準確性(圖5B)。
為進一步評估各種制備方案的蛋白質定量分析的效果,選取各制備方案中定量值最低的100 種蛋白質。通過交叉比對,挑選在各組實驗中均為最低豐度范圍的IMPA1(P29218)和CBPQ(Q9Y646)2 種蛋白質作為評價基準。TTI 和XTI 方案鑒定的2 種蛋白質的豐度水平明顯高于其它處理組(圖5C 和5D)。以上結果表明, TTI 和XTI 方案對低豐度蛋白質的鑒定性能優異,這也可能是這2 種方案在蛋白質鑒定數量和穩定性方面顯著提升的主要原因。
2.6 TTI方案在FFPE蛋白質組研究中的性能優勢
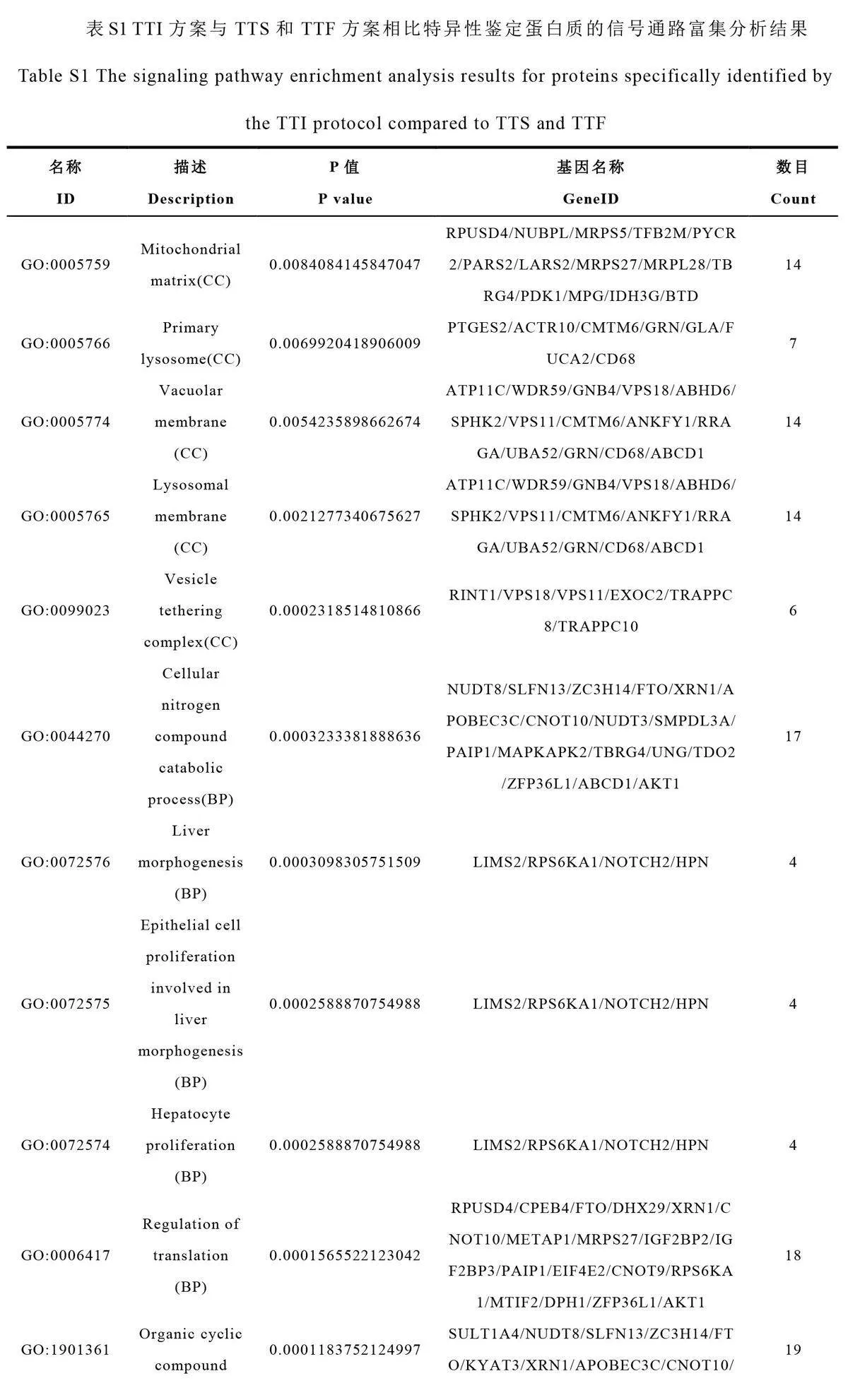
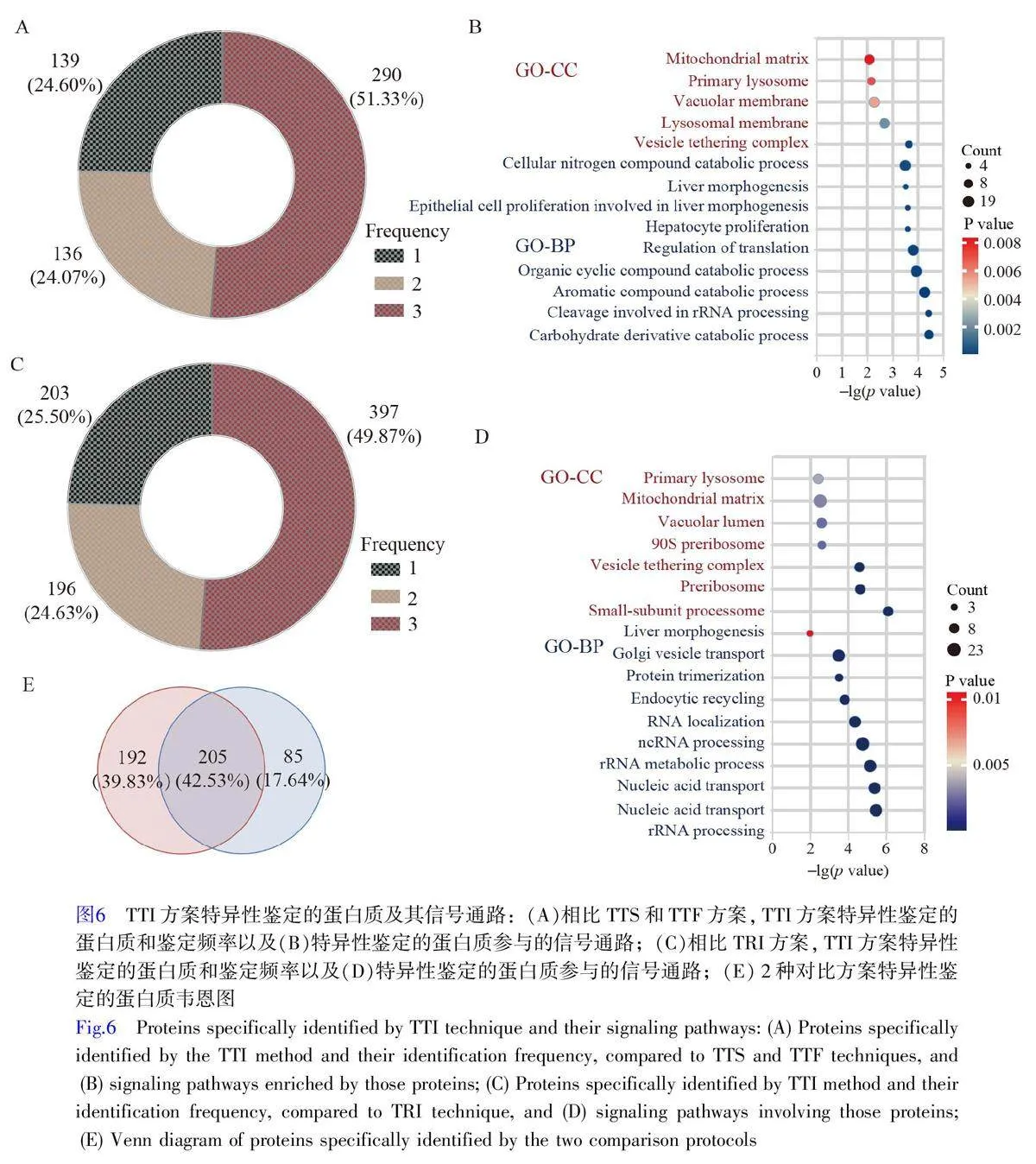
上述分析結果證明, TTI 方案是FFPE 蛋白質組研究的首選。基于肝細胞癌的FFPE 組織樣本,本研究重點考察了TTI 方案在蛋白質組研究中的性能優勢。比較了TTI 與TTS 和TTF方案的差異,發現TTI方案特異性鑒定出了565 種蛋白質,其中, 290種蛋白質在3 次重復實驗中均被鑒定(圖6A)。GO 富集分析結果顯示,這290 種蛋白質主要位于囊泡錨定復合體、溶酶體膜和液泡膜等細胞結構(圖6B,電子版文后支持信息表S1),并參與翻譯調控、肝細胞增殖、上皮細胞增殖和肝臟形態發生等生物學過程。此外,在肝細胞增殖、上皮細胞增殖以及肝臟形態發生等過程的蛋白質鑒定方面, TTI 方案較TTS 和TTF 方案能識別更多相關蛋白質。
通過對TTI 和TRI 的韋恩圖分析,研究了TFE(-T-)和RapiGest(-R-)2 種裂解液的效果。TTI 方案特異性鑒定出796 種蛋白質,其中397 種在3 次重復實驗中均被鑒定(圖6C)。GO 富集分析表明,這397 種蛋白質主要定位于小亞基過程體、前核糖體和囊泡錨定復合體等細胞結構,涉及rRNA 加工、核酸運輸和肝臟形態發生等多個生物過程(圖6D,電子版文后支持信息表S2)。以上結果進一步證明了TFE 裂解液在提高FFPE 組織樣本蛋白質鑒定性能方面具有顯著優勢,為疾病臨床研究提供了重要線索。
通過韋恩圖分析發現, TTI 制備方案與TRI、TTS 和TTF 制備方案之間在蛋白質特異性鑒定方面具有高度相關性, 205種蛋白質在比較中顯示出重疊,占TTI-TTS-TTF 特異性鑒定總蛋白質數目的70.69%。表明TTI 技術鑒定的特異性蛋白質具有高度獨特性(圖6E)。
綜上所述,無論是基于iST酶切方案,還是基于TFE裂解液的TTI 技術,都顯著提升了FFPE 蛋白質組的分析性能,特異性鑒定出超過200種蛋白質,這為肝細胞癌的發展機制提供了一個更加系統和全面的蛋白質組圖譜,對于臨床FFPE組織樣本的蛋白質組研究具有重要的價值。
3 結論
本研究通過正交實驗方法設計了12種樣本制備方案,涉及脫蠟液、裂解液和酶切方案,以選擇最適合FFPE 蛋白質組分析的實驗方法。結果表明, Triton X-100和二甲苯作為脫蠟液對蛋白質組分析的影響較小,可使用Triton X-100替代二甲苯進行脫蠟。在裂解液方面, TFE 相較于RapiGest 展現出更高的蛋白質和肽段鑒定效率,并在特異性蛋白質鑒定方面表現更優。在酶切方案的比較中, iST方案在蛋白質和肽段的鑒定數目及特異性蛋白質鑒定方面顯著優于SP3 和FASP 方案。
綜合評估結果,推薦Triton X-100、TFE 和iST酶切方案的組合方案(TTI),此組合方案在蛋白質和肽段鑒定數量、重復性、穩定性和低豐度蛋白質鑒定等多個方面表現出卓越性能。TTI 方案通過特定蛋白質鑒定和信號通路富集分析,成功鑒定出200多種具有方法特異性的蛋白質,這些蛋白質在細胞生長、基因轉錄和腫瘤發展中發揮了關鍵作用,證明TTI 技術能夠提供更全面的蛋白質組學信息,可為臨床研究的深入進行提供技術支持。
支持信息

