豬CREBRF 基因生物信息學和表達規律分析

摘要:CREBRF 基因在雌性動物生殖過程中具有重要調控作用,為了深入了解豬的CREBRF 基因特征和功能,對CREBRF 基因進行生物信息學分析,并通過RT-qPCR分析不同階段巴馬豬卵巢組織中CREBRF 的表達規律。結果顯示,在5個品種豬基因組上鑒定到20個CREBRF 基因的堿基突變,其中7個為同義突變,13個為錯義突變。豬CREBRF 基因的CDS區全長1 920 bp,共編碼639個氨基酸,不穩定系數較高,為親水性蛋白,有85個高置信度的磷酸化位點和4個糖基化位點,且CREBRF 的mRNA具有20個高可信度的m6A甲基化修飾位點,豬、人和小鼠中的CREBRF蛋白保守性較強。RT-qPCR結果顯示,豬卵巢中CREBRF 基因的表達量在豬出生0 和28 d 時表達水平較高,隨著豬生長發育,在出生180 d 時表達量顯著降低,在母豬妊娠38 和80 d 時CREBRF 的表達再次升高。通過比對不同品種豬中CREBRF 基因CDS區的堿基突變并分析該基因的理化性質及表達規律,發現了CREBRF 基因在豬胎兒期、出生早期和妊娠期卵巢組織中的高表達,推測CREBRF 在母豬生殖過程中起重要作用,為豬高繁殖力基因挖掘和分子標記開發提供參考。
關鍵詞:豬;卵巢;CREBRF;生物信息學分析;基因表達
doi:10.13304/j.nykjdb.2024.0154
中圖分類號:S828 文獻標志碼:A 文章編號:1008‐0864(2024)09‐0044‐10
雌性動物的繁殖性狀直接影響著畜牧業的生產效率和經濟效益,近年來對雌性動物繁殖性狀的研究主要集中于生殖生理調控、營養管理與疾病控制、遺傳改良與選擇育種及生殖技術應用等方面,以提高種畜的繁殖能力和生產效率。豬是重要的畜牧動物之一,在農業經濟中扮演著重要角色,豬的繁殖性能直接影響了養殖業的發展和效益。對豬繁殖性狀候選基因的研究有助于揭示其對豬繁殖性能的影響,為改良豬的繁殖性狀提供理論依據和技術支持,對提高豬的生產效率、加快豬的遺傳改良進程具有重要意義[1]。
CREBRF (CREB3 regulatory factor, CREBRF)是Luman/CREB3 蛋白(cAMP responsive elementbinding protein 3,CREB3)的調節因子,又稱Luman/CREB3 募集因子[2]。Luman/CREB3 是一種內質網膜結合轉錄因子,在內質網應激(endoplasmic reticulum stress,ERS)過程中,CREB3參與調節膜內蛋白水解和核小體轉位,激活下游基因,CREBRF蛋白與CREB3在核內相互作用并結合以促進CREB3的降解[2]。CREBRF 基因在雌性動物的繁殖中發揮著非常重要的作用。張麗萌等[3]研究表明,CREBRF 基因在綿羊各組織中均表達,其中腎臟、心臟和卵巢中的表達水平較高。CREBRF 的敲低會顯著抑制雌性動物子宮內膜的功能[4],此外,CREBRF 在ERS誘導的小鼠顆粒細胞凋亡中也具有重要作用[5],其可通過調節小鼠子宮基質細胞的增殖來調節妊娠期間的蛻膜化[6]。楊延周等[7]研究了CREBRF 在雌性小鼠發情周期中的表達變化規律,發現CREBRF 與卵母細胞的生長、發育、成熟及排卵等過程息息相關,同時CREBRF 可能參與胚胎發育及附植并介導ERS通路參與調節卵巢顆粒細胞的凋亡,并受到雌激素、孕激素的調節。在基因敲除小鼠中發現CREBRF缺失的小鼠糖皮質激素信號傳導受到影響,母系行為有嚴重缺陷,不愿照顧幼崽[8]。
上述研究表明,CREBRF 基因在雌性動物生殖生理調控及卵巢發育過程中有著不可或缺的作用。目前關于該基因的研究主要集中于人和小鼠,但對豬的研究較少。本課題組前期研究中發現,豬CREBRF 基因在不同組織中均有表達,且在卵巢、子宮以及輸卵管等組織中表達水平較高。因此,本研究克隆了不同品種豬CREBRF 基因的CDS區并進行序列比對,對該蛋白進行生物信息學分析,并進一步探討了CREBRF 在不同階段豬卵巢中的表達規律,為后續進一步探索CREBRF基因對豬繁殖性能的調控機制奠定基礎。
1 材料與方法
1.1 試驗材料
本試驗組織樣品為不同品種180日齡母豬的卵巢組織,采自山東日照豬場,包括巴馬豬、梅山豬、松遼豬、大白豬和長白豬。CREBRF 基因在豬不同發育時期的表達量檢測選用巴馬豬的卵巢組織,包括胚胎期80 d 的雌性胎豬、出生后0、28、180 d和妊娠38和80 d母豬的卵巢組織。
1.2 主要儀器與試劑
無酶無菌水(R1600-10),北京索萊寶科技有限公司;2×Phanta Max Master Mix 高保真酶(P515)、RNA Isolater Total RNA Extraction Reagent傳統總RNA提取試劑(R401-01)、HiScript Ⅲ Allin-one RT SuperMix Perfect for qPCR(R333)、ChamQ Universal SYBR qPCR Master Mix(Q711),南京諾唯贊生物科技股份有限公司;瓊脂糖凝膠DNA回收試劑盒(DR0101050),浙江易思得生物科技有限公司;引物由上海生工生物工程有限公司合成。
組織勻漿儀(PreceIIys 24),Bertin Technologies(法國);研磨珠(120030C),Welab;離心機(Micro17R),Thermo Scientific;PCR 儀(C1000Touch?)、電泳儀(PowerPac HV)、凝膠成像系統(Universal HoodⅡ),上海伯樂生命醫學產品有限公司;分光光度計(Nano-100),杭州奧盛儀器有限公司;實時熒光定量PCR 儀(QuantStudio 3),Applied Biosystems。
1.3 組織RNA 提取及反轉錄
使用傳統Trizol法提取豬卵巢組織的RNA[9],使用分光光度計檢測RNA的純度與含量,檢測合格后按照反轉錄試劑盒的操作方法取1 μg RNA反轉錄為cDNA,存放于-20 ℃冰箱備用,剩余RNA存放于-80 ℃冰箱備用。
1.4 引物設計與合成
在NCBI 網站上獲得家豬CREBRF 基因的CDS 區序列(登錄號:XM_013990647.2),使用SnapGene 軟件和NCBI-Blast設計特異性引物(表1),由上海生工生物工程有限公司合成。
1.5 豬CREBRF 基因克隆與測序
使用豬卵巢組織的cDNA為模板進行PCR擴增,PCR 反應體系40 μL:2 × Phanta Max MasterMix 20 μL,上、下游引物各 1 μL,無菌水16 μL,cDNA 2 μL。反應條件:95 ℃預變性3 min;95 ℃變性15 s,56 ℃退火30 s,72 ℃延伸30 s,35次循環;72 ℃修復延伸5 min。使用膠回收試劑盒回收產物并交由上海生工生物工程有限公司進行一代測序。
1.6 生物信息學分析
在NCBI 上下載豬CREBR 蛋白的氨基酸序列,通過在線工具Expasy-ProtParam(https://web.expasy. org/protparam/)分析其理化性質;使用Expasy-ProtScale(https://web.expasy.org/protscale/)在線工具分析親/疏水性;使用WOLF PSORT(https://wolfpsort.hgc.jp/)進行亞細胞定位;使用NetNGlyc(https://services.healthtech.dtu.dk/services/NetNGlyc-1.0/)進行糖基化位點分析;NetPhos3.1(https://services.healthtech.dtu.dk/services/NetPhos-3.1/)進行磷酸化位點分析;使用SRAMP(https://www.cuilab.cn/sramp)進行m6A 甲基化位點預測;在NCBI上下載豬(登錄號:XP_005657688.1)、人(登錄號:NP_705835.2)、小鼠(登錄號:NP_084146.1)的氨基酸序列,用ClustalW進行多序列比對,用ESPript 3.0對結果進行可視化分析。蛋白質二級結構使用SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)在線工具進行分析預測。
1.7 基因相對表達量檢測和分析
以不同發育時期豬卵巢組織的cDNA 為模板,通過RT-qPCR測定豬CREBRF 基因的相對表達量,使用β-ACTIN 作為內參,每組設置3個生物學重復。RT-qPCR 反應體系15 μL:2 × ChamQUniversal SYBR qPCR Master Mix 7.5 μL,CREBRF-F/R各0.3 μL,無菌水16 μL,cDNA 1 μL。反應程序:95 ℃預變性30 s;95 ℃變性5 s,60 ℃退火34 s,40 次循環;95 ℃ 15 s ,60 ℃延伸1 min,95 ℃退火1 s。結果采用2-△△CT法[10]計算基因的相對表達量。
1.8 統計分析
試驗結果使用GraphPad prism進行統計學分析,用One-Way ANOVA 方差分析進行顯著性分析,數據結果采用平均值±標準差表示,Plt;0.05表示差異顯著,Pgt;0.05表示差異不顯著。
2 結果與分析
2.1 豬CREBRF 基因的擴增及測序
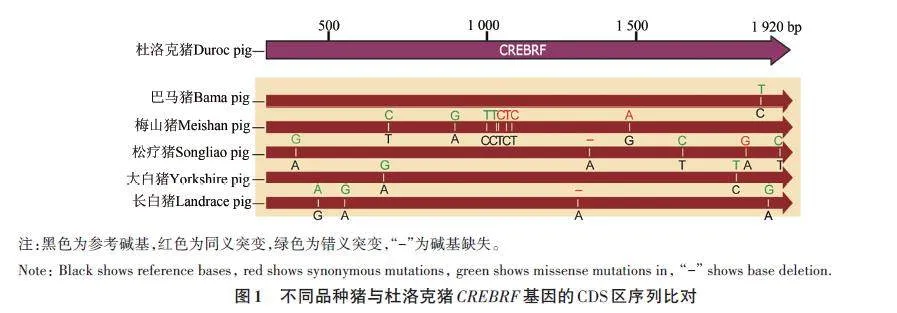
選取巴馬豬、梅山豬、松遼豬、大白豬和長白豬的卵巢組織cDNA為模板,通過PCR擴增得到豬CREBRF 基因的CDS 區。對PCR 純化產物進行測序,比對后發現(圖1),巴馬豬CREBRF 的CDS區與參考基因組(杜洛克豬)相比存在1個突變位點,為錯義突變;梅山豬的CDS區存在8個突變位點,其中有4個同義突變,4個錯義突變;松遼豬的CDS區存在1個堿基缺失和4個堿基突變,其中有2 個同義突變,3 個錯義突變;大白豬的CDS區存在2個突變位點,均為錯義突變;長白豬的CDS區存在1個堿基缺失,3個堿基突變,其中有1個同義突變,3個錯義突變,這些突變表明不同品種豬之間CREBRF 基因編碼區序列存在堿基突變,不同品種間存在的基因序列差異可能是導致該基因在品種間基因表達和功能差異的原因。
2.2 CREBRF 蛋白理化性質分析
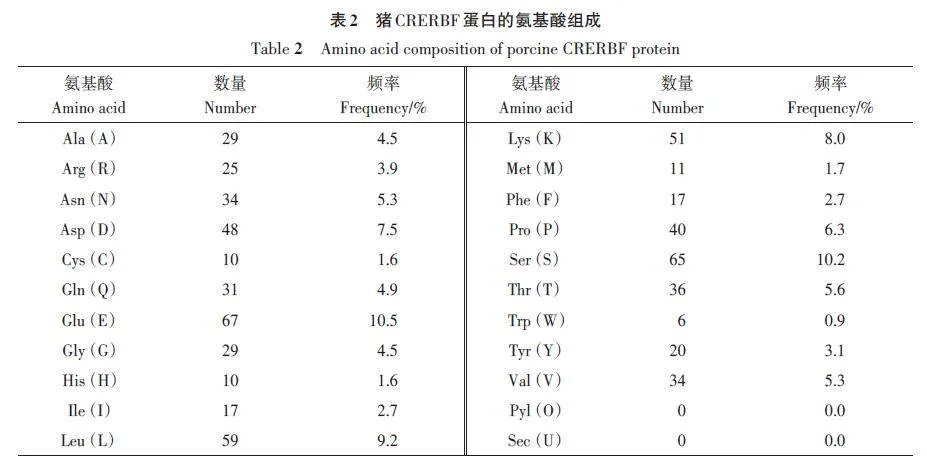
利用ProtParam 在線軟件預測豬CREBRF 蛋白理化性質,CREBRF蛋白含有639個氨基酸,在氨基酸組分中谷氨酸(Glu)含量最多(10.5%),色氨酸(Trp)含量最低(0.9%)(表2)。CREBRF的蛋白分子式為C3 128H4 918N856O1 056S21,原子總數9 979,相對分子質量72 085.82 Da,理論等電點(pI)4.77。CREBRF 蛋白帶正電荷殘基總數量(賴氨酸和精氨酸)為76個,負電荷氨基酸殘基的數量(天冬氨酸和谷氨酸)為115 個。體外半衰期為30 h,不穩定系數為53.574(lt;40為穩定,≥40為不穩定),因此CRERBF蛋白為不穩定蛋白,容易發生結構變化或失去功能,易降解。
2.3 CREBRF 蛋白親/疏水性預測
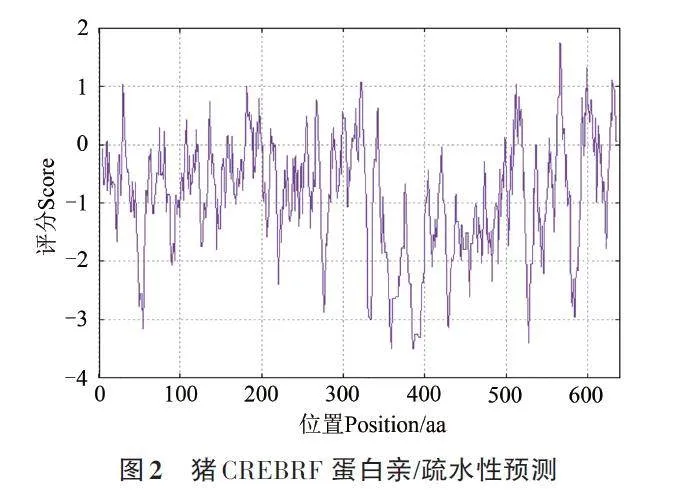
使用Protscale工具分析CREBRF蛋白的親疏水性,分值(score)大于0表示氨基酸在蛋白質結構中更偏向疏水性,這些氨基酸往往會在蛋白質的內部區域聚集,形成蛋白質的核心結構,也稱為疏水核心,如苯丙氨酸、亮氨酸、纈氨酸、異亮氨酸、蘇氨酸等。分值小于0則表示氨基酸在蛋白質結構中更偏向親水性,如谷氨酸、天冬氨酸、賴氨酸、精氨酸、組氨酸等。這些氨基酸主要位于蛋白質的表面區域,與周圍的水分子相互作用,通過這些親水性氨基酸,蛋白質能夠與其他分子進行相互作用。由圖2可知,CREBRF 蛋白氨基酸殘基大多數在親水區,其中親水性最大值為359、328、386和387位的谷氨酰胺,分值為-3.500,疏水性最大值為566位的氨基酸,分值為1.756,表明CREBRF為親水性蛋白。
2.4 CREBRF 蛋白磷酸化位點、糖基化位點和m6A 甲基化位點預測
磷酸化、糖基化和甲基化是3種常見的生物分子修飾形式,它們對生物分子的功能和相互作用產生重要影響。磷酸化可以改變蛋白質的結構和活性,調節細胞信號傳導和代謝途徑;糖基化可以影響蛋白質的穩定性和功能,參與細胞黏附和信號轉導;甲基化在基因表達調控中起著重要作用,影響DNA的可讀性和轉錄過程。
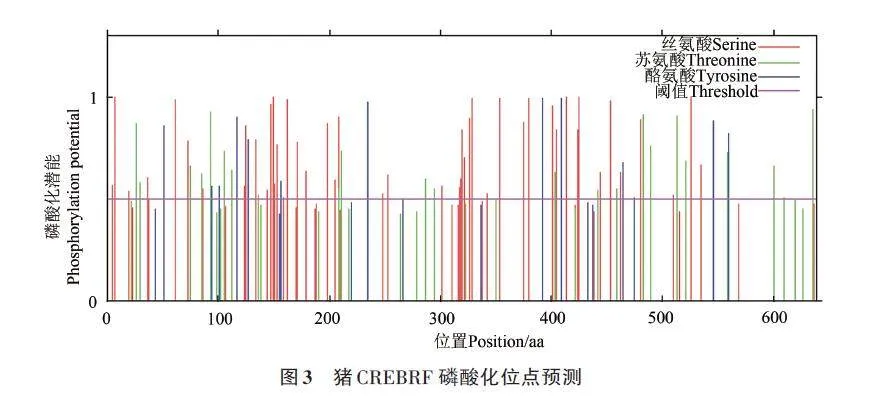
使用在線工具NetPhos3.1預測CREBRF蛋白潛在的磷酸化位點,磷酸化潛能大于0.5表明該位點是潛在的磷酸化位點。結果顯示,CREBRF蛋白存在85 個潛在的磷酸化位點,其中絲氨酸(serine)磷酸化位點有49個,蘇氨酸(threonine)磷酸化位點有23個,酪氨酸(tyrosine)磷酸化位點有13個(圖3),提示CREBRF可能具有復雜的調控機制和功能,而該蛋白可以在不同的時間點、不同的細胞環境下被磷酸化,以實現其復雜的功能調控。
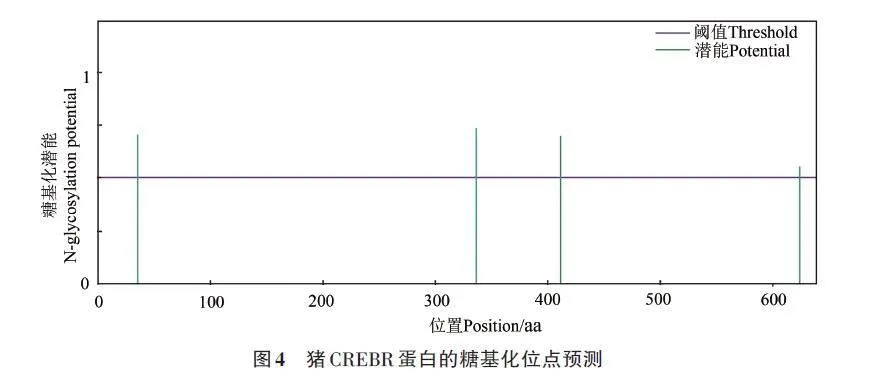
使用在線工具NetNGlyc預測CREBRF蛋白的糖基化位點,糖基化潛能大于0.5為陽性,縱坐標的數值越高,代表該氨基酸位置越可能是個糖基化位點。結果顯示,CREBRF共存在4個糖基化位點,分別為第35位的NSSD(N-糖基化勢能0.699 9)、第336位的NYSL(N-糖基化勢能0.730 1)、第411位的NDSV(N-糖基化勢能0.694 8)和第624 的NPTG(N-糖基化勢能0.551 2)(圖4),這些高置信度的糖基化位點可能參與調控蛋白質的活性或信號轉導途徑,可能對蛋白質的功能具有關鍵影響。
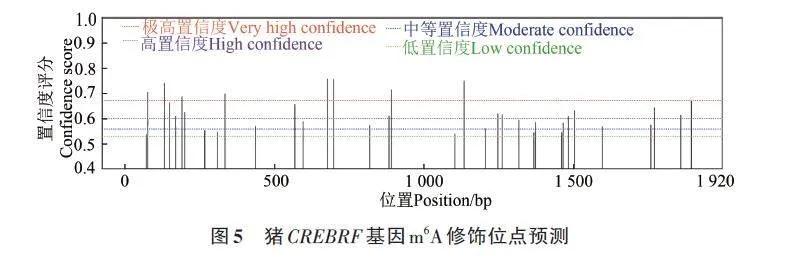
通過SRAMP 網站對CREBRF 基因的CDS區的N6-甲基腺苷(m6A)修飾位點進行預測。結果顯示,CREBRF 基因CDS區存在8個極高置信度的位點(very high confidence),12 個高置信度的位點(high confidence)(圖5),因此認為其CDS區存在m6A修飾。
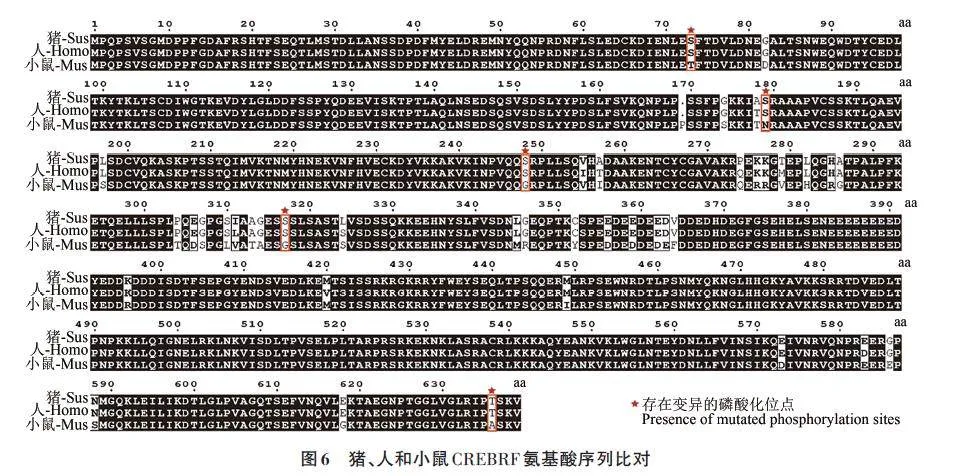
2.5 豬、人和小鼠CREBRF 氨基酸序列比對
小鼠是最常用的實驗動物之一,其基因組與人類有很高的相似性,繁殖周期較短且維護成本相對低廉,因此常被用于研究遺傳學、免疫學、藥理學、腫瘤學等領域[11]。而豬作為大型哺乳動物,其生理結構和代謝特征更接近人類,被廣泛用于心血管病學、外科手術模型以及藥物安全性評價等研究領域[12]。將豬、人和小鼠CREBRF的氨基酸序列進行比對。由圖6 可見,豬、人和小鼠CREBRF的氨基酸序列保守性較強,豬和人的序列相似性為98.59%,小鼠和人的序列相似性為93.74%。同時,通過將差異氨基酸與CREBRF蛋白的化學修飾位點比對發現,在第73、第179、第248、第317 和第636 位氨基酸處,CREBRF 蛋白的磷酸化位點在豬和人中保持一致,在小鼠中發生變異,這些磷酸化位點的差異可能影響CREBRF 蛋白的磷酸化修飾及其調控的基因表達模式。
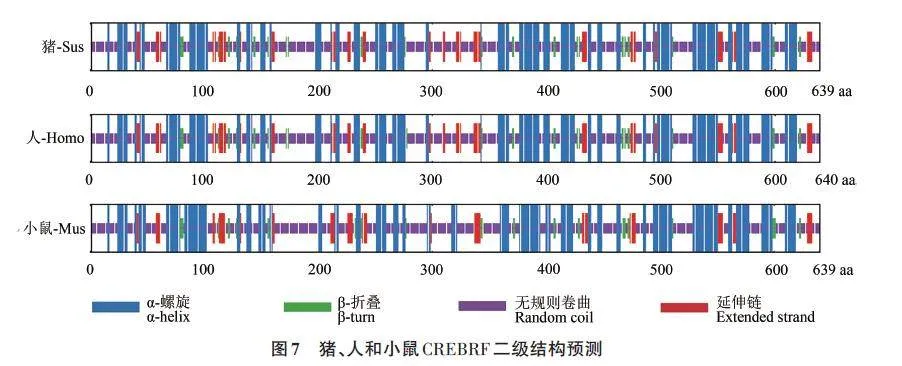
2.6 豬、人和小鼠CREBRF 二級結構比對
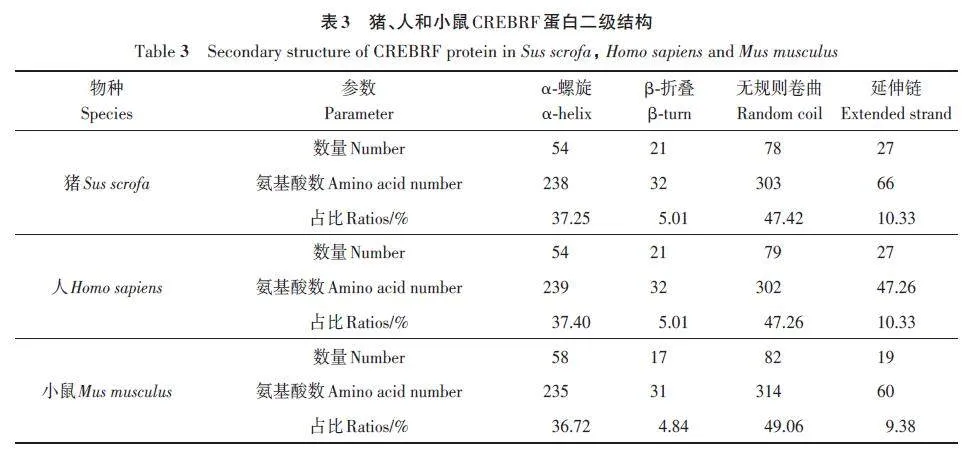
基于氨基酸序列的比對結果,對豬、人和小鼠CREBRF蛋白進行二級結構預測,根據預測結果(圖7),在豬、人和小鼠這3種物種CREBRF蛋白的二級結構分布略有不同。
豬和人CREBRF 蛋白中的α-螺旋結構均有54個,β-折疊結構均有21個,但小鼠CREBRF蛋白中α-螺旋結構有58 個,β-折疊結構有17 個,同時,在豬和人的CREBRF 蛋白中,無規則卷曲結構個數接近,分別為78和79個,而在小鼠中無規卷曲結構個數為82 個(表3)。綜上所述,CREBRF 蛋白的二級結構顯示豬和人CREBRF蛋白結構更加相近,提示豬可以更好地作為人的研究模型。
2.7 CREBRF 在不同階段豬卵巢組織的表達水平差異
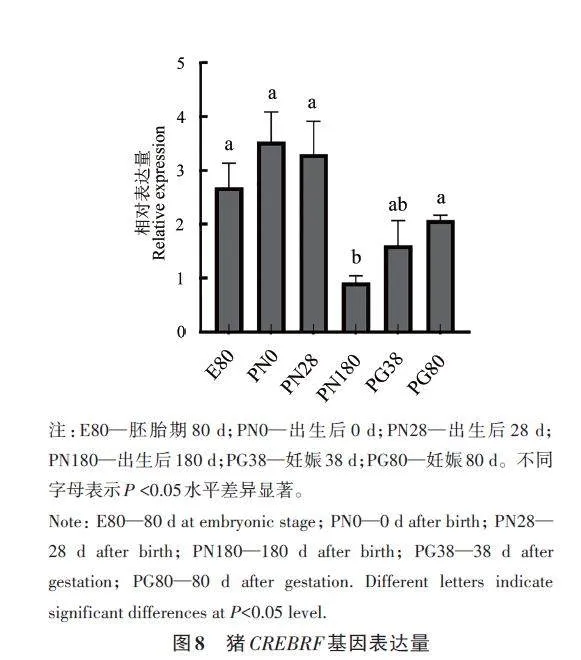
通過RT-qPCR對胚胎期80 d的胎豬,出生后0、28 和180 d 及妊娠38 d 及妊娠80 d 母豬卵巢組織中CREBRF 基因的表達量進行分析,結果(圖8)表明,CREBRF 基因的表達量在仔豬出生第0天時最高,隨著豬生長發育,在出生180 d時表達量最低,在妊娠母豬和胎豬的卵巢中表達量顯著上升。CREBRF 基因在豬胎兒期、出生早期和妊娠期卵巢組織中的高表達提示其在豬的生殖系統發育和妊娠過程中非常重要。
3 討論
CREBRF最早是由加拿大圭爾夫大學發現的一種具有未折疊蛋白質反應的堿基區亮氨酸拉鏈蛋白[2],其通過與細胞轉錄因子CREB3/Luman相互作用促進CREB3蛋白降解[2],抑制蛋白反應元件的激活。目前CREBRF 已被鑒定為多種核受體的新型轉錄調節因子[13‐14],CREBRF 通過內質網絡應激途徑參與誘導細胞凋亡[5],還可通過CREB3/ATG5途徑阻斷缺氧誘導的自噬[14]。
中外豬種在表型和基因型上均存在巨大差異[15],與歐洲豬相比,亞洲品種表現出更高的繁殖能力、更多的脂肪積累和更慢的生長速度[16]。豬的繁殖效率受卵母細胞成熟[17]、卵巢激素[18‐19]、卵巢顆粒細胞凋亡[20]等諸多因素影響,本團隊前期研究中發現并鑒定了梅山豬和大白豬的CREB3基因單核苷酸多態性[21],并在后續研究中發現了妊娠中期母豬卵巢黃體中的差異表達基因[22],本研究進一步分析了CREBRF 基因的特征及其表達規律。克隆得到全長為1 920 bp的豬CREBRF 基因片段,基于CREBRF 基因所編碼蛋白展開生物信息學分析發現,該基因共編碼639個氨基酸,分子質量為72 085.82 Da,蛋白分子式為C3128H4918N856O1056S21,親水性較高,為極不穩定蛋白。亞細胞定位預測顯示CREBRF蛋白主要定位于細胞核,但是在Yang等[5]對小鼠卵泡閉鎖期間的卵巢顆粒細胞的研究中發現CREBRF 蛋白定位于凋亡顆粒細胞的細胞質中,提示CREBRF 蛋白可能具有多種亞細胞位置,其定位可能受到細胞環境、信號通路激活等因素的影響。因此,在不同的條件下,CREBRF蛋白可能呈現不同的亞細胞定位。
豬的CREBRF 蛋白被預測到有85個磷酸化位點,與張麗萌等[3]對綿羊CREBRF 蛋白磷酸化位點預測到的87個磷酸化位點相近,進一步證實CREBRF 基因的氨基酸序列的高保守性,有學者提出CREB 會應答各種信號等磷酸化反應[23],而作為CREB3的募集因子,CREBRF蛋白高置信度的磷酸化位點提示其在細胞信號傳導、代謝調節、基因轉錄等方面也可能受到磷酸化修飾的影響。CREBRF 蛋白預測的糖基化位點只有4個,提示該蛋白在糖基化修飾方面的影響相對較少。本研究通過預測發現,CREBRF 基因CDS 區共存在20個高置信度的m6A甲基化位點,說明CREBRF基因在轉錄后調控過程中可能受到m6A修飾的影響,提示該基因在轉錄后調控中扮演重要角色。通過對豬、人和小鼠CREBRF蛋白進行氨基酸序列比對發現,其保守性較強,可能在生理過程有著相似的功能。
作為CREBRF 的互作蛋白[24],CREB3在果蠅胚胎發生終止時具有特定的作用[25],并且在雌性哺乳動物的生殖過程中也發揮重要作用,CREB3在雌性小鼠的子宮、卵巢以及輸卵管中均有表達[26],而且CREB3 的表達量也隨發情周期的變化呈現規律性地表達[27]。鑒于CREBRF 調節CREB3的活性,而CREBRF 敲除的小鼠母性行為嚴重喪失[8],Penney等[28]為了闡明CREB3 的生物學功能,構建了CREB3 敲除的基因編輯小鼠,發現CREB3缺失的小鼠產仔數顯著下降,且與野生型相比母性較差。CREB3 與雌性動物的生殖相關,進一步表明了其募集因子CREBRF 在雌性動物繁殖過程中的重要調控作用。
本研究初步分析了CREBRF 在不同階段母豬卵巢中的表達規律,結果顯示,CREBRF 在仔豬出生時表達量最高,隨著豬的生長發育,表達量逐漸降低,在母豬妊娠期CREBRF 基因表達水平再次升高,CREBRF 在母豬卵巢中的動態表達提示其可能在母豬生長發育和懷孕過程中發揮重要功能。然而,關于CREBRF 基因具體的作用機制仍需要進一步深入研究和探討。
通過對CREBRF 的基因和表達特征研究發現,豬的CREBRF 基因的蛋白翻譯后修飾位點非常豐富,表明它可能在調控細胞信號傳導、基因表達調控以及細胞內外相互作用中起著重要作用,且CREBRF 在豬生長生殖過程中的卵巢組織中呈現的“ 先高后低再高”的動態表達模式,提示CREBRF 基因在胎兒發育和生長過程中扮演著重要的角色,且在母豬妊娠過程中具有重要的調控作用。本研究能夠為母豬高繁殖力基因挖掘和分子標記開發提供參考。
參考文獻
[1] 孫敬春.基于基因組變異信息鑒定大白豬繁殖性狀關鍵候選基因的研究[D].楊凌:西北農林科技大學, 2023.
SUN J C. Identification of key candidate genes for reproductivetraits in large white pigs based on genomic variationinformation [D]. Yangling: Northwest Aamp;F University, 2023.
[2] AUDAS T E, LI Y, LIANG G Q, et al .. A novel protein, Luman/CREB3 recruitment factor, inhibits luman activation of theunfolded protein response [J]. Mol. Cell. Biol., 2008, 28(12):3952-3966.
[3] 張麗萌,劉愛菊,李閏婷,等. 綿羊CREBRF 基因克隆、生物信息學及組織表達分析[J]. 中國畜牧獸醫, 2022, 49(5):1599-1609.
ZHANG L M, LIU A J, LI R T, et al .. Cloning, bioinformaticsand tissue expression analysis of CREBRF gene in ovis aries [J].China Anim. Husb. Vet. Med., 49(5): 1599-1609.
[4] YANG D, JIANG T, LIU J, et al.. CREB3 regulatory factormTOR-autophagy regulates goat endometrial function duringearly pregnancy [J]. Biol. Reprod., 2018, 98(5): 713-721.
[5] YANG Y Z, LIN P F, CHEN F L, et al .. Luman recruitingfactor regulates endoplasmic reticulum stress in mouse ovariangranulosa cell apoptosis [J]. Theriogenology, 2013, 79(4): 633-639.
[6] LI X, LIN P, CHEN F, et al.. Luman recruiting factor isinvolved in stromal cell proliferation during decidualization inmice [J]. Cell Tissue Res., 2016, 365(2): 437-447.
[7] 楊延周. LRF在雌性小鼠生殖及卵巢顆粒細胞凋亡過程中的作用研究[D]. 楊凌: 西北農林科技大學, 2012.
YANG Y Z. Study on function of LRF in female mousereproduction and granulosa cell apoptosis [D]. Yangling: NorthwestAamp;F University, 2012.
[8] MARTYN A C, CHOLERIS E, GILLIS D J, et al .. Luman/CREB3 recruitment factor regulates glucocorticoid receptoractivity and is essential for prolactin-mediated maternalinstinct [J]. Mol. Cell. Biol., 2012, 32(24): 5140-5150.
[9] SUN S, LIU S M, LUO J, et al .. Repeated pregnant mare serumgonadotropin-mediated oestrous synchronization alters geneexpression in the ovaries and reduces reproductive performance indairy goats [J]. Reprod. Domest. Anim., 2019, 54(6): 873-881.
[10] LIVAK K J, SCHMITTGEN T D. Analysis of relative geneexpression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) method [J]. Methods, 2001, 25(4): 402-408.
[11] LIU E T, BOLCUN-FILAS E, GRASS D S, et al.. Of mice andCRISPR: The post-CRISPR future of the mouse as a model systemfor the human condition [J]. EMBO Rep., 2017, 18(2): 187-193.
[12] 王妍,曹永春,邢凱.豬作為模式動物的研究進展[J].中國實驗動物學報, 2023, 31(12): 1636-1645.
WANG Y,CAO Y C,XING K. Progress in use of pigs as modelanimals [J]. Acta Lab. Anim. Sci. Sinica, 31(12): 1636-1645.
[13] WANG L, LU M J, ZHANG R X, et al .. Inhibition of Luman/CREB3 expression leads to the upregulation of testosteronesynthesis in mouse Leydig cells [J]. J. Cell Physiol., 2019, 234(9):15257-15269.
[14] XUE H, ZHANG J S, GUO X, et al .. CREBRF is a potenttumor suppressor of glioblastoma by blocking hypoxia-inducedautophagy via the CREB3/ATG5 pathway [J]. Int. J. Oncol.,2016, 49(2): 519-528.
[15] ZHOU R, LI S T, YAO W Y, et al .. The Meishan pig genomereveals structural variation-mediated gene expression andphenotypic divergence underlying Asian pig domestication [J].Mol. Ecol. Resour., 2021, 21(6): 2077-2092.
[16] HALEY C S, LEE G J. Genetic basis of prolificacy in Meishanpigs [J]. J. Reprod. Fertil. Suppl., 1993, 48: 247-259.
[17] EPPIG J J. Reproduction: oocytes call, granulosa cells connect[J]. Curr. Biol., 2018, 28(8): R354- R356.
[18] SIROTKIN A V, PIVKO J. Hormonal indexes as predictors ofporcine reproductive traits [J/OL]. Anim. Sci. J., 2023, 94(1):e13879 [2024-04-18]. https://doi.org/10.1111/asj.13879.
[19] GUO Z H, LV L, LIU D, et al .. A meta-analysis: Effect ofandrogens on reproduction in sows [J/OL]. Front. Endocrinol.(Lausanne), 2023, 14: 1094466 [2024-04-18]. https://doi.org/10.3389/fendo.2023.1094466.
[20] DU X, WANG L F, LI Q Q, et al .. miR-130a/TGF- β1 axis isinvolved in sow fertility by controlling granulosa cell apoptosis [J].Theriogenology, 2020, 157: 407-417.
[21] LARSON S, ZHOU R, LI K, et al .. Genetic diversity in thestress regulatory gene LUMAN/CREB3 of Yorkshire andMeishan pigs [J]. Can. J. Anim. Sci., 2021, 101(4): 798-804.
[22] ZHOU R, YANG Y L, LIU Y, et al .. High serum reproductivehormone levels at mid-pregnancy support Meishan pigprolificacy [J]. J. Integr. Agric., 2023, 22(11): 3489-3499.
[23] MAYR B, MONTMINY M. Transcriptional regulation by thephosphorylation-dependent factor CREB [J]. Nat. Rev. Mol.Cell. Biol., 2001, 2(8): 599-609.
[24] LAN X L, JIN Y P, YANG Y Z, et al .. Expression andlocalization of Luman RNA and protein during mouseimplantation and decidualization [J]. Theriogenology, 2013,80(2): 138-144.
[25] ANDREW D J, BAIG A, BHANOT P, et al .. The DrosophiladCREB-A gene is required for dorsal/ventral patterning of thelarval cuticle [J]. Development,1997,124(1): 181-193.
[26] 蘭向莉. Luman在小鼠卵巢、輸卵管、子宮中表達[D].楊凌:西北農林科技大學, 2013.
LAN X L. Expression of Luman in mouse ovary, testis anduterus [D]. Yangling: Northwest Aamp;F University, 2013.
[27] 趙璠.Luman在小鼠顆粒細胞和子宮內膜基質細胞功能調節中的作用研究[D].楊凌: 西北農林科技大學, 2018.
ZHAO F. The regulation of Luman on the funactionality ofgranulosa cell and endometrial stromal cell [D]. Yangling:Northwest Aamp;F University, 2018.
[28] PENNEY J, MENDELL A, ZENG M H, et al .. LUMAN/CREB3is a key regulator of glucocorticoid-mediated stress responses [J].Mol. Cell. Endocrinol., 2017, 439: 95-104.
基金項目:科技創新2030重大項目(2023ZD0404702);國家自然科學基金項目(32130102,31972541)。

