紫花苜蓿不育系與保持系線粒體全基因組比較分析



摘要:細胞質雄性不育(Cytoplasmic male sterility,CMS),它可以極大地減少人工去雄所帶來的人工成本。本試驗以紫花苜蓿(Medicago sativa L.)不育系MSGN-1A及其保持系MSGN-1B為試驗材料,采用二代Illumina Hiseq測序技術結合三代PacBio測序技術,并以三代Naopore測序作為輔助進行gap補平,對2份材料的線粒體基因組測序后進行組裝,并比較分析不育系和保持系的線粒體基因組結構和基因差異。結果顯示紫花苜蓿MSGN-1A和MSGN-1B線粒體基因組大小分別為297 940 bp和310 534 bp,兩份材料均注釋到蛋白編碼基因31個,tRNA基因分別為18個和17個,均注釋到3個rRNA基因。不育系和保持系對比發(fā)現存在大量的SNPs和InDels,導致部分蛋白編碼基因的編碼產物發(fā)生變化。預測編碼開放閱讀框(Open reading frame,ORFs)分別為67個和71個,預測到不育系特有的ORFs為20個,其中8個含有跨膜結構域。最終篩選出atp8,nad4,rps3,ccmFn四個蛋白編碼基因和orf145a,orf135b兩個ORFs,可能與紫花苜蓿細胞質雄性不育有關。
關鍵詞:紫花苜蓿;細胞質雄性不育;線粒體基因組;差異基因
中圖分類號:S812""" 文獻標識碼:A""""" 文章編號:1007-0435(2024)09-2737-12
doi:10.11733/j.issn.1007-0435.2024.09.007
引用格式:
賈" 雪, 蔡回彩, 于" 瀾,等.紫花苜蓿不育系與保持系線粒體全基因組比較分析[J].草地學報,2024,32(9):2737-2748
JIA Xue, CAI Hui-cai, YU Lan,et al.Comparison of Mitochondrial Genome Between Sterile Line and Maintainer Line of Medicago sativa L.[J].Acta Agrestia Sinica,2024,32(9):2737-2748
Comparison of Mitochondrial Genome Between Sterile Line and
Maintainer Line of Medicago sativa L.
JIA Xue, CAI Hui-cai, YU Lan, LI Pei, XU Bo*
(College of Forestry and Grass Science, Jilin Agricultural University, Changchun, Jilin Province 130118, China)
Abstract:Cytoplasmic male sterility (CMS) can significantly reduce the labor costs associated with artificial emasculation. In this study,the sterile alfalfa line MSGN-1A and its maintainer line MSGN-1B were utilized as experimental materials. The second-generation Illumina Hiseq sequencing technology,combined with third-generation PacBio sequencing technology and third-generation Naopore sequencing was employed to assist filling the gap. The mitochondrial genomes of the two materials were sequenced and assembled. Subsequently,a comparison and analysis of the mitochondrial genome structure and gene differences between the sterile line and the maintainer line were conducted.The results revealed that the mitochondrial genome sizes of MSGN-1A and MSGN-1B were 297 940 bp and 310 534 bp,respectively. Additionally,31 protein-coding genes,18 tRNA genes,and 3 rRNA genes were annotated in both materials. A significant number of SNPs and InDels were identified in both sterile lines and maintainers,which lead to the changes in the coding products of certain protein-coding genes. Furthermore,67 coded Open Reading Frames (ORFs) were predicted for MSGN-1A,while 71 ORFs were predicted for MSGN-1B. Among these ORFs,20 were specific to sterility lines with eight containing transmembrane domains.Finally,four protein-coding genes (atp8,nad4,rps3,and ccmFn) along with two ORFs (orf145a and orf135b) were identified as potential candidates related to cytoplasmic male sterility in alfalfa.
Key words:Alfalfa (Medicago sativa L.);Cytoplasmic male sterility;Mitochondrial genome;Differential genes
收稿日期:2024-02-29;修回日期:2024-04-19
基金項目:科技創(chuàng)新2030-重大項目(2022ZD04012)資助
作者簡介:
賈雪(1999-),女,漢族,遼寧沈陽人,碩士研究生,主要從事草種質資源與遺傳育種研究,E-mail:1658380989@qq.com;* 通信作者Author for correspondence,E-mail:xubo0308@126.com
紫花苜蓿(Medicago sativa L.),是一種優(yōu)良的多年生的豆科牧草,堪稱“牧草之王”,其具有良好的適口性、較高的蛋白質含量和優(yōu)良的草種品質被作為優(yōu)質飼草在全世界許多地區(qū)廣泛種植。可以利用雜種優(yōu)勢增加紫花苜蓿的產量和品質[1],但是對于紫花苜蓿這類雌雄同花,有性生殖且異花授粉的植物來說,如何防止外源花粉的入侵和自花授粉則是這一類植物進行雜交育種的一個重要問題[2],利用雄性不育系進行雜交制種則為紫花苜蓿的雜種優(yōu)勢利用開辟了新途徑[3]。雄性不育系普遍存在于高等植物中,目前已經在小麥(Triticum aestivum L.)、玉米(Zea mays L.)、水稻(Oryza sativa L.)、辣椒(Capsicum annuum L.)、棉花(Gossypium spp.)和甜菜(Beta vulgaris L.)等在內的43科162屬617種或種間,發(fā)現了雄性不育現象[4]。雄性不育系作為遺傳育種研究中的重要資源,利用其作為母本獲得雜交種子,不僅可以提高制種效率,提高種子產量,還可以極大的縮短育種年限。
目前通常會將雄性不育分成兩類,一類是由細胞核調控的雄性不育,我們稱之為核不育型(nucleus male sterility,GMS);另一類是由細胞核和細胞質共同作用進行調控的雄性不育,即核質互作不育型(Cytoplasmic male sterility,CMS),也叫細胞質雄性不育。細胞質雄性不育的育性主要是由胞質中的基因調控的,而在高等植物的細胞質的細胞器中,線粒體作為供能中心,為植物的生長發(fā)育提供能量。與此同時線粒體的結構復雜,可以對外來的基因進行整合,依據之前細胞質基因組的研究結果表明,不育基因主要存在與線粒體上,一部分嵌合基因的改變或是形成了特有的ORF(Open reading frame,ORFs)都會影響植物的育性[5]。目前的研究先后發(fā)現了玉米中的orf346[6],棉花中的orf610[7],orf160a基因[8],油菜中的orf138,orf288[9],orf224基因[10],小麥中的orf79基因和orf182基因[11]等多個細胞質雄性不育基因,基于以上的研究人們也推測,植物的CMS主要是由線粒體DNA的突變和重組引起的,與重排產生的特異性前和基因密切相關,但對于紫花苜蓿線粒體與其細胞質雄性不育之間的關聯(lián)卻鮮見報道。
本研究采用現有的紫花苜蓿不育系MSGN-1A和保持系MSGN-1B作為試驗材料。對兩份材料的線粒體基因組進行測序并加以組裝和注釋,分析兩系線粒體基因組的差異和線粒體基因組結構上的變異,并篩選可能與紫花苜蓿細胞質雄性不育相關的編碼基因及ORFs,為進一步在分子水平上解釋紫花苜蓿雄性不育的敗育機理提供依據。
1" 材料與方法
1.1" 試驗材料
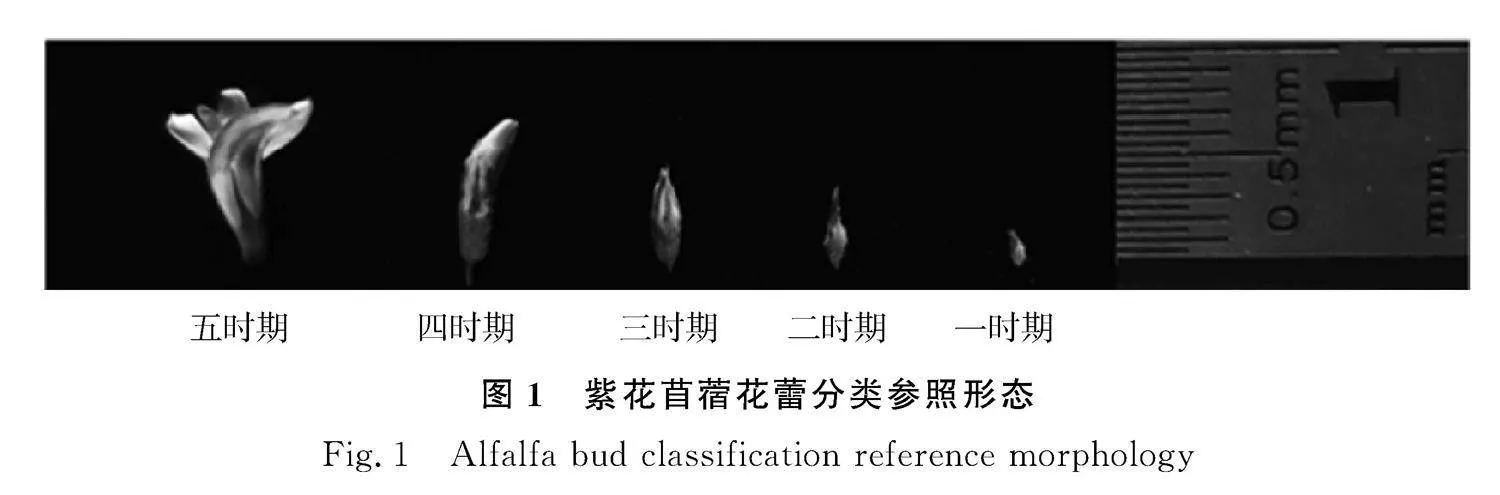
用于進行線粒體基因組測序和比較分析的MSGN-1A為紫花苜蓿雄性不育系,MSGN-1B為其對應的保持系。均為2008年于洪柱等人[12]在紫花苜蓿品種‘公農1號’‘公農3號’和‘公農3號’的衛(wèi)星搭載的后代中發(fā)現的紫花苜蓿雄性不育的新材料MS-GN品種的子代,將紫花苜蓿不育系及保持系的花蕾按照如圖1的狀態(tài)進行時期的區(qū)分,保留花藥,用于提取RNA,MSGN-1A和MSGN-1B兩份材料種子及花蕾均獲取于吉林省長春市吉林農業(yè)大學草業(yè)科學試驗田。
1.2" 紫花苜蓿不育系及保持系測序材料的準備
選取籽粒飽滿的干凈的紫花苜蓿不育系及保持系的種子,經消毒后放置于MS培養(yǎng)基中進行無菌苗培養(yǎng),培養(yǎng)至兩片子葉完全展開時,剪下子葉置于誘導培養(yǎng)基中進行愈傷組織誘導,最后選取長勢良好且無綠色芽點的愈傷組織分別混合后,經液氮速凍,置于-80℃冰箱保存,用于后續(xù)樣品的送測。
1.3" 紫花苜蓿不育系及保持系線粒體基因組測序及組裝
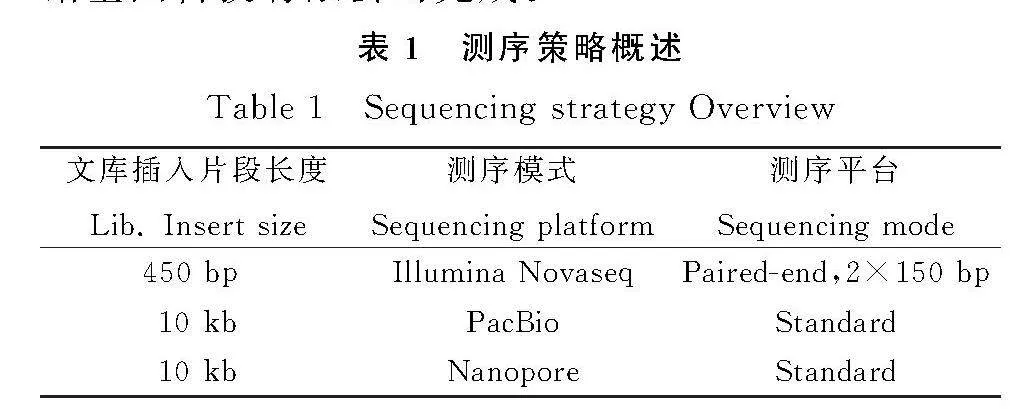
研究采用全基因組鳥槍法(Whole Genome Shotgun,WGS)策略,建立了不同插入片段的文庫。使用了第二代測序技術(Next-Generation Sequencing,NGS),采用Illumina Novaseq測序平臺。同時,還運用了第三代單分子測序技術,使用PacBio測序平臺對文庫進行測序,并結合第三代Nanopore測序對gap進行填補。每個樣本分別構建了3種文庫(見表1)。最終,根據參考基因組,確定了紫花苜蓿線粒體的起始位置和方向,得到了最終的紫花苜蓿線粒體基因組序列。這些測序服務均由南京派森諾基因科技有限公司完成。
1.4" 紫花苜蓿線粒體基因組組分分析
利用同源預測、tRNAscan-SE v2.0.7等軟件,對基因組中包含的ncRNA進行了預測。通過同源比對預測的方式,對樣本基因組進行基因預測。在NCBI上對線粒體參考基因組的蛋白序列進行快速比對到樣本基因組。過濾不好的比對結果,去冗余,然后進行人工過濾不好的比對結果,獲得高準確性的保守基因集。使用getorf軟件對植物線粒體進行全基因組ORFs掃描,設置的參數是:-table 1 -minsize 300(長度閾值為100 aa)。使用軟件OGDRAW(https://chlorobox.mpimp-golm.mpg.de/OGDraw.html)將基因預測的結果進行可視化分析。利用軟件TMhmm 2.0,對ORFs的跨膜結構進行分析。
1.5" 紫花苜蓿線粒體基因功能注釋
在線粒體中預測得到的蛋白編碼基因與各種數據庫中包含的蛋白質進行blastp比較,若該蛋白質和數據中的某一蛋白質具有顯著的序列相似性,則可以初步確定該蛋白具有和數據庫中的蛋白質具有相似甚至是相同的功能。常見的數據庫主要包括:NR庫(http://www.ncbi.nlm.nih.gov/),以及SwissProt庫(http://www.ebi.ac.uk/uniprot/),eggNOG庫(http://eggnogdb.embl.de/),外加KEGG庫(http://genome.jp/kegg/)和GO庫(http://geneontology.org/)。
1.6" 線粒體全基因組共線性、SNPs和InDels分析分析
用MUMmer v3.23軟件對MSGN-1A和MSGN-1B線粒體基因組進行共線性分析,確定兩者間大范圍的共線性關系。找出潛在的SNP位點,再使用LASTZ軟件對兩份材料的線粒體基因組進行比對,得到可能存在的InDel位點,并確定其易位區(qū),倒置區(qū)及易位+倒置區(qū)。
1.7" 6個候選基因在紫花苜蓿花藥發(fā)育不同時期的qRT-PCR分析
使用Bio-rad CFX96 Touch PCR(Hamburg,Germany)和SYBR Green Realtime PCR Master Mix (Toyobo,日本)試劑盒進行qRT-PCR分析。以β-Actin基因作為內參,使用2-ΔΔCT法計算相對的基因表達水平。每個時期的樣品進行三個技術學重復,實時熒光定量引物見表2。
2" 結果與分析
2.1" 紫花苜蓿線粒體基因組測序結果
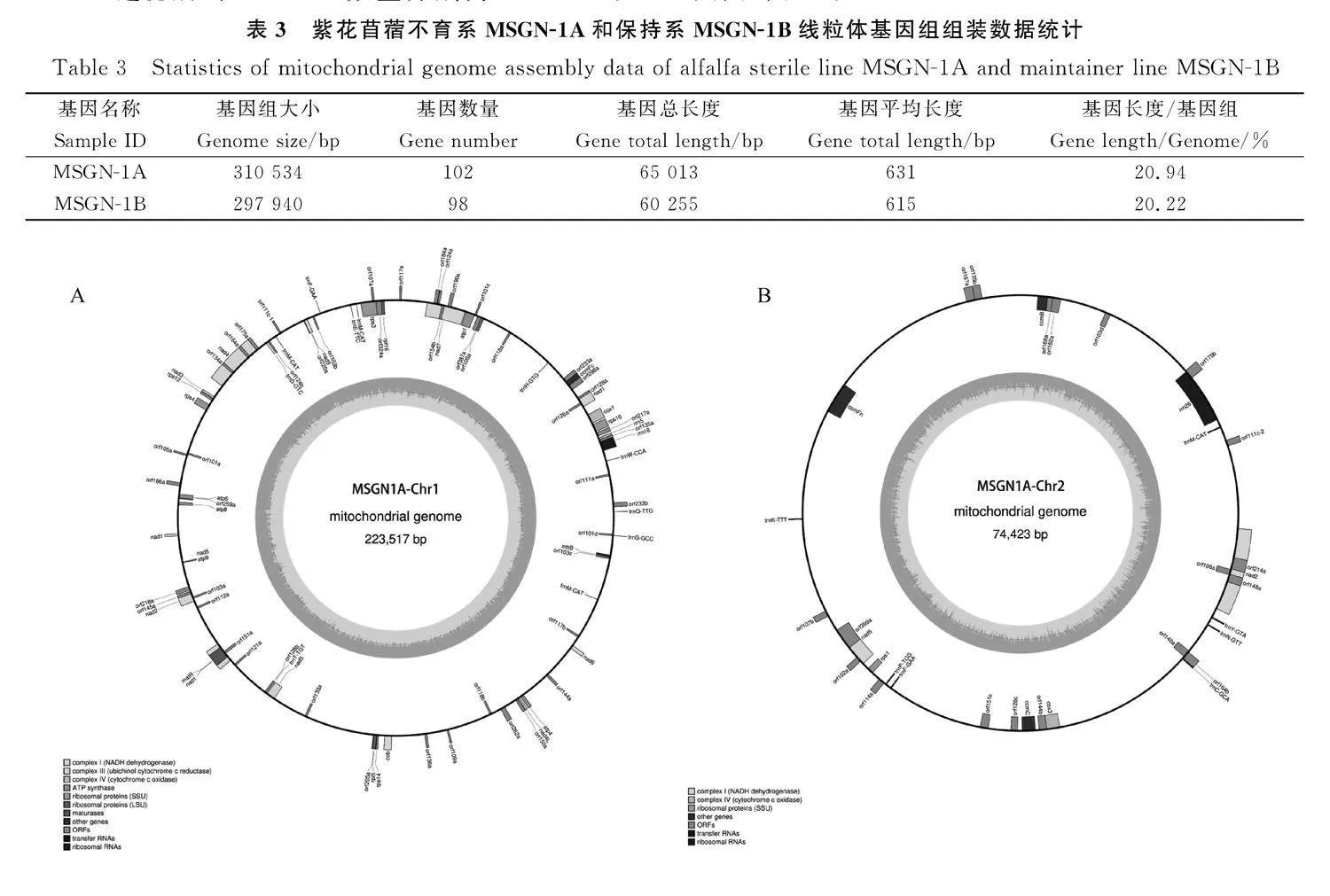
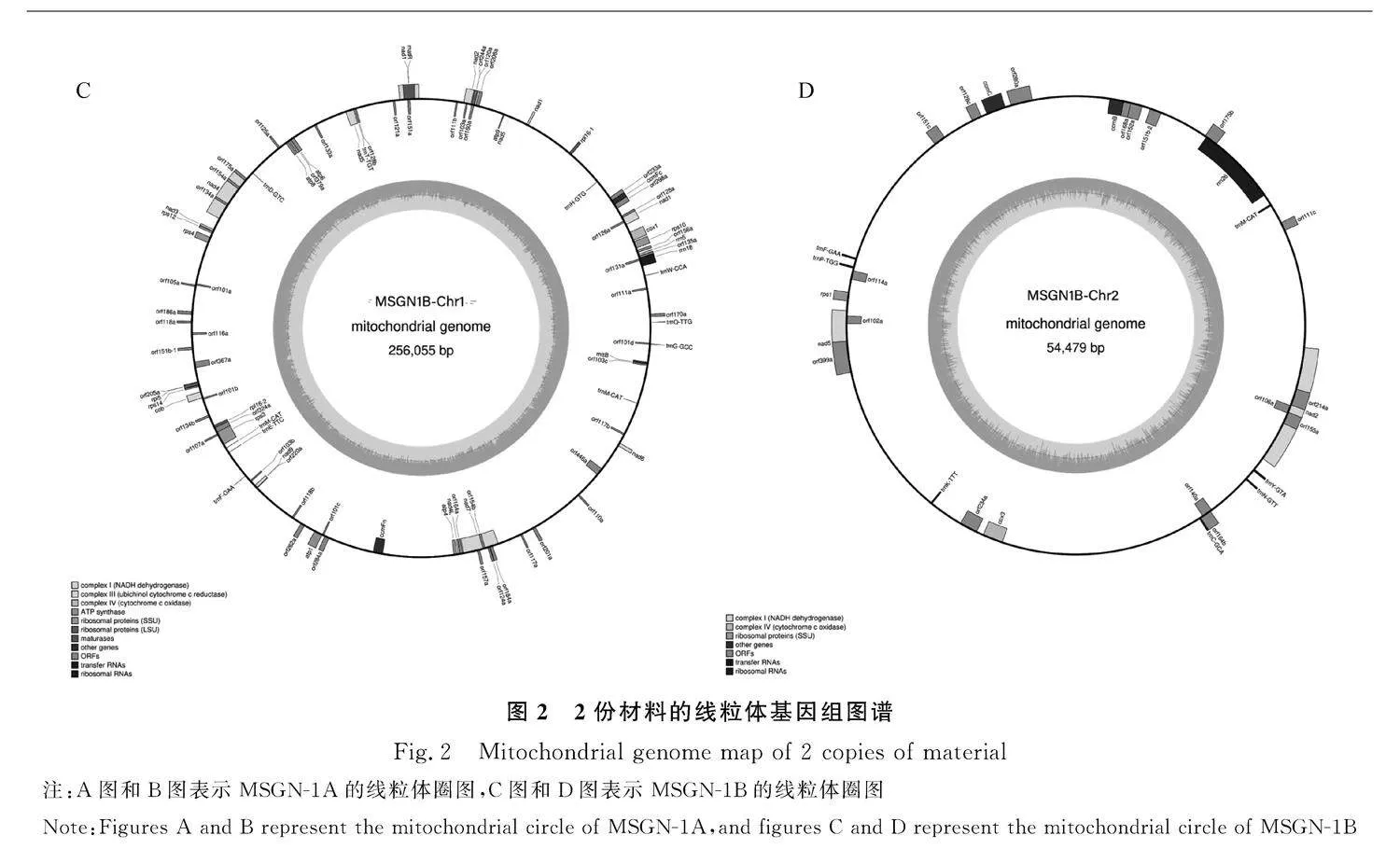
2.1.1" 紫花苜蓿線粒體基因組序列分析" 對不育系MSGN-1A和保持系MSGN-1B的線粒體基因組分別進行了測序。首先通過Illumina NovaSeq 6000測序,從MSGN-1A和MSGN-1B分別獲得3797.6 Mb和2535.3 Mb的過濾數據,在測序的原始數據占比96.37%和94.32%。MSGN-1A和MSGN-1B的Q30值分別為90.95%和89.92%。在而后的PacBio測序結果顯示,MSGN-1A和MSGN-1B過濾后的subreads數量分別為133 489和117 419,總大小分別為1 345 587 352 bp和1 377 144 050 bp。MSGN-1A的N50和N90分別為14 394 bp和6854 bp,subreads的平均長度為11 728 bp,最長的大小為47 555 bp;MSGN-1B的N50和N90分別為12 991 bp和5647 bp,subreads的平均長度為10 080 bp,最長的大小為42 670 bp。利用生物學軟件OGDRAW將MSGN-1A和MSGN-1B的線粒體基因組進行組裝,分別得到大小為297 940 bp和310 534 bp的環(huán)狀基因組,GC含量分別為45.43%和45.21%(表3),經可視化分析后,分別組裝成兩個沒有間隙的環(huán)狀基因組圈圖(圖2)。
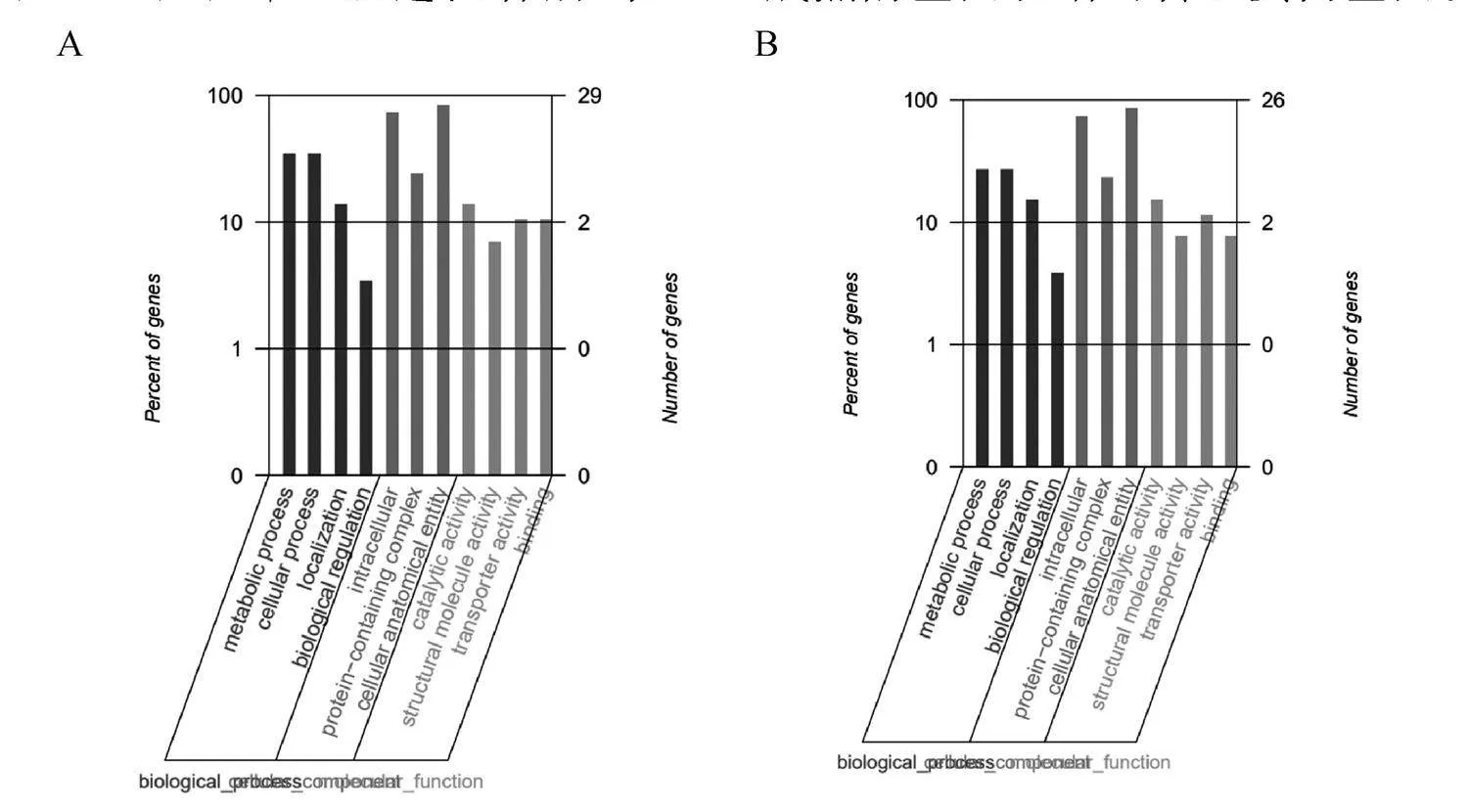
2.1.2" 紫花苜蓿線粒體基因組注釋" 利用五個數據庫對兩份材料的線粒體基因組進行注釋,五個參考數據庫的注釋結果顯示:NR和Swiss-Prot注釋的基因數量最多,GO和KEGG注釋到的基因數量最少,但注釋到的基因數目相同。GO注釋的結果如圖所示(圖3A,3B),兩份材料的大部分的基因均被聚類到了生物的代謝過程中。而后利用KEGG數據庫對兩份材料的線粒體基因組進行富集,結果顯示兩份材料大部分基因除富集到人類疾病的基因外,其余基本都被富集到氧化磷酸化和代謝通路(圖3C,3D)。KOG功能分類統(tǒng)計結果顯示絕大多數的基因功能注釋主要集中在能量的產生和轉換的過程中(圖3E,3F)。
2.1.3" 線粒體基因組組分分析" 經過注釋后,在MSGN-1A中,共識別了31個蛋白編碼基因,67個orfs和21個非編碼RNA(non-coding RNA,ncRNAs),在MSGN-1B中識別了31個編碼基因,71個orfs和20個ncRNAs,兩份材料識別到的這些ORFs都編碼超過100個氨基酸的蛋白質,與此同時,通過注釋結果顯示二者均鑒定出相同的31個蛋白質編碼基因(表4)。此外,MSGN-1A的線粒體基因組和MSGN-1B中分別預測出11個和20個特有的orfs。MSGN-1A線粒體基因組和MSGN-1B線粒體基因組的大多數基因參與編碼NADH-泛醌氧化還原酶、細胞色素bc1、細胞色素c氧化酶、ATP合酶、核糖體大亞基蛋白基因、胞嘧啶C基因、成熟酶基因和編碼轉運蛋白基因。
2.2" 紫花苜蓿線粒體基因組比較分析
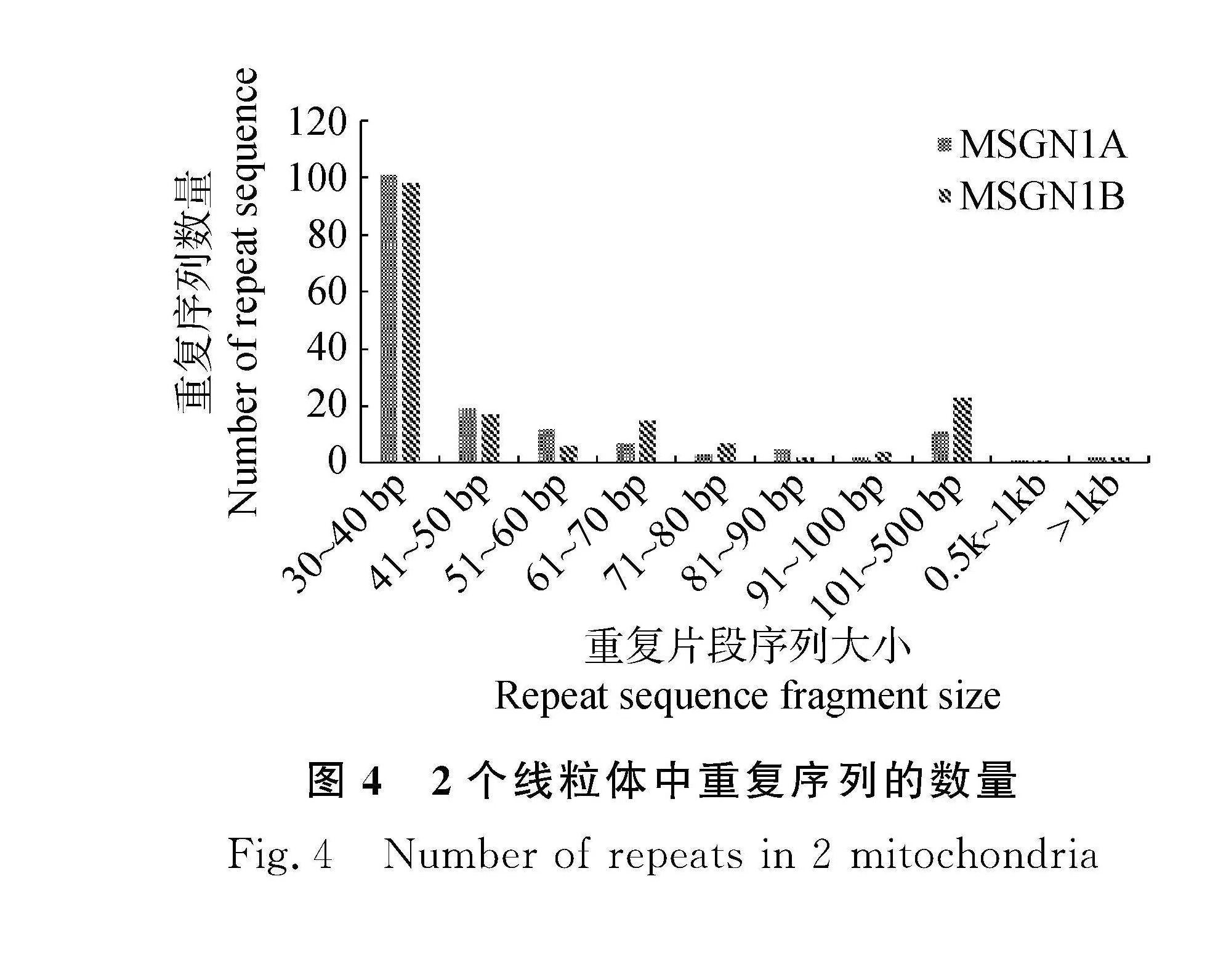
2.2.1" 重復序列分析" 在紫花苜蓿不育系MSGN-1A和保持系MSGN-1B中都存在著大量的重復序列,其中以30~40 bp的重復序列數目最多,其次才是41~50 bp,101~500 bp,51~60 bp的重復序列(圖4),雖然短序列片段不存在有較高的活性,也引起不了基因組結構和大小上過多的變化,但是它們卻也往往可以導致重組的產生。與此同時,小于100 bp的重復序列數目在不育系和保持系中差別不大,但二者在超過100 bp的重復序列的數量上存在著很大的差別。
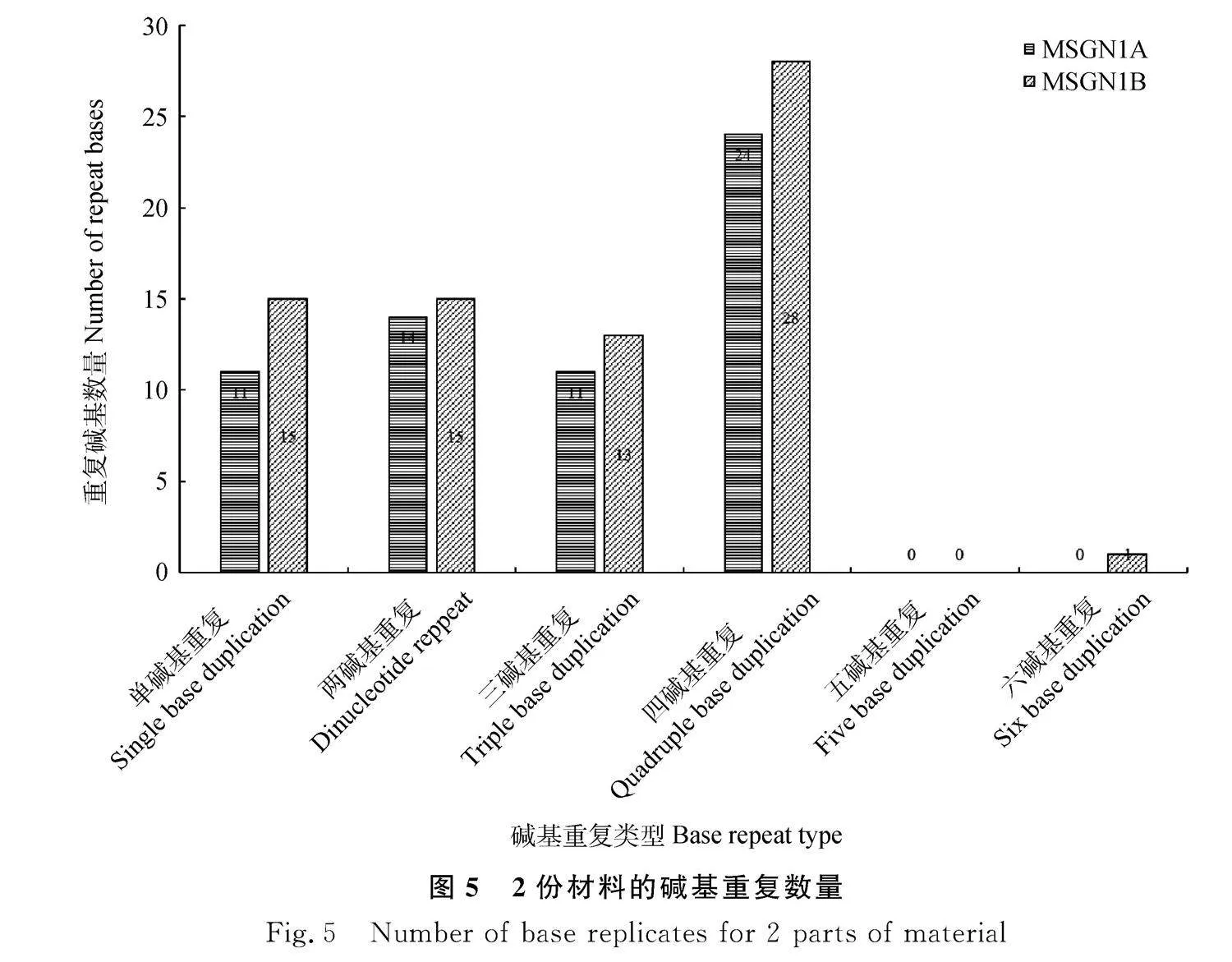
利用軟件SSR Hunter,搜索不育系MSGN-1A和保持系MSGN-1B線粒體基因組中的存在的SSR點位,兩份試驗材料線粒體基因組中的SSR數量為60~72個,其中兩堿基的重復在2份材料中差別不大,且它們均不存在五堿基的重復。而其他重復不育系則明顯少于保持系(圖5)。
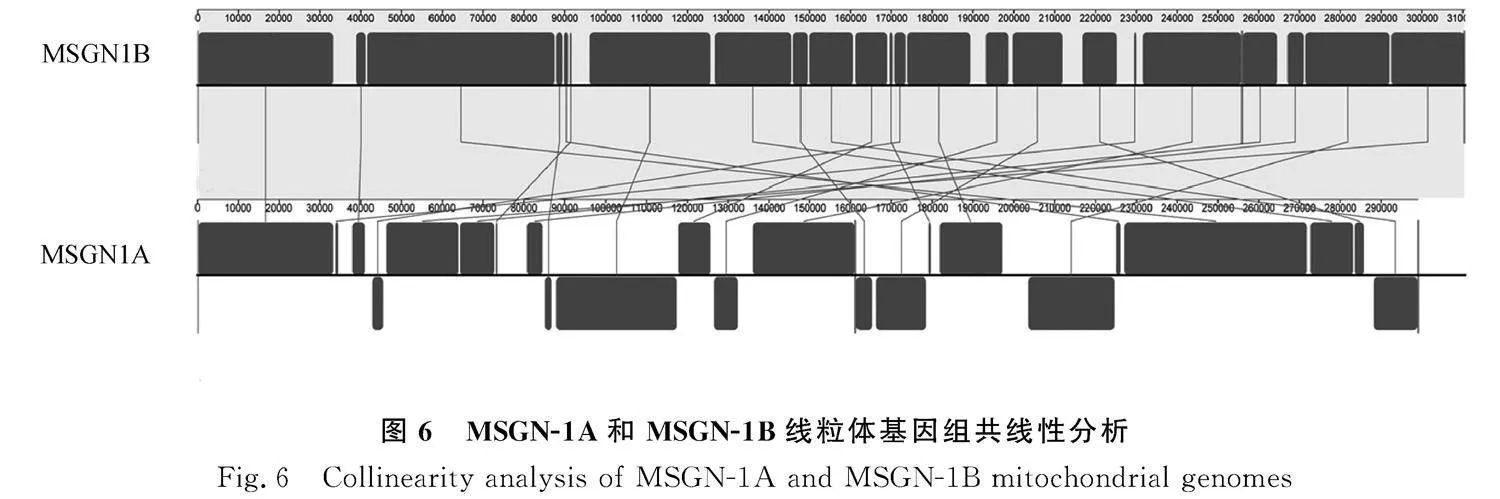
2.2.2" 紫花苜蓿不育系及保持系序列共線性分析" 通過對不育系MSGN-1A和保持系MSGN-1B進行了比較分析。在基因組大小方面,發(fā)現MSGN-1A的基因組大小比MSGN-1B小12 594 bp。共鑒定出20個共線序列塊,其中6個序列塊在MSGN-1A與MSGN-1B之間發(fā)生了反轉。排列順序發(fā)生了很多改變,MSGN-1B的長度稍短。不育系相較保持系存在一定片段缺失。通過圖6的結果顯示,盡管兩者線粒體基因組的組成非常相似,但在不育系細胞質和保持系細胞質之間的線粒體基因組結構上存在顯著差異。
2.3" 紫花苜蓿線粒體基因組差異基因分析
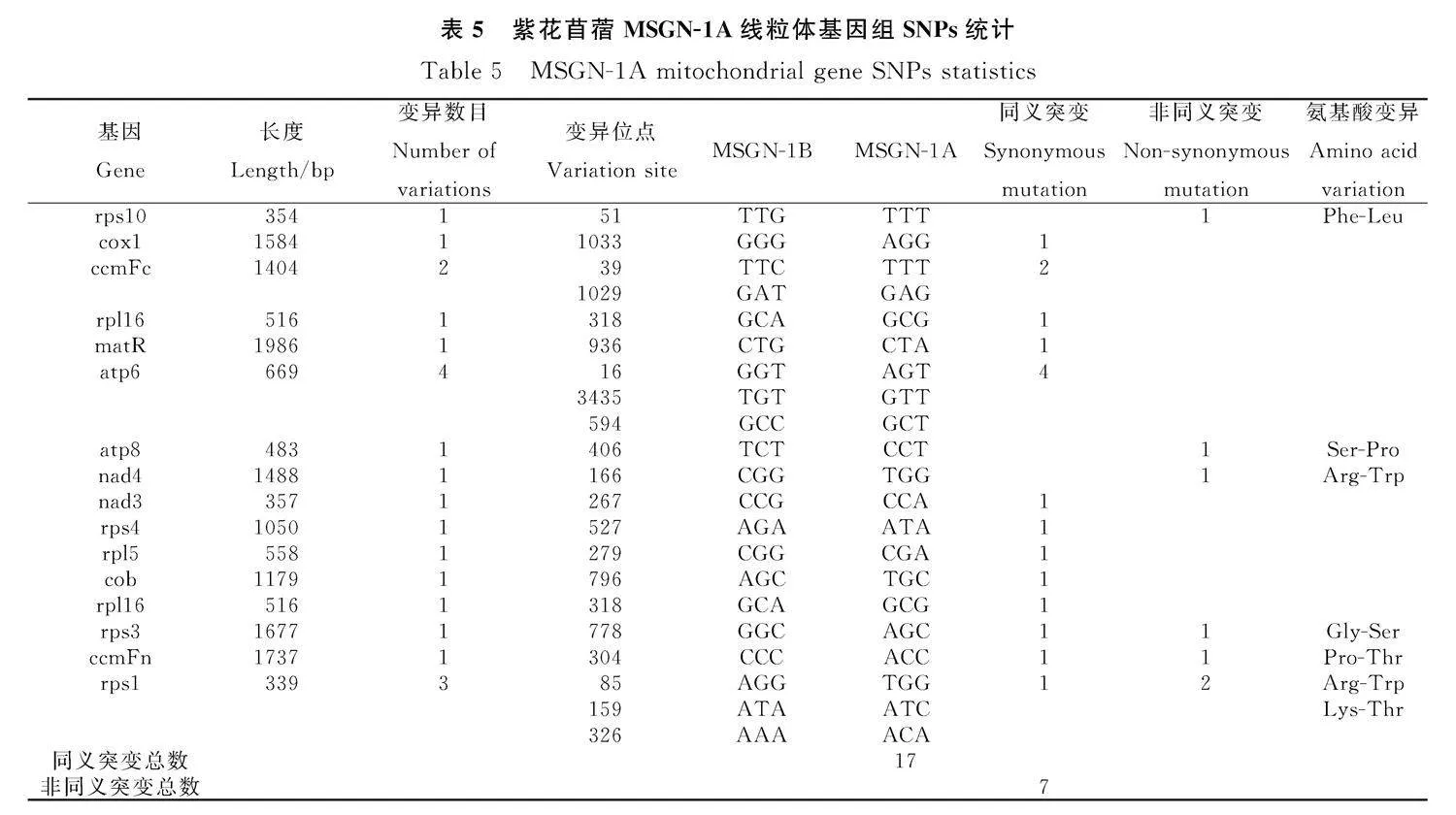
2.3.1" SNPs和InDel統(tǒng)計及差異蛋白編碼基因分析" 通過對不育系MSGN-1A線粒體基因組和保持系MSGN-1B線粒體基因組中的蛋白編碼基因序列比對發(fā)現,在MSGN-1A中鑒定出336個SNPs,有24個SNPs位于16個蛋白質編碼基因中,包括17個同義突變和7個非同義突變;312個SNPs位于非編碼區(qū),蛋白質編碼基因中的同義突變占總SNP的4.761,9%,非同義占總SNP的2.083 3%。rps10,atp8,nad4,rps3,ccmFn這五個基因包含5個非同義突變,cox1,ccmFc,rpl16,matR,nad3,rps4,rpl5,cob和rpl16這9個基因包含11個同義突變。與此同時,atp6和rps1包含的SNP最多,atp6包含4個同義突變,rps1包含1個非同義突變和2個同義突變。在所有的SNPs中,36.4%的SNPs都是A-G發(fā)生了顛換。以上的基因中,通過統(tǒng)計發(fā)現,核糖體蛋白的編碼基因更容易發(fā)生突變(表5)。
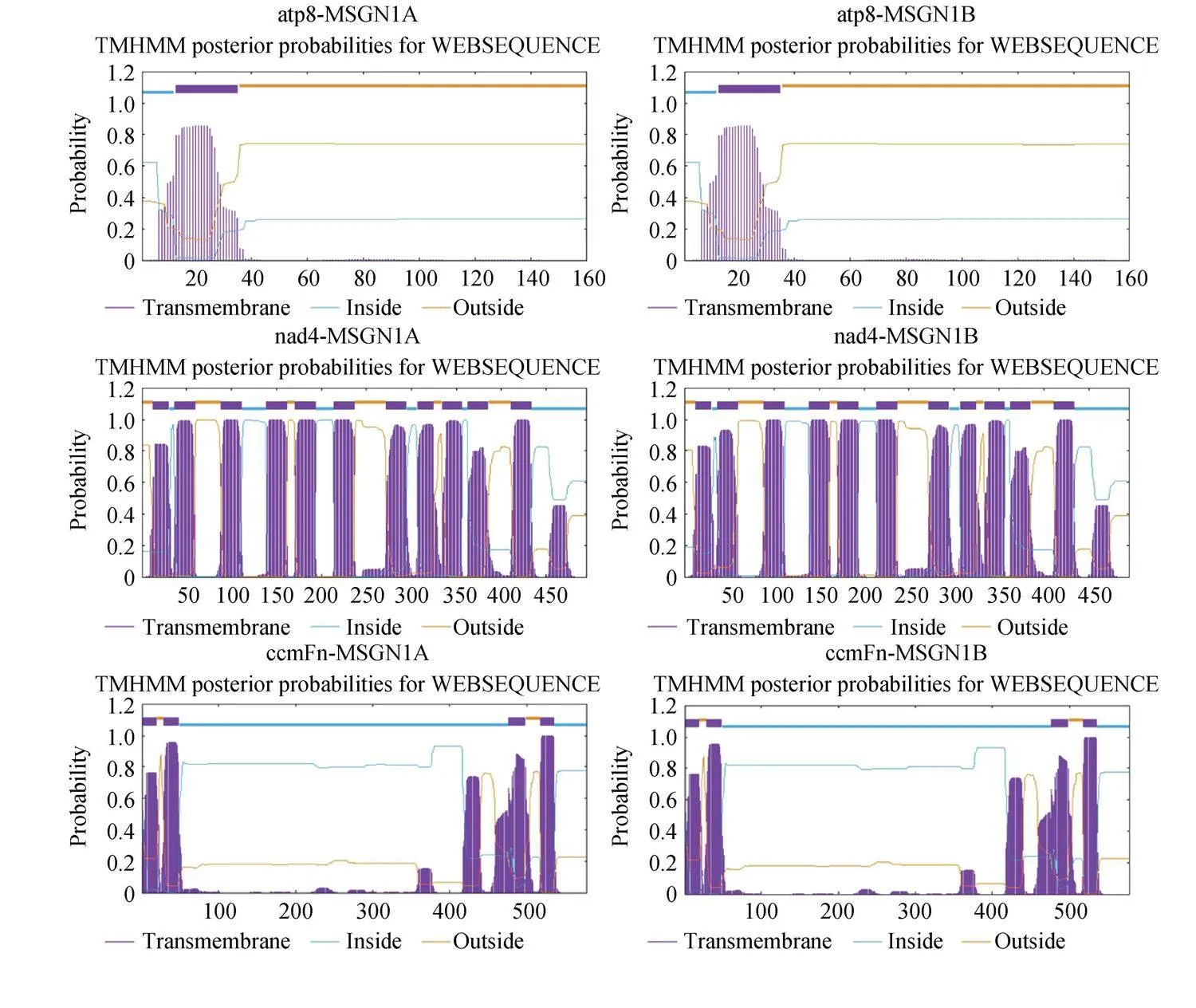
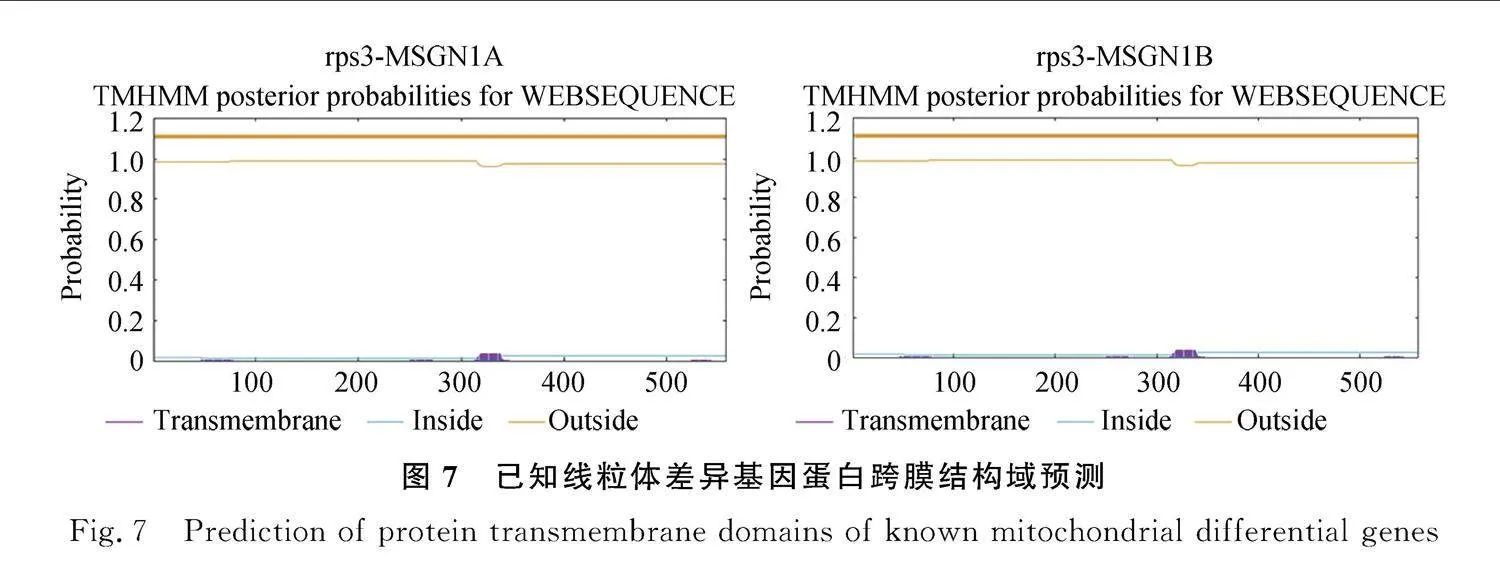
對MSGN-1A的線粒體基因組的InDel分析的結果顯示,共存在89個InDels,在蛋白質編碼區(qū)存在一個InDel,為rps10基因的58 bp處存在一個6堿基的缺失,導致該基因的蛋白編碼產物缺少一個天冬酰胺和一個苯丙氨酸。其余88個InDels存在于非編碼區(qū)。其中53個為插入,35個為缺失。與此同時,對以上基因利用TMHMM(http://www.cbs.dtu.dk/services/TMHMM/)進行跨膜結構域預測發(fā)現atp8,nad4,rps3和ccmFn這4個基因具有跨膜結構域(圖7)。
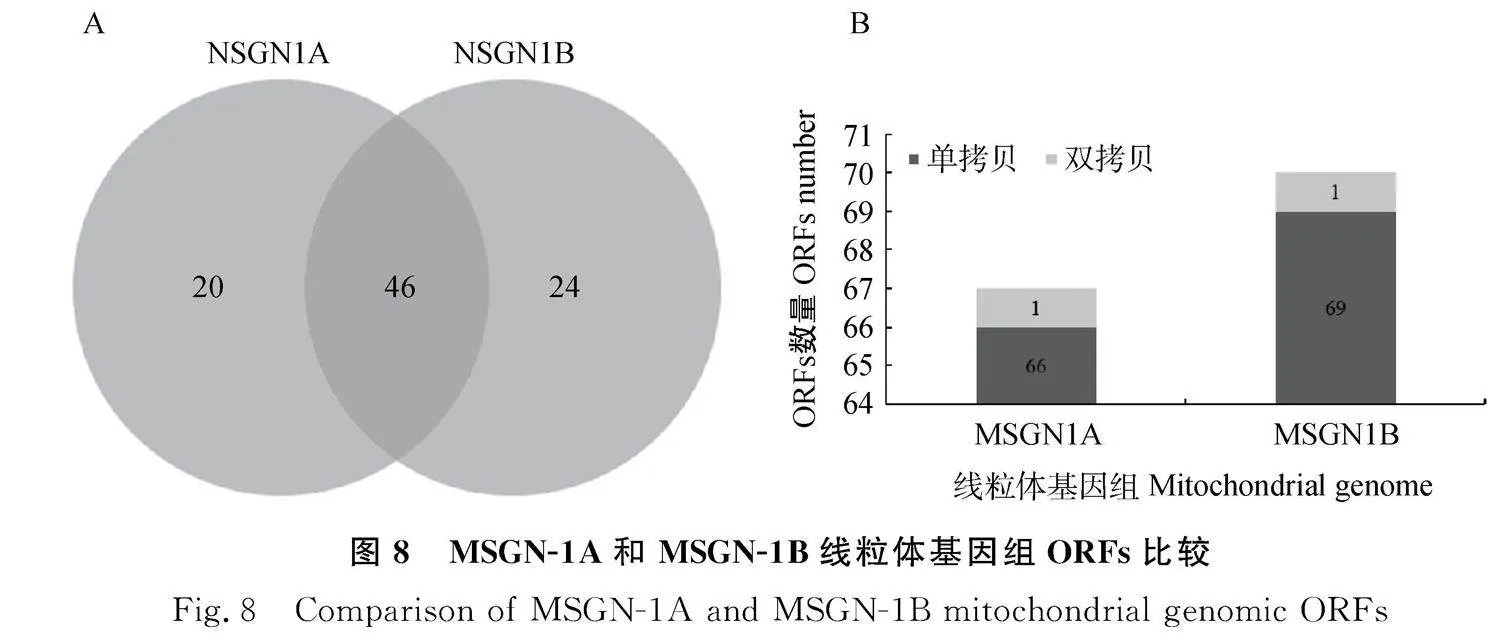
2.3.2" 線粒體基因組ORFs預測" 預測不育系及保持系線粒體基因組的全部ORFs(≥300 bp)發(fā)現,MSGN-1A線粒體基因組中共預測到67個ORFs,MSGN-1B線粒體基因組共預測到71個ORFs,其中46個ORFs為MSGN-1A和MSGN-1B所共有(圖8A);20個ORF為MSGN-1A所特有的;24個ORFs為MSGN-1B所特有的.其中,在保持系MSGN-1B中單拷貝69個,雙拷貝1個,不育系MSGN-1A中單拷貝66個,雙拷貝1個,兩份材料間的拷貝數相差不大(圖8B)。
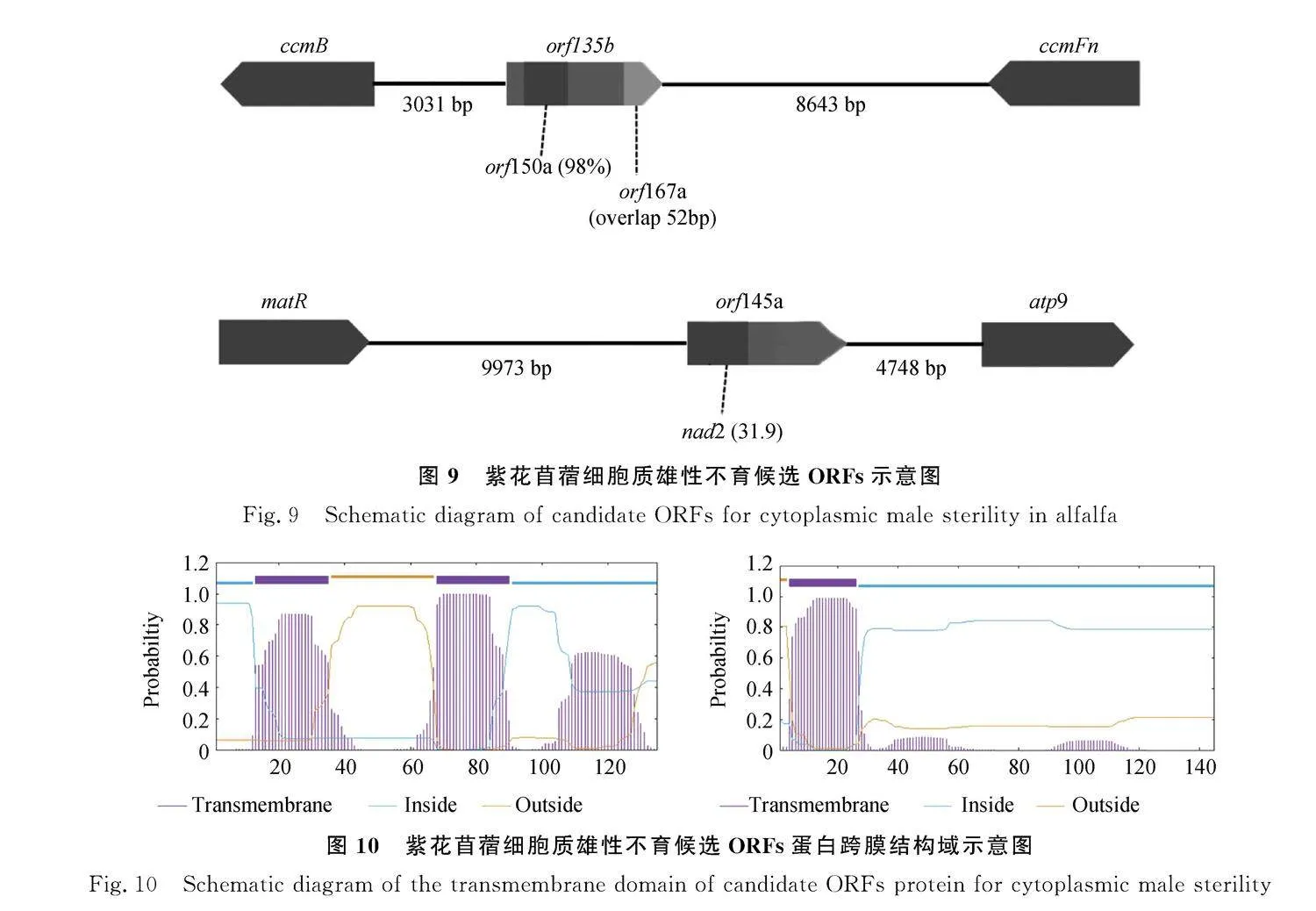
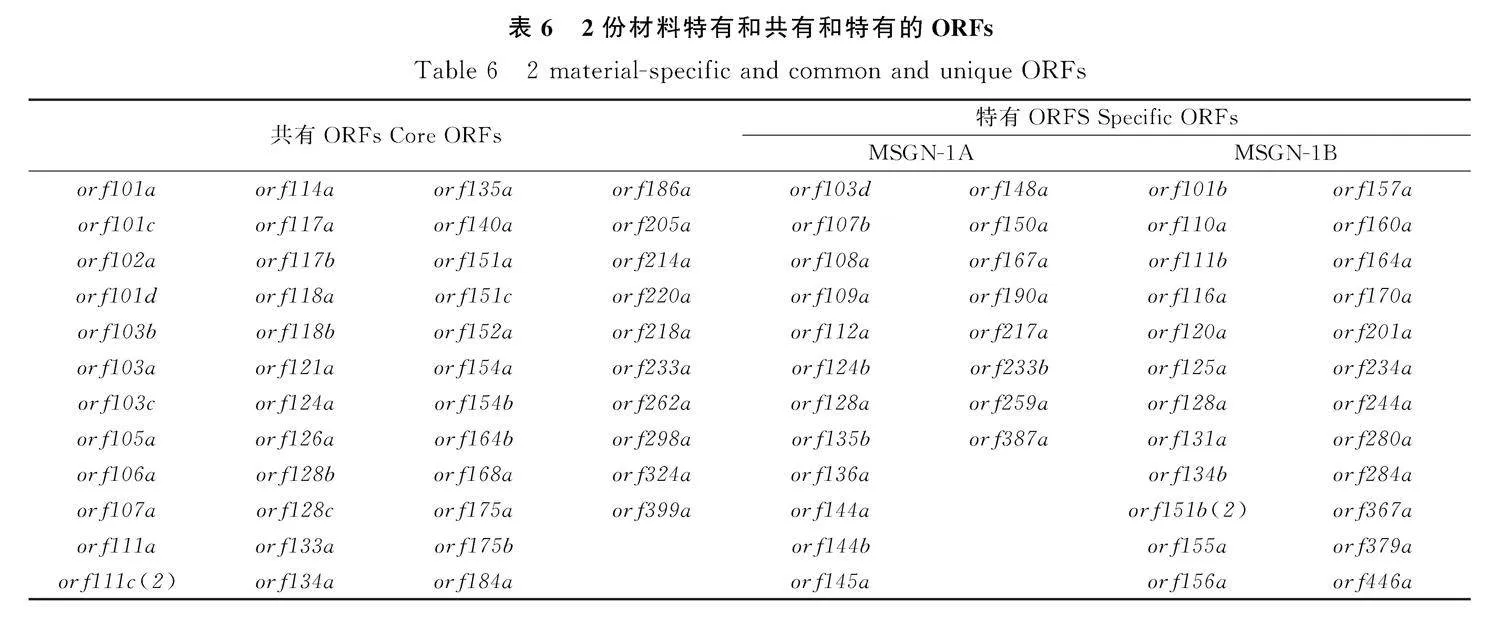
2.3.3" 差異ORFs分析" 對于差異的ORFs的分析發(fā)現,由表6可知,測序結果顯示不育系包括20個獨特的orfs,而不育基因往往來源于不育系特有的ORFs。在20個不育系特有的ORFs中僅orf103d,orf217a,orf259a,orf145a,orf124b,orf112a,orf135b和orf387a以上8個orfs都具有跨膜結構域(圖10),其中orf145a和orf135b存在著嵌合結構。orf145a在末端嵌合了154 bp的已知蛋白編碼基因nad2的序列,orf135b的基因組序列在44 bp處嵌合了168 bp的orf150a序列,與此同時該基因的357~408 bp與orf167a的前端重疊(圖9)。
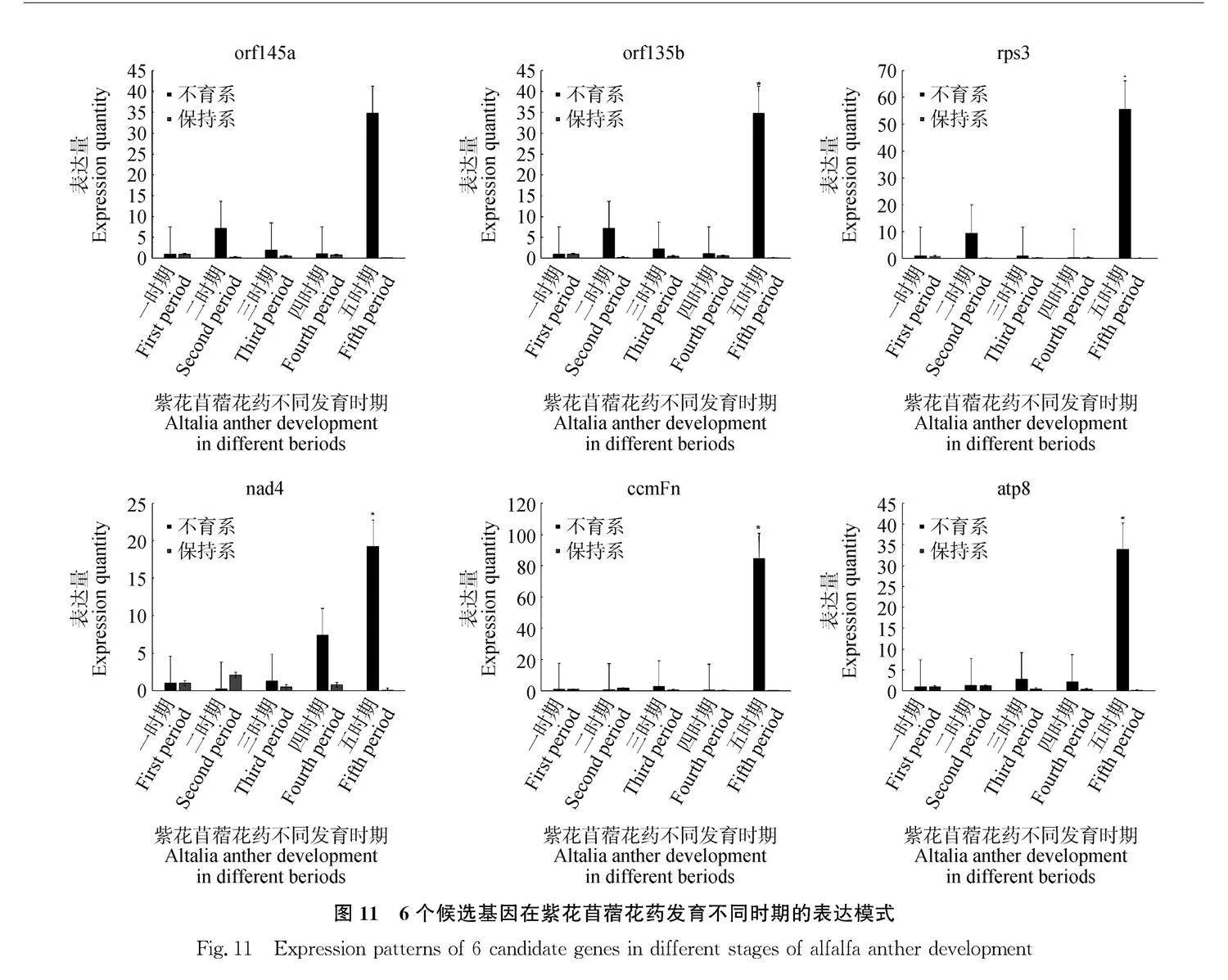
2.3.4" 紫花苜蓿雄性不育候選基因的實時熒光定量分析" 為了驗證以上的4個蛋白質編碼基因和2個orfs在紫花苜蓿不育系和保持系花藥各個時期的表達模式,對它們進行了qRT-PCR的檢測,結果如圖11所示,對于4個蛋白質編碼基因,除nad4基因在二時期的保持系的表達量高于不育系外,其余三個基因在不育系中的表達量均在不同時期高于保持系(以一時期作為空白對照)。測序得到的不育系特有orfs經篩選后的得到的兩個orf135b和orf145a,qRT-PCR的結果顯示,二者在保持系的各時期中雖然也存在一定的低量表達或是不表達,但是在不育系中,均為呈現高表達。因此可以推測以上的6個基因可能是導致紫花苜蓿不育系MSGN-1A發(fā)生CMS的候選基因。
3" 討論
植物中的細胞質雄性不育(Cytoplasmic male sterility,CMS)是作物形成雜交種的重要方式之一,大量的分子生物學研究指出CMS在一定程度上是線粒體基因組中序列的重組與重排引起的[13]。高等植物的線粒體基因組非常龐大的,而且不同物種之間的基因組大小也是從200 kb到2500 kb不等[14-15]。線粒體自己具有一整套獨立的基因組,可以與細胞核內的基因共同調控和編碼線粒體自身所需要的各種蛋白和酶類,線粒體也是細胞中的主要供能場所,有性生殖植物的花粉粒的發(fā)育過程中都需要很多能量來維持,如果線粒體的功能發(fā)生了問題,就會導致無法供能或是過度產能問題,而這些問題都可能導致花粉出現敗育的情況。同時在CMS特殊區(qū)域中的線粒體基因組的重排與重組,也會產生許多新的開放閱讀框(ORFs)、嵌合結構或者與已知的基因產生共轉錄,而這些新的ORFs通常也會影響線粒體的正常代謝功能,這通常也是導致植物發(fā)生CMS的常見原因之一[16]。本研究通對紫花苜蓿雄性不育系MSGN-1A及其對應的保持系MSGN-1B進行了線粒體全基因組測序并對其進行組裝,分別獲得了297 940 bp和310 534 bp的線粒體全基因組。然后對兩個基因組進行比對。篩選出了一部分可能與細胞質雄性不育有關的候選開放閱讀框(ORFs)和已知的編碼基因。
高等植物的線粒體基因組具有節(jié)奏相對較快,重排率較高的特點。這個特點表明線粒體的結構變換頻率和重排率要遠高于葉綠體甚至是其他動物的線粒體,甚至是在植物的不同亞種之間的線粒體基因組結構之間也會有著很大的差別,存在著一些非常明顯的分子間和分子內重組[17]。這也使得線粒體基因組哪怕是在同一物種的不育系和同源保持系之間也可能存在著一定的差異。因此本試驗通過對MSGN-1A及其保持系MSGN-1B的線粒體基因組進行比較分析,發(fā)現二者的基因組在大小上存在著一定的差異,還有一定的序列排列順序的改變以及反轉等,不育系的線粒體基因組較保持系基因組稍小,可能與二者間存在著許多的InDels以及ORFs基因類型的差異有關,與此同時在不育系MSGN-1A的31個蛋白質編碼基因中鑒定出7個非同義突變SNPs,分別位于6個蛋白質編碼基因中,其中也發(fā)現4個存在跨膜結構域的蛋白編碼基因(atp8,nad4,rps3和ccmFn)在兩份材料中編碼產物發(fā)生了變化,因此這些非同義突變也可以被作為篩選導致紫花苜蓿細胞質雄性不育的候選基因的條件之一。同時在對兩份材料的特有ORFs進行比較分析時,發(fā)現不育系中的兩個特有orfs,orf145a和orf135b兩個基因,在不育系特有的前提下,還存在著跨膜結構域和與功能基因的嵌合結構,因此將以上兩個orfs也作為能夠導致紫花苜蓿雄性不育的候選基因之列,通過對以上的基因在紫花苜蓿花藥發(fā)育的不同時期進行qRT-PCR分析,進一步驗證了之前的推測,在日后通過原核表達以及擬南芥或是紫花苜蓿的遺傳轉化,對以上的候選基因的具體功能加以驗證。
4" 結論
目前在主要糧食作物水稻中的CMS-WA型不育究竟是如何與其核編碼的線粒體蛋白相互作用,導致不育以及如何與CMS的恢復基因相互作用的復雜分子機制已經研究清晰,而目前對于紫花苜蓿細胞質雄性不育的理論研究還是稍落后于其他主要栽培農作物,還不夠完整深入,具體的不育機理尚未能夠完全結實清楚,還需要更進一步的研究。本課題組前期通過BSR法將紫花苜蓿雄性不育系與恢復系的相關基因定位比對后發(fā)現MsJMT基因和MsGal基因[18-20]后經過一系列的功能驗證,認定這兩個基因為導致紫花苜蓿雄性不育的基因,后又通過轉錄組和代謝組聯(lián)合分析發(fā)現了紫花苜蓿雄性不育基因MsGDS[21]和MsPL[22]。但目前對于線粒體雄性不育基因關注較少,本研究對紫花苜蓿雄性不育系MSGN-1A和MSGN-1B的線粒體全基因組測序并進行比較,挖掘可能與旨在為解析核質互作不育的機理方面提供細胞質部分候選基因的方面奠定一定的基礎。
參考文獻
[1]" 李澤福,夏加發(fā),唐光勇. 植物雄性不育類型及其遺傳機制的研究進展[J]. 安徽農業(yè)科學,2000(6):742-746
[2]" 金學平,陳彩錦,楊治科,等. 紫花苜蓿雄性不育系研究進展[J]. 安徽農業(yè)科學,2019,47(6):16-19
[3]" BUECKMANN H,THIELE K,SCHIEMAN J. Influence of Soil Moisture and air temperature on the stability of cytoplasmic male sterility (CMS) in Maize (Zea mays L.) [J]. Agricultural Sciences,2016,7(2):70-81
[4]" ISLAM M S,STUDER B,MIILER I M,et al. Genetics and biology of cytoplasmic male sterility and its applications in forage and turf grass breeding [J]. Plant Breeding,2014,133(3):299-312
[5]" 劉芳. 異源胞質雄性不育小白菜分子特性研究[D]. 福州:福建農林大學,2006:34-38
[6]" SANG S,CHENG H,HAO M,et al. Mitochondrial localization of ORF346 causes pollen abortion in alloplasmic male sterility [J]. The Crop Journal,2021,9(6):1320-1329
[7]" ZHANG Y,HAN Y,ZHANG M,et al. The cotton mitochondrial chimeric gene orf610a causes male sterility by disturbing the dynamic balance of ATP synthesis and ROS burst [J]. The Crop Journal,2022,10(6):1683-1694
[8]" 李楊,陳全家,曲延英,等. orf160在不同棉花CMS胞質中的表達分析[J]. 新疆農業(yè)科學,2015,52(3):420-428
[9]" 魏強燕,葛曉宇,趙倫,等. 油菜細胞質雄性不育基因orf138、orf288的功能分析[J]. 華中農業(yè)大學學報(自然科學版),2022,41(3):131-138
[10]趙榮敏,王迎春. 油菜波里馬胞質雄性不育相關線粒體基因orf224在大腸桿菌中的克隆和表達[J]. 農業(yè)生物技術學報,1996,4(1):15-22
[11]應素平. 細胞質雄性不育基因orf182對D1型水稻線粒體呼吸鏈復合物的影響[D]. 南昌:南昌大學,2022:50-53
[12]于洪柱,王志鋒,金春花,等. 苜蓿雄性不育材料的新成員——MS-GN [C].中國草學會牧草育種委員會第七屆代表大會論文集.云南昆明,云南科技出版社,2009:439-439
[13]李彩朝,ZAKARIA G,金威恒,等. 辣椒新細胞質雄性不育線粒體基因組的測序及分析[J]. 分子植物育種,2022,20(16):5250-5257
[14]危文亮,王漢中,劉貴華. 植物細胞質雄性不育性與育性恢復的分子生物學研究進展[J]. 遺傳,2005,27(4):651-658
[15]吳豪,徐虹,劉振蘭,等. 植物細胞質雄性不育及其育性恢復的分子基礎[J]. 植物學通報,2007(3):399-413
[16]王本啟,黃樹蘋,陳霞,等. 辣椒細胞質雄性不育分子生物學組學研究進展[J]. 中國蔬菜,2023(5):42-47
[17]王平,叢玲,王春語,等. 高粱A1型細胞質雄性不育系與保持系線粒體基因組分析比較[J]. 生物技術通報,2019,35(5):42-47
[18]閆冬. 紫花苜蓿雄性不育系轉錄組測序及MsGAL基因的克隆、表達和功能分析[D]. 長春:吉林農業(yè)大學,2021:46-49
[19]徐小博,王鑫堯,郁偉杰,等. 紫花苜蓿MsJMT基因的克隆及其與育性的關聯(lián)分析[J]. 草地學報,2022,30(9):2306-2314
[20]ZHOU L,WANG Y Z,XU X B,et al. Conjunctive analyses of BSA-Seq and BSR-Seq unveil the Msβ-GAL and MsJMT as key candidate genes for cytoplasmic male sterility in alfalfa (Medicago sativa L.) [J]. International Journal of Molecular Sciences,2022,23(13):7172-7192
[21]郁偉杰,苗一凡,穆海婷,等. 轉錄組學解析紫花苜蓿雄性不育系花粉敗育機制[J]. 草地學報,2023,31(6):1702-1713
[22]苗一凡. 紫花苜蓿MsPL基因的克隆、表達模式分析及功能驗證[D]. 長春:吉林農業(yè)大學,2023:39-40
(責任編輯" 劉婷婷)

