H47Q突變對促炎蛋白hGIIA結構穩定性的影響
摘要:為研究H47Q突變對促炎蛋白hGIIA結構穩定性的影響,分別對天然型和突變型(H47Q)的hGIIA進行多次重復模擬,然后對串聯軌跡進行了幾何性質比較、基本動力學分析并構建了自由能圖譜。結果顯示,與天然型hGIIA相比,突變型hGIIA擁有更多的原子間非鍵相互作用,更小的回旋半徑,更低的整體構象柔性和全局自由能最小化區域。與天然型hGIIA相比,突變型hGIIA結構可能采取了更加緊湊包裝,導致hGIIA整體構象柔性的下降,局限在更小的構象空間,不利于hGIIA與底物和整合素的結合。
關鍵詞:IIA分泌型磷脂酶A2;hGIIA;分子動力學;本質動力學;自由能圖譜hGIIA(human group IIA sPLA2,人類IIA分泌型磷脂酶A2)屬于磷脂酶A2(secretory phospholipase A2,sPLA2)家族的酶,該酶由PLA2G2A基因編碼。在細胞外液中,hGIIA通過水解甘油酯中sn2位酯鍵,促使白三烯(前列腺素的前體)、血小板激活因子等炎性介質的產生從而發揮促炎作用。hGIIA的促炎作用不僅與肺癌的形成與轉移密切相關[1],而且在類風濕關節炎[2]、動脈粥樣硬化[3]中也異常表達或活性增強,因此hGIIA被認為是治療炎癥失控癥狀的潛在靶點。遺憾的是,針對hGIIA開發的選擇性抑制劑varespladib和darapladib在Ⅲ期臨床實驗中均未達到預期效果,這表明把hGIIA作為炎癥調節獨立的藥物靶點可能并不合理。hGIIA與細胞上的整合素αvβ3\\α4β1\\α5β1相互作用,同時誘發炎癥反應和細胞增殖,這一事實就是一個很好的證明[4]。hGIIA第47位組氨酸突變為谷氨酰胺(H47Q突變),顯著降低了hGIIA的活性,為hGIIA與整合素作用機制研究提供了新的切入點。
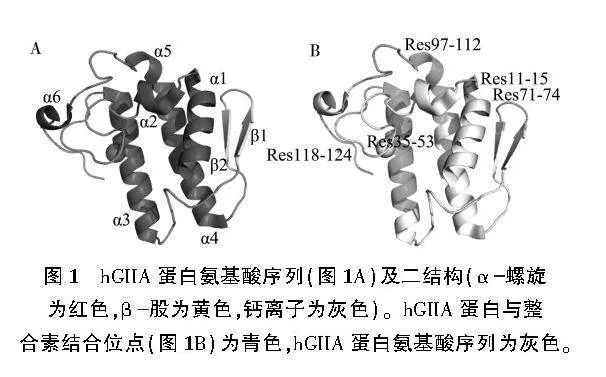
hGIIA全長包括124個氨基酸殘基,相對分子質量約為1.4 kDa。hGIIA晶體結構由一個較小的C端和N端、6個α螺旋、2個β折疊、1個保守的Ca2+結合環和保守的催化二聯體His/Asp(圖1A)。其酶結構只有一個域,底物結合口袋入口主要由α1、α2、Ca2+結合環構成,α3、α4位于結合口袋的底部,與整合素的結合涉及5個肽段(圖1B)。
1材料與方法
1.1模擬體系構建
從PDB數據庫中獲取完整的天然型hGIIA(NThGIIA)結構PDB ID:3U8D和H47Q突變型(MThGIIA)結構PDB ID:1N28。使用PyMOL分解晶體結構均以A鏈作為模板, MThGIIA使用PyMOL的PySwissSidechain插件進行了A1N突變建模,確保了天然型和突變型結構的可比性。
1.2分子動力學模擬(Molecular dynamics,MD)
分子動力學模擬使用GROMACS5.1.2和AMBER99SBLIDN全原子立場,水分子模型為TIP3P,體系溶劑化遵循邊界原子向外延伸1.0 nm的原則,構建十二面體水盒子。使用最陡下降法對2個體系進行能量優化。然后對模擬體系進行NVT和NPT各10 ns平衡模擬,對每個模擬體系分別進行3個獨立100 ns生產動力學模擬。
1.3分析方法
通過計算模擬過程中溶質結構相對于初始結構的骨架RMSD(Root Mean Square Deviation),評價了軌跡的平衡性,然后比較了2個模擬的幾何性質。最后進行了本質動力學分析(Principal Component Analysis,PCA),并構建了蛋白質溶劑體系的自由能圖譜(Free Energy Landscape,FEL)。
2結果
2.1軌跡平衡及收斂性
NThGIIA的3個模擬副本,大約5 ns可以達到相對穩定的RMSD值,而MThGIIA的3個副本僅需要3 ns便達到相對穩定的RMSD波動,表明MThGIIA比NThGIIA更容易達到平衡波動。對于每個系統,分別將3個軌跡中的平衡軌跡部分(5~100 ns)串聯成一個285 ns的組合軌跡。
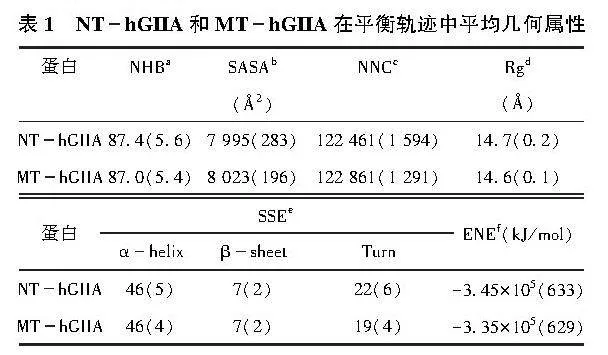
依據表1動態結構性質的定量分析可以得出:在模擬過程中,與NThGIIA 結構相比,MThGIIA結構模型更加緊湊。
a氫鍵的數量。如果供體氫受體原子的角度大于120°且供體與受體原子的距離小于3.5 ,則表明供體與受體之間存在氫鍵。
b溶劑可及表面積。
c范德華接觸數量。如果2個原子之間的距離小于6 ,則表明這2個原子之間存在近距離接觸。
d回旋半徑。
e相應二級結構單元中的殘基數量。
f使用Amber99sbildn力場以及PME靜電處理方式計算的勢能。
2.2構象柔性比較
除了數量有限的區域之外,NThGIIA在整體上比MThGIIA具有更高的柔性。在模擬過程中,除了Ca2+結合環,α1、α2、α3、α4都具有相對于其初始結構更低的構象偏差值,這正是底物結合口袋具有高構象柔性的原因。此外,在兩個模型中, Res1115、Res3557、Res97112肽段均具有較低的RMSD值(lt;0.3 nm),表現出較高的剛性;而Res7174和Res118124肽段均具有較高的RMSD值,表現出較高的柔性。
2.3本質動力學分析
本質動力學分析表明,2個hGIIA的模擬軌跡均只有少數本征向量具有顯著的本征值。對角線化處理NThGIIA和MThGIIA的Ca原子協方差矩陣后,得到總均方波動值分別為7.67 nm2和5.15 nm2,表明NThGIIA在模擬中經歷了更大的構象波動。NThGIIA和MThGIIA的前10個和前30個本征向量的均方波動之和占總均方根波動的比例分別為87.4%、95.2%、85.2%和94.2%。
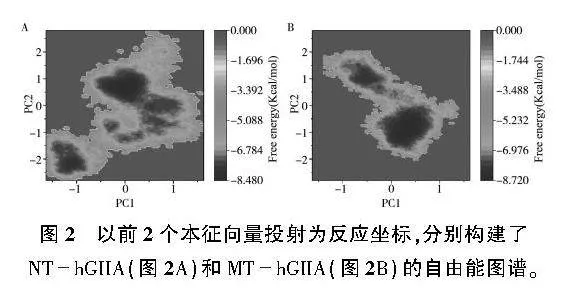
2.4自由能圖譜分析
圖2以前2個本征向量投射為坐標系,分別構建NThGIIA和MThGIIA的二維FEL。NThGIIA的FEL中PC1和PC2所跨越的范圍分別為3.3 nm、5.6 nm,而MThGIIA的FEL中PC1和PC2所跨越的范圍分別為2.8 nm、4.1 nm,表明前者較后者具有更大的自由能表面積。2個模型都有2個主要的自由能井, MThGIIA全局自由能最小化區域(-8.7 kcal/mol)比NThGIIA全局自由能最小化區域(-8.5 kcal/mol)更低,說明前者具有更高的熱穩定性。
3討論
(1) H47Q突變顯著降低了hGIIA的活性,但是并不影響hGIIA與整合素的結合。這表明H47Q突變并不是影響hGIIA與整合素相互作用的關鍵因素,因此探究hGIIA的H47Q突變體結構穩定性有助于理解hGIIA與整合素的作用機制。
(2) NThGIIA具有更大的全局構象柔性和局部構象柔性,這意味著NThGIIA比MThGIIA具有更多的構象子狀態、更豐富的構象多樣性以及更加復雜的動力學行為。NThGIIA自由能表面更為粗糙、復雜。越粗糙的自由能表面所導致的多構象狀態決定了hGIIA的功能多樣性。MThGIIA比NThGIIA具有更多的范德華接觸,這是導致其具有更低自由能的原因。
(3) MThGIIA底物結合口袋被限制在更少的構象空間,不利于蛋白與底物結合。根據誘導契合學,底物結合口袋構象變化受限導致底物結合能力下降,可能是導致MThGIIA失活的另一個重要原因[5]。hGIIA與整合素結合的Res1115、Res3553、Res97112的3個肽段均表現出較低的柔性,這些肽段可能是整合素能夠有效識別hGIIA的關鍵位點。針對hGIIA底物結合口袋聯合整合素結合位點的藥物開發可能是一個更優的選擇。
參考文獻:
[1]DONG Z, MELLER J, SUCCOP P, et al. Secretory phospholipase A2IIa upregulates HER/HER2elicited signaling in lung cancer cells[J]. International Journal of Oncology, 2014, 45(3): 978-984.
[2]BOILARD E, LAI Y, LARABEE K, et al. A novel antiinflammatory role for secretory phospholipase A2 in immune complexmediated arthritis[J]. EMBO Molecular Medicine, 2010, 2(5): 172-187.
[3]ROSENSON R S, HURTCAMEJO E. Phospholipase A2 enzymes and the risk of atherosclerosis[J]. European Heart Journal, 2012, 33(23): 2899-2909.
[4]FUJITA M, ZHU K, FUJITA C K, et al. Proinflammatory secreted phospholipase A2 type IIA (sPLAIIA) induces integrin activation through direct binding to a newly identified binding site (site 2) in integrins αvβ3, α4β1, and α5β1[J]. Journal of Biological Chemistry, 2015, 290(1): 259-271.
[5]張珊,鞏衛康,張娜,等.人分泌型磷脂酶A2ⅡA的功能性動力學特征研究[J].生物化學與生物物理進展,2022(7):49.
基金項目:2022年度云南省教育廳科學研究基金項目“H47Q突變對人類sPLA2IIA酶動力學的影響研究”(2022J1681);2021年度昭通市“十四五”教育研究規劃課題“昭通衛生職業教育實驗教學效益研究”(202136)
作者簡介:張忠弘,女,四川渠縣人,副教授,本科,研究方向:分子生物學。
通信作者:李智,男,四川蒼溪人,副教授,在職研究生,研究方向:分子生物學。

