銅與硝酸反應及后續實驗的一體化新設計
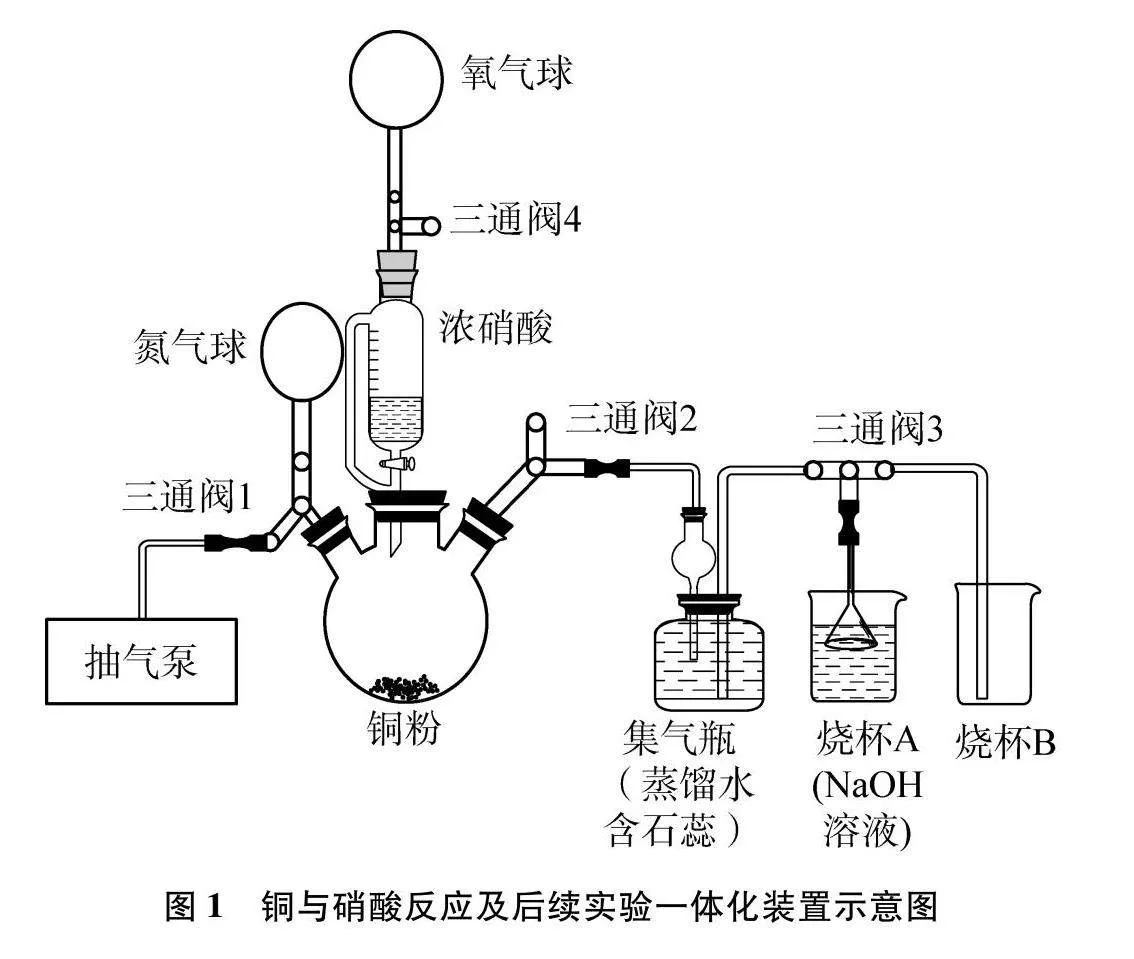
摘 要: 綜合各版本教材中銅與濃、稀硝酸反應實驗及相關文獻,設計銅和硝酸反應及其后續實驗的一體化新裝置。新裝置使銅與硝酸在無氧條件下反應,有效解決了銅與稀硝酸反應生成的NO立刻被裝置中的氧氣氧化的問題。改進裝置可一體化用于銅與濃硝酸、銅與稀硝酸、NO與氧氣、NO2與水反應的四個實驗,還可拓展用于其他需要無氧環境的液液反應和固液反應實驗。
關鍵詞: 裝置一體化; 銅與硝酸反應; 實驗裝置改進; 實驗探究
文章編號: 10056629(2024)10007203
中圖分類號: G633.8
文獻標識碼: B
1 問題提出
氮及其化合物是高中化學階段無機化學中重要的非金屬元素,氮氧化物的制備、性質及其轉化是高中化學重要的實驗之一。《普通高中化學課程標準(2017年版)》中將“氮氧化物的轉化”和“濃、稀硝酸的性質”寫入了“常見無機物及其應用”主題學習活動建議的實驗中,主題“常見的無機物及其應用”的內容要求中也建議通過實驗探究了解氮及其重要化合物的主要性質[1]。現行各版本的高中化學教材也都編排了銅與濃、稀硝酸發應的實驗,除了表述形式與實驗裝置等略有不同外,也都存在一定的不足之處。
對于銅和硝酸反應的實驗改進,文獻大多集中于銅與濃稀硝酸反應一體化,以解決實驗的污染和安全問題。黎佩茹[2]將濃硝酸稀釋為稀硝酸,在同一裝置中完成了銅與濃、稀硝酸的反應,但該裝置中的空氣并未排出,根據現象,學生容易誤認為銅與稀硝酸反應直接生成了紅棕色的二氧化氮。趙立勝等[3]利用雙注射器巧妙結合了銅和不同濃度硝酸的反應,但該實驗存在裝置復雜、不易操作等問題;姚亮發等[4]完成了銅與稀硝酸的反應,一定程度上排除了氧氣的干擾,但缺少了銅與濃硝酸反應的重要實驗。
化學實驗是課堂教學中培養學生核心素養的重要載體。如銅與稀硝酸反應的產物是NO,進而演示NO氧化得到NO2,這對于學生科學探究與創新意識、證據推理與模型認知等核心素養的培養具有不可替代的作用。基于此,本文設計了一套銅與濃、稀硝酸反應的一體化實驗裝置,充分說明稀硝酸與銅反應的產物為NO;利用三通閥和氮氣球實現NO2與水的反應,并解決了尾氣污染等問題。
2 銅與硝酸反應及后續實驗的一體化新設計
2.1 實驗原理
NO極易被氧化,裝置中需要去除氧氣。新設計利用抽氣泵和氮氣球,通過“抽氣回充氮氣”的方法,實現無氧的反應環境。利用三通閥和氧氣球,為氧化NO提供氧氣,驗證銅與稀硝酸反應產生的氣體為NO,NO與O2反應才生成紅棕色NO2。用氧氣替代空氣可增加實驗的嚴謹性,有效落實證據推理化學核心素養的培養。
2.2 實驗儀器及試劑
實驗儀器:真空隔膜泵(西安雙尺戒儀器有限公司,型號:BT15T)、恒壓滴液漏斗(50mL)、三頸圓底燒瓶(19#磨口,100mL)、燒杯(200mL)、集氣瓶(200mL)、橡膠塞、漏斗、球型干燥管、氣球
實驗試劑及用品:NaOH溶液(0.5mol/L)、濃硝酸(63%,3.5mL)、稀硝酸(濃硝酸3.5mL和水14mL混合物)、銅粉(2.0g)、氧氣球、氮氣球、三通閥、蒸餾水、石蕊
2.3 實驗裝置
新設計的實驗裝置如圖1所示(夾持裝置略)。抽氣裝置采用小型實驗室用抽氣泵,配合氮氣球可實現三頸圓底燒瓶無氧反應環境。一體化實驗裝置主要由抽氣裝置、反應發生裝置、收集裝置、尾氣處理裝置等組成。
2.4 實驗步驟及現象
(1) 檢查裝置氣密性。如圖1所示安裝好實驗儀器,關閉恒壓滴液漏斗旋塞,旋轉三通閥2,聯通三頸圓底燒瓶和玻璃管路;打開三通閥3,使之水平相通;打開三通閥1,將氮氣球中的氮氣充入燒瓶,觀察集氣瓶右側水中玻璃管的液面是否上升,如上升說明裝置氣密性良好。
(2) 去除反應體系中的氧氣。采用“抽氣置換”法將反應體系中的空氣置換為氮氣。抽氣前先在三頸圓底燒瓶中裝入銅粉(2.0g),向恒壓滴液漏斗加入濃硝酸(7.0mL),上口接三通閥4、三通閥4接氧氣球(所連三通閥4為關閉狀態)。具體操作為:關閉三通閥2、三通閥3和恒壓滴液漏斗,通過抽氣泵和旋轉三通閥1將燒瓶中的空氣抽走;然后旋轉三通閥1向三頸圓底燒瓶中充入氮氣(氣流速率不宜過快,容易將銅粉吹散);重復上述操作3次,將反應體系(三頸圓底燒瓶和恒壓滴液漏斗)中的空氣置換成氮氣,最后關閉三通閥1。
(3) 銅與濃硝酸反應。首先,旋轉三通閥2,聯通反應管路,然后旋轉三通閥3使之水平相通。打開恒壓滴液漏斗旋塞,將濃硝酸滴入圓底燒瓶,并通過旋轉活塞控制濃硝酸滴入速度和量(3.5mL),觀察到銅粉表面有氣泡產生,燒瓶中馬上充滿紅棕色氣體——NO2。
(4) NO2與水反應。驗證NO2與水反應生成硝酸和NO。具體操作為:旋轉三通閥1,讓氮氣充入圓底燒瓶,直至將紅棕色氣體全部通過管路通入含有石蕊的蒸餾水中,水變紅色(說明集氣瓶中發生NO2與水反應生成酸性物質,酸性物質使石蕊變紅)。同時液體被氣體壓至燒杯B。旋轉三通閥3,將多余的紅棕色NO2壓至燒杯A中用NaOH溶液吸收;關閉三通閥1,停止通入氮氣。打開三通閥4,使氧氣充入反應體系,圓底燒瓶、管路和集氣瓶上方均出現紅棕色氣體。說明NO2與水反應生成酸性物質外,還生成NO氣體。根據NO2的化合價和產物NO的化合價,我們推測酸性物質為硝酸(化合價歧化),即反應的方程式為:3NO2+H2O2HNO3+NO。關閉氧氣,打開三通閥1,用氮氣將紅棕色NO2氣體壓入燒杯A中繼續用NaOH溶液吸收。
(5) 銅與稀硝酸反應。用注射器快速向恒壓滴液漏斗注入水(14mL)將剩余濃硝酸(3.5mL)稀釋為稀硝酸。重復步驟(2),將體系中的氧氣置換為氮氣。打開恒壓滴液漏斗旋塞,調節并控制滴入的稀硝酸,可以觀察到有氣泡產生,但無有色氣體生成。
(6) NO的氧化。旋轉三通閥3,聯通燒杯A;旋轉氧氣球所連三通閥4,將氣球中的氧氣與恒壓滴液漏斗和三頸圓底燒瓶聯通,可觀察到三頸圓底燒瓶出現了紅棕色氣體,即生成了NO2。
(7) 尾氣吸收。升高蒸餾水集氣瓶中右側導管,旋轉三通閥2,使管路相通,氧氣可繼續壓入三頸圓底燒瓶,將紅棕色的NO2氣體排入燒杯A中用NaOH溶液吸收,直至裝置內無紅棕色氣體。反應的方程式為:4NO2+O2+4NaOH4NaNO3+2H2O。
3 小結
本改進實驗具有以下優點:
(1) 一體化整合:將Cu與濃硝酸反應生成NO2,Cu與稀硝酸反應生成NO,NO與O2反應生成NO2,NO2與H2O反應生成HNO3和NO四個教學實驗整合為一體,教師可根據教學進度來安排演示實驗,實現一次投料,分步、有序進行多個實驗的目的。
(2) 實驗操作易控:恒壓滴液漏斗帶有刻度,可有效控制硝酸用量和滴加速度,進而控制反應進行,方便實驗展示,提高教學效果。
(3) 無氧條件:設計的“抽氣回充氮氣”方法,能達到一般的無氧條件,可以適用于其他需要無氧條件下的固液反應和液液反應。
參考文獻:
[1]中華人民共和國教育部制定. 普通高中化學課程標準(2017年版) [S]: 北京: 人民教育出版社, 2018.
[2]黎佩茹. 銅與硝酸反應裝置的改進[J]. 中學化學教學參考, 2020, (13): 44~45.
[3]趙立勝, 李德前. 銅與濃、稀硝酸反應實驗的新設計[J]. 中國現代教育裝備, 2017, (24): 43~44.
[4]姚亮發, 鄭柳萍, 張賢金等.基于證據推理意識的銅與稀硝酸反應實驗的新設計[J]. 化學教學, 2022, (12): 75~77.

