PD-L1高表達伴EGFR與KRAS共突變晚期肺肉瘤樣癌1例并文獻復習


[摘要]目的探討程序性死亡配體-1(PD-L1)高表達伴表皮生長因子受體(EGFR)與Kirsten大鼠肉瘤病毒癌基因同源物(KRAS)共突變肺肉瘤樣癌(PSC)的診斷和治療。
方法回顧性分析1例PD-L1高表達伴EGFR與KRAS共突變的晚期PSC病人,結合相關的文獻復習,總結其診治經過及治療經驗。
結果病人經化療、放療、免疫治療和靶向治療等綜合治療,病情得到有效控制,總生存期已達29個月。
結論晚期PSC具有顯著的異質性,綜合治療可為病人帶來更好的生存獲益,而腫瘤組織的動態基因檢測有助于指導治療藥物的選擇。基于多重熒光免疫組織化學檢測的腫瘤微環境分型對免疫治療效果的預測作用有待進一步驗證。
[關鍵詞]癌,非小細胞肺;B7-H1抗原;ErbB受體;基因,ras;突變;基因檢測;治療結果;病例報告
[中圖分類號]R730.26
[文獻標志碼]B
[文章編號]2096-5532(2024)04-0615-04
doi:10.11712/jms.2096-5532.2024.60.129
[開放科學(資源服務)標識碼(OSID)]
[網絡出版]https://link.cnki.net/urlid/37.1517.R.20240919.1017.002;2024-09-1918:00:38
Advanced pulmonary sarcomatoid carcinoma with a high expression level of programmed death-ligand 1 and co-mutation of EGFR and KRAS: A case report and literature review
LIANG Yanan, YU Zhuang, FENG Lingxin, QI Qi, WANG Jing
(Department of Oncology, The Affiliated Hospital of Qingdao University, Qingdao 266000, China)
; [Abstract]ObjectiveTo investigate the diagnosis and treatment of pulmonary sarcomatoid carcinoma (PSC) with a high expression level of programmed death-ligand 1 (PD-L1) and co-mutation of epidermal growth factor receptor (EGFR) and Kirsten Rat Sarcoma Viral Oncogene Homolog (KRAS).
MethodsA retrospective analysis was performed for one patient with advanced PSC with a high expression level of PD-L1 and co-mutation of EGFR and KRAS, and a literature review was performed to summarize the diagnosis and treatment of the patient and related treatment experience.
ResultsThe condition of the patient was effectively controlled after multimodality therapy including chemotherapy, radiotherapy, immunotherapy, and targeted therapy, and the overall survival time had reached 29 months.
ConclusionAdvanced PSC has significant heterogeneity, and multimodality therapy can bring better survival benefits to patients. Dynamic gene detection of tumor tissue can guide the selection of therapeutic agents. Further studies are needed to verify the value of tumor microenvironment typing based on tumor multiple fluorescent immunohistochemical assay in predicting the efficacy of immunotherapy.
[Key words]carcinoma, non-small-cell lung; B7-H1 antigen;ErbB receptors; genes, ras; mutation; genetic testing; treatment outcome; case reports
已知肺肉瘤樣癌(PSC)是一種侵襲性非小細胞肺癌(NSCLC),占所有肺部惡性腫瘤的0.1%~0.4%,預后較差[1]。大多數病人確診時已是晚期,手術機會少,對放化療也不敏感。延長病人的生存時間已成為一大挑戰[2]。程序性死亡配體-1(PD-L1)在PSC中的陽性表達率超過50%,且與免疫治療的療效呈正相關[3]。信迪利單抗和替雷利珠單抗是抗程序性細胞死亡蛋白1(PD-1)的單克隆抗體,對PSC有明確療效[4-5]。PSC存在不同的突變基因,例如表皮生長因子受體(EGFR)、Kirsten大鼠肉瘤病毒癌基因同源物(KRAS)和間充質上皮轉化因子(MET)等,其中EGFR-KRAS是最常見的共突變基因,約占NSCLC突變基因的30%[2,6-8]。本文報告1例PD-L1高表達伴EGFR與KRAS突變的晚期PSC病人,該病人經過多線、不同機制的抗腫瘤藥物治療,取得了滿意的療效。
1病例報告
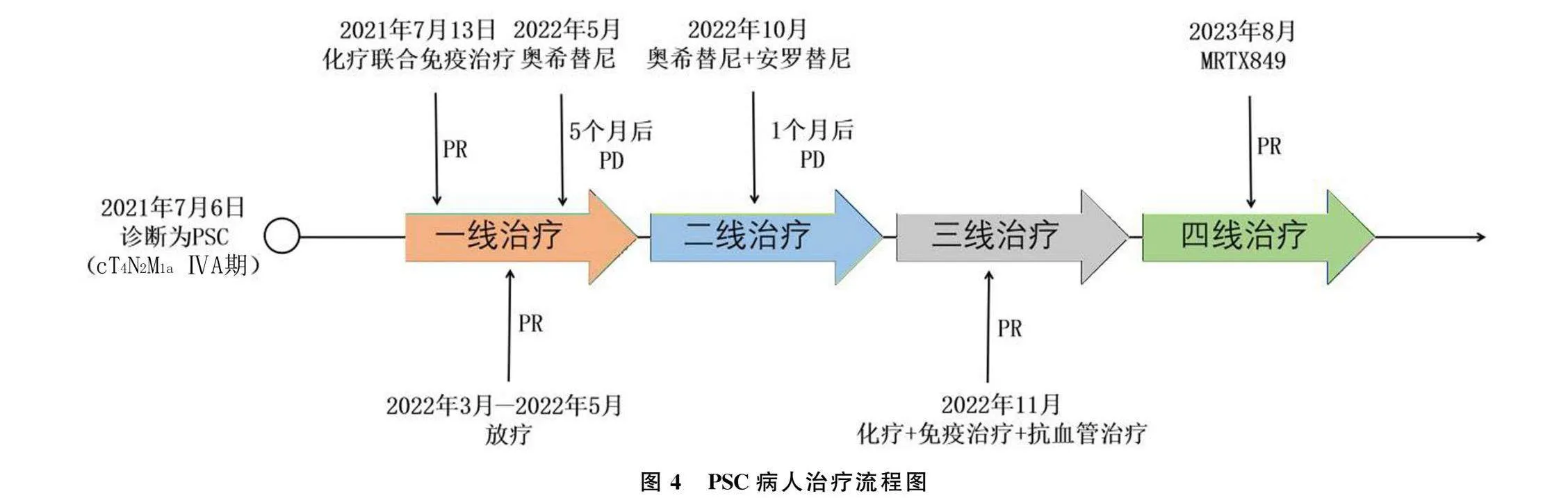
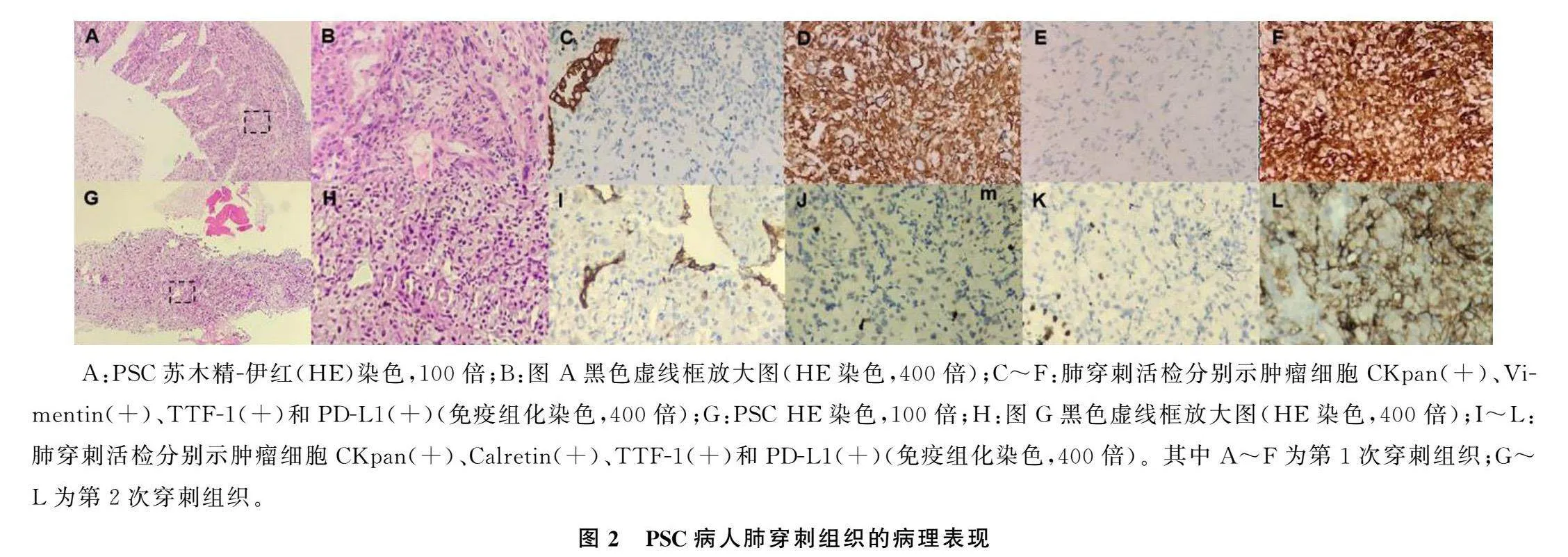
病人,女性,64歲,因“左側胸痛”于2021年7月1日就診于青島大學附屬醫院腫瘤科。病人疼痛數字評定量表(NRS)評分為2分,美國東部腫瘤協作組(ECOG)體力狀況分級為1分,胸部CT顯示左肺部近縱隔側占位性病變(大小71.7 mm×16.4 mm),同側縱隔淋巴結腫大(圖1A~C)。CT引導下肺穿刺活檢病理診斷為肉瘤樣癌。免疫組化檢查:廣譜細胞角蛋白(CKpan)(+),鈣視網膜蛋白(Calretinin)(-),WT-1(-),CK5/6(-),甲狀腺轉錄因子-1(TTF-1)(-),胃酶樣天冬氨酸蛋白酶(NapsinA)(-),P40(-),CD56(-),癌胚抗原(CEA)(-),MOC-31(-),葡萄糖轉運蛋白1(GLUT1)(+),婆羅雙樹樣基因4(SALL4)(-),波形蛋白(Vimentin)(+),PD-L1陽性表達率為70%(圖2A~F)。完善影像學檢查,明確分期為cT4N3M1a,ⅣB期(TNM分期,肺癌AJCC第8版)。病人初診時未行基因檢測。
2021年7月13日,病人開始接受順鉑(75 mg/m2,第1天,每3周1次)、白蛋白紫杉醇(240 mg/m2,第1、8天,每3周1次)和信迪利單抗(200 mg,第1天,每3周1次)的一線治療,6個周期后改為信迪利單抗維持治療。最佳療效為部分緩解(PR)(圖1D~F)。后因病人出現心悸和甲狀腺功能異常等不良反應,停用信迪利單抗。為進一步鞏固治療,2022年2月4日—3月14日,對殘余病灶進行了局部放療(6 MV X線,IMRT),PTV 4760 cGy/28f,PGTV 5880 cGy/28f,常規分割。放療結束2個月后,即于2022年5月進行了復查,療效評價仍為PR(圖1G~I)。
為了進一步治療,病人按照醫生建議對穿刺的腫瘤組織進行了基因檢測,檢測結果顯示,病人存在EGFR 19Del突變和KRAS Exon2 G12C突變(ARMS-PCR法),并接受了EGFR-TKI藥物奧西替尼(80 mg,每日1次)治療。期間復查病灶穩定。治療約5個月后,病人于2022年10月17日復查CT,發現雙肺上葉出現新發結節,左側腎上腺出現轉移灶(圖1J~L),腫瘤療效評估為疾病進展(PD)。隨后行奧希替尼聯合安羅替尼治療(10 mg,每日1次),治療1個月后復查CT,療效評價為PD(圖1M~O)。
為明確病理類型有無轉化和基因改變,對病人右肺上葉病灶進行了第2次活檢,病理仍為肉瘤樣癌(圖2G~L);基因檢測結果顯示,KRAS Exon2 G12C突變仍然存在,豐度為45.2%,未檢測到EGFR基因突變,新增了p53基因突變,腫瘤突變負荷(TMB)為5.67 Muts/Mb(二代測序)。采用多重熒光免疫組織化學(mIHC)技術評估病人腫瘤微環境狀態,病人分型為Ⅳ型(PD-L1+腫瘤細胞的陽性率為10.07%,CD8+T細胞浸潤率為3.26%,CD4+T細胞浸潤率為2.34%)。見圖3。
根據上述基因檢測和mIHC結果,決定重啟免疫治療并聯合應用貝伐珠單抗和單藥白蛋白紫杉醇,4個周期后停用白蛋白紫杉醇(圖1P~R),繼續維持免疫治療聯合抗血管治療。治療從2022年11月開始,共持續了10個月,最佳療效為PR。此后,病人出現腰痛并進行性加重,復查顯示腎上腺病灶增大(圖1S~U)。
病人于2023年8月1日進入臨床試驗中,并且開始接受KRAS G12C小分子靶向抑制劑MRTX849(adagrasib)600 mg、每日2次的四線治療。治療2個周期,腎上腺病灶縮小了50%,療效為PR(圖1W~Y)。
2023年11月,病人病灶呈持續PR狀態,背痛完全緩解,生活狀況良好。見圖4。
2討論
PSC是一種罕見的低分化肺部惡性腫瘤,5年生存率僅為24.5%[9]。既往大多數研究顯示,PSC對化療不敏感。與化療相比,化療聯合免疫治療可明顯延長病人的生存期[10]。本文病人經一線免疫治療聯合化療也取得了滿意療效。在病情進展后的第2次活檢中,雖然PD-L1表達率從70%降至10%,但重啟免疫治療依然有效。另外,放療對PSC的治療效果不佳。但LIANG等[11]分析了SEER數據庫中1 723例病人的生存相關治療因素發現,放療組與未經特殊治療組的2年總生存率(OS)分別為9.1%和5.4%,提示放療顯著改善了不宜手術的Ⅰ~Ⅲ期PSC病人的OS。本文病人經放療有效地治療了原發病灶,并維持了緩解狀態。
PSC病人的基因突變并不少見。與其他類型的NSCLC一樣,對這類病人應進行基因檢測以指導治療。PSC病人的EGFR突變率為8.8%~25.0%,而KRAS突變率則可高達38.0%[8]。EGFR和KRAS共突變可能影響EGFR-TKI的療效。有研究表明,在接受EGFR-TKI治療的NSCLC病
人中,僅有EGFR突變病人的無進展生存期為35個月[12],而EGFR-KRAS共突變病人只有2~3個月[13]。
本文病人的兩次基因檢測結果顯示,EGFR 19Del在奧昔替尼治療失敗后消失,但KRAS G12C仍然存在且豐度增加,表明不同的細胞克隆并存,進一步證實了肉瘤樣癌細胞的異質性。研究表明,與接受帕博利珠單抗治療的KRAS野生型PSC病人相比,KRAS突變型PSC病人的無進展生存期更長[14],KRAS和p53突變可增強免疫治療的效果。本研究采用mIHC技術評估了病人腫瘤微環境狀態,這種檢測方法根據腫瘤細胞PD-L1+和T細胞CD4、CD8表達情況將腫瘤微環境分為Ⅰ~Ⅳ型。其中,Ⅱ型腫瘤病人最可能從免疫檢查點的藥物治療中獲益,其次為Ⅳ型,Ⅰ型最差。mIHC檢測結果顯示,本文病人為Ⅳ型,提示該病人有可能從免疫檢查點抑制劑治療中獲益。然而,PD-L1表達陽性且CD8+T細胞密度較高的病人通常從PD-L1/PD1單抗治療中獲益更大。本文病人在一線治療后腫瘤細胞PD-L1陽性表達率和CD8+T細胞浸潤密度降低,這可能與一線放療、化療和免疫治療引起的腫瘤微環境改變和腫瘤異質性有關。研究表明,貝伐單抗可以改善腫瘤微環境,提高PD-L1/PD1單抗的治療效果[15]。因此,本研究選擇了兩種藥物聯合用于該病人的三線治療,取得了明顯的療效。
本文病人在三線治療再次進展后被納入臨床研究,接受MRTX849治療。該藥是一種KRAS G12C抑制劑,于2022年12月首次在美國獲批,用于治療KRAS G12C突變且接受過≥1次全身治療的局部晚期或轉移性成人NSCLC[16]。MRTX849治療對本文中接受過三線治療和多種藥物治療的病人療效顯著。然而,迄今為止,對于EGFR和KRAS共突變的病人,目前尚不清楚EGFR-TKI和KRAS抑制劑是應該聯合使用還是序貫應用。
綜上所述,PSC具有顯著的異質性,個體化精準治療對PSC的治療非常重要。同時,需要對PSC進行更全面的評估,除了常規的PD-L1檢測,基因檢測和腫瘤免疫微環境評估同樣重要。mIHC等新技術的應用還需要深入研究。
[參考文獻]
[1]YENDAMURI S, CATY L, PINE M, et al. Outcomes of sarcomatoid carcinoma of the lung: a Surveillance, Epidemiology, and End Results database analysis[J]. Surgery, 2012,152(3):397-402.
[2]LI X, WU D, LIU H Y, et al. Pulmonary sarcomatoid carcinoma: progress, treatment and expectations[J]. Therapeutic Advances in Medical Oncology, 2020,12:1758835920950207.
[3]LEE J Y, CHOI Y, JUNG H A, et al. Outstanding clinical efficacy of PD-1/PD-L1 inhibitors for pulmonary pleomorphic carcinoma[J]. European Journal of Cancer, 2020,132:150-158.
[4]QIAN X Y, WANG Y, LIU F R, et al. The efficacy and safety analysis of first-line immune checkpoint inhibitors in pulmonary sarcomatoid carcinoma[J]. Frontiers in Immunology, 2022,13:956982.
[5]XU L, TAO N N, LIANG B, et al. Use of PD-1 inhibitor tislelizumab in the treatment of advanced pulmonary sarcomatoid carcinoma: a case report[J]. Thoracic Cancer, 2022,13(3):502-505.
[6]SCHROCK A B, LI S D, FRAMPTON G M, et al. Pulmonary sarcomatoid carcinomas commonly harbor either potentially targetable genomic alterations or high tumor mutational burden as observed by comprehensive genomic profiling[J]. Journal of Thoracic Oncology: Official Publication of the International Association for the Study of Lung Cancer, 2017,12(6):932-942.
[7]WANG X M, CAO J, DU W J, et al. Response to gefitinib/crizotinib combination in a pulmonary sarcomatoid carcinoma patient harboring concurrent EGFR mutation and MET amplification[J]. Clinical Case Reports, 2021,9(7):e04487.
[8]ITALIANO A, CORTOT A B, ILIE M, et al. EGFR and KRAS status of primary sarcomatoid carcinomas of the lung: implications for anti-EGFR treatment of a rare lung malignancy[J]. International Journal of Cancer, 2009,125(10):2479-2482.
[9]VENISSAC N, POP D, LASSALLE S, et al. Sarcomatoid lung cancer (spindle/giant cells):an aggressive disease? [J]. The Journal of Thoracic and Cardiovascular Surgery, 2007,134(3):619-623.
[10]PIAO M N, MA X T, TANKERE P, et al. Anlotinib combined with chemotherapy and immunotherapy for advanced pulmonary sarcomatoid cancer: a case report and literature review[J]. Annals of Translational Medicine, 2022,10(18):1030.
[11]LIANG X H, CHENG Y N, YUAN Z J, et al. Clinical, pa-
thological and treatment factors associated with the survival of patients with pulmonary sarcomatoid carcinoma[J]. Oncology Letters, 2020,19(6):4031-4039.
[12]TAMURA Y, FUJIWARA Y, YAMAMOTO N, et al. Retrospective analysis of the efficacy of chemotherapy and molecular targeted therapy for advanced pulmonary pleomorphic carcinoma[J]. BMC Research Notes, 2015,8:800.
[13]FU Y L, WANG A Q, ZHOU J Q, et al. Advanced NSCLC patients with EGFR T790M harboring TP53 R273C or KRAS G12V cannot benefit from osimertinib based on a clinical multicentre study by tissue and liquid biopsy[J]. Frontiers in Oncology, 2021,11:621992.
[14]DONG Z Y, ZHONG W Z, ZHANG X C, et al. Potential predictive value of TP53 and KRAS mutation status for response to PD-1 blockade immunotherapy in lung adenocarcinoma[J]. Clinical Cancer Research: an Official Journal of the American Association for Cancer Research, 2017,23(12):3012-3024.
[15]QUAIL D F, JOYCE J A. Microenvironmental regulation of tumor progression and metastasis[J]. Nature Medicine, 2013,19(11):1423-1437.
[16]DHILLON S. Adagrasib: first approval[J]. Drugs, 2023,83(3):275-285.
(本文編輯牛兆山)

