雙酚A通過上調Apoa1基因的表達抑制TM3細胞睪酮合成


摘 要: 旨在從脂質代謝的角度探討載脂蛋白A1(apolipoprotein A1,Apoa1)是否介導了雙酚A(bisphenol A,BPA)暴露所致小鼠睪丸間質細胞株(TM3)睪酮合成的降低。將TM3細胞隨機分為不同濃度的BPA暴露劑量(0、5、10、20、40、60、80 μmol·L-1)組,0 μmol·L-1 BPA為對照組(CON)。給予相應劑量處理24 h后,運用CCK-8法檢測TM3細胞活力,確定BPA最適染毒劑量;通過ELISA檢測TM3細胞培養上清液睪酮(testosterone,T)含量;利用RT-qPCR檢測TM3細胞脂質代謝相關基因Apoa1、Apoa2(apolipoprotein A2)、Apoc3(apolipoprotein C3)的mRNA表達水平;運用Western blot和免疫熒光方法檢測APOA1蛋白表達水平;采用油紅O染色觀察細胞內脂滴累積情況。結果表明,20 μmol·L-1 BPA處理24 h對TM3細胞活力無顯著影響,40 μmol·L-1 BPA處理24 h后,TM3細胞活力受到極顯著抑制(Plt;0.01);此外,20 μmol·L-1 BPA處理TM3細胞24 h后,培養上清液中睪酮含量極顯著低于對照組(Plt;0.01),Apoa1基因的mRNA表達水平及蛋白表達量極顯著升高(Plt;0.001),但Apoa2和Apoc3基因的mRNA表達水平無顯著變化;與對照組相比,20 μmol·L-1 BPA處理24 h,TM3細胞的脂滴累積量極顯著降低(Plt;0.000 1)。綜上,BPA可通過上調Apoa1基因的表達水平,增強膽固醇逆向轉運(reverse cholesterol transport, RCT),引起TM3細胞內的脂滴含量減少,導致TM3細胞的睪酮合成分泌降低。
關鍵詞: 雙酚A(BPA);載脂蛋白A1(Apoa1);小鼠睪丸間質細胞(TM3);睪酮(T)
中圖分類號:S814
文獻標志碼:A
文章編號:0366-6964(2024)08-3516-10
收稿日期:2023-11-03
基金項目:黑龍江省自然科學基金優秀青年基金項目(YQ2022C018)
作者簡介:趙 彤(2000-),女,遼寧朝陽人,碩士,主要從事動物繁殖生理學研究,E-mail:ZT215926@163.com
通信作者:趙立佳,主要從事動物繁殖生理學研究,E-mail: ljzhao@neau.edu.cn
Bisphenol A Inhibits Testosterone Synthesis in TM3 Cells by Upregulating Apoa1
Gene Expression
ZHAO" Tong1, YANG" Wenzhe1, PAN" Feilong1, ZHAO" Shuchen1,2, LIU" Kexiang1,2, L Zhanjun1,2,
ZHAO" Lijia1,2*
(1.College of Animal Medicine, Northeast Agricultural University, Harbin 150030," China;
2.
Key Laboratory of the Provincial Education Department of Heilongjiang for Common Animal Disease Prevention
and Treatment, Harbin 150030," China)
Abstract:" The aim of the study was to investigate whether apolipoprotein A1 (apolipoprotein A1,Apoa1) mediates the reduction of testosterone synthesis in mouse Leydig cells line (TM3) induced by bisphenol A (BPA) exposure from the perspective of lipid metabolism. TM3 cells were randomly divided into 7 groups with different concentrations (0, 5, 10, 20, 40, 60, and 80 μmol·L-1), and 0 μmol·L-1 BPA was the control group (CON); After 24 h of treatment with the different concentrations, cell viability was detected using theby CCK-8 method to determine the optimal dose of BPA." Testosterone (testosterone, T) synthesiscontent in TM3 cell supernatant was detected by ELISA; mRNA expression levels of lipid metabolism-related genes Apoa1, Apoa2 (apolipoprotein A2) and Apoc3 (apolipoprotein C3) genes were measured in TM3 cells usingby RT-qPCR. APOA1 protein expression level was detected usingby Western blot and immunofluorescence method. Intracellular lipid droplet accumulation was observed usingby oil red O staining. The results showed that 20 μmol·L-1 BPA treatment for 24 h had no significant effect on the viability of TM3 cells; However, an extremely significant inhibition of TM3 cell viability was observed followingin treatment with 40 μmol·L-1 BPA for 24 h (Plt;0.01); In addition, after 20 μmol·L-1 BPA treatment on TM3 cells for 24 h, the testosterone content in the culture supernatant was extremely significantly lower than that in the CON group (Plt;0.01), the mRNA expression level and protein expression of Apoa1 gene were extremely significantly elevated (Plt;0.001), but there was no significant change in the mRNA expression level of Apoa2 andor Apoc3 genes; The accumulation of lipid droplets in TM3 cells was extremely significantly reduced by 20 μmol·L-1 BPA treatment for 24 h compared with the CON group (Plt;0.000 1). In conclusion, BPA can reduce the lipid droplets accumulation in TM3 cells by up-regulating Apoa1 expression levels, enhancing reverse cholesterol transport (Reverse cholesterol transport, RCT), leading to a decrease in testosterone synthesis in TM3 cells.
Key words: bisphenol A (BPA); apolipoprotein A1 (Apoa1); mouse Leydig cells (TM3); testosterone (T)
*Corresponding author: ZHAO Lijia,E-mail: ljzhao@neau.edu.cn
雙酚A(bisphenol, BPA)是聚碳酸酯(polycarbonate, PC)塑料的主要成分,因其具有高強度和透明度等特性,在建筑、汽車、電子、醫療器械制造及航空航天等多個領域中廣泛應用[1]。然而,由于BPA的高需求和大范圍使用,導致其在環境中大量積累,進而在動植物甚至人類體內殘留[2]。經調查研究顯示,BPA存在于人的血液、尿液甚至母乳中[3]。此外,當生物攝入BPA后,通過食物鏈層層積累放大,更增加了生物群體的安全風險。大量研究表明,BPA暴露可引起內分泌系統、生殖系統、心血管系統、代謝和神經行為等方面的疾病[4-7]。以往研究結果顯示,BPA可促使更多脂肪酸從脂肪組織向肝轉運,刺激肝內源性脂肪酸的生成,最終導致肝中甘油三酯的過度累積[8]。Kim等[9]研究表明,BPA暴露可引起成年小鼠糖脂代謝紊亂,導致肝細胞異常分化和脂肪堆積,從而增加代謝性疾病的風險[9]。然而,BPA是否通過影響脂質代謝調節睪丸間質細胞睪酮合成尚不清楚。
載脂蛋白(apolipoprotein)在體內脂質運輸過程中發揮關鍵作用,其有助于將水不溶性的膽固醇、甘油三酯和其他脂質從一個組織或細胞轉移到其他組織或細胞,通過協助膽固醇的逆向運輸和調節甘油三酯水平,以滿足機體能量需求、脂質儲存及維護體內的脂質平衡。載脂蛋白家族成員主要包括APOA1(apolipoprotein A1)、APOA2(apolipoprotein A2)、APOB(apolipoprotein B)和APOC3(apolipoprotein C3)等蛋白,它們通過影響膽固醇和甘油三酯的運輸和代謝,在脂質代謝過程中發揮重要作用[10-11]。APOA1是高密度脂蛋白(high density lipoprotein,HDL)的主要成分,其通過ATP結合盒轉運蛋白A1(ATP-binding cassette transporter protein A1,ABCA1)與膽固醇結合生成HDL,將外周細胞內的膽固醇運回肝,這一生理過程被稱為膽固醇逆向轉運(reverse cholesterol transport, RCT),有助于機體清除體內多余的膽固醇[12]。已有研究表明,BPA通過調控稀有鰷魚啟動子區Esr募集和DNA甲基化來上調睪丸Apoa1基因的表達,增加RCT,并降低睪丸中的膽固醇水平[13]。脂質代謝紊亂已被證明與生殖異常存在關聯[10]。睪酮作為一種重要的類固醇激素,在雄性生長發育、性欲維持、生殖功能、物質代謝及衰老等生理過程中發揮重要作用[14]。在睪丸間質細胞中,膽固醇作為合成睪酮的前體,參與睪酮的合成過程[15]。Bernecic等[16]研究表明,膽固醇水平與睪酮含量呈正相關。因此,睪丸間質細胞獲得足夠的膽固醇是產生睪酮并維持正常水平的必要前提。然而,Apoa1是否介導BPA暴露抑制小鼠睪丸間質細胞睪酮合成的研究鮮有報道。
本試驗以小鼠睪丸間質細胞株TM3細胞為研究模型,經BPA染毒24 h后,觀察細胞內的脂質累積情況,檢測脂質代謝相關基因mRNA及蛋白的表達水平,評估細胞培養上清液中的睪酮含量,為從脂質代謝角度揭示BPA暴露抑制小鼠睪丸間質細胞睪酮合成機制提供新的研究思路。
1 材料與方法
1.1 試驗材料
小鼠睪丸間質細胞株TM3細胞由東北農業大學動物醫學學院李金龍教授惠贈。
主要試劑:BPA(≥99%,Sigma,USA)、DMEM/HIGH GLUCOSE培養基(HyClone,USA)、10%胎牛血清(四季青,中國)、1%青霉素/鏈霉素溶液(HyClone,USA)、DMSO(細胞培養級)(索萊寶,中國)、增強型CCK-8試劑盒(碧云天,中國)、RNA提取試劑RNAiso Plus(TaKaRa,日本)、PrimeScriptTMRT Reagent Kit with gDNA Eraser(TaKaRa,日本)、SYBR Green Realtime PCR Master Mix(TOYOBO,日本)、增強型BCA蛋白檢測試劑盒(碧云天,中國)、雙色SDS-PAGE蛋白上樣緩沖液(6×)(碧云天,中國)、PVDF膜(索萊寶,中國)、兔抗APOA1(Proteintech,USA)、鼠抗β-actin(生工,中國)、辣根過氧化物酶標記的山羊抗兔抗體(索萊寶,中國)、辣根過氧化物酶標記的山羊抗鼠抗體(生工,中國)、Alexa Fluor 488標記山羊抗兔IgG(H+L)(Bioss,中國)、3% Triton X-100、DAPI染色試劑、抗熒光淬滅封片劑、牛血清白蛋白(Biosharp,中國)、飽和油紅O染色液(索萊寶,中國)、睪酮檢測試劑盒(南京建成,中國)。
主要儀器:CO2培養箱(Boxun,中國),超凈工作臺(Boxun,中國),倒置顯微鏡(新惠澤奧,中國),Epoch型酶標儀(BioTek,美國),line gene 9600型熒光定量PCR儀(BIOER,中國),iCEN-24R型高速冷凍離心機(奧盛儀器,中國),流式圖像計數儀(卓微,中國)、Tanon 5200發光成像系統(原平皓,中國)、徠卡DM IL LED熒光倒置顯微鏡(徠卡,德國)。
1.2 試驗方法
1.2.1 BPA對TM3細胞的最適染毒劑量篩選
TM3細胞在含有10%胎牛血清和1%青霉素/鏈霉素溶液的DMEM/HIGH GLUCOSE培養基中常規培養,取對數生長期細胞,用胰酶(含EDTA)消化后,將細胞密度稀釋為2×104個·mL-1,以100 μL·孔-1種于96孔板中,培養板四周孔中加入200 μL PBS作為保濕孔。將96孔板置于37℃、5% CO2的培養箱中培養24 h。吸棄全部培養液,分別加入含BPA濃度為0、5、10、20、40、60、80 μmol·L-1的培養液,并將每組中DMSO的濃度調至0.1%,染毒后繼續培養24 h。每孔中加入10 μL CCK-8試劑溶液,混勻后在37℃、5% CO2培養箱內繼續培養1.5 h,之后于酶標儀450 nm波長處測D值,計算細胞相對存活率。
1.2.2 睪酮含量測定
取對數生長期的TM3細胞,每孔2 mL密度為2.5×105個·mL-1細胞混懸液,接種于6孔培養板內,培養液為含有10%胎牛血清和1%青霉素/鏈霉素溶液的DMEM/HIGH GLUCOSE培養基,37℃、5% CO2條件下培養24 h。將細胞分為2組,具體為對照組(0 μmol·L-1 BPA)和篩選出的對細胞活力無顯著影響的BPA濃度組,每組3個重復,處理24 h。收集細胞培養上清液,ELISA試劑盒測定睪酮含量。在酶標儀450 nm處讀取D值。
1.2.3 RNA提取和RT-qPCR
將TM3細胞按5×105個·孔-1密度接種于6孔板中,37℃、5% CO2條件下培養24 h,分組及處理時間同“1.2.2”。用TRIzol 法提取細胞內總RNA,超微量紫外分光光度儀檢測總RNA的濃度和純度,A260/A280范圍為1.8~2.1,反轉錄采用20 μL體系,設置為37℃ 15 min,85℃ 5 s,得到反轉錄產物cDNA。根據GenBank中小鼠的Apoa1、Apoa2、Apoc3、Gapdh基因序列,使用Primer-Blast設計引物,由生工生物工程(上海)股份有限公司合成引物,序列見表1。采用20 μL體系,擴增反應條件設置為:95℃ 30 s預變性;95℃ 5 s、55℃ 10 s、72℃ 15 s,共40個循環。以2 μL的cDNA為模板, Gapdh作為內參進行實時熒光定量PCR,檢測Apoa1、Apoa2、Apoc3基因的mRNA的表達,按2-ΔΔCt計算目的基因相對表達量。
1.2.4 Western blot
將TM3細胞按5×105個·孔-1的密度接種于6孔板中,37℃、5% CO2條件下培養24 h,分組方式及處理時間同“1.2.2”。收集細胞,提取蛋白后,使用增強型BCA蛋白檢測試劑盒檢測濃度。按比例加入雙色SDS-PAGE蛋白上樣緩沖液(6×),95℃、5 min變性,-20℃保存。以β-actin為內參蛋白,進行SDS-PAGE凝膠電泳,待蛋白分離之后,將目的蛋白轉至PVDF膜上,用封閉液在25℃下封閉15 min后,加入抗APOA1抗體(1∶1 000)、抗β-actin 抗體(1∶500)于4℃孵育過夜。次日將膜取出TBST清洗3次,每次10 min;辣根過氧化物酶偶聯二抗(1∶5000)37℃孵育1 h,經TBST清洗3次后,用ECL化學發光法進行顯色。用Tanon 5200發光成像系統進行成像,運用ImageJ軟件進行條帶灰度值分析,目的基因灰度值/內參基因灰度值得出相對表達量。
1.2.5 免疫熒光
將TM3細胞接種于提前放置玻片的6孔板內,每孔接入2×105個細胞,待細胞貼壁后,按照“1.2.2”的分組及處理時間進行染毒。用4%多聚甲醛固定,0.3% Triton X-100室溫孵育5 min完成通透,以5%牛血清白蛋白封閉2 h。用PBS清洗,于爬片上滴加1∶200比例稀釋的一抗50 μL,濕盒內4℃孵育過夜。第2日以PBS洗滌含細胞的爬片后,加1∶200稀釋的二抗50 μL,濕盒內37℃避光孵育1 h后,再以PBS洗滌,加入DAPI染核,并用PBS洗滌,待爬片干后用抗熒光淬滅劑封片,熒光顯微鏡下觀察,拍照。每組隨機選擇3個不同視野,并運用ImageJ軟件對3張圖片進行量化分析。
1.2.6 油紅O染色
選取對數生長期的細胞接種于6孔板中,在培養箱中培養24 h,分組及處理時間同“1.2.2”。吸去培養液,用PBS清洗3次;加入4%多聚甲醛固定30 min,PBS洗凈;油紅O染色30 min;PBS清洗3次;自來水充分沖洗后風干,甘油明膠進行封片,在倒置顯微鏡下觀察細胞內脂滴的情況并采集圖像。每組隨機選擇三張圖片,采用ImageJ軟件進行量化分析。
1.2.7 數據分析與統計
應用Graph Pad Prism 10.0軟件對試驗數據進行作圖及統計分析,試驗結果以“平均值±標準誤”表示。兩組間比較采用t檢驗,多組間比較采用單因素方差分析(one-way ANOVA),各獨立試驗至少重復3次,以Plt;0.05表示差異顯著。*表示CON組與BPA組比較差異顯著(P<0.05),**、***、****表示CON組與BPA組比較差異極顯著(P<0.01)。*代表Plt;0.05,**代表Plt;0.01,***代表Plt;0.001,****代表Plt;0.000 1。
2 結 果
2.1 BPA 對 TM3 細胞活力的影響
為了篩選出BPA對TM3細胞活力無顯著影響的染毒劑量,將TM3細胞暴露于不同劑量的BPA(0、5、10、20、40、60、80 μmol·L-1)24 h后,使用CCK-8試劑盒檢測細胞活力。如圖1所示,與對照組相比,20 μmol·L-1 BPA處理對TM3細胞的細胞活力沒有顯著影響,但BPA濃度增加至40 μmol·L-1時,細胞活力極顯著降低(Plt;0.01)。此外,當BPA濃度為60和80 μmol·L-1時,TM3細胞的細胞活力進一步降低(Plt;0.000 1),表明隨著BPA劑量濃度的增加,細胞活力逐漸下降,呈劑量依賴性關系。上述結果說明,BPA處理24 h對TM3細胞的細胞活力沒有顯著影響的最大濃度為20 μmol·L-1,因此本研究選用20 μmol·L-1 BPA進行后續試驗。
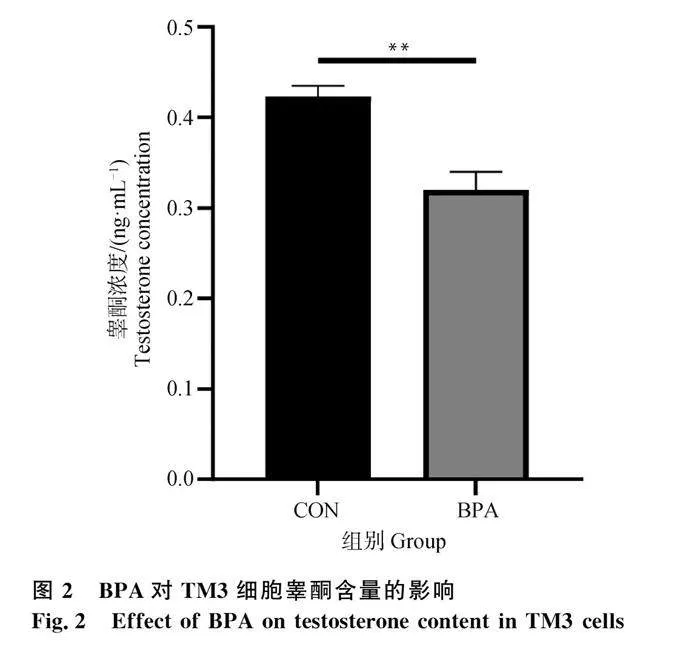
2.2 BPA對TM3細胞睪酮含量的影響
為探討BPA暴露對TM3細胞睪酮合成含量的影響,本研究收集了經BPA處理24 h后的細胞培養上清液,運用ELISA檢測其中的睪酮含量。結果如圖2所示,20 μmol·L-1 BPA處理組與對照組相比,TM3細胞培養上清中睪酮含量極顯著降低(Plt;0.01)。結果表明,20 μmol·L-1 BPA暴露24 h顯著抑制TM3細胞睪酮合成。
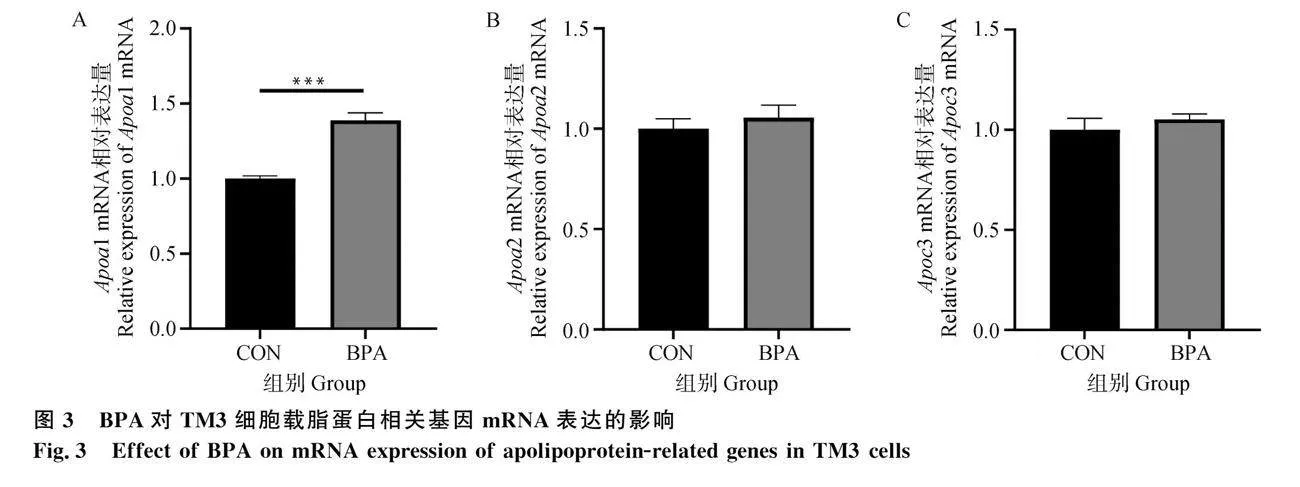
2.3 BPA對TM3細胞載脂蛋白相關基因mRNA表達量的影響
為探究BPA暴露抑制TM3細胞睪酮合成與脂質代謝的關系,將TM3細胞分為對照組和20 μmol·L-1 BPA處理組,采用RT-qPCR檢測經BPA處理24 h的TM3細胞載脂蛋白相關基因Apoa1、Apoa2、Apoc3 mRNA水平。結果如圖3A所示,與對照組相比,20 μmol·L-1 BPA處理組Apoa1基因mRNA表達水平極顯著增加(Plt;0.001),圖3B、3C顯示,Apoa2、Apoc3基因mRNA表達量與對照組相比無顯著差異。結果表明,BPA暴露24 h能夠顯著上調TM3細胞中Apoa1 mRNA的表達,Apoa1表達增加會增強RCT過程,進而引起細胞內膽固醇水平發生改變,從而導致TM3細胞睪酮含量降低。
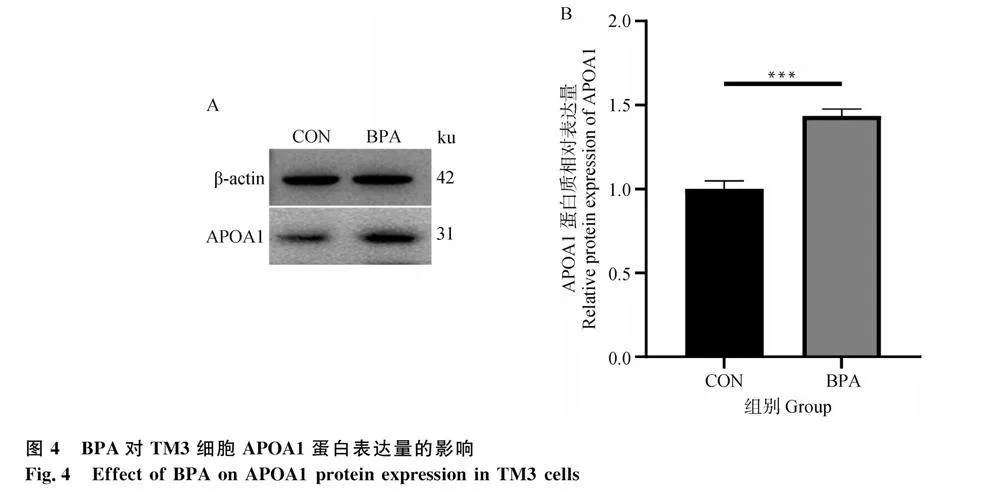
2.4 BPA對TM3細胞APOA1蛋白表達的影響
為驗證BPA對APOA1蛋白的影響,本研究采用Werstern blot檢測APOA1蛋白表達水平的變化。結果如圖4A所示,經灰度值相關性分析并量化處理后,如圖4B所示,20 μmol·L-1 BPA處理組的APOA1蛋白表達水平相比于對照組極顯著增加(Plt;0.001)。結果表明,20 μmol·L-1 BPA處理24 h不僅能夠上調TM3細胞的Apoa1基因mRNA表達水平,還顯著提高了APOA1蛋白表達水平(Plt;0.001)。
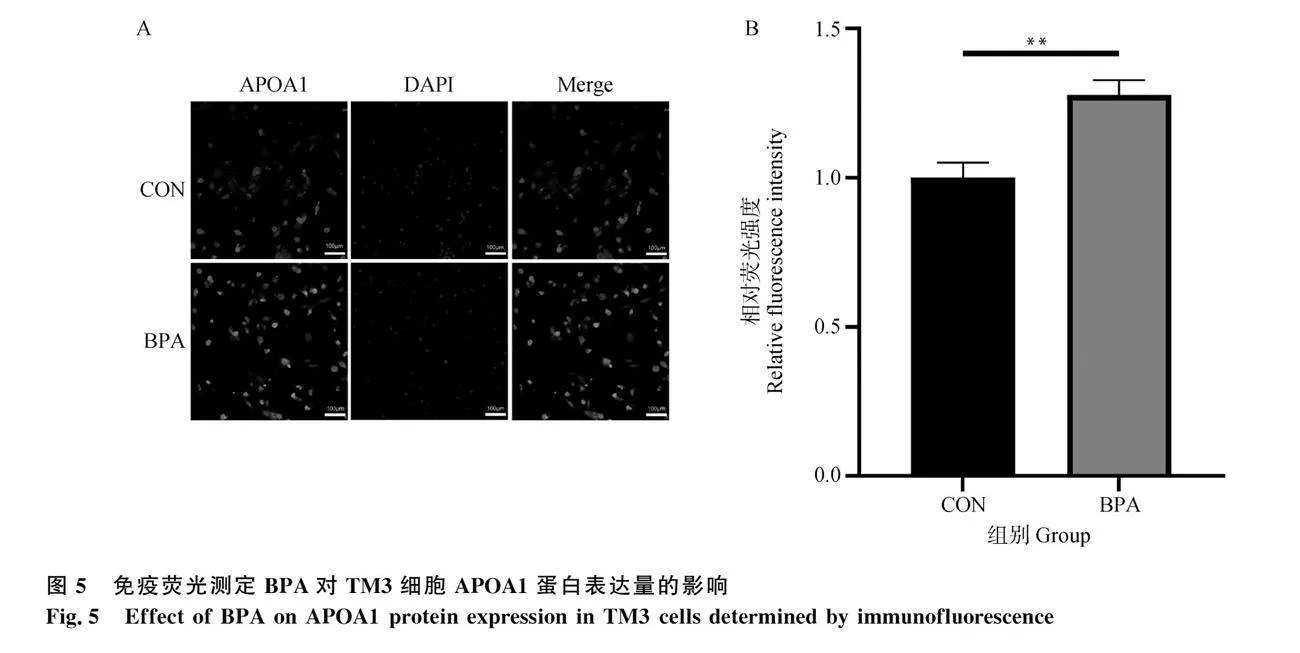
2.5 免疫熒光測定BPA對TM3細胞APOA1蛋白表達的影響
為進一步驗證BPA對APOA1蛋白表達的影響,本研究通過免疫熒光試驗觀察細胞內蛋白的表達情況。如圖5A所示,與對照組相比20 μmol·L-1 BPA干預24 h后細胞內APOA1熒光強度明顯變強。對熒光圖進行量化分析,結果如圖5B所示,20 μmol·L-1 BPA處理組熒光強度極顯著高于對照組(Plt;0.01)。上述結果表明,20 μmol·L-1 BPA 處理極顯著上調了TM3細胞中APOA1的蛋白表達量,此結果與RT-qPCR及Western blot的結果一致。
2.6 BPA對TM3細胞脂滴含量的影響
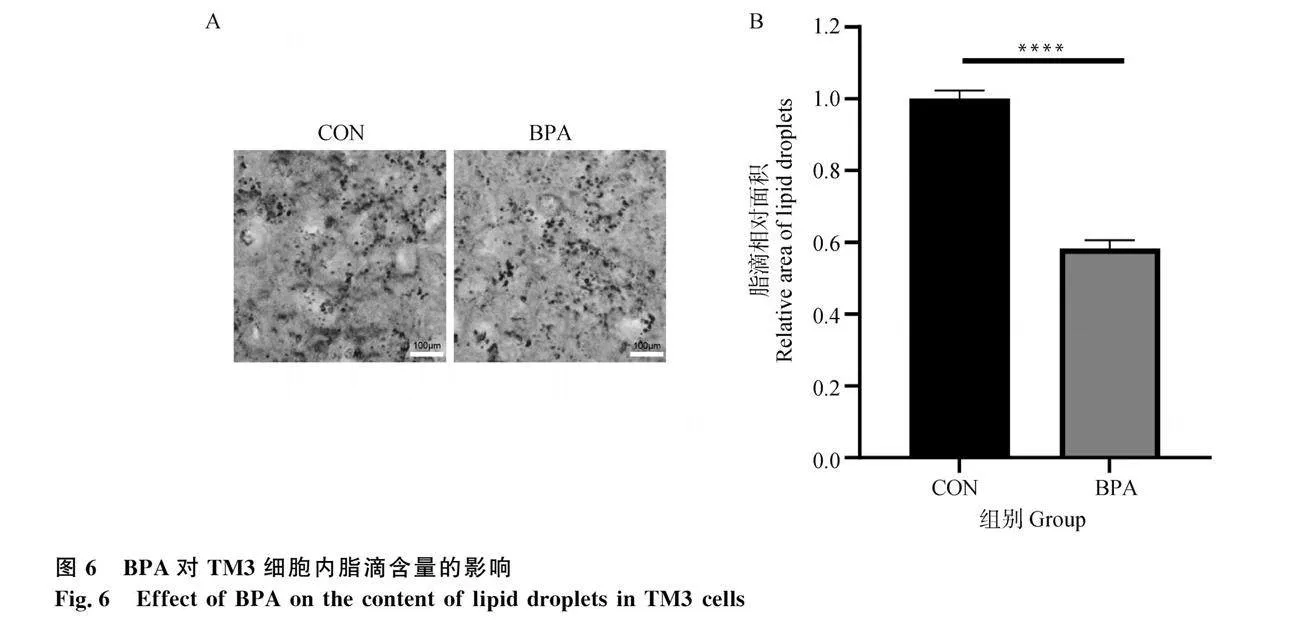
脂滴是細胞內中性脂質的主要儲存部位,主要包括甘油三酯和膽固醇酯。睪丸間質細胞內用于合成睪酮的膽固醇主要來源于脂滴的分解,脂滴的儲備量可以間接反映細胞內部膽固醇的含量。本研究使用油紅O染色檢測了經過20 μmol·L-1 BPA處理24 h的TM3細胞內脂滴的變化。結果如圖6A所示,對照組細胞內可見有大量紅色、大而圓的脂滴,20 μmol·L-1 BPA處理組的脂滴數量明顯少于對照組。量化分析結果如圖6B所示,20 μmol·L-1 BPA處理組脂滴積累量極顯著低于對照組(Plt;0.000 1)。結果表明,20 μmol·L-1 BPA處理能夠降低TM3細胞內脂滴的累積,使細胞內部的膽固醇含量減少,最終導致睪酮合成降低。
3 討 論
本研究以小鼠睪丸間質細胞株TM3細胞為研究對象,從脂質代謝角度探討BPA是否通過Apoa1基因調控TM3細胞睪酮合成分泌。結果顯示,細胞存活率隨著BPA的染毒劑量增加而逐漸降低,表明BPA對細胞的損害呈劑量依賴性。BPA暴露極顯著提高了Apoa1基因的mRNA和蛋白表達水平,并極顯著降低了TM3細胞的脂滴累積水平及睪酮分泌量。
BPA是一種無處不在的環境內分泌干擾物質,可引起生殖功能異常。睪酮對雄性性別分化、維持雄性第二性征和精子發生至關重要,而間質細胞是睪酮合成分泌的主要場所,在維持睪酮水平中發揮關鍵作用[17]。本研究CCK-8結果顯示,40 μmol·L-1 BPA處理TM3細胞24 h后,細胞活力出現了極顯著降低,而20 μmol·L-1 BPA對細胞活力無顯著影響。Jambor等[18]研究結果表明,高濃度(10、25和50 μg·mL-1)的BPB(Bisphenol B)、BPA、BPF(Bisphenol F)和BPS(Bisphenol S)在體外培養48 h后顯著降低TM3細胞的活力,5 μg·mL-1 BPA暴露于TM3細胞,其代謝活性沒有受到顯著影響。Li等[19]也描述了類似的效果,其研究結果證實,當BPA濃度分別為5、10和20 μg·mL-1時,對細胞活力有顯著抑制作用(Plt;0.05、Plt;0.001),與本試驗結果一致。Lan等[20]研究表明發現,MA-10細胞系(Mesenchymal stromal cell tumour cell lines)在小于96 μmol·L-1 BPA中培養1 h后不發生凋亡,在200 μmol·L-1 BPA染毒24 h后細胞活力顯著降低。Qian等[21]研究表明,小鼠TM4細胞暴露于0.02、0.2、2.0、20 μmol·L-1 BPA 12 h后,細胞沒有表現出明顯的損傷,而在較高濃度(2或20 μmol·L-1)下染毒24 h,與對照組相比,細胞活力出現明顯的降低;而20 μmol·L-1 BPA孵育48 h明顯誘導TM4細胞凋亡。本研究與Lan等[20]及Qian等[21]報道使細胞活力顯著下降的BPA濃度有所不同,這可能是由于不同的細胞對BPA毒性的耐受程度不同,也可能是由于處理時長的差異所造成。
APOA1是組成HDL的主要載脂蛋白,在HDL合成和RCT過程中發揮關鍵作用。已有研究表明,APOA1被廣泛認為具有心臟保護功能,其機制主要是血清APOA1水平升高可以促進RCT過程,降低血液中膽固醇水平,反之,APOA1缺乏則會產生相反的效果[22]。APOA2是HDL顆粒中含量第二高的載脂蛋白,在人血漿中以同源二聚體的形式存在。有研究顯示,Apoa2基因可增加內臟脂肪積累[23]。APOC3可抑制脂蛋白脂肪酶對乳糜微粒和極低密度脂蛋白中三酰甘油的分解,并可抑制肝對殘余脂蛋白的攝取。Apoc3基因功能喪失性突變可導致三酰甘油分解加快,血漿中三酰甘油水平下降。已有研究表明,人體內Apoc3基因過表達可導致高三酰甘油血癥,進而可能發展為動脈粥樣硬化[24]。睪丸中的膽固醇在很大程度上來自于內源性合成和從血液中對脂蛋白的攝取,多余的膽固醇則通過逆向轉運機制運回肝組織,最終排泄到膽汁中[25]。本研究中,qPCR結果顯示,在20 μmol·L-1 BPA暴露下,TM3細胞中的Apoa1 mRNA水平極顯著增加,而Apoa2、Apoc3的mRNA水平沒有顯著變化,結合油紅O染色的結果表明,TM3細胞中的脂滴含量降低,這表明BPA通過上調Apoa1的表達增強RCT過程,導致細胞內的游離膽固醇含量降低,使TM3細胞的膽固醇代謝發生紊亂。Zhang等[26]研究結果顯示,BPA通過調節Apoa1基因的表達水平導致鰷魚睪丸膽固醇紊亂,這一發現在其他研究中也得到了證實,例如,雄性昆明鼠連續4周內每天分別接受25 mg·kg-1 BPA灌胃喂后,睪丸中的膽固醇水平受到顯著抑制[27],這與本研究相一致。此外,本研究的Western blot和免疫熒光結果也支持了這一觀點,提示BPA通過上調Apoa1基因的表達增強了RCT過程,進而引起睪酮合成的前體物質游離膽固醇(free cholesterol, FC)累積量顯著降低,導致TM3細胞睪酮合成受到抑制。
BPA是一種被廣泛認知的內分泌干擾物,具有雌激素效應。已有研究表明,BPA通過激活c-Jun磷酸化,誘導類固醇基因的表達,導致間質細胞和受BPA處理的動物的睪酮/雌激素(testosterone/estrogen,T/E)比率顯著下降[28]。Hinfray等[29]研究推測,BPA可能通過調節性激素合成基因的表達來影響性激素合成分泌。此外,BPA還通過多種機制影響激素水平,包括對小鼠下丘腦-垂體-性腺軸的影響[30]。越來越多的證據表明,BPA暴露會抑制嚙齒動物的睪酮合成分泌[28]。然而以往的研究大多從睪酮合成基因及神經體液調節方面開展,鮮有研究報道BPA影響睪丸間質細胞中膽固醇水平對睪酮合成和分泌的直接作用。脂滴是細胞內中性脂質的主要儲存部位,其核心由中性脂肪組成,主要包括甘油三酯和膽固醇酯,由單層磷脂分子和圍繞核心的各種蛋白質包裹。有研究證明,細胞內脂滴水平在一定情況下可以反映游離膽固醇的水平,當細胞需要膽固醇時,細胞內脂滴進行水解釋放膽固醇,這表明細胞內高水平的脂滴通常意味著較高的膽固醇儲存[10]。因此,在一定條件下,脂滴水平可以間接反映出FC的水平[31]。FC是睪酮合成的前體物質。已有研究證實,FC水平與性激素水平密切相關[32]。本研究對TM3細胞的脂滴水平進行了檢測,油紅O染色結果顯示,BPA處理組的脂滴水平明顯少于對照組。因此,本研究為BPA暴露后睪丸間質細胞睪酮水平改變的機制提供了另一種可能的解釋。
本研究首次從BPA影響膽固醇水平的角度探討BPA對睪丸間質細胞合成睪酮含量降低的機制,盡管目前僅限于小鼠睪丸間質細胞TM3細胞株水平,但本研究已為BPA抑制睪丸間質細胞睪酮合成的機制提供了新的見解。TM3細胞來源于雄性小鼠睪丸,其具有增殖能力強、易于傳代培養等優點。而小鼠原代睪丸間質細胞是從睪丸組織通過膠原酶消化法分離,Percoll等密度梯度離心法進行純化等一系列方法獲得的細胞[33]。原代睪丸間質細胞相比于TM3細胞株,其細胞學特性未發生很大變化,仍保持原有的生物特征,可更好地反映細胞在體內的生長狀態,從而更易獲得與體內生理功能更接近的數據[34]。下一步本團隊計劃開展小鼠原代睪丸間質細胞和在體試驗研究,以從更加全面的角度驗證本研究的結論。
4 結 論
本研究旨在探究BPA暴露抑制TM3細胞睪酮合成的調控機制,重點關注其對Apoa1基因表達和膽固醇穩態的影響。研究結果顯示,BPA暴露上調了TM3細胞中Apoa1基因mRNA和蛋白的表達水平,減少了細胞內脂滴的積累,從而導致睪酮的合成分泌降低。這一發現為從脂質代謝角度深入了解BPA暴露導致TM3細胞睪酮含量降低的分子機制提供了新視角。
參考文獻(References):
[1] LIGUORI F,MORENO-MARRODAN C,BARBARO P.Biomass-derived chemical substitutes for bisphenol A:recent advancements in catalytic synthesis[J].Chem Soc Rev,2020,49(17):6329-6363.
[2] 王 浩.雙酚A類物質在市政污水處理廠中的去除機理及人體暴露分析[D].廣州:華南理工大學,2021.
WANG H.Bisphenol A and its analogues:removal mechanisms in municipal wastewater treatment plants and human exposure analysis[D].Guangzhou:South China University of Technology,2021.(in Chinese)
[3] BHANDARI R K,DEEM S L,HOLLIDAY D K,et al.Effects of the environmental estrogenic contaminants bisphenol A and 17α-ethinyl estradiol on sexual development and adult behaviors in aquatic wildlife species[J].Gen Comp Endocrinol,2015,214:195-219.
[4] THAYUMANAVAN G,JEYABALAN S,FULORIA S,et al.Silibinin and naringenin against bisphenol A-induced neurotoxicity in zebrafish model-potential flavonoid molecules for new drug design,development,and therapy for neurological disorders[J].Molecules,2022,27(8):2572.
[5] LOUP B,POUMEROL E,JOUNEAU L,et al.BPA disrupts meiosis I in oogonia by acting on pathways including cell cycle regulation,meiosis initiation and spindle assembly[J].Reprod Toxicol,2022,111:166-177.
[6] DIRINCK E,JORENS P G,COVACI A,et al.Obesity and persistent organic pollutants:possible obesogenic effect of organochlorine pesticides and polychlorinated biphenyls[J].Obesity (Silver Spring),2011,19(4):709-714.
[7] SERGEEV A V,CARPENTER D O.Residential proximity to environmental sources of persistent organic pollutants and first-time hospitalizations for myocardial infarction with comorbid diabetes mellitus:a 12-year population-based study[J].Int J Occup Med Environ Health,2010,23(1):5-13.
[8] 王 敏.雌激素受體α在雙酚A引起肝細胞脂質沉積中的作用[D].廣州:南方醫科大學,2023.
WANG M.The role of estrogen receptor α in Bisphenol A-induced lipid deposition in hepatocytes[D].Guangzhou:Southern Medical University,2023.(in Chinese)
[9] KIM N,NAKAMURA H,MASAKI H,et al.Effect of lipid metabolism on male fertility[J].Biochem Biophys Res Commun,2017,485(3):686-692.
[10] SU X,PENG D Q.The exchangeable apolipoproteins in lipid metabolism and obesity[J].Clin Chim Acta,2020,503:128-135.
[11] 顏 麗,何津春,王志祿,等.載脂蛋白與家族性高膽固醇血癥家系成員冠心病患病關系的研究[J].蘭州大學學報:醫學版,2016,42(5):31-35.
YAN L,HE J C,WANG Z L,et al.Research on relationship between apolipoprotein and coronary heart disease in family members with familial hypercholesterolemia[J].Journal of Lanzhou University:Medical Sciences,2016,42(5):31-35.(in Chinese)
[12] 尹 凱.ABCA1介導載脂蛋白A1調節巨噬細胞炎癥反應及其機制[D].衡陽:南華大學,2012.
YIN K.Effect and mechanism of apolipoprotein A-I on macrophages inflammatory response via an ABCA1-dependent manner[D].Hengyang:University of South China,2012.(in Chinese)
[13] ZHANG Y Y,YUAN C,GAO J C,et al.Testicular transcript responses in rare minnow Gobiocypris rarus following different concentrations bisphenol A exposure[J].Chemosphere,2016,156:357-366.
[14] 呂友緣,于春曉,管慶波.代謝綜合征對男性睪酮水平的影響及其機制的研究進展[J].老年醫學研究,2022,3(3):42-46.
LV Y Y,YU C X,GUAN Q B.Research progress on the effect of metabolic syndrome on male testosterone level and its mechanism[J].Geriatrics Research,2022,3(3):42-46.(in Chinese)
[15] ZHOU J Z,ZHANG Y W,ZENG L,et al.Paternal cadmium exposure affects testosterone synthesis by reducing the testicular cholesterol pool in offspring mice[J].Ecotoxicol Environ Saf,2022,242:113947.
[16] BERNECIC N C,DE GRAAF S P,LEAHY T,et al.HDL mediates reverse cholesterol transport from ram spermatozoa and induces hyperactivated motility[J].Biol Reprod,2021,104(6):1271-1281.
[17] CORONA G,MAGGI M.The role of testosterone in male sexual function[J].Rev Endocr Metab Disord,2022,23(6):1159-1172.
[18] JAMBOR T,KNIZATOVA N,GREIFOVA H,et al.Toxicity of bisphenol A and its replacements in the mice Leydig cells in vitro[J].Physiol Res,2023,72(1):71-86.
[19] LI C M,ZHANG L L,MA T T,et al.Bisphenol A attenuates testosterone production in Leydig cells via the inhibition of NR1D1 signaling[J].Chemosphere,2021,263:128020.
[20] LAN H C,WU K Y,LIN I W,et al.Bisphenol A disrupts steroidogenesis and induces a sex hormone imbalance through c-Jun phosphorylation in Leydig cells[J].Chemosphere,2017,185:237-246.
[21] QIAN W Y,ZHU J Y,MAO C F,et al.Involvement of CaM-CaMKII-ERK in bisphenol A-induced Sertoli cell apoptosis[J].Toxicology,2014,324:27-34.
[22] COCHRAN B J,ONG K L,MANANDHAR B,et al.APOA1:a protein with multiple therapeutic functions[J].Curr Atheroscler Rep,2021,23(3):11.
[23] MARZAL-CASACUBERTA A,BLANCO-VACA F,ISHIDA B Y,et al.Functional lecithin:cholesterol acyltransferase deficiency and high density lipoprotein deficiency in transgenic mice overexpressing human apolipoprotein A-II[J].J Biol Chem,1996,271(12):6720-6728.
[24] SILBERNAGEL G,SCHARNAGL H,KLEBER M E,et al.Common APOC3 variants are associated with circulating ApoC-III and VLDL cholesterol but not with total apolipoprotein B and coronary artery disease[J].Atherosclerosis,2020,311:84-90.
[25] SHI J F,LI Y K,REN K,et al.Characterization of cholesterol metabolism in Sertoli cells and spermatogenesis (Review)[J].Mol Med Rep,2018,17(1):705-713.
[26] ZHANG Y Y,ZHANG M,ZHU Z,et al.Bisphenol A regulates apolipoprotein A1 expression through estrogen receptors and DNA methlylation and leads to cholesterol disorder in rare minnow testis[J].Aquat Toxicol,2021,241:105999.
[27] GAO Z S,LIU S H,TAN L,et al.Testicular toxicity of bisphenol compounds:homeostasis disruption of cholesterol/testosterone via PPARα activation[J].Sci Total Environ,2022,836:155628.
[28] LAN H C,LIN I W,YANG Z J,et al.Low-dose bisphenol A activates Cyp11a1 gene expression and corticosterone secretion in adrenal gland via the JNK signaling pathway[J].Toxicol Sci,2015,148(1):26-34.
[29] HINFRAY N,NóBREGA R H,CAULIER M,et al.Cyp17a1 and Cyp19a1 in the zebrafish testis are differentially affected by oestradiol[J].J Endocrinol, 2013,216(3):375-388.
[30] CHEN W T,LAU S W,FAN Y Q,et al.Juvenile exposure to bisphenol A promotes ovarian differentiation but suppresses its growth-Potential involvement of pituitary follicle-stimulating hormone[J].Aquat Toxicol,2017,193:111-121.
[31] 韓思蘭.魚類脂滴自噬與脂滴水解在脂代謝調控中的互作機制研究[D].上海:華東師范大學,2021.
HAN S L.The interaction between lipophagy and lipolysis in regulation of lipid metabolism in fish[D].Shanghai:East China Normal University,2021.(in Chinese)
[32] MONDUL A M, SELVIN E,ROHRMANN S,et al.Association of serum cholesterol and cholesterol-lowering drug use with serum sex steroid hormones in men in NHANES III[J].Cancer Causes Control,2010,21(10):1575-1583.
[33] 趙為民,楊建英,代 濤,等.小鼠睪丸間質細胞體外原代培養方法的建立[J].中國組織工程研究與臨床康復,2011,15(46):8665-8667.
ZHAO W M,YANG J Y,DAI T,et al.Establishment of a method for primary culture of mouse Leydig cells in vitro[J].Chinese Journal of Tissue Engineering Research,2011,15(46):8665-8667.(in Chinese)
[34] 鄒治然,王雪婷,朱 俐.低氧對原代睪丸間質細胞和細胞系TM3、MLTC-1中核呼吸因子1與睪酮合成的影響[J].南通大學學報:醫學版,2017,37(5):395-399.
ZOU Z R,WANG X T,ZHU L.Effects of hypoxia on the synthesis of nuclear respiratory factor 1 and testosterone in primary Leydig cells,cell lines TM3 and MLTC-1[J].Journal of Nantong University:Medical Sciences,2017,37(5):395-399.(in Chinese)
(編輯 范子娟)

