蜘蛛絲:一種神奇的天然生物纖維材料

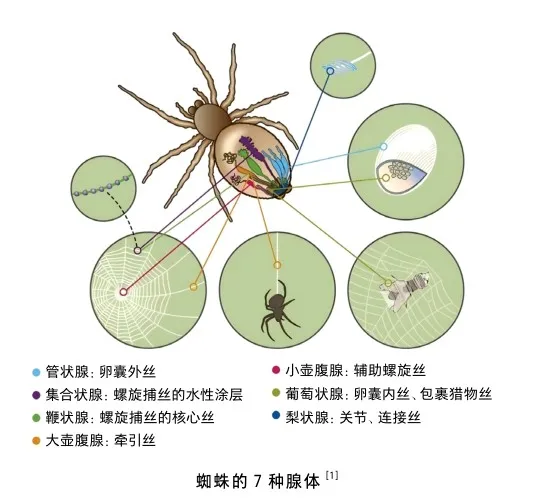
蜘蛛屬于節肢動物門,是一種全球廣泛分布的動物,其起源可以追溯至遠古時代,大約4億年前的泥盆紀時期。截至最新的統計數據,世界上已發現超過42 750種類型的蜘蛛,大多數的蜘蛛至少含有7種絲腺,即大壺狀腺、小壺狀腺、葡萄狀腺、柱狀或管狀腺、鞭狀或冠狀腺、梨狀腺和集合腺[1]。不同的絲腺可以分泌出不同物理性質的絲,具有不同的功能。例如,由大壺腹狀腺分泌的牽引絲,又叫框絲,具有優異的機械性能,可以用于建網、捕食、逃避捕食者等;由集合狀腺分泌的連接絲具有很高的黏性,可以用于連接、黏附等。
蛛絲蛋白初級結構

蜘蛛絲主要由一種或多種蜘蛛蛋白組成,這些蛋白質往往很大(每個單體可達350千道爾頓)。盡管蜘蛛絲性質不同,但所有蜘蛛蛋白都有一個共同的初級結構模式,中間為一個由重復模塊單元組成的大核心,兩側是非重復結構域。非重復末端結構域具有折疊的球形結構,由100~140個氨基酸組成。這種末端結構域對于蛛絲腺中蛛絲蛋白的儲存和紡絲管中纖維的形成至關重要。重復核心序列由模塊單元組成,每個單元包含40~200個氨基酸,這些模塊單元在核心域內大約重復100次。在大壺狀腺、小壺狀腺和鞭毛狀絲中,模塊單元主要由(Ala)4-14、(GlyAla)n、GlyGlyX和GlyProGlyXX序列組成,其中X代表可變氨基酸。一般來說,這些序列的子集、順序和數量對纖維的機械性能至關重要。
由大壺狀腺分泌的蜘蛛牽引絲,其拉伸強度為0.88~1.6吉帕,韌性為136~350 兆焦每立方米,是被研究的最多、最深入的蜘蛛絲之一。這種牽引絲主要由兩種大壺狀腺蛛絲蛋白MaSp1和MaSp2構成,是一種嵌段共聚物。MaSp1的單個模塊單元通常包括一個聚丙氨酸塊和幾個GGX基序,在MaSp2模塊中,GGX基序被GPGXX基序取代,顯著增加了MaSp2的脯氨酸含量。這些基序的重復交替組成了牽引絲的核心結構域,末端則是由小的非重復氨基和羧基結構域構成[2]。
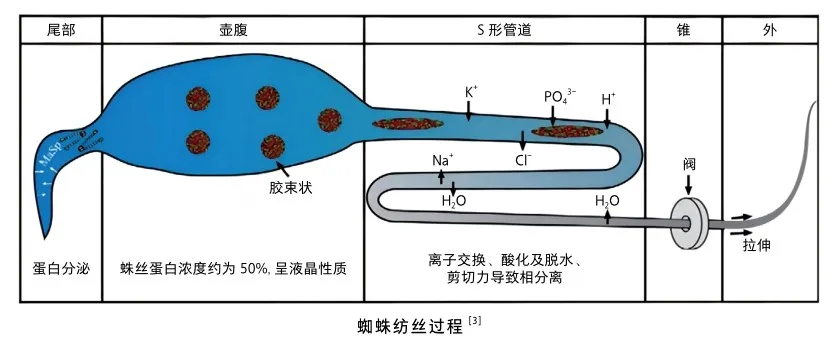
蜘蛛紡絲過程
蜘蛛的紡絲過程可分為4個部分[3]。第一部分在尾部,由專屬細胞分泌蛛絲蛋白;第二部分在壺腹/囊中,蛛絲蛋白被儲存起來,與壺腹中的其他化合物混合形成纖維的皮膚層。在壺腹中,蛛絲蛋白的濃度可以達到50%(質量分數),在這個濃度下,大多數蛋白傾向于不可逆的聚集。為了防止這種非特異性聚集,蛛絲蛋白借助其兩親性的性質形成膠束狀結構。另外,非重復末端結構域也支持這種超分子組裝體的形成。這種具有向列液晶相性質的蛛絲蛋白稱為紡絲液。在第三部分,蛛絲蛋白流經S-形軌道,隨著軌道逐漸變窄,剪切力增加,液晶性蛛絲蛋白形成β-折疊晶區。在紡絲過程的最后一部分,纖維從噴絲口拉出,剪切力進一步提高,導致蛛絲蛋白產生一些結構變化,特別是在末端結構域,上皮細胞將水排出去導致蛛絲蛋白和溶劑發生相分離,疏水區域被暴露,這些末端結構域的變化造成膠束狀結構核心區域的重新排列,與剪切力一起支持蛛絲蛋白組裝。另外,除了剪切力的影響外,在S-形軌道發生的化學變化也會影響蛛絲蛋白結構變化。Na+、Cl-和K+、PO43-的交換導致羧基末端非重復結構域中疏水區域的暴露;將pH從7降低到6,氨基末端結構域二聚化,可充當物理交聯點交聯蛛絲蛋白結構。
在纖維離開噴絲口之前,會通過一個“閥門”,一個在內部破裂后幫助重新啟動紡絲過程的器官。通過對管道進行前后加捻,以此將破裂的纖維移動到打開的閥門中。一旦纖維從噴絲口中噴出去,蜘蛛將會進一步拉伸纖維導致纖維進一步水分蒸發和分子有序排列。這種復雜精細的紡絲過程產生了一種強而韌的蜘蛛絲。
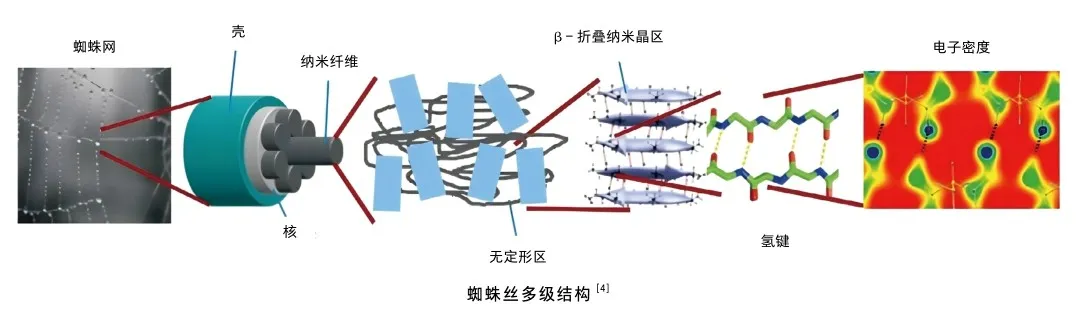
蜘蛛牽引絲多級結構
蜘蛛牽引絲具有一種多級結構,對蛛絲切片并免疫染色,然后通過透射電子顯微鏡觀察到MaSp1和MaSp2蛋白在蛛絲橫截面上異質分布,呈現一種“核殼結構”[4]。即外殼主要由MaSp1蛋白組成,表現為高模量和低延展性;內核則是由MaSp1和MaSp2蛋白混合構成,表現為低模量和高延展性。這種剛柔并濟的核殼結構是蜘蛛牽引絲兼具優異強度和韌性的重要原因之一。另外,科學家借助原子力顯微鏡在蜘蛛絲表面觀察到了螺旋扭曲的納米纖維結構,這些納米纖維沿著蜘蛛絲長度方向有序排列[5];將蛛絲放在去離子水中進行超聲分解,可以得到直徑10納米的納米纖維,單根納米纖維的斷裂強度約為120納牛。曾有研究者通過有限元模擬證實了這種螺旋的納米纖維結構在高剪切變形下可以發生滑動,放大形變,提高能量耗散,增大蛛絲的韌性;而分子鏈在納米纖維中的有序排列,可以提高纖維的強度[6]。
在分子水平上,富含丙氨酸的基序形成了β-折疊晶區,富含甘氨酸的基序形成了β-轉折、β-螺旋、α-螺旋和無定型基質,納米尺度的β-折疊晶區嵌在由β-轉折、β-螺旋l、α-螺旋以及隨機線圈組成的無定形基質中形成交聯網絡,影響纖維的機械性能。β-折疊晶區沿纖維軸向排列,充當交聯網絡的節點,提高蛛絲變形過程中的強度,而α-螺旋以及隨機線圈在拉伸過程中伸展,促進纖維的延展性。β-折疊晶區由蛛絲蛋白多肽鏈通過氫鍵自組裝形成,其尺寸對纖維的力學性能影響巨大。研究人員通過一系列分子動力學模擬,揭示了尺寸限制在幾納米內的β-折疊晶區,能夠更有效地利用氫鍵的均勻剪切變形和耗散分子黏滑變形,使纖維具有更高的硬度、強度和韌性[7]。由上述內容可知,蜘蛛牽引絲展現了一種多級結構,包括核殼結構、螺旋納米纖維結構以及β-折疊晶區交聯等,這些結構是蛛絲具有優異性能的重要原因。
人造蛛絲制備
雖然天然蜘蛛絲具有十分優異的性能,如高強度、良好的柔韌性和彈性,以及良好的生物相容性和生物可降解性等,但是由于蜘蛛同類相食的特性,不能大量養殖,因此,人造蛛絲的制備就顯得尤為重要。基于重組蛛絲蛋白制備人造蛛絲是一種有效的方式[8]。
2015年,有研究小組小組采用十字園蛛絲蛋白3(ADF3),在大腸桿菌中表達重組蛛絲蛋白。將凍干的重組蛛絲蛋白溶解并透析作為紡絲液進行紡絲,得到的人造蛛絲纖維拉伸強度為370兆帕,韌性為183兆焦每立方米;2017年,該團隊又設計了一種短的主壺腹腺蛛絲蛋白,該蛋白融合了角織蛛末端結構域和圓織蛛核心結構域,所制備的人造蛛絲纖維拉伸強度為282兆帕,韌性為144兆焦每立方米。
另外,科學家們發現重組蛛絲濃度和分子量也會影響人造蛛絲纖維的力學性能。重組蛛絲蛋白分子量越高,所制得的人造蛛絲纖維力學強度越高,由分子量為284.9千道爾頓的重組蛛絲蛋白制備得到的人造蛛絲纖維拉伸強度可以達到508兆帕,楊氏模量達到21吉帕。
一般來說,重組蛛絲蛋白的濃度很難達到天然蛛絲蛋白的濃度(50%)。有研究團隊設計了一種嵌合重組蛛絲蛋白,由來自Euprosthenops australis MaSp1可溶的氨基末端結構域和來自大腹園蛛MiSp可溶的羧基末端結構域組成,這種嵌合重組蛛絲蛋白濃度高達50%,紡出的纖維拉伸強度為162兆帕,韌性為45兆焦每立方米。與純蛛絲蛋白纖維相比,多組分復合纖維有望具有更高的機械性能和穩定性。另有研究團隊將蜘蛛牽引絲蛋白和絲素蛋白復合,制備的纖維韌性達到116兆焦每立方米。此外,將MaSp1靶向整合到家蠶絲腺中,顯著改善了蠶絲纖維的力學性能,尤其是拉伸性能,所得到的纖維斷裂強度為371.5兆帕,斷裂應變為32.2%。而其他學者將蛛絲蛋白基因插入絲素蛋白重鏈或輕鏈的內含子中,由此產生的纖維拉伸強度高達1.2吉帕。
除了基于重組蛋白制備人造蛛絲外,科學家們通過模仿蜘蛛絲的多級結構如交聯結構、螺旋的納米纖維結構以及核殼結構等,已經開發出了很多性能優異的人造纖維[9]。
結 語
蜘蛛絲作為一種天然生物蛋白纖維,具有高強、高韌、輕質柔性以及生物相容性、可降解等特點,在生物醫學、軍事工業、材料科學等領域具有廣泛的應用。通過對蜘蛛絲結構和性能的深入研究,可以推動人們對新型功能纖維材料的仿生結構設計,創造出更多性能優異、功能多樣的纖維材料。
[1]Rising A, Johansson J. Toward spinning artificial spider silk. Nature Chemical Biology, 2015, 11: 309–315.
[2]Yarger J L, Cherry B R, van der Vaart A. Uncovering the structurefunction relationship in spider silk. Nature Reviews Materials, 2018, 3(3): 8000.
[3]Eisoldt L, Smith A, Scheibel T. Decoding the secrets of spider silk . Materials Today, 2011, 14(3): 80-86.
[4]Sponner A, Vater W, Monajembashi S, et al. Composition and hierarchical organisation of a spider silk. Plos One, 2007, 2(10): e998.
[5]Xu G, Gong L, Yang Z, et al. What makes spider silk fibers so strong? From molecular-crystallite network to hierarchical network structures. Soft Matter, 2014, 10(13): 2116-2123.
[6]Wang Q, Schniepp H C. Strength of recluse spider’s silk originates from nanofibrils. ACS Macro Letters, 2018, 7(11): 1364-1370.
[7]Keten S, Xu Z, Ihle B, et al. Nanoconfinement controls stiffness, strength and mechanical toughness of β-sheet crystals in silk. Nature Materials, 2010, 9(4): 359-367.
[8]Li J, Li S, Huang J, et al. Spider silk-inspired artificial fibers. Advanced Science, 2022, 9(5): 2103965.
[9]Liu S, Cui Z, Liu Z, Zhao W, Zhou X. Research progress on spiderinspired tough fibers. Chinese Journal of Chemistry. 2023, 3401.
關鍵詞:蜘蛛絲 多級結構 紡絲 纖維 人造蛛絲 ■

