基于負載在碳基底上的釕納米顆粒的類過氧化物酶活性比色檢測抗氧化劑


關鍵詞納米酶;晶格應變;抗氧化劑;比色分析
天然抗氧化劑具有重要的生物學功能和藥理作用,能夠預防氧化應激相關疾病,如心血管疾病、癌癥和糖尿病等[1],因此,發展針對這些抗氧化劑的定量檢測方法具有重要意義。常見的抗氧化劑的檢測方法包括氣相色譜法[2]、液相色譜法[3]、電化學分析法[4]和極譜法[5]等。盡管上述方法靈敏度較高,但需要昂貴的設備且操作步驟繁瑣,限制了其廣泛應用。相比之下,比色法因具有操作簡單、響應迅速、可重復性良好等特點備受關注[6-7]。
天然酶的催化活性高且特異性好,在比色分析中表現出良好的應用潛力[8]。但是,天然酶存在易失活、成本高及難儲存等缺點,限制了其在比色分析中的應用[9]。納米酶是一類具有內在類酶活性的納米材料,具有可調的催化活性、成本低及易儲存等優勢,有望成為天然酶的有效替代物[10-11]。自2007年首次報道Fe3O4納米顆粒具有類過氧化物酶活性以來[12],許多納米材料包括金屬氧化物[13]、金屬有機骨架[14]、碳基材料[15]和貴金屬[16]等被發現同樣具有類酶活性,其中,具有類過氧化物酶活性的貴金屬基納米酶被廣泛應用于生物傳感、腫瘤治療和抗菌等領域[17-19]。貴金屬納米酶的催化活性與其顆粒尺寸密切相關。一般而言,減小粒徑有助于增強其催化效率,但小尺寸的貴金屬納米粒子由于表面能高,在催化反應過程中容易聚集,使其催化活性不斷降低[20]。因此,尋找合適的載體用于穩定和負載貴金屬納米酶對提高貴金屬納米顆粒的催化活性具有重要意義[21-22]。
本研究合成了一種均勻穩定地負載在氮改性碳納米片上并且具有晶格應變效應的釕納米顆粒(RuNPs/NC)。其中,RuNPs的晶格應變效應以及NC基底中氮元素的引入有效提高了RuNPs/NC的穩定性以及類過氧化物酶催化活性。基于抗壞血酸(AA)、沒食子酸(GA)和單寧酸(TA)對RuNPs/NC催化的3,3′,5,5′-四甲基聯苯胺(TMB)-H2O2顯色反應的抑制[23],RuNPs/NC-H2O2-TMB體系被成功應用于AA、GA和TA等的比色檢測。本研究不僅為調節貴金屬納米酶的催化活性提供了良好的思路,也為抗氧化劑的檢測提供了一種簡便且有效的方法。
1實驗部分
1.1儀器與試劑
SmartLab9KW型原位X-射線粉末衍射儀(XRD,日本理學公司);JEM2100F透射電子顯微鏡(TEM,日本電子株式會社);K-AlphaX射線光電子能譜儀(XPS,美國賽默飛世爾科技公司);UV-8000紫外-可見分光光度計(上海元析儀器有限公司);MagnettechESR5000電子順磁共振譜儀(EPR,德國布魯克公司)。
氯化釕(99.9%,美國Sigma-Aldrich公司);乙酸(99.8%)、AA(99%)、乙酸鈉(99%)和TMB(98%)(上海麥克林試劑有限公司);TA(95%)、GA(99%)、乙醇(99.7%)、雙氰胺(99%)、均苯三甲酸(97%)、蔗糖(Sucrose)、果糖(Fru)、葡萄糖(Glu)和乳糖(Lac)(上海阿拉丁試劑有限公司)。
1.2RuNPs/NC-x復合材料的制備
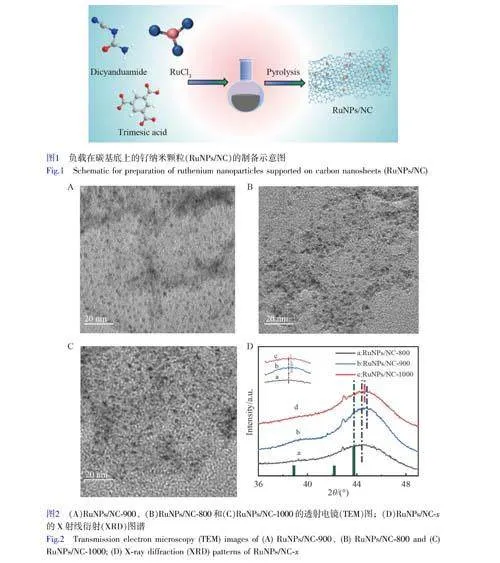
采用濕化學-熱解法制備了RuNPs/NC[24]。將10mg氯化釕溶解在10mL乙醇中,攪拌直至完全溶解,得到溶液A。將10mg均苯三甲酸和1g雙氰胺溶解在30mL乙醇中,攪拌1h至完全溶解,得到溶液B。將上述A、B溶液充分混合后,置于80℃油浴中繼續攪拌至蒸干乙醇溶劑。隨后,將干燥的混合物在不同溫度(800、900和1000℃)的氮氣氛圍中熱解1h,得到一系列具有不同氮含量的RuNPs/NC-x(x代表熱解溫度)樣品。另外,以雙氰胺和均苯三甲酸為原料制備了NC-x。
1.3RuNPs/NC-x的類過氧化物酶活性測試
以TMB-H2O2顯色反應考察RuNPs/NC的類過氧化物酶活性。在2mL離心管中依次加入10μLRuNPs/NC(0.1mg/mL)、50μLH2O2(0.1mol/L)、50μLTMB(5mmol/L)和890μLHAc-NaAc緩沖溶液(0.2mol/L,pH=4.0),混合均勻后,于室溫下反應20min,然后記錄反應體系在500~800nm波長范圍內的吸收光譜。將RuNPs/NC在室溫下放置3個月后重復上述步驟,記錄其在500~800nm波長范圍內的吸光度,考察其穩定性。
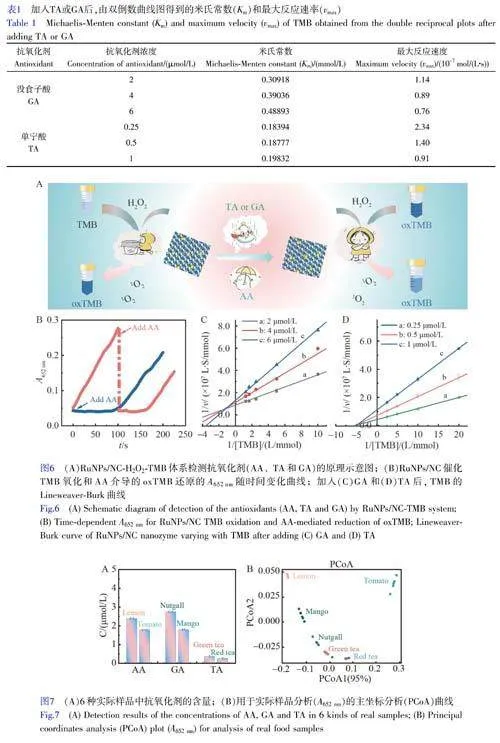
在含有HAc-NaAc緩沖溶液(0.2mol/L,pH4.0)體系中,分別改變TMB和H2O2的濃度,記錄體系在652nm處的吸光度隨時間變化的曲線。利用Michaelis-Menten方程擬合計算反應體系的動力學參數[25]:
其中,v為反應初速率,S為底物濃度,Km為Michaelis常數,vmax為最大反應速率。
1.4比色法檢測抗氧化劑
配制不同濃度的抗氧化劑標準樣品(AA:1~10μmol/L;GA:2~16μmol/L;TA:0.25~3.5μmol/L)。將10μLRuNPs/NC(0.1mg/mL)、50μLTMB(5mmol/L)、50μLH2O2(0.1mol/L)和840μLHAc-NaAc緩沖溶液(0.2mol/L,pH=4.0)混合后,在室溫下反應20min,然后分別加入不同濃度的3種抗氧化劑(50μL),孵育40s后,測定溶液的吸光度。通過抗氧化劑濃度與吸光度之間的線性關系進行抗氧化劑的定量分析。
1.5實際樣品中抗氧化劑的檢測
檸檬和西紅柿富含AA,茶葉富含TA,五倍子和芒果果皮富含GA。因此,以上述物質為代表,對實際樣品中的抗氧化劑進行檢測和評估。檸檬、西紅柿、茶葉(紅茶和綠茶)和芒果均購買于本地超市,五倍子購買于本地中藥店。檸檬、西紅柿和芒果榨汁后,離心取上清液,稀釋5倍后備用;將1g茶葉和五倍子分別加入50mL沸水中,5min后取上清液,備用。除用實際樣品代替標準抗氧化劑溶液外,檢測步驟與1.4節的方法相同。
2結果與討論
2.1RuNPs/NC的結構表征
將氯化釕、均苯三甲酸和雙氰胺混合乙醇溶液在80℃加熱,直至乙醇完全蒸發,得到的固體樣品在不同溫度下高溫處理1h,制得不同含量氮摻雜的RuNPs/NC-x樣品(圖1)。利用TEM對RuNPs/NC-x的形貌進行了表征。如圖2A~2C所示,RuNPs均勻地分散在NC上,表明3種熱解溫度下獲得的RuNPs的形貌無明顯區別。
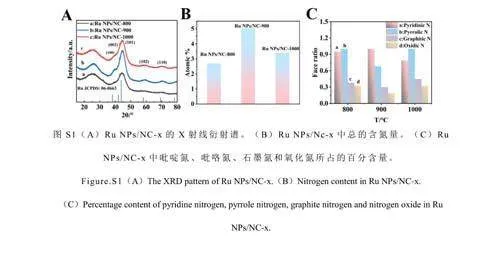
通過XRD對RuNPs/NC-x的晶體結構進行了表征。如電子版文后支持信息圖S1A所示,釕為六方密排堆積相(JCPDSNo.06-0663)[27]。與標準卡片相比,3種熱解溫度下獲得的RuNPs的衍射峰均向高角度方向移動(圖2D),表明RuNPs與載體之間的強相互作用導致RuNPs的晶格壓縮[28]。其中,RuNPs/NC-900的偏移程度高于RuNPs/NC-800和RuNPs/NC-1000,表明在900℃下,RuNPs的晶格應變程度更大[29]。
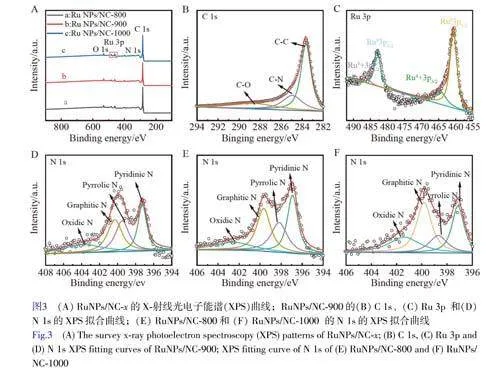
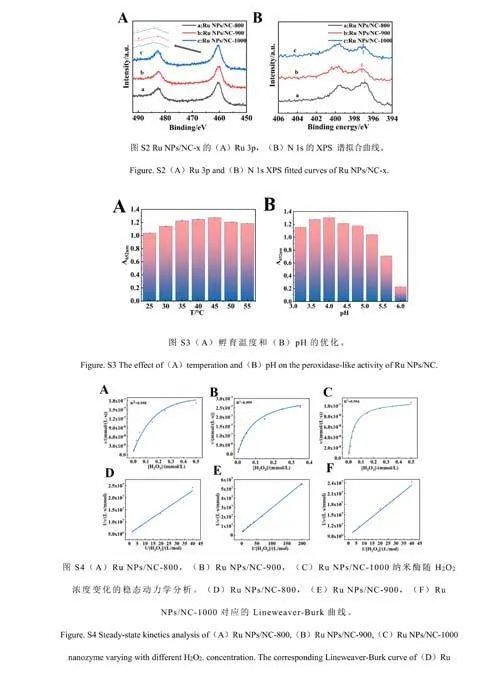
利用X-射線光電子能譜(XPS)研究了RuNPs/NC-x的化學組成和金屬價態。如圖3A所示,RuNPs/NC-x樣品中存在C、N、O和Ru元素。以RuNPs/NC-900為例,對其各元素存在形式進行了分析。如圖3B所示,C1s的XPS擬合曲線顯示C—C(284.4eV)、C—N(285.4eV)和C—O(288.7eV)的特征峰。如圖3C所示,Ru3p的XPS擬合曲線顯示位于464.4、486.9、461.4和483.6eV處的4個峰分別對應Ru4+3p3/2、Ru4+3p1/2、Ru03p3/2和Ru03p1/2,表明釕的價態為0和4。N1s的XPS譜顯示了4種類型的氮物種,包括吡啶氮(398.1eV)、吡咯氮(399.5eV)、石墨氮(400.8eV)和氧化氮(402.3eV)(圖3D和3F)。由電子版文后支持信息圖S2A和S2B可知,RuNPs/NC-x的Ru3p和N1s的XPS衍射峰發生了相對位移,說明在RuNPs和NC之間發生了電子轉移。通過XPS結果計算氮含量,發現RuNPs/NC-900中氮含量最高(電子版文后支持信息圖S1B)。相對于RuNPs/NC-800和RuNPs/NC-1000,RuNPs/NC-900具有最高比例的吡啶氮(電子版文后支持信息圖S1C)。由于吡啶位點上的孤對電子可以與金屬原子形成強的化學鍵,從而限制了金屬原子的擴散和聚集,使得納米顆粒可以更加穩定的負載在NC基底上[30],有效提高了材料的類酶活性[31]。
2.2類過氧化物模擬酶活性評估及催化機理
如圖4A所示,只有當H2O2、TMB和RuNPs/NC-900共存時(曲線a),在652nm處出現氧化態TMB(oxTMB)的特征吸收峰,表明RuNPs/NC-900具有類過氧化物酶活性。如圖4B所示,在含有TMB及H2O2的溶液中加入相同質量的RuNPs/NC-800(曲線b)、RuNPs/NC-1000(曲線c)和NC(曲線d),發現RuNPs/NC-900的吸光度最大,表明RuNPs/NC-900具有最高的類過氧化物酶活性。上述結果表明,RuNPs/NC中氮含量越高,吡啶氮越多,其類過氧化物酶活性越好[32]。另外,由于NC的吸收峰與其它吸收峰相比可以忽略不計,表明RuNPs/NC-x的類酶活性主要源于RuNPs。
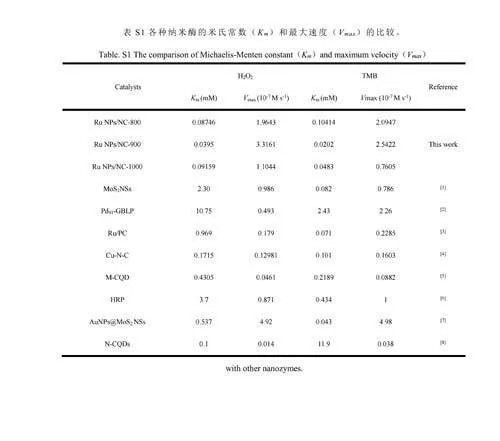
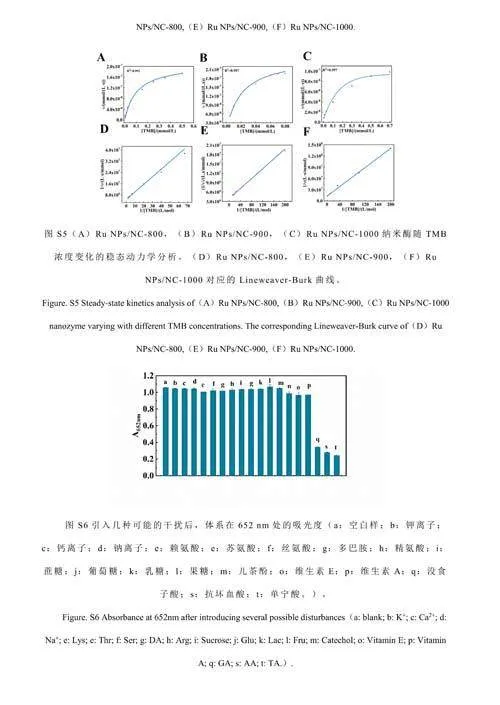
納米酶的催化活性與催化反應孵育溫度和反應體系的pH值有關。對溫度(25~55℃)和pH值(3.2~6.0)的影響進行了考察。由電子版文后支持信息圖S3A和S3B可知,最佳反應溫度為45℃,最佳pH為4.0。在25~55℃范圍內,溫度對納米酶的催化活性影響不大,因此選擇室溫進行后續測試。考察了RuNPs/NC的儲存穩定性。結果表明,RuNPs/NC在保存3個月之后其活性仍保持在初始活性的95%以上,證明其具有良好的穩定性(圖4C)。以H2O2和TMB為底物,進行了穩態動力學實驗。如電子版文后支持信息圖S4和S5所示,在合適的底物濃度范圍內,RuNPs/NC-x的催化反應遵循典型的Michaelis-Menten動力學模型[33],計算得到動力學常數(電子版文后支持信息表S1),相對于天然酶及已報道的其它納米酶,RuNPs/NC-x在與底物的親和力和反應速率方面均具有優勢。另外,RuNPs/NC-900的動力學常數優于RuNPs/NC-800和RuNPs/NC-1000,也說明RuNPs/NC-900具有最高的類酶活性[34]。
過氧化物酶活性與活性氧(ROS)的產生密切相關[35-37]。因此,為闡明RuNPs/NC的催化機理,對RuNPs/NC催化過程中的活性氧類型進行了測試。首先,利用異丙醇、色氨酸和超氧化物歧化酶分別作為·OH、1O2和O2·的捕獲劑[38-40],將上述捕獲劑分別加入到RuNPs/NC-H2O2-TMB體系中,測定其在652nm處的吸光度。結果表明,只有在加入色氨酸后,體系在652nm處的吸光度明顯降低,表明體系中產生了1O2(圖4D)。電子順磁共振(EPR)x∶y∶z三重峰的出現進一步證實了1O2的存在(圖4E)。
2.3抗氧化劑的檢測
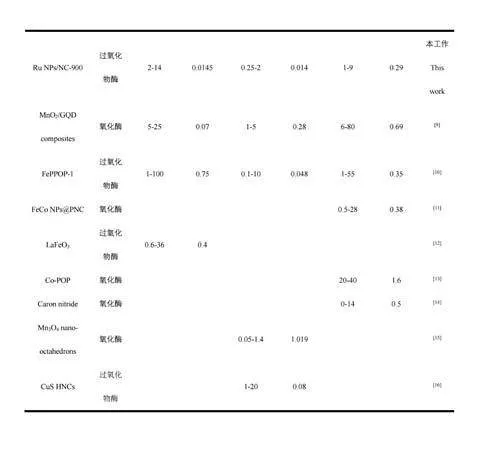
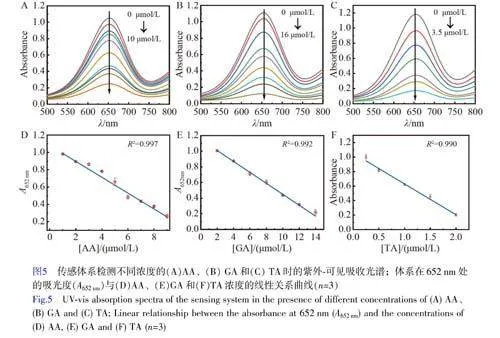
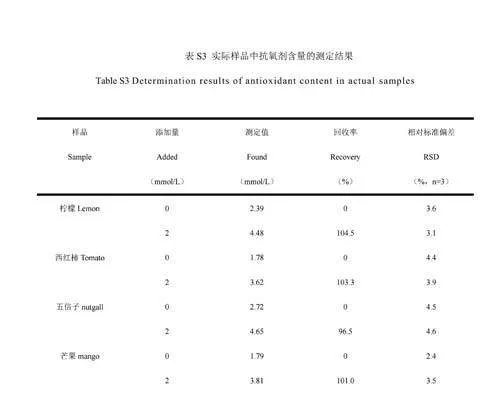
考察了RuNPs/NC-H2O2-TMB體系用于AA、TA和GA檢測的可行性。當向體系中分別加入3種抗氧化劑(圖4F曲線b、c和d)時,體系在652nm處的吸光度(A652nm)相對于未加入抗氧化劑(曲線a)時明顯降低,且A652nm隨抗氧化劑濃度升高而逐漸降低(圖5),證明RuNPs/NC-H2O2-TMB體系可用于AA、TA和GA的檢測。A652nm與AA、GA和TA的濃度分別在在1~10μmol/L、2~16μmol/L和0.25~3.50μmol/L范圍內呈線性關系。根據3σ/S(σ表示空白樣的標準偏差,S表示曲線的斜率)計算得到AA、GA、TA的檢出限分別為0.29、0.014和0.014μmol/L。與已報道的檢測AA/GA/TA的方法相比(電子版文后支持信息表S2),本體系對抗氧化劑AA、GA和TA的靈敏度更高。選擇食品和中藥中常見的氨基酸、離子、糖類以及其它抗氧化劑(兒茶酚、維生素E、維生素A)作為干擾物質考察體系的選擇性。如電子版文后支持信息圖S6所示,加入干擾物質后,體系的A652nm未發生明顯的變化,表明本體系對AA、TA和GA具有良好的選擇性。
2.4抗氧化劑對RuNPs/NC類過氧化物酶活性的抑制機理
AA、GA和TA作為抗氧化劑,可抑制RuNPs/NC催化TMB的氧化反應,如圖6A所示。AA作為抗氧化劑和自由基清除劑,可有效抑制酶引發的顯色反應[41]。通過猝滅動力學[42]研究了AA對RuNPs/NC催化的TMB-H2O2反應的抑制作用。如圖6B所示,將AA加入到預先反應的RuNPs/NC-H2O2-TMB體系中,652nm處的吸光度迅速下降(曲線a),證實AA可還原氧化的TMB(oxTMB)。如在反應的初始階段引入AA時(曲線b),RuNPs/NC催化的TMB的氧化反應被抑制;隨著AA被消耗,氧化反應逐漸恢復,證明AA可以清除來自RuNPs/NC-H2O2-TMB體系的1O2。上述結果表明,AA通過還原oxTMB及消耗1O2抑制RuNPs/NC催化TMB的氧化反應。TA和GA作為抗氧化劑,能夠抑制RuNPs/NC催化TMB的氧化反應。通過抑制動力學研究了TA和GA對RuNPs/NC催化TMB-H2O2反應的抑制作用[43]。抑制動力學遵循Michaelis-Menten方程。TA和GA的Lineweaver-Burk曲線圖如6C和6D所示,各曲線線性關系良好,并且相交于第二象限。由公式(1)和(2)計算得到的Km和vmax見表1,可見隨著TA和GA濃度的增大,Km增大,vmax減小,表明TA和GA抑制RuNPs/NC催化TMB氧化的機理為混合型抑制[44]。
2.5實際樣品的比色分析
考察了RuNPs/NC-H2O2-TMB體系在檢測實際樣品中抗氧化劑的應用潛能,測定結果如圖7A所示。同時進行了標準添加回收實驗,回收率為96.0%~104.5%,相對標準偏差(RSD)小于5%(電子版文后支持信息表S3),表明本方法在實際樣品檢測中具有較高的準確性和較好的重現性。為了評價本體系對真實樣品的識別和區分能力,對獲得的數據進行了主坐標分析(PCoA)[45]。將制備的檸檬、番茄、芒果果皮、五倍子、紅茶和綠茶待測液分別加入到RuNPs/NC-H2O2-TMB體系中,測量A652nm,每個樣品重復測定6次。通過PCoA分析對數據降維處理,將數據轉換為兩個規范因子,如圖7B所示。可以看出,這6種樣品分別形成了6個不重疊的區域,說明通過PCoA可將不同的樣品很好地區分開。
3結論
采用簡單的濕化學-熱解法制備了均勻分散在NC基底上的RuNPs。通過不同的熱解溫度處理對RuNPs/NC中的氮含量以及吡啶氮、吡咯氮、石墨氮和氧化氮的相對含量進行了有效調控。結果表明,吡啶氮的相對含量越多,RuNPs/NC可表現出更優異的類過氧化物酶活性。晶格應變的壓縮增強了催化活性位點與底物之間的結合強度,從而提高了RuNPs/NC的類過氧化物酶活性。RuNPs/NC-H2O2-TMB體系被成功應用于AA、GA和TA的檢測。本研究不僅提供了一種合成穩定釕基納米酶的簡便方法,并且拓展了納米酶在生物傳感領域的應用范圍。

