蜂巢小甲蟲保幼激素環氧水解酶基因JHEH1和JHEH1-2生物信息學及表達分析

關鍵詞:保幼激素環氧水解酶;蜂巢小甲蟲;保幼激素;生物信息學分析;基因表達
中圖分類號:S895:Q786 文獻標識號:A 文章編號:1001-4942(2024)06-0103-10
蜂巢小甲蟲(Aethina tumida Murray)屬鞘翅目(Coleopera)露尾甲科(Nitdiuldae),是蜂群的重要寄生性害蟲,源自于非洲南部的撒哈拉以南地區,目前已擴散至除南極洲之外的所有大陸,我國2017年首次報道該蟲的危害。蜂巢小甲蟲不僅對養蜂業造成巨大的經濟損失,還可入侵熊蜂、無刺蜂和獨棲蜂,從而破壞當地的物種生態平衡。蜂巢小甲蟲具有對環境適應能力強、傳播途徑廣、寄主種類多、飛行距離遠、繁殖率高、成蟲壽命長等特點。據報道,一只雌蟲可存活6個月之久,一生可產卵2000多粒,幼蟲和成蟲均可取食蜂蜜、花粉、蜜蜂幼蟲和蛹,幾個月后幾只成蟲即可繁殖出成千上萬只,并再次侵染爆發成災。
蜂巢小甲蟲作為蜜蜂的六大重要病原體之一(World Organisation for Animal Health,2019),侵害早期很難被察覺,目前無行之有效的預防手段,其一旦進入我國適宜生長的地區,很容易爆發成災,破壞生態平衡的同時也將對當地養蜂業造成嚴重影響。保幼激素(juvenile hormone,JH)是一類倍半萜類激素,在昆蟲發育和生殖過程中發揮著重要的調控作用,干擾其合成和代謝一直被認為是一種很有前途的替代化學殺蟲劑的方法,并且對非目標生物毒性低。研究表明,保幼激素降解過程主要涉及3種酶:保幼激素環氧水解酶JHEH、保幼激素脂酶(juvenile hormone esterase,JHE)和保幼激素二醇激酶(juvenile hormone di-olkinase,JHDK),其中JHEH屬于微粒體環氧化物水解酶家族(microsomal epoxide hydrolase family),與組織中膜結合,催化血淋巴中JH和保幼激素酸(juvenile hormone acid,JHa),使之降解為沒有活性的保幼激素二醇(juvenile hormone di-ol,JHd)和保幼激素酸二醇(juvenile hormone acid diol,JHad),并中斷咽側體JH的合成。目前,JHEH基因在多種昆蟲中進行了較為深入的研究,如褐飛虱Nilaparvata lugens、煙芽夜蛾Heliothis virescens、家蠶Bombyx mori、粉紋夜蛾Trichoplusia ni、赤擬谷盜Tribolum castane-um、橘小實蠅Bactrocera dorsalis、意大利蜜蜂Apis mellifera、黏蟲Mythimna separata等。不同昆蟲中JHEH基因的數量不同,其功能也不盡相同。但鞘翅目昆蟲中,關于蜂巢小甲蟲保幼激素及保幼激素降解酶的研究鮮有報道。
本課題組前期對蜂巢小甲蟲卵巢組織進行了轉錄組測序,注釋到5條JHEH基因,其中JHEH1和JHEH1-2的表達在不同發育時期卵巢中差異顯著。本研究對蜂巢小甲蟲保幼激素環氧水解酶基因JHEH1和JHEH1-2進行生物信息學分析,并檢測其在成蟲不同發育時期的卵巢等不同組織中的表達模式,為后續深入研究JHEH基因對蜂巢小甲蟲生長發育調控機制提供重要的理論基礎。
1材料與方法
1.1試驗材料
蜂巢小甲蟲采自海南省海口市瓊中縣吊羅山鄉區域內中華蜜蜂蜂場(109°57′36″E,18°47′48″N),帶回實驗室飼養于人工氣候箱和暗室的養蟲籠內。參照Neumann的方法飼養,略有改動。蜂巢小甲蟲成蟲和幼蟲均用自制蜂糧(含蜂蜜、花粉、豆粉、奶粉)飼喂。飼養條件為:溫度(27±1)℃,相對濕度(60±10)%,未成熟幼蟲黑暗飼養約2周;老熟幼蟲人工放進高溫滅菌的沙土(含水量8%~10%)內化蛹;蛹及羽化后的成蟲每日自然光照14 h飼養;成蟲產卵孵化為幼蟲后,再黑暗飼養,周而復始。
1.2主要試劑和儀器
Eastep@ Super Total RNA Extraction Kit為美國Promega公司產品;TRUEscript RT Master Mix(OneStep gDNA Removal)試劑盒、2×SYBRrGreen qPCR Mix(Low ROX)試劑盒購自北京艾德萊生物科技有限公司。主要儀器為體視顯微鏡(卡爾蔡司光學(中國)有限公司)、湘儀高速離心機(湖南湘儀實驗室儀器開發有限公司)、微量紫外可見分光光度計(ND2000C,Thermo Fisher Sci-entific)、實時熒光定量PCR儀(Applied Biosys-tems,Thermo Fisher Scientific)等。
1.3蜂巢小甲蟲JHEH基因生物信息學分析
從GenBank數據庫(http://www.ncbi.nlm.nih.gov/genbank/)中獲取基因編碼的氨基酸序列,使用InterPro工具(https://www.ebi.ac.uk/in-terro/)進行功能結構域分析,在NCBI上利用在線軟件BLAST(https://blast.ncbi.nlm. nih.gov/Blast.cgi)進行比對,使用MEGA 7.0軟件對氨基酸序列進行分析并使用鄰接法構建系統進化樹。對目的基因編碼產物,使用ProtParam工具(ht-tp://protparam.net/index.html)預測其理化性質,使用ProtScale工具(https://www.expasy.org/re-sources/protscale)分析疏水性,使用TMHMM 2.0(http://www.cbs.dtu.dk/services/TMHMM)預測跨膜結構域,使用SignaIP 5.0(www.cbs.dtu.dk/services/SignalP)分析信號肽,使用SOPMA工具(http://npsa-pbil.ibcp.fr/cgi-bin/npsa_automat.pl? page=npsa_sopma.html)預測蛋白二級結構,用SWISS-MODEL工具(https://swissmodel.ex-pasy.org/)預測三級結構。
1.4蜂巢小甲蟲JHEH基因表達分析
1.4.1組織樣品采集 分別取未出土(0d)和出土后1日齡、2日齡、3日齡(1、2、3 d)的蜂巢小甲蟲雌成蟲若干,置于硅膠盤上,放置于體視顯微鏡下解剖出卵巢,用PBS緩沖液沖洗并除去多余的脂肪、氣管等組織后用于試驗。同日齡的5個蜂巢小甲蟲卵巢作為1個生物學重復,設3個重復。此外,取早期未出土成蟲60只,分別收集頭、胸、足和脂肪體樣本。每個組織收集3組,每組為一個生物學重復(20只),設3個重復。所有樣品放人液氮中速凍后置于-80℃冰箱中備用。
1.4.2總RNA提取與cDNA第一鏈合成 將組織樣品用液氮充分研磨至粉末狀,轉入1.5 mL無RNA酶離心管中稱量,加入裂解液反復吹打直至無明顯塊狀組織。根據Eastep Super總RNA提取試劑盒說明書提取總RNA。微量分光光度計檢測RNA濃度和純度,1.5%瓊脂糖凝膠電泳檢測RNA完整性。總RNA提取完成后統一稀釋至100ng/μL。按照反轉錄試劑盒TRUEscript RTMaster Mix(OneStep gDNA Removal)操作說明書進行反轉錄。轉錄后的cDNA保存于-20℃作為qPCR模板備用。
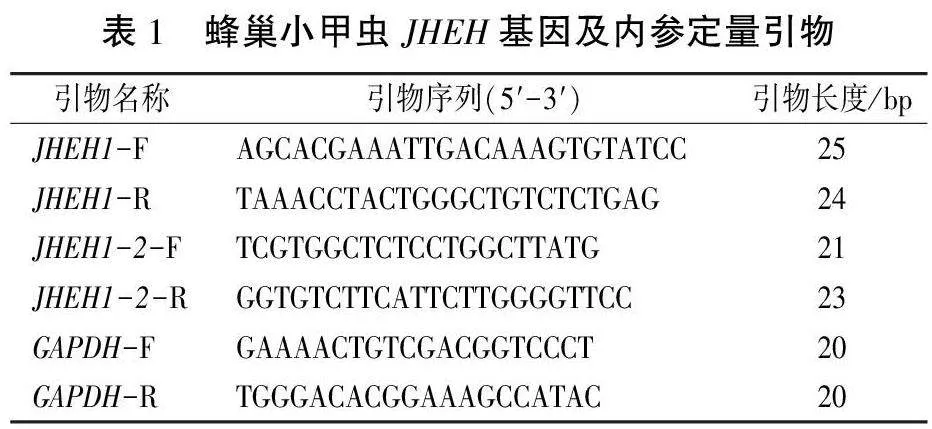
1.4.3引物設計及RT-qPCR擴增 以蜂巢小甲蟲的甘油醛-3-磷酸鹽脫氫酶(glyceraldehydes-3-phosphate dehydrogenase,GAPDH)作為內參基因,引物來源于文獻,JHEH1和JHEH1-2基因的引物設計和合成均由上海生工生物工程有限公司完成(表1)。以1.4.2合成的cDNA為模板,采用2×SYBR Green qPCR Mix(Low ROX)試劑盒,在熒光定量PCR儀QuantStudio 6 Flex real-time qPCR System通過2步法進行。反應體系為20μL:2× SYBR qPCR Mix (Low ROX) 10μL,DNA模板1μL,上、下游引物各0.4μL,ddH2O8.2μL。反應程序為:95℃2 min;95℃15s,60℃30 s,72℃30 s,40個循環。每個樣品重復3次,生物學重復3次。
1.5數據分析
使用SPSS 17.0軟件進行數據分析。采用2-△△Ct法計算蜂巢小甲蟲成蟲不同發育時期及組織JHEH1和JHEHl-2的相對表達量,采用單因素方差分析(ANOVA)的LSD法進行顯著性差異檢驗(Plt;0.05),使用GraphPad Prism 5軟件作圖。
2結果與分析
2.1蜂巢小甲蟲JHEH1和JHEH1-2基因序列分析
從GenBank數據庫中獲取蜂巢小甲蟲JHEH1(LOC109597754)和JHEH1-2(LOC109605925)基因的開放閱讀框(ORF),預測可編碼的蛋白質分別含有460個和461個氨基酸(圖1)。使用InterPro數據庫對兩個蛋白的結構域進行預測,表明JHEH1蛋白和JHEHl-2蛋白均屬于環氧化物水解酶(epoxide hydrolase)蛋白家族,且均具有環氧化物水解酶的N端結構域,分子功能預測前者具備乙醚水解酶活性,后者具有催化活性。
2.2蜂巢小甲蟲JHEH1和JHEH1-2基因系統進化分析
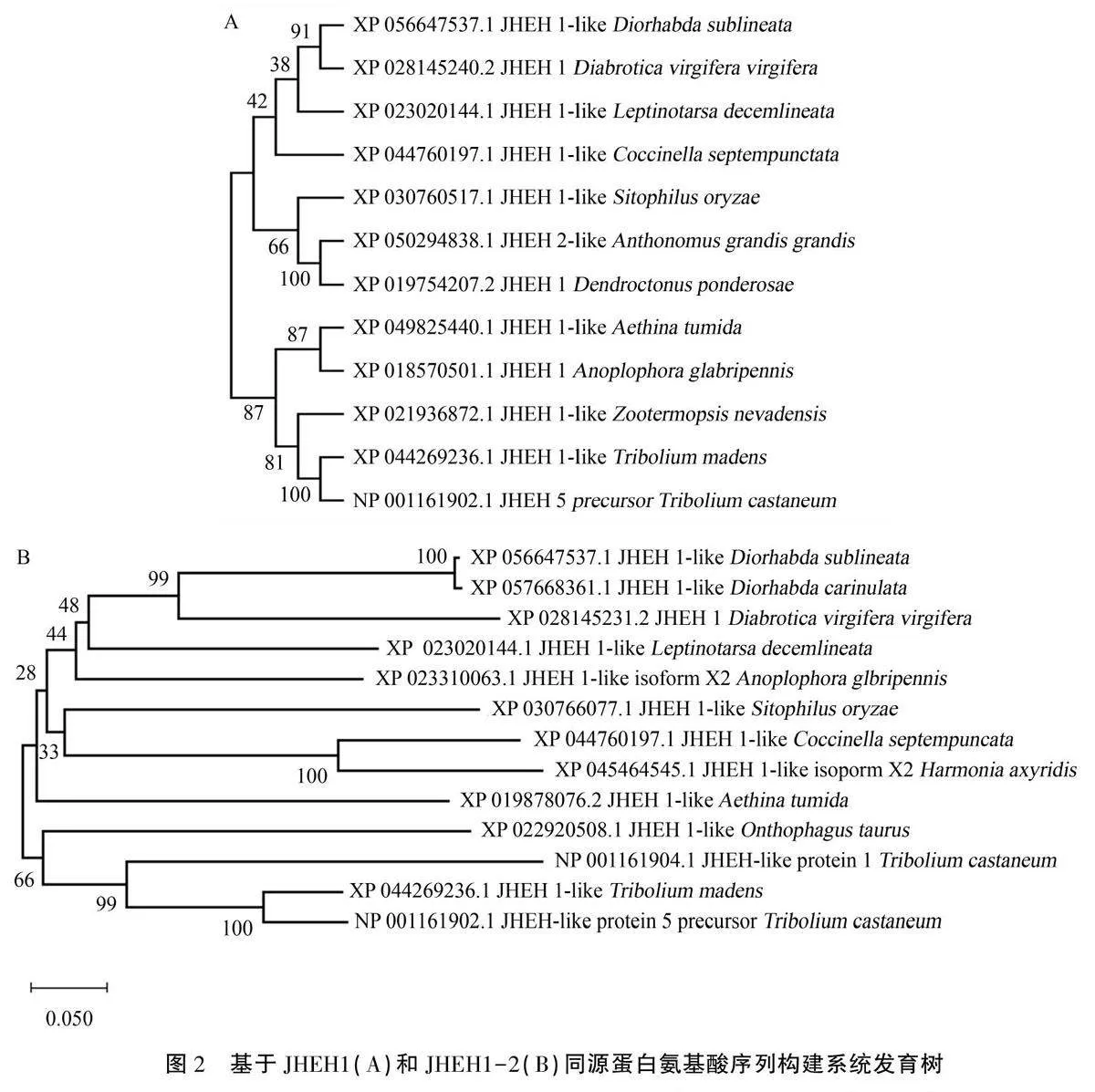
從NCBI數據庫中分別搜索與蜂巢小甲蟲JHEH1和JHEH1-2存在同源關系的同源蛋白序列,獲得了包括光肩星天牛(Anpoploppora glabrip-ennis)、內華達白蟻(Zootermopsis nevadensis)等昆蟲的氨基酸序列,并采用Bootstrap法重復1000次以構建系統發育樹。JHEH1的系統進化分析結果(圖2A)顯示,蜂巢小甲蟲與光肩星天牛被歸為一支,并進一步與內華達白蟻聚為一類。JHEHl-2的系統進化分析結果(圖2B)表明,蜂巢小甲蟲的JHEH1-2較為保守,與檉柳葉甲(Di-orhabda sublineata)、紅柳粗角螢葉甲(Diorhabda carinulata)、異色瓢蟲(Harmonia axyndis)、七星瓢蟲(Coccinella septempunctata)、米象(Sitophilus oryzae)聚為一支。
2.3蜂巢小甲蟲JHEH1和JHEHl-2基因生物信息學分析
2.3.1編碼蛋白理化性質分析 使用ProtParam對兩個基因所編碼蛋白產物的理化性質進行分析,結果顯示,JHEH1編碼460個氨基酸,蛋白相對分子質量為52 kDa,預測的理論等電點(pI)為8.06,蛋白分子式為C2425 H3707 N603O660S16,原子總數為7411。JHEH1編碼的總氨基酸序列中,亮氨酸(Leu)占比最高,為10.2%,其次為纈氨酸(Val),占比為7.6%,其中吡咯賴氨酸(Pyl)和硒代半胱氨酸(Sec)的含量為零。帶有負電荷的氨基酸殘基(Asp+Glu)為46個,帶有正電荷的氨基酸殘基(Arg+Lys)為48個。該蛋白N端推測為蛋氨酸(Met),推測其半衰期為30 h(哺乳動物網織紅細胞,體外)。其不穩定系數為32.69,脂肪系數為91.93,總平均親水系數為-0.109。
JHEH1-2編碼461個氨基酸,蛋白相對分子質量為52 kDa,預測的理論等電點(pI)為8.70,蛋白分子式為C2420 H3713N597O656S15,原子總數為7401。JHEH1-2編碼的總氨基酸序列中,亮氨酸(Leu)占比最高為10.6%,其次為賴氨酸(Val)占比為8.5%,其中吡咯賴氨酸(Pyl)和硒代半胱氨酸(Sec)的含量為零。帶有負電荷的氨基酸殘基(Asp+Glu)為43個,帶有正電荷的氨基酸殘基(Arg+Lys)為48個。該蛋白N端推測為蛋氨酸(Met),推測其半衰期為30 h(哺乳動物網織紅細胞,體外)。其不穩定系數為31.85,脂肪系數為93.64,總平均親水系數為-0.070。
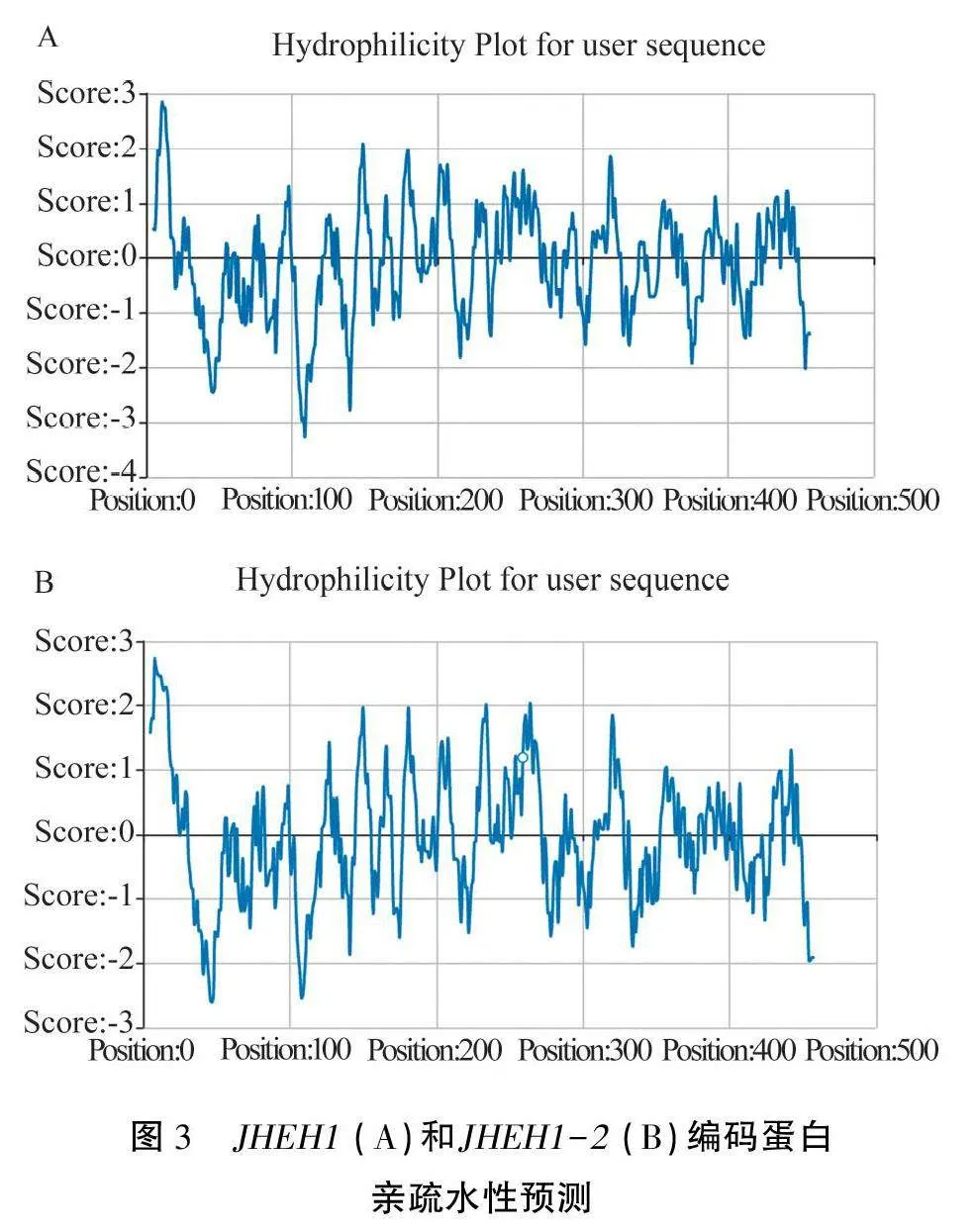
2.3.2編碼蛋白疏水性分析 使用ProtScale工具對JHEH1和JHEH1-2這兩個基因所編碼蛋白的親疏水性進行分析。結果(圖3)表明,JHEH1和JHEH1-2編碼的蛋白分別約含有4個和5個高峰(疏水區),N端疏水性均較強,需要結合跨膜結構域預測以進行下一步分析。
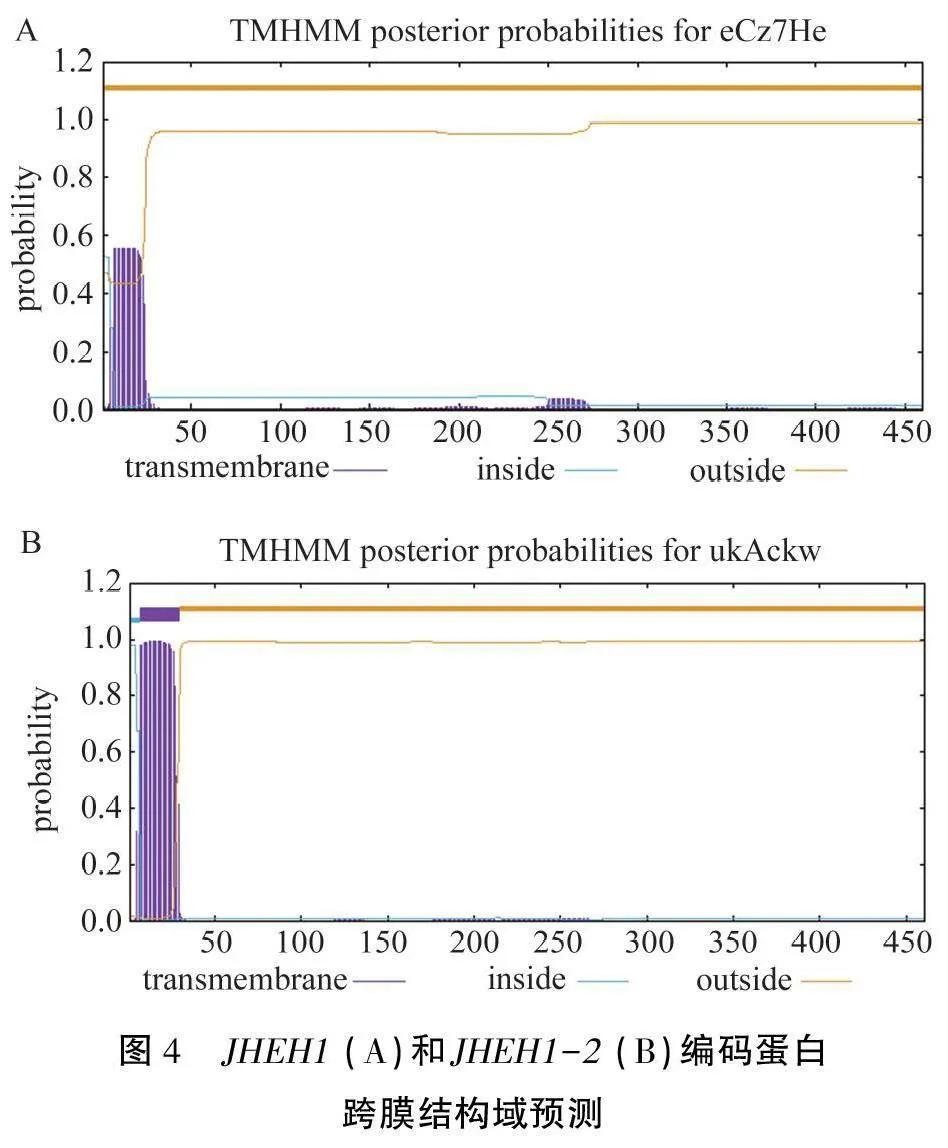
2.3.3編碼蛋白跨膜結構域預測與分析 使用TMHMM 2.0工具對JHEH1和JHEH1-2進行跨膜結構域預測分析。結果(圖4)顯示,JHEH1編碼蛋白的1—27位氨基酸位于跨膜結構域的可能性較低,且預測全部氮基酸均位于細胞內側(圖4A);JHEH1-2編碼蛋白的1—6位氨基酸位點位于細胞內側,7—29位氨基酸位于跨膜區,其余30—461位氨基酸定位于細胞外側,與疏水性預測的結果高度吻合。
2.3.4編碼蛋白信號肽預測與分析 使用Sig-naIP 5.0軟件對JHEH1和JHEH1-2基因編碼蛋白的信號肽進行分析。結果(圖5)顯示,JHEH1編碼蛋白有信號肽的概率為86.563%,信號肽切割位點為22—23位,可能性為52.080%,預測的信號肽序列為MGKCGTFYVAIVALLAYGGYRA(圖SA);JHEH1-2編碼蛋白有信號肽的概率為51.493%,信號肽切割位點為25-26位,可能性為30.760%,預測的信號肽序列為MGKVCGLFLL-GIFATLAFVGFKTYS(圖5B)。
2.3.5編碼蛋白二級結構預測與分析 使用SOPMA工具對JHEH1和JHEH1-2編碼蛋白的二級結構進行預測與分析。結果(圖6)顯示,JHEH1二級結構中,α螺旋占41.52%,延伸鏈占12.17%,無規則卷曲占43.48%,β轉角占2.83%。JHEH1-2二級結構中,α螺旋占41.87%,延伸鏈占12.58%,無規則卷曲占42.30%,β轉角占3.25%。
2.3.6編碼蛋白三級結構預測 使用SWISS-MODEL工具對JHEH1和JHEH1-2基因編碼蛋白的三級結構進行預測。以光肩星天牛保幼激素環氧水解酶為模板建模,結果(圖7)顯示JHEH1序列與其同源性為63.76%,JHEH1-2序列與其同源性為62.09%。
2.4蜂巢小甲蟲JHEH1和JHEH1-2基因表達分析
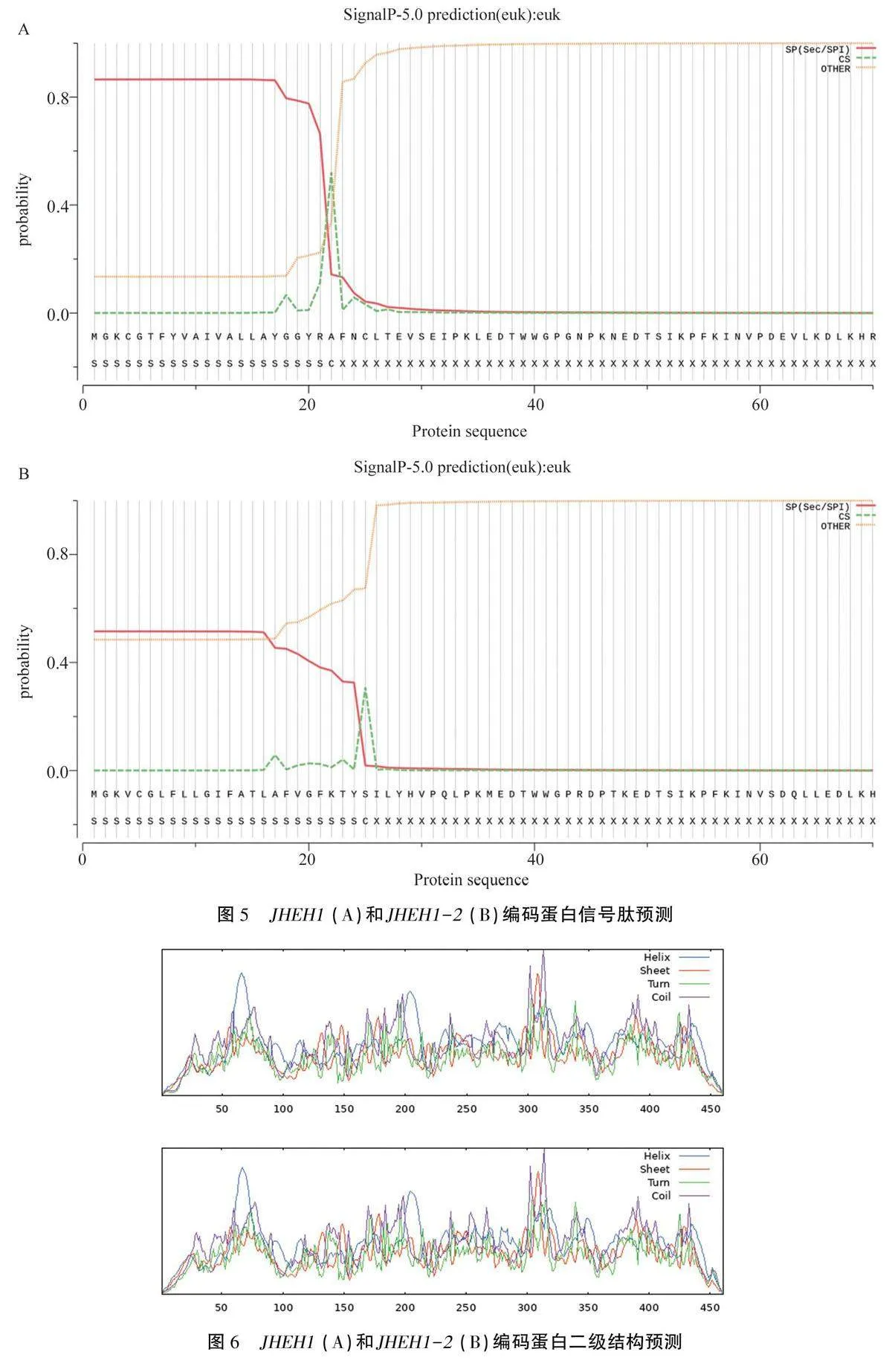
蜂巢小甲蟲成蟲不同時期卵巢的RT-qPCR結果(圖8)顯示,JHEH1和JHEH1-2均在未出土成蟲的卵巢中處于高水平表達狀態。從1日齡到3日齡,兩基因表達量均呈先下降再上升然后再下降的趨勢。JHEH1表達量在1日齡最低,JHEH1-2表達量在3日齡時最低。
蜂巢小甲蟲未出土成蟲不同組織的RT-qPCR結果(圖9)顯示,兩個基因在5種組織中的表達有較大差異。JHEH1在卵巢和脂肪體中的相對表達量顯著高于頭、胸和足(Plt;0.05);JHEH1-2在卵巢中的相對表達量最高,顯著高于其他組織(Plt;0.05)。
3討論與結論
JH在昆蟲的生長發育過程中發揮重要作用,參與昆蟲變態、發育、繁殖和滯育等生命活動。JHEH是JH的重要水解酶之一,通過影響昆蟲體內的JH滴度調控昆蟲的蛻皮、繁殖、滯育和變態。本研究對蜂巢小甲蟲JHEH1和JHEH1-2基因序列的分析表明,它們均屬于環氧化物水解酶蛋白家族,具有JHEH的典型結構特征,并且N-末端包含氨基酸組成的疏水性信號肽序列,編碼的蛋白疏水性較強,與已報道的昆蟲JHEH特征基本一致。通過構建系統進化樹分析表明,蜂巢小甲蟲JHEH1與同為鞘翅目的光肩星天牛JHEH聚為一支,說明鞘翅目內的昆蟲親緣關系較近。蜂巢小甲蟲JHEH1編碼的氨基酸全部位于細胞內側,JHEH1-2編碼的氨基酸跨膜分布,與疏水性預測的結果高度吻合。蜂巢小甲蟲JHEH蛋白的二級結構為α螺旋/β折疊型,以α螺旋為主。用SWISS-MODEL同源建模的方法構建蜂巢小甲蟲JHEH的模擬三維結構,結果表明,蜂巢小甲蟲JHEH1和JHEH1-2與光肩星天牛JHEH的結構相似度較高。
JHEH基因在昆蟲體內的表達具有明顯的組織特異性。現有研究表明,馬鈴薯甲蟲LdJHEH1和LdJHEH2在所有檢測組織中均有表達,且Ld-JHEH1在胸肌、前腸、中腸、后腸高表達,LdJHEH2在腦-心-偶體復合體、后腸、馬氏管、雌性卵巢內高表達;橘小實蠅BdJHEH2在脂肪體內高表達,而BdJHEH3在馬氏管內高表達;黏蟲Bd-JHEH2在體壁和脂肪體中高表達;九香蟲AcJHEH在脂肪體中表達量最高,其次為卵巢、精巢和中腸。本研究中,蜂巢小甲蟲JHEH1和JHEH1-2在成蟲卵巢內的表達量均顯著高于頭、胸和足,此外,JHEH1還在脂肪體中較高表達,JHEH1-2在胸部較高表達。這些結果表明,JHEH在昆蟲不同組織中均有降解JH的作用,其發揮作用的大小取決于物種的種類。此外,JHEH基因的表達量在昆蟲不同發育階段也存在顯著差異,如JHEH在意大利蝗卵早期發育階段呈現出先快速上升再下降的趨勢;九香蟲4~5齡若蟲體內JHEH表達量較高,而七星瓢蟲JHEH在初羽化的成蟲體內表達量較高。JHEH1和JHEH2在馬鈴薯甲蟲幼蟲各個齡期也均有表達,在4齡幼蟲孵化后32h表達量達到峰值。本研究中,JHEH1和JHEH1-2均在早期未出土成蟲的卵巢中表達量較高,推斷它們在蜂巢小甲蟲卵巢的發育過程中起重要的調控作用。
JH是昆蟲特有的性激素,在調節發育和生殖成熟的生理過程中發揮重要作用,干擾其生物合成或降解過程中重要基因的功能,一直都被認為是代替非靶向化學殺蟲劑的有效策略。JHEH是降解JH的關鍵酶,抑制其活性可以改變昆蟲體內JH滴度,從而擾亂昆蟲的生理。當前已有粉紋夜蛾和煙草天蛾JHEH特異性酶抑制劑的報道。基于這些抑制劑對昆蟲內分泌系統的影響,可將它們作為潛在的可用于農業的新型殺蟲劑。
綜上所述,通過生物信息學分析,蜂巢小甲蟲JHEH1和JHEH1-2基因具有降解JH的功能,且在早期未出土成蟲卵巢內高表達,說明JHEH在蜂巢小甲蟲的生殖過程中發揮重要作用。該研究可為進一步利用RNA干擾技術研究蜂巢小甲蟲JHEH的功能奠定基礎,為蜂巢小甲蟲綠色防控產品的開發提供理論依據。

