補肺益腎組分方Ⅲ組分配伍對慢性阻塞性肺疾病大鼠氣道重塑的干預作用研究


【摘要】 背景 慢性阻塞性肺疾病(COPD)是重大慢性疾病,氣道重塑是其重要病理機制。補肺益腎方對COPD療效較好,其有效成分組成的補肺益腎組分方Ⅲ(ECC-BYF Ⅲ)與之療效相當,可顯著改善COPD模型大鼠氣道重塑,但其組分配伍規律尚待揭示。目的 基于COPD大鼠模型評價ECC-BYF Ⅲ及其組分配伍對COPD氣道重塑的干預作用。方法 將ECC-BYF Ⅲ組分分成補氣、補腎、化痰、活血4類,按數學排列組合的方法將其分成不同的組分配伍組。2018年5—9月進行動物實驗。將216只SD大鼠隨機分為正常、模型、ECC-BYF Ⅲ、不同組分配伍及氨茶堿組,共18組,每組12只。第1~8周,采用香煙煙霧暴露聯合反復細菌感染的方法制備COPD穩定期大鼠模型(正常組除外);第9~16周,給予相應的藥物干預。蘇木素-伊紅(HE)染色技術觀察氣道壁及氣道平滑肌變化;酶聯免疫吸附試驗(ELISA)檢測血清中基質金屬蛋白酶12(MMP-12)、堿性成纖維細胞生長因子(bFGF)及支氣管肺泡灌洗液(BALF)中膠原蛋白(COL)-1、COL-3、MMP-12等氣道重塑相關指標水平。Region(R)值綜合評價各組分配伍對COPD大鼠氣道重塑的干預作用。結果 與模型組比較,ECC-BYF Ⅲ及其組分配伍、氨茶堿組大鼠氣道壁厚度均降低,ECC-BYF Ⅲ組、補氣化痰組、扶正化痰組、扶正活血組、補氣祛邪組、氨茶堿組大鼠平均氣道平滑肌細胞數減少(P<0.05)。與模型組比較,ECC-BYF Ⅲ組、補腎組、補氣化痰組、補氣活血組、補腎化痰組、補腎活血組血清bFGF水平降低,ECC-BYF Ⅲ組、扶正組血清MMP-12水平降低,ECC-BYF Ⅲ及其組分配伍、氨茶堿組BALF MMP-12、BALF COL-1水平均降低,ECC-BYF Ⅲ組、補腎組、化痰組、活血組、扶正組、補氣化痰組、補氣活血組、補腎活血組、扶正化痰組、補氣祛邪組、補腎祛邪組及氨茶堿組BALF COL-3水平均降低(P<0.05)。對COPD大鼠氣道壁厚度、氣道平滑肌增生情況、血清及BALF中所有氣道重塑相關指標進行R值綜合評價結果顯示,除化痰、祛邪組分配伍外,ECC-BYF Ⅲ及其余組分配伍和氨茶堿組均可改善COPD大鼠氣道重塑(P<0.05),以補氣祛邪、扶正化痰、補氣活血組分配伍改善COPD大鼠氣道重塑效果較好。結論 ECC-BYF Ⅲ及其組分配伍可不同程度干預COPD大鼠氣道重塑,其中以補氣祛邪、扶正化痰、補氣活血(均含補氣類組分:人參皂苷Rh1和黃芪甲苷)組分配伍效果較為顯著。
【關鍵詞】 肺疾病,慢性阻塞性;補肺益腎組分方Ⅲ;氣道重塑;組分配伍;大鼠
【中圖分類號】 R 563.9 【文獻標識碼】 A DOI:10.12114/j.issn.1007-9572.2023.0868
The Evaluation of Effective-component Compatibility of Bufei Yishen FormulaⅢ and Components Compatibility in Treating Airway Remodeling of COPD
QIN Yanqin1,2,DONG Haoran1,2,YANG Jingfan1,LI Haibo1,ZHAO Peng1,2,LI Jiansheng1,3*
1.Henan University of Chinese Medicine/Henan Key Laboratory of Chinese Medicine for Respiratory Disease/Co-construction Collaborative Innovation Center for Chinese Medicine and Respiratory Diseases by Henan & Education Ministry of P.R.,Zhengzhou 450046,China
2.Academy of Chinese Medical Sciences,Henan University of Chinese Medicine,Zhengzhou 450046,China
3.Department of Respiratory and Critical Care Medicine,the First Affiliated Hospital of Henan University of Chinese Medicine,Zhengzhou 450003,China
*Corresponding author:LI Jiansheng,Professor/Doctoral supervisor;E-mail:li_js8@163.com
【Abstract】 Background Chronic obstructive pulmonary disease(COPD)is a major chronic disease,and airway remodeling is an important pathological mechanism. Bufei Yishen formula and effective-component compatibility of Bufei Yishen formula Ⅲ(ECC-BYF Ⅲ)are effective for COPD treatment. ECC-BYF Ⅲ significantly improves airway remodeling of COPD model rats,however,the components compatibility remains to be revealed. Objective To evaluate the effect of ECC-BYFⅢ and components compatibility in treating airway remodeling of COPD based on the COPD rat model. Methods The components of ECC-BYFⅢ were divided into four categories:Buqi,Bushen,Huatan,and Huoxue. The four categories were divide into different groups according to the method of mathematical permutation. The animal experiment were performed during May to September in 2018. 216 SD rats were randomly divided into normal,model,ECC-BYF Ⅲ,different components compatibility and aminophylline groups,and 12 rats in each model. From week 1 to week 8,rat model of COPD in stable phase was established by cigarette smoke exposure combined with repeated bacterial infections. The rats were orally gavaged with corresponding drugs from week 9 to week 16. Hematoxylin eosin(HE)staining technique was used to observe the changes of bronchial wall and airway smooth muscle. Enzyme linked immunosorbent assay(ELISA)was used to detect the levels of matrix metalloprotein 12(MMP-12),basic fibroblast growth factor(bFGF)in serum and levels of collagen(COL)-1,COL-3,and MMP-12 in bronchoalveolar lavage fluid(BALF). Region(R)value comprehensive evaluation method was used to evaluate the effect of different component compatibility on airway remodeling in COPD rats. Results ECC-BYFⅢ,different components compatibility and aminophylline weakened the thickness of airway wall,when compared to model group. ECC-BYFⅢ,Buqi Huatan,Fuzheng Huatan,Fuzheng Huoxue,Buqi Quxie and aminophylline significantly decreased the number of airway smooth muscle hyperplasia(P<0.05). When compared to model group,the level of bFGF in serum decreased in ECC-BYF Ⅲ,Bushen,Buqi Huatan,Buqi Huoxue,Bushen Huatan,and Bushen Huoxue groups. The level of MMP-12 in serum decreased ECC-BYFⅢ,Fuzheng groups. The levels of MMP-12,COL-1 in BALF decreased in ECC-BYFⅢ,different components compatibility and aminophylline groups. The level of COL-3 in BALF decreased in ECC-BYFⅢ,Bushen,Huatan,Huoxue,Fuzheng,Buqi Huatan,Buqi Huoxue,Bushen Huoxue,Fuzheng Huatan,Buqi Quxie,Bushen Quxie,and aminophylline groups(P<0.05). The results of R-value comprehensive evaluation about airway wall thickness,airway smooth muscle hyperplasia,indicators related to airway remodeling in serum and BALF in COPD rats showed that the components compatibility,except for Huatan,Quxie,ECC-BYFⅢ,other components compatibility and aminophylline improved the airway remodeling of COPD rats(P<0.05). Buqi Quxie,Fuzheng Huatan,and Buqi Huoxue showed better effects in improving airway remodeling in COPD rats. Conclusion ECC-BYFⅢ and its components compatibility showed different effects on airway remodeling in COPD rats. Buqi Quxie,Fuzheng Huatan,Buqi Huoxie(containing ginsenoside Rh1,astragaloside)showed better effects.
【Key words】 Pulmonary disease,chronic obstructive;Effective-component compatibility of Bufei Yishen formulaⅢ;Airway remodeling;Components compatibility;Rats
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是以不完全可逆性氣流受限為主要特征的可以預防和治療的疾病。氣道重塑是COPD的重要病理機制,與COPD氣道狹窄和不可逆性氣流受限密切相關。氣道重塑主要發生在小氣道,是氣道受損引起的氣道壁結構變化和反復修復的過程,以氣道結構變化、氣道壁增厚、管腔狹窄為主要特征[1-2]。氣道重塑的機制尚不完全清楚,目前認為與炎癥反應、氧化應激、蛋白酶/抗蛋白酶失衡、細胞外基質沉積等有關[3-5]。多種病理環節導致的氣道重塑引起氣道管腔狹窄,使氣流阻力增加、氣流受限,最終形成不可逆的慢性氣流阻塞,是COPD病情發展和轉折的重要環節[6]。因此,有效干預氣道重塑將是治療COPD的重要手段。補肺益腎方是臨床治療COPD的有效方劑,可減輕患者臨床癥狀,減低急性加重次數,提高患者生存質量[7-8]。中藥有效組分配伍組成的組分方是研發現代中藥的新模式,便于進行藥物質量控制,有助于闡釋藥物作用機制。本課題組前期基于系統藥理學方法并結合體內外實驗,在補肺益腎方的基礎上經補肺益腎組分方(effective-component compatibility of Bufei Yishen formula,ECC-BYF)Ⅰ、ECC-BYF Ⅱ[9-11],優化成由人參皂苷Rh1、黃芪甲苷、淫羊藿苷、川陳皮素、丹皮酚組成的ECC-BYF Ⅲ[12]。前期研究發現ECC-BYF Ⅲ對COPD大鼠有較好的療效,且能顯著抑制COPD大鼠氣道重塑[13],但其組分配伍對COPD氣道重塑的干預特點仍需進一步研究。
鑒于上述原因,本研究在中醫理論指導下,按原單味藥功效,將ECC-BYF Ⅲ分成補氣類代表組分(人參皂苷Rh1、黃芪甲苷)、補腎類代表組分(淫羊藿苷)、化痰類代表組分(川陳皮素)和活血類代表組分(丹皮酚)4類,進行不同組分配伍,基于香煙煙霧暴露聯合反復細菌感染誘導的COPD穩定期大鼠模型,評價ECC-BYF Ⅲ及其組分配伍干預COPD氣道重塑的配伍特點。
1 材料與方法
1.1 實驗材料
1.1.1 動物:SPF級SD大鼠216只,體質量(200±20)g,
雌雄各半,購于河南省實驗動物中心(SCXK〔豫〕2017-0001)。所涉及實驗已通過河南中醫藥大學第一附屬醫院實驗動物福利倫理審查委員會審查(倫理審查批準編號:YFYDW2019031)。
1.1.2 香煙與細菌:紅旗渠過濾嘴香煙(硬金紅,河南中煙工業有限責任公司生產,烤煙型,焦油含量11 mg,煙氣煙堿含量0.9 mg,煙氣一氧化碳含量11 mg);肺炎克雷伯桿菌(菌株號:46117),由中國藥品生物制品檢定院中國醫學細菌保藏管理中心提供。
1.1.3 主要藥品與試劑:人參皂苷Rh1(CHB180608)購于成都克洛瑪生物科技有限公司;黃芪甲苷(MUST-17022804)、淫羊藿苷(MUST-16111710)、丹皮酚(MUST-16071405)購于成都曼斯特生物科技有限公司;川陳皮素(HL-20170312)購于西安匯林生物科技有限公司;氨茶堿片(100 mg/片×100片)購于山東新華制藥股份有限公司。伊紅染色液(71014544)、二甲苯(10023428)、無水乙醇(10009218)、中性樹膠(10004160)等由國藥集團化學試劑有限公司提供;蘇木素染色液(H9627)由美國Sigma公司提供。大鼠基質金屬蛋白酶12(matrix metalloprotein 12,MMP-12)、酶聯免疫吸附試驗(ELISA)Kit(E-EL-R0044c)、大鼠堿性成纖維細胞生長因子(basic fibroblast growth factor,bFGF) ELISA Kit(E-EL-R0091c)、大鼠膠原蛋白(collagen,COL)-1 ELISA Kit(E-EL-R0233c)、大鼠COL-3 ELISA Kit(E-EL-R0233c)購于武漢伊萊瑞特生物科技股份有限公司。
1.1.4 主要實驗儀器:IVC-Ⅱ型動物飼養籠具(馮氏實驗動物設備有限公司,蘇州);ELX800UV型酶標儀(BIO-TEK,美國);RM2145型自動切片機(Leica,德國);DMI3000 B型熒光顯微鏡(Leica,德國)。
1.2 實驗方法
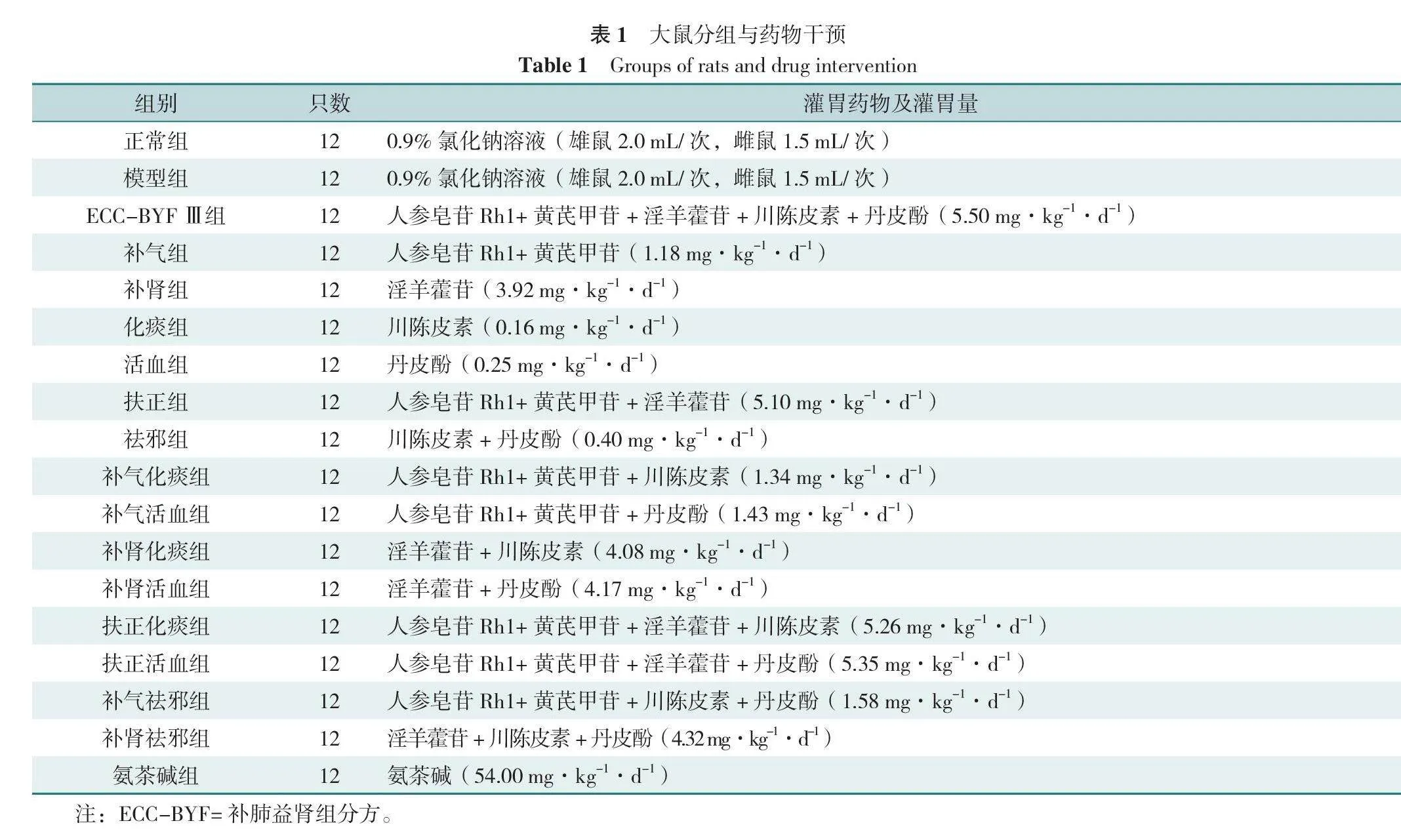
1.2.1 動物分組與藥物干預:于2018年5—9月進行動物實驗,大鼠飼養條件為:溫度(25±2)℃,相對濕度(50±10)%,給予無菌水及飼料常規飼養,每日更換墊料。適應性飼養1周后,將大鼠隨機分為18組,每組12只,雌雄各半。1~8周采用香煙煙霧暴露聯合反復細菌感染的方法制備COPD穩定期大鼠模型,每4周檢測大鼠肺功能,根據肺功能變化評價模型是否成功[14](正常組除外)。9~16周各組給予相應的藥物干預。采用等效劑量系數換算公式計算;公式為:D大鼠=D人×(HI大鼠/HI人)×(W大鼠/W人)2/3,D表示劑量,HI表示體型系數,W表示體質量。動物分組與藥物干預具體情況見表1。
1.2.2 大鼠取材:第17周,藥物干預結束后取材(每組6只),取材前1 天大鼠禁食禁水。大鼠麻醉后,經腹主動脈采血,分離血清;取出肺組織,結扎右支氣管,預冷的1×磷酸鹽緩沖液(phosphate buffered solution,PBS)灌注左肺3次,收集支氣管肺泡灌洗液(bronchoalveolar lavage fluid,BALF),離心后取上清液,保存于-80 ℃備用。
1.2.3 常規蘇木素-伊紅(hematoxylin eosin,HE)染色:左肺進行4%多聚甲醛灌注固定,蠟塊包埋,切4 μm切片,進行常規HE染色。顯微鏡下選擇直徑200~400 μm形狀規則的氣道,測量其內徑和外徑,根據公式:氣道壁厚度(μm)=外徑長-內徑長,計算氣道壁厚度。測量氣道外周長及內周長,統計氣道平滑肌細胞數,根據公式:平均氣道平滑肌細胞數(個/mm)=細胞總數/(外周長-內周長),計算平均氣道平滑肌細胞數。
1.2.4 ELISA法檢測血清bFGF、MMP-12及BALF中MMP-12、COL-1、COL-3水平。
1.3 Region(R)值綜合評價
采用R值綜合評價法(著作權號:國作登字-2013-A-00096833)對大鼠血清及BALF中氣道重塑相關指標及總指標進行綜合評價。R值綜合評價法是根據疾病對指標的影響和藥物對指標的糾正作用,計算藥物對指標的糾正強度,考察藥物對多個指標的綜合作用[15]。
1.4 統計學方法
實驗數據采用IBM SPSS 22.0統計學軟件進行統計分析。計量資料方差齊者采用最小顯著差(least significant difference,LSD)法,方差不齊經數據轉化后用LSD法以(x-±s)表示,多組間比較采用單因素方差分析。顯著性水準取α=0.05。
2 結果
2.1 ECC-BYF Ⅲ及其組分配伍對COPD大鼠病理變化的影響
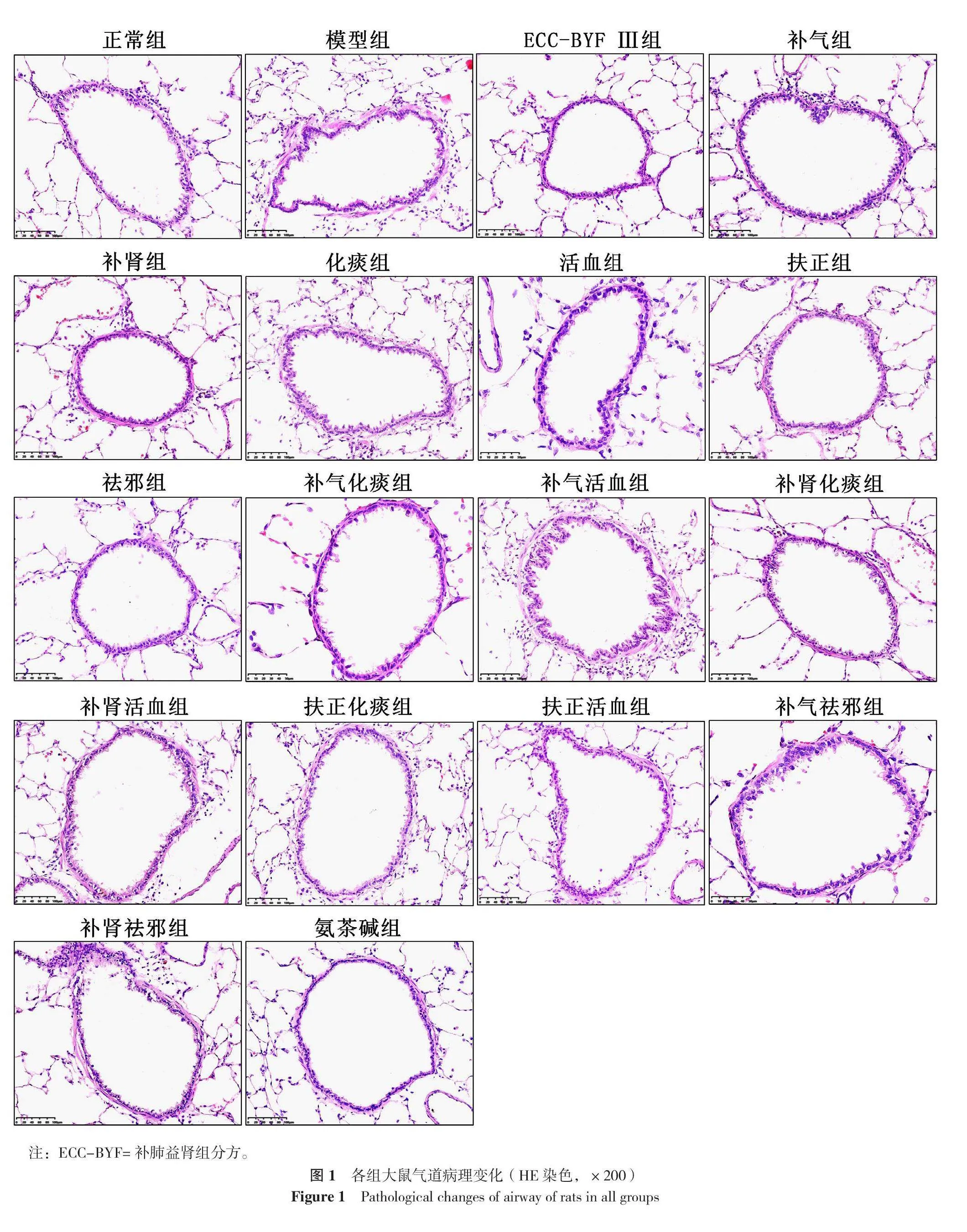
18組大鼠氣道壁厚度、平均氣道平滑肌細胞數比較,差異有統計學意義(P<0.05)。與正常組比較,模型組大鼠氣道壁增厚,平均氣道平滑肌細胞數增多,差異有統計學意義(P<0.05);與模型組比較,ECC-BYF Ⅲ及其組分配伍、氨茶堿組大鼠氣道壁厚度均降低,ECC-BYF Ⅲ組、補氣化痰組、扶正化痰組、扶正活血組、補氣祛邪組、氨茶堿組大鼠平均氣道平滑肌細胞數減少,差異有統計學意義(P<0.05),見表2、圖1。
2.2 ECC-BYF Ⅲ及其組分配伍對COPD大鼠血清及BALF氣道重塑指標的影響
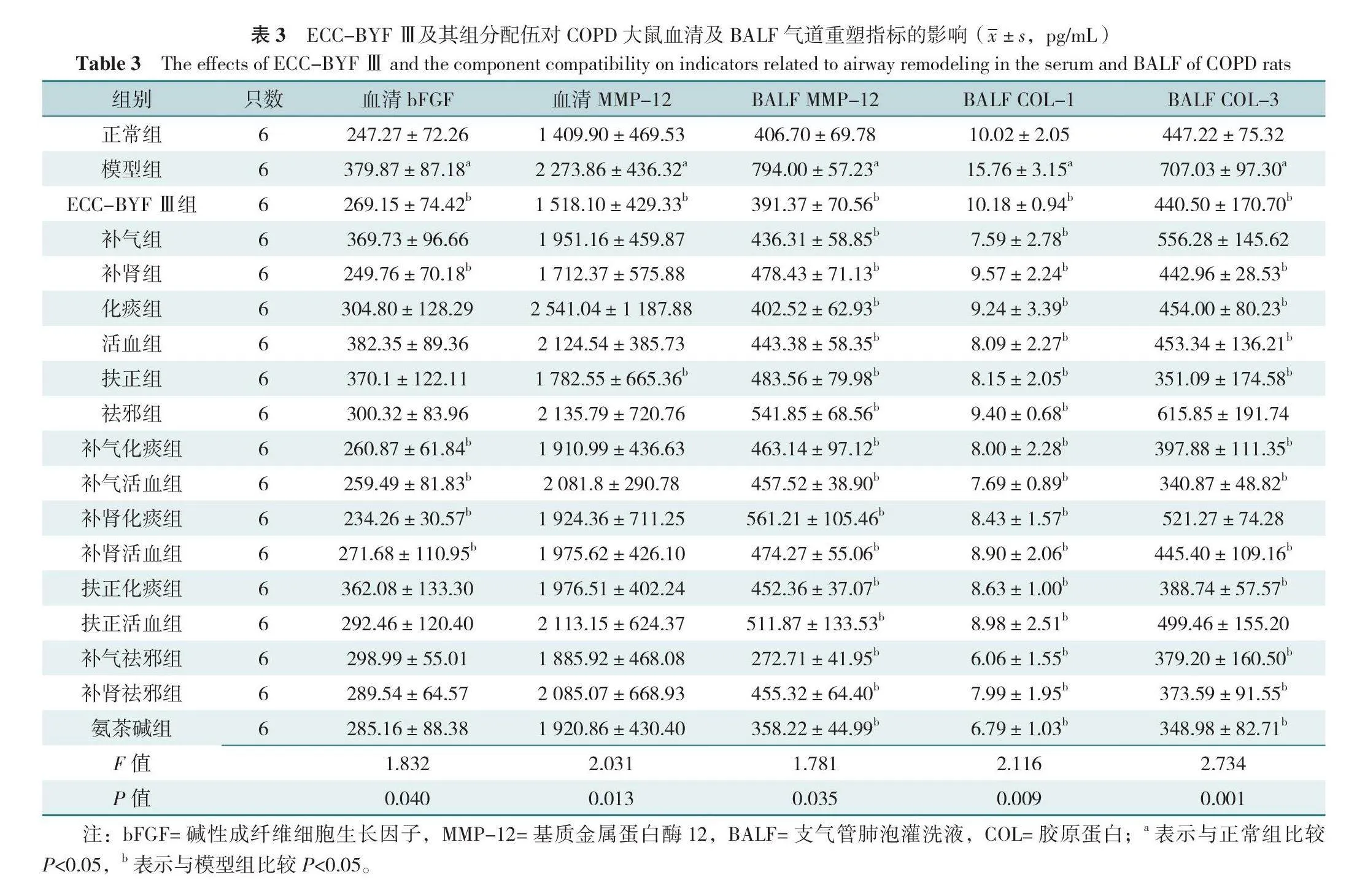
18組大鼠血清bFGF、血清MMP-12、BALF MMP-12、BALF COL-1、BALF COL-3水平比較,差異有統計學意義(P<0.05)。與正常組比較,模型組大鼠血清bFGF、血清MMP-12、BALF MMP-12、BALF COL-1、BALF COL-3水平均升高,差異有統計學意義(P<0.05);與模型組比較,ECC-BYF Ⅲ組、補腎組、補氣化痰組、補氣活血組、補腎化痰組、補腎活血組血清bFGF水平降低,ECC-BYF Ⅲ組、扶正組血清MMP-12水平降低,ECC-BYF Ⅲ及其組分配伍、氨茶堿組BALF MMP-12、BALF COL-1水平均降低,ECC-BYF Ⅲ組、補腎組、化痰組、活血組、扶正組、補氣化痰組、補氣活血組、補腎活血組、扶正化痰組、補氣祛邪組、補腎祛邪組及氨茶堿組BALF COL-3水平均降低,差異有統計學意義(P<0.05),見表3。
2.3 ECC-BYF Ⅲ及其組分配伍對COPD大鼠氣道重塑干預的綜合評價
因各組分配伍對各指標效應不同,本研究采用R值綜合評價法進行評價。對大鼠血清及BALF中氣道重塑相關指標R值綜合評價結果顯示,除化痰、祛邪、補腎化痰和扶正活血組分配伍外,ECC-BYF Ⅲ及其他組分配伍和氨茶堿組均能不同程度地糾正血清及BALF中氣道重塑指標分泌(P<0.05),以補氣祛邪、補氣活血、扶正化痰組分配伍效果最佳。對COPD大鼠氣道壁厚度、氣道平滑肌增生情況、血清及BALF中所有氣道重塑相關指標(總指標)進行R值綜合評價結果顯示,除化痰、祛邪組分配伍外,ECC-BYF Ⅲ及其余組分配伍和氨茶堿組均可改善COPD大鼠氣道重塑(P<0.05),補氣祛邪、扶正化痰、補氣活血組分配伍效果較好,見表4。
3 討論
COPD歸屬中醫“肺脹”“喘病”等范疇,與“肺脹”最為接近。肺臟感邪,遷延失治,痰瘀稽留,損傷正氣,肺脾腎三臟虛損,正虛衛外不固,外邪易反復侵襲而誘使本病發作,其主要病機為“正虛積損”,兼痰瘀閉阻[16]。正虛為肺腎氣虛、陽虛或陰陽兩虛,以肺虛為始、腎虛為基、氣虛為本;積損是指痰瘀及其互結成積、日久損傷正氣,正氣漸損而積損難復。元代朱丹溪之《丹溪心法·咳嗽》曰:“肺脹而咳,或左或右不得眠,此痰夾瘀血礙氣而病”,提示肺脹的發生與痰瘀互結,阻礙肺氣有關。久病肺脾腎三臟虧虛,痰瘀互結,阻滯氣道,使氣道澀滯不利,肺氣受阻,還于肺間,肺氣脹滿而失斂降。正虛為痰瘀形成的主要原因,血瘀痰阻,氣道澀滯不利則是導致肺氣受阻而形成肺脹的基礎。這與COPD氣道重塑引起氣道狹窄、阻塞,進一步導致氣流受限的機理一致。因此,可以認為COPD氣道重塑的病機為久病正氣虛損,痰瘀互結,阻塞氣道,氣道澀滯不利,即正虛血瘀痰阻。肺腎氣虛證兼見痰瘀是COPD穩定期主要證候,補肺益腎佐以化痰祛瘀是其主要治則。ECC-BYF Ⅲ是在補肺益腎方的基礎上優化篩選形成的,課題組前期動物實驗研究結果顯示,ECC-BYF Ⅲ可顯著改善COPD大鼠肺功能,抑制炎癥反應[17-18],減輕氣道重塑[13]。本研究旨在探討ECC-BYF Ⅲ對COPD氣道重塑干預作用的配伍規律。
COPD的主要特征為不可逆性氣道重塑和氣流受限,氣道重塑是發生氣流受限的主要病理基礎,在COPD 的形成和發展過程中有重要地位。COPD患者氣道管壁增厚變形,以平滑肌增厚最為顯著,導致氣道管腔狹窄和氣流阻力增加。氣道重塑主要表現為氣道壁增厚、氣道平滑肌細胞增殖及細胞外基質沉積。在COPD氣道重塑中,小氣道平滑肌細胞增生肥大,數目顯著增多,變化突出[19-20]。本研究結果顯示,模型組大鼠氣道壁明顯增厚,氣道平滑肌細胞顯著增多,說明香煙煙霧暴露聯合反復細菌感染的方法誘導的COPD大鼠存在氣道重塑。ECC-BYF Ⅲ干預組大鼠氣道壁厚度較模型組明顯變薄,氣道平滑肌細胞數減少,提示ECC-BYF Ⅲ對COPD氣道重塑有顯著糾正作用。
COPD氣道重塑是損傷/修復的反復過程,機制復雜,涉及多種因子和多個環節。bFGF是具有較強絲裂原活性的多肽分子,可促進平滑肌細胞、成纖維細胞及血管內皮細胞等生長、增殖和分化,并趨化成纖維細胞、內皮細胞參與損傷組織的重建和修復[21-22]。bFGF還能激活成纖維細胞,使膠原合成增加并堆積于氣道壁和血管壁細胞外基質中,加重氣道重塑。血清bFGF的表達與COPD急性加重期患者氣道阻塞程度密切相關[23]。基質金屬蛋白酶(MMPs)可降解細胞外基質和基底膜的多種蛋白成分,參與氣道重塑。在香煙煙霧、細菌等刺激下,MMPs分泌增多,降解細胞外基質中的膠原蛋白,破壞細胞外基質成分,促進細胞外基質沉積,加速氣道重塑[24-25]。本研究結果顯示,COPD大鼠血清中bFGF、MMP-12水平顯著升高,且BALF中MMP-12、COL-1、COL-3水平顯著升高。這可能與bFGF的高表達促進膠原蛋白的合成與沉積有關。bFGF高表達加重氣道平滑肌細胞的增生,平滑肌細胞收縮使管腔狹窄,細胞外基質過度沉積限制了管腔擴張,共同促進COPD氣道重塑。ECC-BYF Ⅲ干預組大鼠bFGF、MMP-12、COL-1、COL-3水平均顯著降低,提示ECC-BYF Ⅲ對COPD氣道重塑的干預作用可能與調節bFGF、MMP-12分泌、減輕細胞外基質沉積有關。
為了探討ECC-BYF Ⅲ組分配伍對COPD氣道重塑的配伍規律,本研究還檢測了不同組分配伍對氣道重塑相關指標的影響,結果顯示不同組分配伍對相關指標有不同的影響。R值綜合評價發現,在對大鼠血清及BALF中氣道重塑相關的影響方面,除化痰、祛邪、補腎化痰和扶正活血組分配伍外,ECC-BYF Ⅲ及其他組分配伍均能不同程度地糾正血清及BALF中氣道重塑指標分泌,以補氣祛邪、補氣活血、扶正化痰效果最佳。對所有指標進行R值綜合評價,結果顯示,除化痰、祛邪外,余組分配伍可顯著糾正COPD大鼠氣道重塑,作用較強的為補氣祛邪、扶正化痰、補氣活血組分配伍。補氣祛邪、扶正化痰、補氣活血組分配伍均含補氣類組分人參皂苷Rh1和黃芪甲苷。因此,可以認為含補氣類組分(人參皂苷Rh1和黃芪甲苷)的配伍對COPD大鼠氣道重塑有較好的糾正作用。
綜上所述,ECC-BYF Ⅲ中不同組分配伍對COPD氣道重塑指標有不同的作用,含補氣類(人參皂苷Rh1和黃芪甲苷)的組分配伍對COPD大鼠氣道重塑有較好的糾正作用,但其作用機制有待于進一步研究。本研究基于ECC-BYF Ⅲ的良好療效,評價不同組分配伍對COPD大鼠氣道重塑的干預特點,為組分方的配伍規律及優化治法研究提供思路。但是,COPD氣道重塑機制較復雜,本研究僅從體內實驗評價ECC-BYF Ⅲ不同組分配伍對COPD氣道重塑的配伍規律,后續研究需要基于體外模型,評價其療效特點,深入探討機制,為補肺益腎組分方的臨床應用及新藥研發提供基礎。
作者貢獻:李建生提出“組分配伍”的研究思路,設計研究方案;秦燕勤、董浩然進行動物飼養、藥物干預、肺功能檢測及氣道重塑指標測定;楊靜帆、李海博負責肺組織病理檢測;秦燕勤、楊靜帆負責實驗數據收集及統計分析;秦燕勤負責論文起草;趙鵬、李建生負責論文修改;秦燕勤、李建生負責最終版本修訂,對論文負責。
本文無利益沖突。
秦燕勤:https://orcid.org/0000-0002-7313-1576
李建生:https://orcid.org/0000-0002-6485-2371
參考文獻
YANG I A,JENKINS C R,SALVI S S. Chronic obstructive pulmonary disease in never-smokers:risk factors,pathogenesis,and implications for prevention and treatment[J]. Lancet Respir Med,2022,10(5):497-511. DOI:10.1016/S2213-2600(21)00506-3.
RUSTAM S,HU Y,MAHJOUR S B,et al. A unique cellular organization of human distal airways and its disarray in chronic obstructive pulmonary disease[J]. Am J Respir Crit Care Med,2023,207(9):1171-1182. DOI:10.1164/rccm.202207-1384OC.
HIROTA N,MARTIN J G. Mechanisms of airway remodeling[J]. Chest,2013,144(3):1026-1032. DOI:10.1378/chest.12-3073.
AGHASAFARI P,GEORGE U,PIDAPARTI R. A review of inflammatory mechanism in airway diseases[J]. Inflamm Res,2019,68(1):59-74. DOI:10.1007/s00011-018-1191-2.
KUME H,YAMADA R,SATO Y,et al. Airway smooth muscle regulated by oxidative stress in COPD[J]. Antioxidants,2023,12(1):142. DOI:10.3390/antiox12010142.
JONES R L,NOBLE P B,ELLIOT J G,et al. Airway remodelling in COPD:it's not asthma![J]. Respirology,2016,21(8):1347-1356. DOI:10.1111/resp.12841.
LI J S,XIE Y,LI S Y,et al. Comparison of conventional medicine,TCM treatment,and combination of both conventional medicine and TCM treatment for patients with chronic obstructive pulmonary disease:study protocol of a randomized comparative effectiveness research trial[J]. Trials,2014,15:153. DOI:10.1186/1745-6215-15-153.
YU X Q,WANG M H,LI J S,et al. Effect of comprehensive therapy based on Chinese medicine patterns on self-efficacy and effectiveness satisfaction in chronic obstructive pulmonary disease patients[J]. Chin J Integr Med,2019,25(10):736-742. DOI:10.1007/s11655-017-2417-9.
ZHAO P,LI J S,YANG L P,et al. Integration of transcriptomics,proteomics,metabolomics and systems pharmacology data to reveal the therapeutic mechanism underlying Chinese herbal Bufei Yishen formula for the treatment of chronic obstructive pulmonary disease[J]. Mol Med Rep,2018,17(4):5247-5257. DOI:10.3892/mmr.2018.8480.
LI J S,LIU X F,DONG H R,et al. Effective-constituent compatibility-based analysis of Bufei Yishen formula,a traditional herbal compound as an effective treatment for chronic obstructive pulmonary disease[J]. J Integr Med,2020,18(4):351-362. DOI:10.1016/j.joim.2020.04.004.
LI J S,MA J D,TIAN Y G,et al. Effective-component compatibility of Bufei Yishen formula II inhibits mucus hypersecretion of chronic obstructive pulmonary disease rats by regulating EGFR/PI3K/mTOR signaling[J]. J Ethnopharmacol,2020,257:112796. DOI:10.1016/j.jep.2020.112796.
李建生,秦燕勤,田燕歌,等. 補肺益腎組分方Ⅱ活性成分優化及組分方Ⅲ的建立[J]. 中華中醫藥雜志,2023,38(6):2526-2532.
LIU L,QIN Y Q,CAI Z H,et al. Effective-components combination improves airway remodeling in COPD rats by suppressing M2 macrophage polarization via the inhibition of mTORC2 activity[J]. Phytomedicine,2021,92:153759. DOI:10.1016/j.phymed.2021.153759.
LI Y,LI S Y,LI J S,et al. A rat model for stable chronic obstructive pulmonary disease induced by cigarette smoke inhalation and repetitive bacterial infection[J]. Biol Pharm Bull,2012,35(10):1752-1760. DOI:10.1248/bpb.b12-00407.
李建生,崔紅新,田燕歌,等. 調補肺腎三法對慢性阻塞性肺疾病穩定期模型大鼠肺膠原和蛋白酶調節作用的R值綜合評價[J]. 中醫雜志,2014,55(11):949-954. DOI:10.13288/j.11-2166/r.2014.11.014.
李建生. 正虛積損為慢性阻塞性肺疾病的主要病機[J]. 中華中醫藥雜志,2011,26(8):710-713.
LI J S,XIE Y,ZHAO P,et al. A Chinese herbal formula ameliorates COPD by inhibiting the inflammatory response via downregulation of p65,JNK,and p38[J]. Phytomedicine,2021,83:153475. DOI:10.1016/j.phymed.2021.153475.
QIN Y Q,ZHAI J N,YANG J F,et al. Effective-component compatibility of Bufei Yishen formula alleviates chronic obstructive pulmonary disease inflammation by regulating GSK3β-mediated NLRP3 inflammasome activation[J]. Biomedecine Pharmacother,2023,168:115614. DOI:10.1016/j.biopha.2023.115614.
KO F W S,SIN D D. Twenty-five years of respirology:advances in COPD[J]. Respirology,2020,25(1):17-19. DOI:10.1111/resp.13734.
STAMATIOU R,PARASKEVA E,VASILAKI A,et al. The muscarinic antagonist gallamine induces proliferation of airway smooth muscle cells regardless of the cell phenotype[J]. Pharmacol Rep,2019,71(2):225-232. DOI:10.1016/j.pharep.2018.10.010.
GE Z X,LI B,ZHOU X,et al. Basic fibroblast growth factor activates β-catenin/RhoA signaling in pulmonary fibroblasts with chronic obstructive pulmonary disease in rats[J]. Mol Cell Biochem,2016,423(1/2):165-174. DOI:10.1007/s11010-016-2834-7.
OTSUKI Y,GO T,KATO A,et al. Regeneration of emphysematous lungs using gelatin sheets that release basic fibroblast growth factor[J]. Surg Today,2022,52(8):1229-1235. DOI:10.1007/s00595-022-02465-z.
PAVLISA G,PAVLISA G,KUSEC V,et al. Serum levels of VEGF and bFGF in hypoxic patients with exacerbated COPD[J]. Eur Cytokine Netw,2010,21(2):92-98. DOI:10.1684/ecn.2010.0193.
CHRISTOPOULOU M E,PAPAKONSTANTINOU E,STOLZ D. Matrix metalloproteinases in chronic obstructive pulmonary disease[J]. Int J Mol Sci,2023,24(4):3786. DOI:10.3390/ijms24043786.
HAO W D,LI M X,ZHANG Y Q,et al. Expressions of MMP-12,TIMP-4,and neutrophil elastase in PBMCs and exhaled breath condensate in patients with COPD and their relationships with disease severity and acute exacerbations[J]. J Immunol Res,2019,2019:7142438. DOI:10.1155/2019/7142438.
(收稿日期:2024-01-05;修回日期:2024-03-21)
(本文編輯:康艷輝)

