鐵皮石斛miR168分子進化特征及響應藍激光表達分析
李宇晴 姚燕婷 王雅倩 孫剛 賴鐘雄 李漢生


doi:10.7606/j.issn.1004-1389.2024.07.016
https://doi.org/10.7606/j.issn.1004-1389.2024.07.016
收稿日期:2022-09-12? 修回日期:2023-11-06
基金項目:2020年福建省科技廳自然科學基金面上項目(2020J01377);觀賞竹的規模化栽培育種(B17000208);2023年福建省科技特派員。
第一作者:李宇晴,本科生,從事植物生物技術研究。E-mail:3476155755@qq.com
通信作者:李漢生,博士,副教授,主要從事植物生物技術研究。E-mail:1456505560@qq.com
摘? 要? 筆者在關于鐵皮石斛miRNA組學研究中發現較多響應藍激光的miRNA,挑選關鍵且差異表達的miR168進行分子進化特征及其響應藍激光表達分析。經對前體和成熟體分類統計、進化樹構建、靶基因預測、啟動子順示作用元件及響應不同光質表達等進行分析,結果顯示:miR168家族成員分布在40個植物物種中,前體和成熟體成員較少,其在植物中可能進化得不夠完整;物種特異性是影響miR168前體進化特性的重要因素,而序列保守性是影響成熟體進化特性的主要因素;由3p臂上形成的miR168成熟體序列有較高特異性、5p臂形成的成熟體的序列保守性較高;Mfold和Rfam預測表明鐵皮石斛miR168莖序列的保守性高于環序列,前體發卡結構較多,成熟體位置位于3p臂上,既包含莖序列也包含環序列;鐵皮石斛miR168a的啟動子主要包括光、激素、生物和非生物脅迫響應元件,可能通過這些順式元件在其響應藍激光中起調控作用;鐵皮石斛響應藍激光的靶基因主要包括ABC轉運蛋白B家族成員、乙酰輔酶 A 乙酰轉移酶等,主要參與植物生長發育和響應外界因素。實時熒光定量PCR結果表明,鐵皮石斛miR168a與其靶基因gene-MA16_Dca006149、gene-MA16_Dca020995、gene-MA16_Dca017821參與藍激光對鐵皮石斛的影響。
關鍵詞? 鐵皮石斛;miR168;進化特性;激光;實時熒光定量PCR
鐵皮石斛(Dendrobium officinale Kimura et Migo)為蘭科石斛屬草本藥用植物,具有生津、潤肺、排毒,增強免疫力等功效[1]。現代化學和藥理研究表明鐵皮石斛的主要功能性代謝產物為多糖、黃酮類、聯芐類和生物堿等[2]。
研究人員已通過不同方法提高鐵皮石斛功能性代謝產物含量,而光調控是最有效方法之一。不同 LED 光照模式對鐵皮石斛原球莖多糖積累的研究中,發現紅藍混合光對多糖積累的促進作用最為明顯,其中以紅光∶藍光=1∶3 的多糖產量最髙[3]。在不同光質對鐵皮石斛的研究中發現 15 d內單色藍光有利于生物堿含量增加,30 d內單色黃光有利于生物堿含量增加,30 d后紅藍光比例為2∶3的處理更有利于生物堿含量增加[4]。
關于激光光源對植物功能性代謝產物的研究鮮有報道。激光是在發光機理上完全不同于普通光源,具有很好的單色性,不僅能有效解決普通光源存在問題,而且可能對植物生長發育具有新的作用機制。大量研究發現,激光光源預處理種子可顯著提高多種植物的生長發育和代謝進程。例如,當使用 4.0×10-3J/(cm2·s)激光處理白羽扇豆和蠶豆后,120 h 后發現種子細胞中淀粉分解酶的活力值達到最大值,種子 IAA 含量提升,下胚軸伸長加快,鮮重和根長增加[5]。Gao等[6]的研究發現,He-Ne 激光能夠加速植物生長發育,可能因為通過激活植物細胞內源一氧化氮(NO)信號分子和鈣信號的合成和釋放,進而介導胞內發生一系列信號級聯反應途徑而發生的。
筆者在關于鐵皮石斛組培苗響應不同光質(白光、藍光和藍激光)的miRNA組學(PRJCA006154)研究中發現較多響應激光的miRNA,挑選關鍵且差異表達的miR168進行分子進化特征及其響應藍激光表達分析。miRNA是一類內源小分子非編碼單鏈RNA,長度在? 19~25 nt。其不含開放閱讀框,不能編碼蛋白質,在動植物體內通過mRNA直接剪切或抑制功能蛋白翻譯負調控靶基因[7-8]。miR168為植物特有的長約21 nt的miRNA家族,其在不同物種間具有高度的保守性[9]。miR168的功能在植物的生長發育調控中起到重要作用,例如,擬南芥miR168a參與AGO1轉錄后基因沉默,當AGO1在擬南芥中超表達時,即突變體AGO1不受 miR168a 調控,過量表達的AGO1會造成植株生長發育嚴重缺陷;當AGO1抑制表達時,miR168a將無法降解靶基因mRNA的功能,導致miR168a的降解[10]。miR168還能夠參與諸多植物的非生物脅迫響應過程。miR168b可能參與玉米植物響應干旱脅迫反應和甜楊植株響應低溫脅迫反應[11-12]。TEV (Tobacco etch virus,煙草腐蝕病毒)、CrTMV (Crucifer-infecting tobacco mosaic virus,煙草花葉病毒)等植物病毒可以誘導miR168 的表達水平升高[13]。此外,研究發現miR168與植物光周期、干旱脅迫、ABA 誘導、低氮脅迫等都密切相關[14-17]。
綜上所述,植物miR168的功能具有多樣性,而有關鐵皮石斛miR168的研究尚未見報道。本研究通過分析鐵皮石斛和miRBase數據庫已登錄植物miR168家族的進化特性差異,以期為鐵皮石斛miR168家族功能研究提供理論基礎。在此基礎上還對鐵皮石斛miR168和靶基因在激光的表達分析,進一步了解miR168在鐵皮石斛響應藍激光過程中的作用。
1? 材料與方法
1.1? 植物材料
所用組培苗為具有 3~4片真葉,葉寬約 2~3 mm,苗高約2 cm的鐵皮石斛。保證藍激光(450 nm)、藍光(450 nm)、白光、總光強[100 μmol/(m2·s)]、光照時間(12 h/d)、濕度55%~60%和溫度(25±2) ℃等相同的條件上,將鐵皮石斛組培苗置于光照培養箱處理60 d。鐵皮石斛繼代培養基配方為1/2MS+ +30.0 g/L蔗糖+ 6 g/L瓊脂+ 1 g/L活性炭+50 g/L香蕉泥(pH為5.8)。光照處理的培養基配方為1/2MS+ +30.0 g/L蔗糖+ 6 g/L瓊脂+ 1 g/L活性炭(pH為5.8)。現以白光為對照組,試驗組為藍光、藍激光。對照組和處理組的植株經液氮速凍保存于-80 ℃冰箱,用于核酸提取、高通量測序等測定。
1.2? 植物miR168家族成員的物種分布
通過miRbase最新數據庫(https://www.mirbase.org/)下載已登錄的miR168的前體和成熟體序列,獲得擬南芥(Arabidopsis thaliana)、琴葉擬南芥(Arabidopsis lyrata)、油菜(Brassica napus)、蒺藜苜蓿(Medicago truncatula)、蕪菁(Brassica rapa)、水稻(Oryza sativa)、高粱(Sorghum bicolor)、玉米(Zea mays)、二穗短柄草(Brachypodium distachyon)、大豆(Glycine max)、豇豆(Vigna unguiculata)、大葉相思(Acacia auriculiformis)、木薯(Manihot esculenta)、蓖麻(Ricinus communis)、番茄(Solanum lycopersicum)等35個物種的61個miR168前體序列和48個miR168成熟體序列,了解miR168在不同物種之間的分布規律及其特征。
1.3? 植物miR168家族成員進化樹構建
通過MEGA 7.0軟件[18]且參照李漢生等[19]的方法,構建植物miR168的前體和成熟體序列進行系統進化樹。
1.4? 植物miR168家族成員序列分析
通過DNAMAN 軟件比對植物miR168成熟體序列。
1.5? 植物miR168前體序列分析及其二級結構預測
通過Rfam 12.0在線軟件[20] (http://rfam.xfam.org/)對植物miR168家族成員二級結構保守性進行分析。通過Mfold 3.5在線軟件[21](http://unafold.rna.albany.edu/?q=mfold)對植物miR168預測前體二級結構及其分析成熟體? 位置。
1.6? 植物miR168家族成員的靶基因預測
植物miR168家族成員的靶基因預測和分析采用psRNATarget在線軟件(http://plantgrn.noble.org/v1_psRNATarget/)[22]。
1.7? 實時熒光定量PCR
通過TriPure試劑盒(Invitrogen,中國)對激光處理的鐵皮石斛嫩葉進行總RNA的提取。選取凝膠電泳顯示其完整性良好,且紫外分光光度計檢測OD260/280值為1.8~2.0的RNA備用。鐵皮石斛總RNA采用SYBR ExScriptTM(Takara,日本)進行逆轉錄。基于鐵皮石斛基因組[23]和轉錄組數據庫(PRJCA006154)的基礎上,通過Li等[24]描述的方法進行相對miRNAs和靶基因的表達水平分析。miRNA的內參為5.8 s rRNA,靶基因的內參為ACTIN,相對表達水平的測定采用比較2-ΔΔCt方法。相關引物信息見? 表1。
1.8? 數據分析
鐵皮石斛miRNA和靶基因表達量結果至少3個生物學重復。采用SPSS V 19.0單因素方差分析(ANOVA)的DTncan測試法,分析鐵皮石斛響應不同光照處理的表達量。制圖采用GraphPad Prism 6.0軟件和Omic share在線? 軟件。
2? 結果與分析
2.1? 植物miR168家族前體和成熟體分布
植物miR168家族成員分布情況見表2。miRBase最新數據庫中發現40個物種存在miR168,39個物種屬于被子植物,其中包括蘭科(1種)、葡萄科(1種)、茄科(2種)、薔薇科(3種)、蕓香科(3種)、豆科(5種)、十字花科(10種)等;僅1個物種為裸子植物,主要包括松科(1種);被子植物的數量遠多于裸子植物。不同植物miR168家族前體和成熟體數量也存在較大差異,其中被子植物的蕪菁成熟體最多為6個,被子植物的煙草前體最多為5個,以上兩種為分布最多最全的物種,推測miR168在植物中可能進化得不夠完整。
miRBase已登錄植物miR168家族的86個前體和63個成熟體中,前體長度分布范圍為86 nt~358 nt,成熟體長度分布范圍在19 nt~? 24 nt,其長度具有較大差異,推測植物miR168存在復雜的形成機制,而最重要的因素之一為物種特異性。擬南芥、琴葉擬南芥、蕪菁、玉米、番茄、毛果楊及鸚哥鳳梨的2個miR168前體,水稻、二穗短柄草、百脈根、野草莓、大麥、節節麥、甜橙及藍花耬斗菜的1個miR168前體都在3p和5p臂上形成成熟體;有25個miR168成熟體沒有區分3p或5p臂。本研究發現已登錄的植物miR168成員中有23條5p臂和24條3p臂上的成熟體? 序列。
2.2? 植物miR168家族成員前體及成熟體進化特性
為了解植物miR168家族成員進化特點,本研究通過MEGA 7.0軟件對植物miR168家族成員的86個前體和63個成熟體序列進行系統進化樹構建(圖1和圖2)。
大部分植物miR168家族成員前體有著科內物種聚集更近的現象,例如被子植物的十字花科、豆科、禾本科(圖1)。小部分植物miR168家族成員前體比較分散,分別位于不同的小分支上? (圖1)。此外,筆者還發現松科植物歐洲云杉pad-miR168b和豆科大葉相思aaT-miR168單獨聚在一支,而pad-miR168a和菊科刺苞菜薊? cca-miR168a聚在一支,禾本科水稻osa-miR168b和毛茛科藍花耬斗菜aqc-miR168單獨聚在一支,而osa-miR168a單獨聚在一支,可能除物種親緣關系外,還有其他因素影響著miR168的進化,或者這類miRNA存在不同功能(圖1)。因此,物? 種親緣關系是影響植物miR168家族成員前體進化特性的重要因素之一,但是也存在其他影響? 因素。
根據進化樹聚集性將植物miR168成熟體劃分為兩大枝,來自5p臂和3p臂的miR168-5p成熟體都分布聚在不同大枝上(圖2)。此外,聚類分析結果表明植物miR168家族成員的成熟體進化特性與物種特異性存在緊密聯系。
2.3? 鐵皮石斛miR168前體和成熟體進化分析
2.3.1? 鐵皮石斛miR168前體進化分析? 為進一步了解鐵皮石斛miR168的進化特性相關規律,選取蘭科、豆科、十字花科、松科、禾本科的miR168前體和成熟體序列進行系統進化樹構建(圖3和圖4)。
從圖3進化樹分析可知,miR168前體序列分支較多,包括兩個較大的分支,兩大分支主要成員多為十字花科和豆科,但是物種聚集程度總體比較分散。鐵皮石斛miR168的前體單獨為一個分支,與蕪菁的bra-miR168a親緣關系最近。
2.3.2? 鐵皮石斛與其他4個物種miR168成熟體進化分析? 從圖4進化樹分析可知,植物miR168進化樹發現蘭科、松科、禾本科、豆科、十字花科植物共計43個成熟體可分為4大分支,物種聚集程度比較集中。從上往下分別命名為第一到第四分支。不同物種的5p臂miR168主要分布于第一和第二個小分支;而3p臂miR168主要聚在第三和第四分支,鐵皮石斛miR168位于第四分支,與十字花科的ath-miR168b-3p、豆科的lja-miR168-3p親緣性很近。
2.4? 鐵皮石斛miR168成熟體序列分析
為了解植物miR168家族成員成熟體的分子特性,通過DNAMAN軟件對植物miR168-3p成熟體、miR168-5p成熟體以及其他成熟體序列(去除3p、5p臂上的miR168成熟體)進行多序列比對分析(圖5)。
從圖5-A分析結果發現所有物種miR168-5p成員的序列的保守性都很高。從圖5-B可以看出,多數物種miR168-3p家族成員成熟體的序列保守性較高,少數保守性較低,例如,水稻的osa-miR168-3p和hvt-miR168-3p。
從圖5-C可以看出,將無區分3p和5p臂的植物miR168成熟體序列比對分析,多數植物miR168家族成員成熟體的序列保守性較高,除個別植物中若干個堿基存在差異,例如,亞麻薺cas-miR168、大葉相思aat-miR168、藍花耬斗菜aqc-miR168等。這類少數保守性低的成員分布在不同的門、目、科,無規律性可尋,導致序列特異性原因以及序列差異引起功能差異,還有待今后深入研究。結合圖2分析結果可見,序列保守性是影響成熟體進化特性的重要因素。
2.5? 鐵皮石斛miR168二級結構特點
通過Rfam 12.0軟件進行在線分析,進一步探討植物miR168家族成員前體序列的保守程度(圖6)。鐵皮石斛miR168前體3p臂與5p臂上的序列保守性較為一致;miR168家族能夠形成典型的莖環結構,并且莖序列的保守性高于環? 序列。
2.6? 鐵皮石斛miR168前體二級莖狀結構及生成成熟體特征分析
通過Mfold在線軟件預測植物miR168前體序列的二級莖狀結構,主要包括被子植物的擬南芥、煙草、鐵皮石斛及裸子植物的歐洲云杉,如圖7所示。植物miR168前體可以形成典型的發卡結構,每個前體可形成8~13個不等的環狀結構,其中鐵皮石斛miR168發卡結構較多。其結構最小自由能(△G)分別為ath-miR168a-3p? (-281.16 kJ/mol)、ath-miR168a-5p (-187.02? kJ/mol)、ath-miR168b-3p(-281.16 kJ/mol)、nta-miR168c-3p(-463.38 kJ/mol)、pab-miR168a-3p(-242.25 kJ/mol)、do-miR168a-3p(-406.64? kJ/mol)。植物miR168成熟體形成的位置在3p臂或5p臂上,成熟體序列有的只包含莖序列,有的包含部分環序列。而鐵皮石斛miR168成熟體位置位于5p臂上。
2.7? 植物miR168家族成員的靶基因預測與分析
為了解植物miR168家族成員的靶基因功能,挑選被子植物的鐵皮石斛、大豆、甘蔗、擬南芥、玉米、水稻的miR168家族成員成熟體共15條,包括miR168、miR168a、miR168b、成員以及不同成員的miR168-5p、miR168-3p預測靶基因功能,具體見表3。
從表3分析結果看出,miR168抑制靶基因的方式主要包括裂解和翻譯抑制。從靶基因的數量上來看,不同物種miR168的靶基因數在2至19個之間。同一物種不同miR168家族成員的靶基因可能完全相同,例如ath-miR168a-5p與ath-miR168b-5p、zma-miR168a-5p與zma-miR168b-5p的靶基因完全相同。此外,同物種同miR168成員不同臂上形成的成熟體的靶基因卻可能完全不同,如ath-miR168a-5p與ath-miR168a-3p、ath-miR168b-5p與ath-miR168b-3p、osa-miR168a-5p與osa-miR168a-3p、zma-miR168a-5p與zma-miR168a-3p、zma-miR168b-5p與zma-miR168b-3p的靶基因完全不同。從靶基因注釋來看,不同
物種miR168靶基因功能各不相同。擬南芥miR168靶基因注釋主要包括多核苷酸轉移酶(polyntcleotidyl transferase)、 SET 域的蛋白質賴氨酸甲基轉移酶家族蛋白質(SET-domain containing protein lysine methyltransferase family protein)。水稻miR168靶基因注釋主要包括含有蛋白激酶結構域的蛋白質(protein kinase domain containing protein)、反轉錄轉座子蛋白(retrotransposon protein)。鐵皮石斛miR168靶基因功能主要注釋包括ABC轉運蛋白B家族成員、細胞色素P450、乙酰輔酶A乙酰轉移酶、DNA拓撲異構酶III等,功能分別為防御機制,次級代謝物的生物合成,脂質運輸和代謝,復制、重組和修復等。
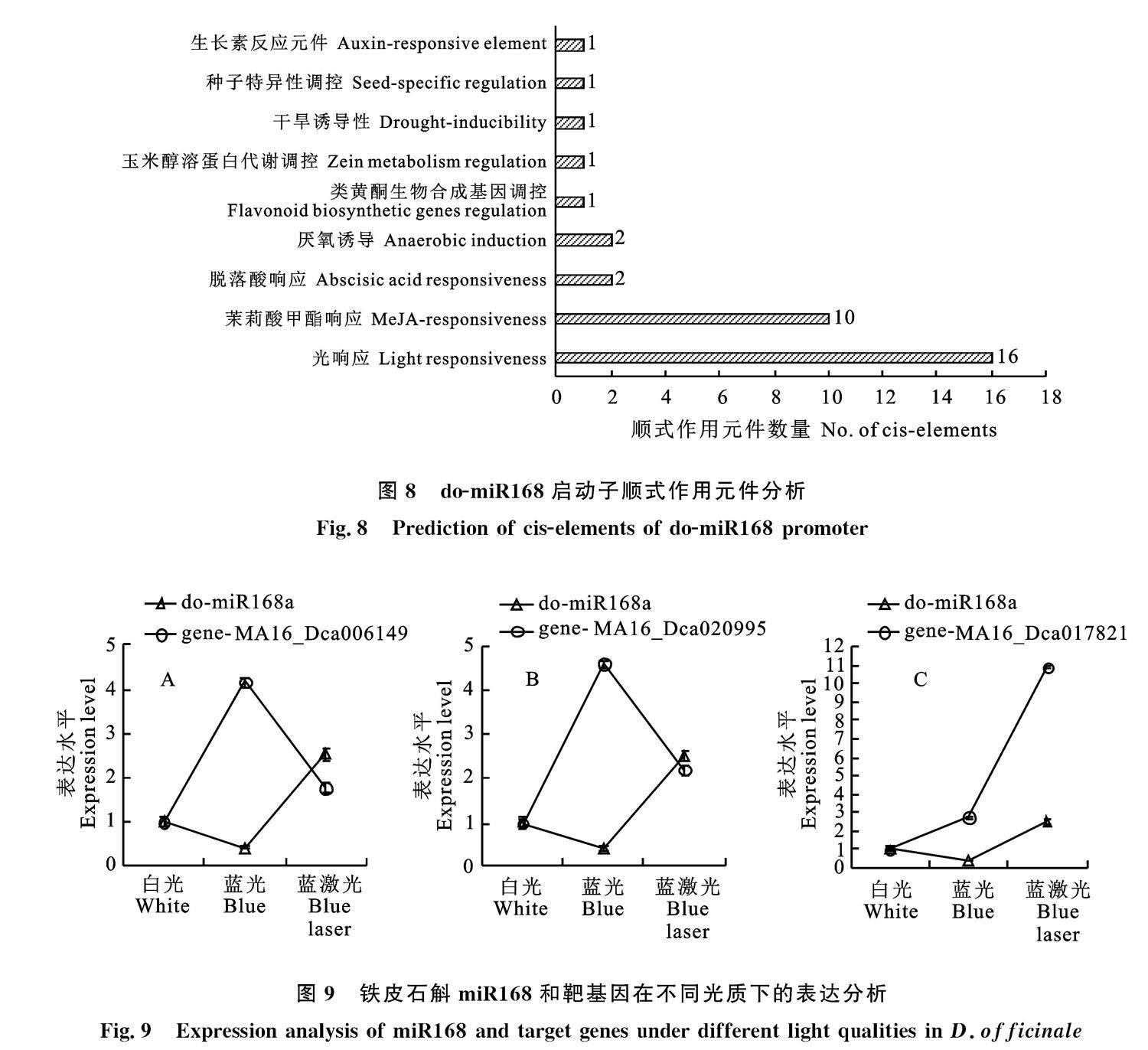
2.8? 鐵皮石斛miR168啟動子順式作用元件預測分析
基于do-miR168a序列,結合鐵皮石斛基因組數據,通過BDGP 軟件預測其轉錄起始位點,從而確定啟動子序列。通過plantcare在線軟件預測其啟動子順式作用元件,結果如圖8所示。
鐵皮石斛do-miR168a的啟動順式作用元件中,最多為光響應元件(16個);其次激素響應元件:茉莉酸甲酯(10個)、脫落酸(2個)、生長素(1個);還含有厭氧誘導元件(2個)、類黃酮生物合成調控元件(1個)、干旱誘導元件(1個)、玉米蛋白代謝調節元件(1個)、種子特異性調控元件(1個)。推測do-miR168在植物響應光照、激素時起到重要調控作用。
2.9? 鐵皮石斛miR168響應激光的表達分析
鐵皮石斛miR168a和靶基因在白光、藍光、藍激光的qPCR結果如圖9所示。所選3個靶基因gene-MA16_Dca017821 (乙酰輔酶A乙酰轉移酶,putative acetyl-CoA acetyltransferase)、gene-MA16_Dca006149 (ABC轉運蛋白B家族,ABC transporter B family member 20)、gene-MA16_Dca020995 (細胞色素P450,cytochrome P450 89A2-like)在鐵皮石斛生長和代謝中具有重要調控作用。do-miR168a與gene-MA16_Dca01782的表達量趨勢在藍激光處理未呈現負相關,推測靶基因gene-MA16_Dca017821可能存在其他miRNA同時調控,從而實現靶基因轉錄水平調控。do-miR168a與靶基因gene-MA16_Dca006149、gene-MA16_Dca020995的表達量趨勢呈現負相關,表明do-miR168a可能通過負調控靶基因,參與到藍激光調控鐵皮石斛的生長和代謝。以上調控機制有待遺傳轉化進一步驗證。
3 ?討 論
3.1? 鐵皮石斛miR168家族成員的進化特點
本研究表明,植物miR168家族的40個物種中包含86個前體序列和63個成熟體序列,其多數為被子植物,少數為裸子植物。植物miR168家族成員成熟體序列比對分析結果再次證明了miR168家族在植物中的保守性。
從鐵皮石斛miR168家族成員前體和成熟體的進化特性分析結果看出,其前體進化特性影響的重要因素為物種親緣性,而物種親緣性對成熟體進化特性影響不大[25]。從鐵皮石斛miR168家族成員成熟體進化樹分析看出,5p臂或3p臂形成的成熟體都分別聚在一支。本研究還發現
5P臂的成熟體序列保守性較高,這與王艷芳等[26](miR171)、劉煒婳等[27](miR172)和翟俊淼等[28](miR396)研究結果相同,表明植物miR168成熟體聚類的主要因素為序列的保守性,其次才是物種差異性。以上觀點符合科內物種的miR168(圖3)以及種間物種miR168(圖4)家族成員的前體和成熟體的進化特性分析結果,同時植物miR168成員成熟體序列分析結果也證明該觀點。此外,本研究還發現植物miR168前體進化樹分支較多,可以推測miR168家族來源于古老的祖先,并且經歷了串聯重復、片段重復、反向重復、隨機起源等進化方式的更迭以及長期復雜的進化演變過程[19,29]。
植物miR168的86個前體序列長度具有較大差異,長度范圍在86 nt~358 nt,物種特異性明顯。而植物miR168的63個成熟體序列長度范圍為在19 nt~24 nt,具有較強的保守性,表明其在進化上特異性和保守性并存。miR168家族成員成熟體序列分析結果也進一步說明了miR168家族成員的保守性。植物miR168的63個成熟體分布在39個物種中,分別有23條來自5p臂和24條來自3p臂。二級結構保守性分析結果表明5p臂形成的成熟體的保守性高于3p臂。此外,相關研究已經表明序列差異會引起基因功能差異,而植物miR168同一物種同一成員不同臂上形成的成熟體是否會引起功能不同還需進一步研究[30]。
3.2? 鐵皮石斛miR168在藍激光響應過程中的作用
通過植物miR168家族成員靶基因預測結果表明(表3),不同物種miR168的靶基因數量不同(2~19個);同物種不同miR168家族成員的靶基因完全或者部分相同;同物種相同miR168家族成員不同臂上形成的成熟體的靶基因卻可能完全不同。以上結論可能是因為3p臂上的序列特異性較強,5p臂上的序列具有較高保守性,而miRNA與靶基因需要高度互補才可以對靶基因起到作用。序列特異的3p臂上形成的miR168成熟體與序列較保守的5p臂上形成的成熟體很可能引起靶基因的差異。
植物miR168具有多種生物學功能,不同物種miR168靶基因的功能不同,其靶基因注釋主要包括多核苷酸轉移酶、SET 域的蛋白質賴氨酸甲基轉移酶家族蛋白質、蛋白激酶結構域的蛋白質等,以上基因作為miR168的保守性靶基因,已被廣泛研究報道[9]。而通過psRNATarget在線軟件預測鐵皮石斛miR168a的靶基因,發現靶基因gene-MA16_Dca006149,gene-MA16_Dca020995,gene-MA16_Dca017821注釋分別為ABC轉運蛋白B家族、細胞色素P450、乙酰輔酶A乙酰轉移酶。
ABC轉運蛋白B家族是一類廣泛存在于植物中的跨膜轉運蛋白,在植物次生代謝物質的轉運與積累、激素運輸、脂質代謝、抵抗生物和非生物脅迫等方面起著關鍵作用[31]。本研究發現光照培養下,鐵皮石斛miR168a與靶基因gene-MA16_Dca006149的表達量基本呈負相關,推測miR168可能通過負調控靶基因參與藍激光對鐵皮石斛細胞信號轉導的影響。
細胞色素P450廣泛參與植物次生代謝調控,主要涉及植物激素、苯丙素類、生物堿類、萜類、甾醇類、脂肪酸、色素等的合成及代謝[32-33]。鐵皮石斛響應激光過程中,此類次生代謝產物的提升,有利于提高應對外界因素的能力。推測鐵皮石斛miR168可能通過調控靶基因gene-MA16_Dca020995參與藍激光對鐵皮石斛的影響。
乙酰輔酶A乙酰轉移酶主要功能為脂質運輸和代謝調控,而植物角質層是形成于表皮細胞壁外表面的脂質保水層。角質層通常由角質和蠟質組成,角質是角質層的主要結構成分,其主要組分是聚酯,蠟質成分主要是黃酮類、三萜類物質以及極長鏈飽和脂肪酸及其衍生物。相關研究表明植物表皮蠟質對紫外線輻射和可見光都有反射作用,且蠟質對紫外線輻射的反射作用比可見光更強[34]。研究人員利用玉米的蠟質缺失突變體研究葉片表皮蠟質在抵抗紫外線的作用。與正常植株相比,表皮蠟質缺失的玉米受紫外線傷害程度明顯更大,植物表型和遺傳均受到顯著影響。與表皮蠟質較少的葉片相比,蠟質較多的葉片能夠吸收更多紫外線,降低植物體的損傷[35]。推測鐵皮石斛靶基因gene-MA16_Dca017821除miR168調控外,可能還有其他miRNA共同調控,從而實現靶基因轉錄水平調控,參與到藍激光對鐵皮石斛的影響。
4? 結? 論
本研究分析了鐵皮石斛與其他植物miR168家族進化特性差異,為其功能研究提供理論基礎。分析了鐵皮石斛miR168和靶基因在激光的表達分析,深入了解miR168在鐵皮石斛響應藍激光過程中的作用,推測鐵皮石斛miR168a可能通過靶基因gene-MA16_Dca006149、gene-MA16_Dca020995參與到藍激光對鐵皮石斛的影響;而靶基因gene-MA16_Dca017821除miR168調控外,可能還有其他miRNA共同調控,從而參與到藍激光對鐵皮石斛的影響。關于這種調控機制有待遺傳轉化進一步驗證。
參考文獻? Reference:
[1]? 陳曉梅,田麗霞,單婷婷,等.鐵皮石斛種質資源和遺傳育種研究進展[J].藥學學報,2018,53(9):1493-1503.
CHEN X M,TIAN L X,SHAN T T,et al.Advances in germplasm resources and genetics and breeding of Dendrobium officinale[J].Acta Pharmaceutica Sinica,2018,53(9):1493-1503.
[2]林江波,王偉英,鄒? 暉,等.基于轉錄組測序的鐵皮石斛黃酮代謝途徑及相關基因解析[J].福建農業學報,2019,190(9):27-33.
LIN J B,WANG W Y,ZOU H,et al.Transcriptome analysis on pathway of and genes related to flavonoid synthesis in Dendrobium officinale[J]. Fujian Journal of Agricultural Sciences,2019,190(9):27-33.
[3]林? 嘯.光質誘導鈣信號對鐵皮石斛原球莖生長及多糖積累的影響研究[D].成都:四川農業大學,2015.
LIN? X.Influence of caluim signal on the growth and polysaccharide accumulation of Dendrobium officinale protocorm under photoinduction[D].Chendu:Sichuan Agricultural?? University,2015.
[4]婁鈺姣.光質對鐵皮石斛生長及次生代謝產物的積累調控[D].成都:四川農業大學,2016.
LOU Y J.Light quality on the growth and accumulation of secondary metabolites in the regulation of Dendrobium officinale[D].Chendu:Sichuan Agricultural University,2016.
[5]李永鋒.He-Ne 激光和 UV-B 輻射對小麥葉綠體超微結構及蛋白質組學的影響研究[D].太原:山西師范大學,2017.
LI Y F.Studies on effects of He-Ne laser and enhanced UV-B radiation on chloroplast ultrastructure and proteomics in wheat seedlings[D].Taiyuan:Shanxi Normal University,2017.
[6]GAO L ,LI Y ,HAN R.Cell wall reconstruction and DNA damage repair play a key role in the improved salt tolerance effects of He-Ne laser irradiation in tall fescue seedlings[J].Bioscience,Biotechnology,and Biochemistry,2016,80:682-693.
[7]盧寶偉,安鳳霞,楊永建,等.藥用植物miRNA與次生代謝[J].植物生理學報,2019,55(5):569-576.
LU B W,AN F X,YANG Y J,et al.MiRNA and secondary metabolism of medicinal plants[J].Plant Physiology Journal,2019,55(5):569-576.
[8]王夢蕾,趙? 淼,李用芳.植物microRNA的保守性及其分布的分析[J].中國生物化學與分子生物學報,2019, 35(12):1341-1351.
WANG M L,ZHAO M,LI Y F.Conservation and distribution of micrornas in plants[J].Chinese Journal of Biochemistry and Molecular Biology,2019,35(12):1341-1351.
[9]韓? 璐,欒雨時.植物miR168的研究進展[J].基因組學與應用生物學,2014(2):438-444.
HAN? L,LUAN Y SH.Progress on theresearch of plant miR168[J].Genomics and Applied Biology,2014(2):438-444.
[10]? VAUCHERET H,MALLORY A C,BARTEL D P.AGO1 homeostasis entails coexpression of? miR168 and AGO1 and preferential stabilization of miR168 by AGO1[J].Molecular Cell,2006,22(1):129-136.
[11]LI W,CUI X,MENG Z,et al.Transcriptional regulation of Arabidopsis? miR168a and ARGONAUTE1 homeostasis in abscisic acid and abiotic stress responses[J].Plant Physiology,2012,158(3):1279-1292.
[12]IKI T,ANTOINE C,BOLOGNA N,et al.Structural flexibility enables alternative maturation,ARGONAUTE sorting and activities of miR168,a global gene silencing regulator in plants[J].Molecular Plant,2018,11(8):1008-1023.
[13]VA VRALLYAY,A VLCZI,KOS GYI,et al.Plant virus-mediated induction of miR168 is associated with repression of ARGONAUTE1 accumulation[J].The EMBO Journal,2017,36:1641-1642.
[14]SUNITHA S,LOYOLA R,ALCALDE J A,et al.The role of UV-B light on small RNA activity during grapevine berry development[J].G3-Genes Genomes Genetics,2018,7:10-59.
[15]CAPITO C,PAIVA J,SANTOS D M,et al.In Medicago truncatula,water deficit modulates the transcript accumulation of components of small RNA pathways[J].BMC Plant Biology,2011,11(1):79-79.
[16]LI W,CUI X,MENG Z,et al.Transcriptional regulation of Arabidopsis? miR168a and ARGONAUTE1 homeostasis in abscisic acid and abiotic stress responses[J].Plant Physiology,2012,158(3):1279-1292.
[17]NISCHAL L,MOHSIN M,KHAN I,et al.Identification and comparative analysis of MicroRNAs associated with low-N tolerance in rice genotypes[J].Plos One,2012,7(12):1-13.
[18]KUMAR S,STECHER G,TAMURA K.MEGA7:molecular evolutionary genetics analysis version 7.0 for bigger datasets[J].Molecular Biology and Evolution,2016,33(7):1870-1874.
[19]李漢生,孫? 剛,陳曉慧,等.龍眼miR396分子進化特性及響應藍光的表達分析[J].西北植物學報,2019,39(12):2109-2122.
LI H SH,SUN G,CHEN X H,et al.Analysis on evolutionary characteristics and expression patterns responding to blue light of miR396 in Dimocarpus longan Lour[J].Acta Botanica Boreali-Occidentalia Sinica,2019,39(12):2109-2122.
[20]NAWROCKI E P,BURGE S W,BATEMAN A,et al.Rfam 12.0:updates to the RNA families database[J].Nucleic Acids Research,2015,43(1):130-137.
[21]GLAVAC D,POTOCNIK U,PODPECNIK D,et al.Correlation of MFOLD-predicted DNA secondary structures with separation patterns obtained by capillary electrophoresis single-strand conformation polymorphism (CE-SSCP) analysis[J].Human Mutation,2002,19(4):384-394.
[22]DAI X,ZHAO P X.psRNATarget:a plant small RNA target analysis server[J].Nucleic Acids Research,2011,39:155-159.
[23]ZHANG G Q,XU Q,BIAN C,et al.The Dendrobium catenatum Lindl,genome sequence provides insights into polysaccharide synthase,floral development and adaptive evolution[J].Scientific Reports,2016,6(19029):1-10.
[24]LI H,YE W,WANG Y,et al.RNA sequencing-based exploration of the effects of far-red light on lncRNAs involved in the shade-avoidance response of D.officinale[J].PeerJ,2021,9(1):e10769.
[25]徐小萍,廖? 琪,陳? 旭,等.龍眼miR397家族成員分子特性及其在體胚發生早期的表達分析[J].果樹學報,2019,36(5):567-577.
XU X P,LIAO Q,CHEN X,et al.Molecular characteristics and expression analysis of miR397 family members during the early somatic embryogenesis in Dimocarpus longan Lour[J]. Journal of Fruit Science,2019,36(5):567-577.
[26]王艷芳,周瑞蓮,趙彥宏.miR-171基因家族進化分析及靶基因預測[J].生命科學研究,2015,19(6):479-483.
WANG Y F,ZHOU R L,ZHAO Y H.Molecular evolution of miR-171 gene family and prediction of their target genes[J].Life Science Research,2015,19(6):479-483.
[27]劉煒婳,林玉玲,林爭春,等.植物miR172家族成員進化與分子特性分析[J].熱帶作物學報,2018,39(3):525-533.
LIU W H,LIN Y L,LIN ZH CH,et al.Analysis of evolution and molecular characteristics of miR172 family members in plants[J].Chinese Journal of Tropical Crops,2018,39(3):525-533.
[28]翟俊淼,欒雨時,崔娟娟.miR396基因家族的進化及功能分析[J].植物研究,2013,33(4):421-428.
ZHAI J M,LUAN Y SH,CUI J J.Evolution and function analysis of miR396 gene family[J].Bulletin of Botanical Research,2013,33(4):421-428.
[29]HEMER? Y.Applications of the crown diameter-stem diameter relationship for different species of broadleaved trees[J].Forest Ecology and Management,2005,215:285-294.
[30]蔣夢琦,蘇立遙,黃倏祺,等.龍眼miR156家族及其調控靶標SPL的生物信息學和表達模式[J].應用與環境生物學報,2020,26(3):558-565.
JIANG M Q,SU L Y,HUANG SH? Q,et al.Bioinformatics and expression pattern analysis of miR156 family and its regulatory target SPL in Dimocarpus longan[J].Journal of Applied and Environmental Biology,2020,26(3):558-565.
[31]閻? 波,劉思思,陳? 娟,等.藥用植物鐵皮石斛ABC轉運蛋白基因的鑒定及其差異表達分析[J].藥學學報,2018,53(7):1177-1189.
YAN B,LIU S S,CHEN J,et al.Identification and differential expression analysis of ABC transporter gene from medicinal plant Dendrobium officinale[J].Acta Pharmaceutica Sinica,2018,53(7):1177-1189.
[32]李永康,馬雪祺,馮婧嫻,等.細胞色素 P450 酶在植物次生代謝產物生物合成中的研究進展[J].分子植物育種,2024,22(7):2176-2183.
LI Y K,MA X Q,FENG J X,et al.Advances of cytochrome P450s in the biosynthesis of plant secondary metabolites[J].Molecular Plant Breeding,2024,22(7):2176-2183.
[33]BEDEWITZ M A,JONES A D,D'AURIA J C,et al.Tropinone synthesis via an atypical polyketide synthase and P450-mediated cyclization[J].Nature Communications,2018,9(1):1-13.
[34]BRUHN D,MIKKELSEN T N,ROLSTED M,et al.Leaf surface wax is a source of plant methane formation under UV radiation and in the presence of oxygen[J].Plant Biology,2014,16(2):512-516.
[35]HAN X,MAO L.Research progress on constituents,histochemical characteristics and biosynthesis of suberin[J].Chinese Bulletin of Botany,2017,52(3):358-374.
Molecular Evolution Characteristics of miR168 in? Dendrobium? officinale and Analysis of? Its Response to Blue Laser Expression
LI?? Yuqing1,YAO Yanting1,WANG Yaqian1,SUN Gang1,LAI Zhongxiong2? and? LI Hansheng1
(1.Fujian Provincial Key Laboratory of Bamboo Resources Development and Utilization,Sanming University,
Sanming? Fujian? 365004,China; 2.Institute of Horticultural Biotechnology,Fujian Agriculture
and Forestry University,Fuzhou? 350002,China)
Abstract? Based on the analysis of miRNAs omics in Dendrobium officinale (D.officinale),the differentially expressed miR168 were selected for further analysis and verification,as it plays a key role in regulating pathway? influencing the effect of laser on D.officinale.We conducted an analysis of the distribution statistics of precursor and mature sequences,construction of phylogenetic trees,sequence alignment,prediction of the target genes,promoter sequence element,as well as expression patterns in response to laser for miR168 in this study.These results showed that the miR168 family members were widely distributed in 40 plant species,with fewer precursors and mature members,suggesting incomplete evolution in plants.Species specificity was an important factor affecting the evolution of miR168 precursors,while sequence conservation was the main factor affecting the evolution of miR168 matures.The members of miR168-3p were quite specific,whereas the members of miR168-5p were conserved.Mfold and Rfam predicted that the stem sequence of D.officinale miR168 was more conservative than the loop sequence.The precursor sequences had more hairpin structures,and the mature sequences was located on the 3p arm (contains both stem and loop sequences).Both of them contain many light-responsive elements,hormone-responsive elements,and biotic and abiotic stress responsive elements,which might play a regulatory role in the longan response to blue light through these cis-elements.In D.officinale,targets responding to laser both contain ABC transporter B family member 20 and acetyl-CoA acetyltransferase,which are? involved in plant growth,and development,and response to external factors.Real-time quantitative PCR showed that miR168a and its target genes (gene-MA16_Dca006149,gene-MA16_Dca020995,gene-MA16_Dca017821) participate in the effects of blue laser on D.officinale.
Key words? Dendrobium officinale Kimura et Migo; miR168; Evolution; Laser; Real-time quantitative PCR
Received ??2022-09-12??? Returned? 2023-11-06
Foundation item? The Natural Science Foundation of Fujian Province(No.2020J01377);Scale Cultivation and Breeding of Ornamental Bamboo(No.B17000208);the 2023 Special Envoy of Science and Technology of Fujian Province.
First author? LI? Yuqing,undergraduate student.Research area:plant biotechnology.E-mail:3476155755@qq.com
Corresponding?? author? LI Hansheng,doctor,associate professor.Research area:plant biotechnology.E-mail:1456505560@qq.com
(責任編輯:郭柏壽? Responsible editor:GUO Baishou)

