不同油梨品種果面蠟質超微結構和組分分析
薛唯佳 張佳麗 李艷霞 馬蔚紅 劉進平 王甲水 楊宏賓

DOI:10.13925/j.cnki.gsxb.20230565
摘??? 要:【目的】明確不同油梨品種果面蠟質的微觀結構和化學組成,為深入研究蠟質功能提供基礎數據。【方法】以5個不同油梨品種(Peterson、RKYYL6-2、Pollock、Walter Hole和RKYYL8-13)為研究材料,利用阿拉伯樹膠分離果實外蠟,通過三氯甲烷提取果實內蠟,利用掃描電鏡、GC-MS和GC-FID對油梨果面蠟質的超微結構、化學成分及含量進行研究。【結果】油梨蠟質的晶體結構主要為相互堆疊的片狀和顆粒狀。油梨外蠟的化學成分由六大類物質組成,分別為烷烴、醛類、酸類、醇類、甾醇和單酰甘油;除以上物質外,油梨內蠟的化學成分還包括生育酚。5個油梨品種的外蠟含量為0.17~0.87 μg·cm-2,內蠟含量為2.00~8.22 μg·cm-2;其中,RKYYL6-2的外蠟、內蠟含量最低,而Walter Hole的外蠟、內蠟含量最高。進一步對外蠟、內蠟各組分含量在不同品種間進行統計分析,結果表明,Walter Hole外蠟、內蠟中的烷烴(C27除外)、醛類、酸類和醇類含量高于其他品種,且Walter Hole內蠟中的生育酚含量在5個品種中最高;Peterson外蠟、內蠟中的甾醇含量在所有品種中最高;Peterson外蠟中的單酰甘油含量顯著高于其他品種,而Walter Hole內蠟中的單酰甘油含量在5個品種中最高。【結論】油梨蠟質的晶體結構通常為片狀和顆粒狀,不同油梨品種的果實在外蠟、內蠟的含量和化學組成上差異明顯。研究結果為進一步明確油梨蠟質的生物學功能奠定了基礎。
關鍵詞:油梨;果實;表皮蠟質
中圖分類號:S667.9?????????? 文獻標志碼:A??????????? 文章編號:1009-9980(2024)05-0956-12
收稿日期:2023-12-29??????? 接受日期:2024-03-10
基金項目:中央級公益性科研院所基本科研業務費專項(1630092023006);海南省重點研發項目(ZDYF2024XDNY236)
作者簡介:薛唯佳,在讀碩士研究生,研究方向為果樹種質資源精準評價與利用。E-mail:1021573732@qq.com
*通信作者 Author for correspondence. Tel:0898-66961361,E-mail:yanghongbin1993@163.com
果 樹 學 報 2024,41(5): 956-967
Journal of Fruit Science
Ultramicrostructural and compositional analyses of fruit cuticular wax in different avocado varieties
XUE Weijia1, 2, ZHANG Jiali2, LI Yanxia2, MA Weihong2, LIU Jinping1, WANG Jiashui2, YANG Hongbin2*
(1School of Tropical Agriculture and Forestry, Hainan University, Danzhou 571737, Hainan, China; 2Tropical Crops Genetic Resources Institute of Chinese Academy of Tropical Agriculture Sciences, Haikou 571101, Hainan, China)
Abstract: 【Objective】 The fruit surface is covered with the cuticular wax layer composed of very long-chain fatty acids (VLCFA) and their derivatives and alicyclic compounds. The fruit cuticular wax can reduce postharvest water loss, and prevent the invasion of microorganisms and pathogens, playing an important role in the growth, development and post-harvest storage of fruit. Avocado (Persea americana Mill.) is one of the typical climacteric fruit, and postharvest water loss and rot of fruit often occur, causing huge economic losses. However, there have been few reports on the study of avocado fruit cuticular wax. This study aimed to clarify the microstructure and chemical composition of the fruit cuticular wax in different avocado varieties, and provide basic data for further research on the cuticular wax functions. 【Methods】 In this work, 5 avocado varieties (Peterson, RKYYL6-2, Pollock, Walter Hole and RKYYL8-13) were used for the analysis of the fruit cuticular wax. Firstly, we observed the ultrastructure of the avocado fruit cuticular wax using the scanning electron microscope, and then separated and extracted the epicuticular wax and intracuticular wax of the avocado fruit. The extraction methods of the epicuticular wax and intracuticular wax were as follows: firstly the gum arabic was applied evenly on the surface of the avocado fruits to separate the epicuticular wax; then, the fruits were immersed to extract the intracuticular wax of the fruits. The chemical composition and content of epicuticular wax and intracuticular wax of avocado fruit were further analyzed by GC-MS and GC-FID. 【Results】 The observation of scanning electron microscope showed that the cuticular wax crystals on the avocado fruit surface were mainly plates and granules. At ×30 000 and ×100 000 magnification, the plates wax crystals were clearly found on the fruit surface on Peterson and RKYYL6-2. The crystals of the cuticular wax of Pollock were relatively small, but the plates structure could also be observed at ×100 000 magnification. The crystals of the cuticular wax of Walter Hole was relatively large, and the continuous cuticular wax crystals could be observed at ×5000 magnification, and the crystal structure of cuticular wax of Walter Hole was also plates at ×30 000 and ×100 000 magnification. The crystal structure of the cuticular wax of RKYYL8-13 was different from those of the above-mentioned varieties. At ×30 000 and ×100 000 magnification, the crystals of the cuticular wax of RKYYL8-13 appeared granular and closely stacked. Subsequently, we analyzed the content and chemical composition of the epicuticular wax and intracuticular wax of the 5 avocado varieties. The chemical composition of the avocado epicuticular wax consisted of six types of compounds, namely alkanes, aldehydes, fatty acids, alcohols, steroids and monoacylglycerols; besides the above compounds, the chemical composition of the avocado intracuticular wax also included tocopherols. In terms of the carbon chain distribution of each component of the epicuticular wax, the carbon chain numbers of the alkanes included C23, C25, C27, C29 and C31, and the aldehydes were C30 and C32, the fatty acids were C28, C30 and C32, and the alcohols were C26, C28, C30, C32 and C34, the steroids included stigmasterol and β-Sitosterol, and monoacylglycerols included 1-Monopalmitin and 1-Monostearin. Besides the above wax components of the different carbon chain lengths, the intracuticular wax also contained C26 fatty acid, C34 fatty acid, δ-tocopherol, γ-tocopherol and α-tocopherol. In terms of the cuticular wax content, the epicuticular wax content of the 5 avocado varieties ranged from 0.17 to 0.87 μg·cm-2, and the intracuticular wax content ranged from 2.00 to 8.22 μg·cm-2; the content of epicuticular wax and intracuticular wax of the RKYYL6-2 was the lowest among the 5 varieties, while Walter Hole was the highest. In most varieties, the alkane had the highest content among the components of the epicuticular wax and intracuticular wax. The intracuticular wax embedded in the cutin and the epicuticular wax covered the outermost layer and together formed the cuticular wax. In terms of the total cuticular wax (the sum of epicuticular wax and intracuticular wax), the variety with the lowest total cuticular wax content was RKYYL6-2, only 2.17 μg·cm-2; Walter Hole had the highest total wax content, up to 9.09 μg·cm-2; and Peterson, Pollock and RKYYL8-13 had similar total cuticular wax content of 4.13, 4.29 and 4.73 μg·cm-2, respectively. In terms of the proportion of the fruit epicuticular wax and intracuticular wax in the total cuticular wax, among the 5 avocado varieties, the content of the epicuticular wax of avocado only accounted for 8.02%-12.81% of the total wax content, while the content of the intracuticular wax accounted for 87.19%-91.99%. Therefore, the proportion of the intracuticular wax in the total cuticular wax was much higher than that of the epicuticular wax. 【Conclusion】 The crystal structure of avocado wax was usually plates or granular, and different avocado varieties apparently differed in the content and chemical composition of the epicuticular wax and intracuticular wax. The research results would be helpful for further clarification of the biological functions of the cuticular wax of avocado fruits.
Key words: Avocado; Fruit; Cuticular wax
薛唯佳
綠色植物在登陸過程中,為應對陸生環境不利的生存條件,進化出了具有保護作用的蠟質層,它存在于所有陸生植物的地上部分(葉、莖和花等),可有效減少植物非氣孔失水、降低水分蒸騰、提高自身耐旱性;同時,表皮蠟質也在減弱紫外線傷害以及抵抗病蟲害等方面發揮重要作用[1]。植物表皮蠟質由脂肪族物質和脂環族物質組成,其中脂肪族物質主要包括烷烴、醛類、超長鏈脂肪酸、醇類、酮類、酯類等,而脂環族物質由三萜類、生育酚、甾醇等化合物組成[2]。根據存在位置不同,表皮蠟質可分為嵌入角質的內蠟(intracuticular wax)和覆蓋于最外層的外蠟(epicuticular wax)[1],部分外蠟可堆疊組裝成二維和三維結構,在掃描電鏡中呈片狀、棒狀、管狀、顆粒狀等晶體形態[3]。
果實表面同樣覆蓋有蠟質層,且部分呈現出白霜、白粉、光亮等肉眼可見的形態[4]。近年來研究人員對柑橘、蘋果、藍莓、杧果、蔓越莓和番茄等果實的蠟質進行了系統研究,明確了果實蠟質的化學組成、晶體結構和部分生物學功能[5]。在柑橘上,王金秋等[6]分析了3種柑橘類型的果面蠟質,發現其主要化學成分為醛類、烷烴、三萜類、醇類和脂肪酸,蠟質晶體呈倒伏片狀;Yang等[7]進一步通過QTL分析,發現柑橘果面蠟質可減少果實采后失水,延長果實貨架期。在蘋果蠟質的研究中,Chai等[8]對10個蘋果品種的果面蠟質進行測定,發現其蠟質由烷烴、伯醇、脂肪酸等物質組成,晶體結構為有裂縫的片狀、網狀;采后進一步試驗的結果表明,蠟質中烷烴含量對蘋果采后貯藏性能和品質保持有重要作用。在藍莓上,Chu等[9]對藍莓果面蠟質進行研究,發現其蠟質主要成分為三萜類和β-二酮,晶體結構為管狀;Kong等[10]通過采后貯藏研究,發現藍莓果面蠟質能夠減緩果實失水。在芒果中,Wu等[11]對4種杧果果面蠟質進行研究,發現其蠟質晶體呈不規則板狀,主要由初級醇、三萜類和酯類等物質組成,同時發現表皮蠟質能有效阻礙炭疽病菌對杧果的入侵。在蔓越莓中,Croteau等[12]對蔓越莓果面蠟質進行研究,發現其蠟質主要由脂肪酸、烷烴和醛類物質組成;Erndwein等[13]進一步研究發現,蔓越莓果面蠟質可抵御光照脅迫,降低果實日灼病的發病程度。在對番茄的研究中,Leide等[14]發現番茄果面蠟質主要由烷烴、三萜類和甾醇等物質組成;Wu等[15]研究發現番茄果面蠟質中的烷烴對果實采后貯藏保鮮有重要作用。
果實蠟質結構可分為表皮細胞最外層的外蠟和嵌在角質中無定形的內蠟兩層。同一物種中,外蠟和內蠟的化學組成和含量也存在差異。目前,在柑橘、葡萄等果實中已經開展了外蠟和內蠟化學組成的比較分析。王金秋等[6]對柑橘果實的外蠟和內蠟進行比較分析,發現甾醇和三萜類物質主要分布在柑橘內蠟中,外蠟中無法檢測到;烷烴在內蠟中的含量也高于外蠟;而外蠟中伯醇和脂肪酸的占比高于內蠟。Yang等[16]對葡萄果實的外蠟和內蠟也進行了研究,發現三萜類物質主要在葡萄內蠟中,外蠟中三萜類含量較少,而脂肪酸物質主要分布在外蠟中,烷烴類物質在內蠟和外蠟中分布均勻;進一步研究發現,除去外蠟的葡萄果實,經采后貯藏,其外蠟能夠恢復[17]。
油梨(Persea americana Mill.)又稱鱷梨、牛油果,富含不飽和脂肪酸,營養豐富,是風靡全球的健康食品[18]。作為典型的呼吸躍變型果實,油梨采收后,呼吸強度大、代謝速率高[19],失鮮失重和果實腐爛是油梨采后生產面臨的突出問題,造成巨大經濟損失[20-21]。果面蠟質是果實抵御外界不利環境的關鍵屏障,可有效減少果實采后失水,防止病原菌入侵,延長果實貨架期[22]。然而,關于油梨果面蠟質的研究鮮見報道,嚴重制約了油梨采后貯藏保鮮新技術的開發。為此,筆者在本研究中利用掃描電子顯微鏡(SEM)、氣相色譜-質譜聯用儀(GC-MS)和氣相色譜-火焰離子化檢測器(GC-FID),對5個油梨品種果面蠟質的晶體結構、外蠟和內蠟的含量及化學組成進行研究。研究結果加深了對油梨果面蠟質的理解,為進一步確定油梨蠟質的生物學功能及油梨保鮮新技術的開發奠定了基礎。
1 材料和方法
1.1 試驗材料
Peterson、RKYYL6-2、Pollock、Walter Hole和RKYYL8-13均采自位于海南省儋州市的海南省省級油梨種質資源圃,其中Peterson、Pollock、Walter Hole為國外商業品種,RKYYL6-2和RKYYL8-13為海南本地品種。采摘時間為2023年8—9月,各品種均達到商業采摘期。每個油梨品種選取大小均一、無病蟲害、果面光潔的健康果實,收獲后立即運回實驗室,進行下一步試驗處理。
1.2 掃描電鏡觀察
用手術刀在油梨果實赤道部位切取3 mm×3 mm大小的表皮,每個品種取6片,置于裝有2.5%戊二醛固定液的離心管中進行固定。隨后,用不同濃度的乙醇對樣品進行逐級脫水。脫水過程為:用30%、50%、70%的乙醇逐級脫水15 min,用90%的乙醇脫水10 min,用100%的乙醇脫水2次,每次10 min;最后將樣品放于叔丁醇置換液中浸泡3次,每次20 min。脫水干燥后的樣品用EICO IB.5 ION coater鍍上10-20 ?的金顆粒,涂覆75 s。最后用Zeiss Sigma 300場發射掃描電子顯微鏡(SEM)對果面蠟質的超微結構進行觀察。
1.3 果實蠟質的提取
外蠟提取,每個品種選取表面無破損果實15個,每5個果實為1個生物學重復。阿拉伯樹膠粉用三氯甲烷去除雜質后,配成濃度為90%(w/V)的乳濁液,用刷子將其均勻涂在果實表面,放置5 h左右,剝離干燥的阿拉伯樹膠,以上步驟重復1次。收集兩次獲取的阿拉伯樹膠,常溫干燥保存。將所得阿拉伯樹膠研磨均勻,取16 g粉末溶于25 mL蒸餾水中混合均勻,隨后加入75 mL三氯甲烷和200 μL正二十四烷內標(質量濃度為1 mg·mL-1),劇烈震蕩,萃提阿拉伯樹膠中的外蠟。萃提待分層后,取下層三氯甲烷溶液,加入0.2 g無水硫酸鈉,隨后進行過濾。含有外蠟的三氯甲烷溶液在N2下吹干,最后加入100 μL N,O-雙(三甲基硅)三氟乙酰胺(含三甲基氯硅烷)在70 ℃衍生化60 min。接著,在衍生化后的樣品中加入100 μL色譜純的三氯甲烷。用孔徑0.22 μm的針筒微孔尼龍濾膜將上述液體過濾至玻璃內插管中,待上樣。
內蠟提取,每個品種選取表面無破損且已去除外蠟的果實15個,每5個果實為1個生物學重復。將上述去除外蠟的果實置于三氯甲烷中浸提3 min,提取后加入200 mL正二十四烷內標(質量濃度1 mg·mL-1)。最后將含有內蠟的三氯甲烷溶液用N2吹干、衍生化,待上樣。
1.4 果實蠟質的測定與分析
蠟質通過氣相色譜儀器進行定量,測定條件為氣相-色譜火焰離子化檢測器(GC-FID,Agilent 7890B),HP-5MS色譜柱(30 m × 0.25 mm × 0.25 μm),N2為載氣,恒流模式(1.2 mL·min-1),進樣口和檢測器溫度為250 ℃。升溫程序為:初始溫度70 ℃,保持1 min,隨后30 ℃·min-1升高至220 ℃,保持1 min,再以4 ℃·min-1升高至300 ℃,保持14 min,然后再以10 ℃·min-1升高至320 ℃,保持1 min,分流比10∶1,進樣量1 μL。根據內標的含量和峰面積,以及目標物質的峰面積,計算蠟質各組分的含量和總蠟含量。蠟質組分的定性通過氣相色譜-質譜聯用(GC-MS)確定,具體如下:Agilent 7890B-5977A氣質聯用儀,EI離子源(70 eV),掃描范圍50~650 m/z,以氦氣(1.2 mL·min-1)為載氣,色譜柱以及升溫程序等與GC-FID條件一致。果實表面積計算方法如下:將油梨果實的果皮用刀片剝離,描繪在紙上,用掃描儀掃描成圖片,隨后通過Photoshop軟件計算果皮的面積。
1.5 數據統計與分析
采用Excle 2010對數據進行整理與分析,用Origin 2021作圖。所有數據均為3個生物學重復,以平均值±標準差表示。
2 結果與分析
2.1 不同油梨品種果面蠟質的超微結構觀察
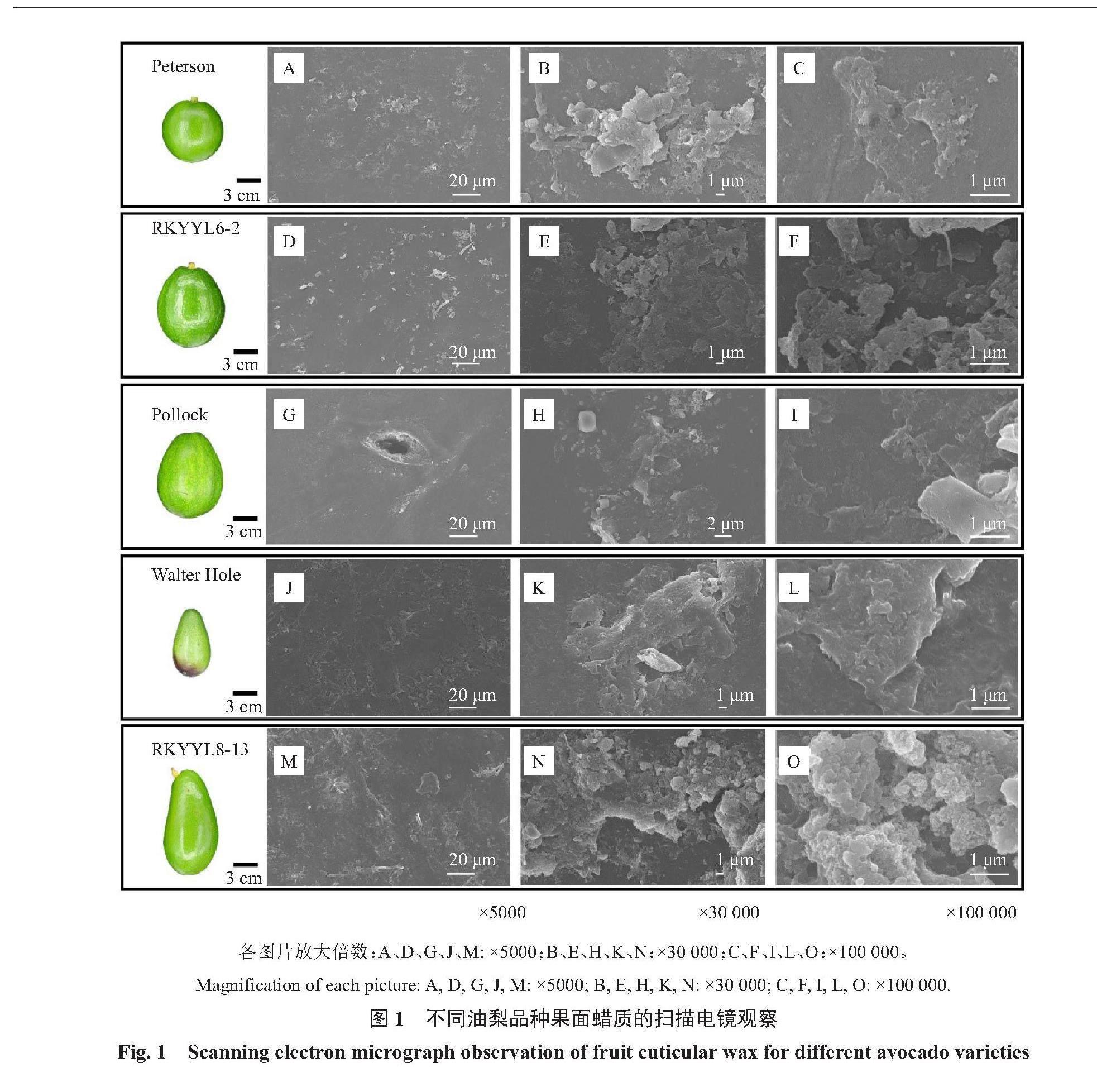
利用SEM對5個油梨品種果實表皮蠟質的超微結構進行觀察,發現油梨果面的蠟質晶體以片狀和顆粒狀為主,且相互堆疊。Peterson、RKYYL6-2在5000倍下能夠看到形似顆粒散落于表面的蠟質晶體(圖1-A、D),在30 000和100 000倍下能清晰地看到片狀蠟質晶體附著于表面(圖1-B、C、E、F);Pollock的晶體顆粒相對較小(圖1-G),但在100 000倍下同樣能夠看到片狀結構的堆疊(圖1-I);Walter Hole的蠟質晶體相對較大,在5000倍下即可看到連片的蠟質晶體,在100 000倍下顯示該品種蠟質的晶體結構也為片狀(圖1-J、K、L);RKYYL8-13的蠟質晶體結構與上述品種略有不同,在30 000和100 000倍的放大倍數下,該品種的蠟質晶體呈現顆粒狀,且緊密堆疊(圖1-M、N、O)。
2.2 不同油梨品種果實外蠟化學成分和含量的比較分析
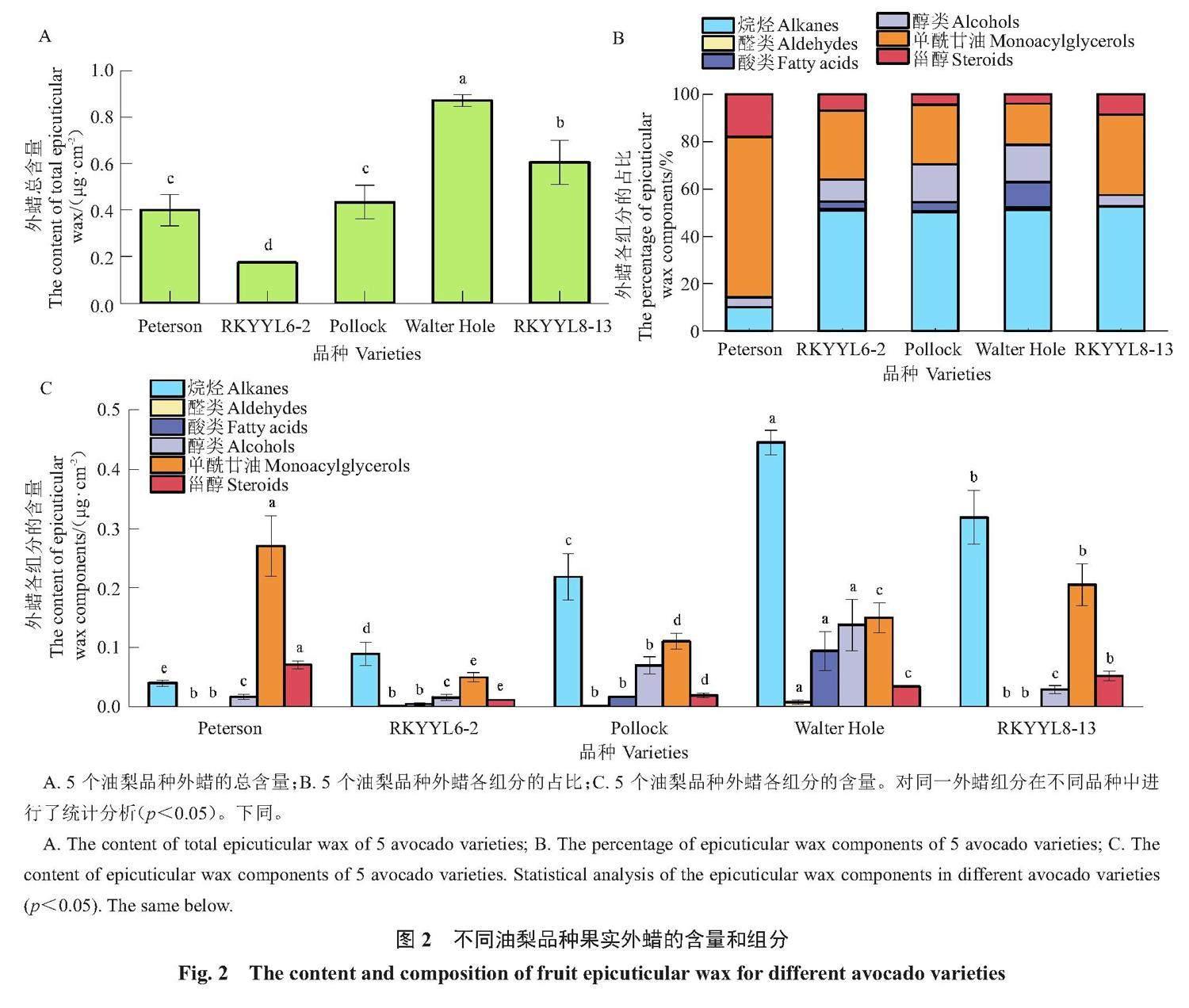
利用阿拉伯樹膠,分離5個油梨品種的果實外蠟,并通過GC-MS和GC-FID對外蠟進行定性和定量分析。結果表明,5個油梨品種的外蠟含量在0.17~0.87 μg·cm-2,通過統計分析發現,Walter Hole的外蠟含量最高,RKYYL8-13的外蠟含量顯著高于Peterson和Pollock,Peterson、Pollock兩者的外蠟含量無顯著差異,RKYYL6-2外蠟含量顯著低于其他品種(圖2-A)。外蠟的化學組分有六大類物質,分別為烷烴、醛類、酸類、醇類、甾醇和單酰甘油(圖2-B~C)。烷烴的碳鏈數包括C23、C25、C27、C29和C31,醛類的碳鏈數為C30和C32,酸類的碳鏈數為C28、C30和C32,醇類的碳鏈數為C26、C28、C30、C32和C34,甾醇包括豆甾醇(stigmasterol)和谷甾醇(β-sitosterol),單酰甘油包括單軟脂酸甘油酯(1-monopalmitin)和單硬脂酸甘油酯(1-monostearin)(表1)。
各品種外蠟含量和組分的具體信息如下:Peterson的外蠟含量為0.40 μg·cm-2(圖2-A),外蠟中未檢測到酸類和醛類,僅有烷烴、甾醇、單酰甘油、醇類,其中單酰甘油占該品種總外蠟含量的67.66%(圖2-B);另外,在5個油梨品種的外蠟中,只有Peterson檢測到了C23烷烴(表1)。RKYYL6-2的外蠟含量為0.17 μg·cm-2(圖2-A),是外蠟含量最低的一個品種,該品種外蠟的主要組分為烷烴和單酰甘油,兩者占比接近80%,而甾醇、醇類、酸類、醛類四大類物質的總占比僅為20%左右(圖2-B);此外,該品種的外蠟僅檢測到1種酸類(C30),在5個品種中脂肪酸種類最少(表1)。Pollock的外蠟含量為0.44 μg·cm-2(圖2-A),其中烷烴和單酰甘油為Pollock外蠟的主要成分,占比分別為50.23%和25.31%(圖2-B)。Walter Hole的外蠟含量為0.87 μg·cm-2(圖2-A),在5個品種中外蠟含量最高,其外蠟主要成分為烷烴、單酰甘油、醇類和酸類,以上物質占該品種總外蠟含量的95.09%(圖2-B)。RKYYL8-13的外蠟含量為0.61 μg·cm-2(圖2-A),外蠟主要成分為烷烴、單酰甘油、醇類和甾醇,該品種中未檢測到醛類和酸類(圖2-B和表1)。
進一步對同一外蠟組分在5個油梨品種間的差異進行了統計分析(圖2-C)。通過方差分析和多重比較發現,外蠟中的烷烴含量在5個品種間均有顯著差異,從高到低依次為Walter Hole、RKYYL8-13、Pollock、RKYYL6-2和Peterson;對于醇類物質,Walter Hole中的含量為0.14 μg·cm-2,顯著高于其他4個品種,Pollock外蠟中醇類含量顯著高于Peterson、RKYYL6-2和RKYYL8-13,且Peterson、RKYYL6-2和RKYYL8-13三者間醇類含量無顯著差異。Peterson的甾醇和單酰甘油含量均顯著高于其他品種,RKYYL6-2中甾醇和單酰甘油物質含量顯著低于其他4個品種;對于酸類和醛類物質,Walter Hole的含量顯著高于其他品種,而Peterson、RKYYL6-2、Pollock和RKYYL8-13的酸類和醛類含量很低,且經統計分析發現,這4個品種間醛類和酸類含量均無顯著差異。
同時對不同碳鏈長度外蠟各組分的含量在5個油梨品種間進行了比較分析(表1)。結果表明,烷烴中只有C27、C29和C31在所有油梨品種中能夠檢測到,其中C27烷烴在RKYYL8-13中含量顯著高于其他4個品種,為0.092 μg·cm-2,Peterson中C27烷烴的含量顯著低于其他品種,僅有0.010 μg·cm-2,Pollock、Walter Hole的C27烷烴含量沒有顯著差異;對于C29和C31烷烴,Walter Hole顯著高于其他品種,含量分別為0.179 μg·cm-2和0.157 μg·cm-2,Peterson中C29和C31烷烴含量顯著低于其他品種。醇類物質的主要成分為C30、C32,Walter Hole和Pollock中C30醇、C32醇的含量顯著高于其他3個品種。對于醛類(C30和C32)和酸類(C28、C30和C32),Walter Hole中的含量最高,顯著高于其他品種。對于甾醇和單酰甘油物質,Peterson的豆甾醇、谷甾醇、單軟脂酸甘油酯和單硬脂酸甘油酯物質含量均顯著高于其他品種,而RKYYL6-2中上述物質的含量在所有品種中最低。
2.3 不同油梨品種果實內蠟化學成分和含量的比較分析
對除去外蠟的果實用三氯甲烷進行浸泡,進一步提取并分析了油梨果實內蠟的化學組分和含量。結果表明,5個油梨品種的內蠟含量在2.00~8.22 μg·cm-2。通過統計分析發現,RKYYL6-2的內蠟含量最低,Walter Hole的內蠟含量最高,Peterson、Pollock和RKYYL8-13的內蠟含量接近,且三者間無顯著差異(圖3-A)。內蠟的化學組分有七大類物質,分別為烷烴、醛類、酸類、醇類、甾醇、單酰甘油和生育酚(圖3-B~C)。與外蠟組分相比,油梨內蠟中含有3種生育酚,分別為δ-tocopherol、γ-tocopherol、α-tocopherol;其余六大類物質各組分的碳鏈長度分布與外蠟組分基本一致(表2)。
各品種內蠟含量和組分的具體信息如下:Peterson和Pollock的內蠟含量接近,分別為3.73 μg·cm-2和3.85 μg·cm-2(圖3-A),但兩者內蠟各組分的含量和比例有所不同,Peterson內蠟中烷烴的含量和比例低于Pollock,但甾醇和單酰甘油的含量和比例高于Pollock(圖3-B~C);Pollock內蠟中的醛類包括C30和C32,而Peterson僅有C32(表2)。RKYYL6-2的內蠟含量為2.00 μg·cm-2(圖3-A),在5個品種中內蠟含量最低,其內蠟的主要組分為烷烴、生育酚和甾醇,三者總占比為80.83%(圖3-B);RKYYL6-2的內蠟中酸類只檢測到C28和C30兩種(表2)。在5個油梨品種中,Walter Hole的內蠟含量最高(8.22 μg·cm-2)(圖3-A),其內蠟的主要成分為烷烴和單酰甘油,兩者占比分別為31.46%和31.53%(圖3-B),Walter Hole內蠟中單酰甘油的占比在5個品種中最高。RKYYL8-13的內蠟含量為4.13 μg·cm-2(圖3-A),其內蠟組成中烷烴的占比高達48.64%(圖3-B),在5個品種中烷烴占比最高(圖3-B);另外,該品種中的醛類也僅含有C32(表2)。
進一步對同一內蠟組分在5個油梨品種間的差異進行了統計分析(圖3-C)。通過方差分析和多重比較發現,對于內蠟中的烷烴含量,Walter Hole和RKYYL8-13兩者無顯著差異,且顯著高于其他3個品種,RKYYL6-2中烷烴含量低于其他4個品種,Peterson和Pollock的烷烴含量無顯著差異;對于醛類、酸類、醇類、單酰甘油和生育酚物質,Walter Hole中的含量均顯著高于其他品種;對于甾醇物質,RKYYL6-2的含量僅為0.51 μg·cm-2,低于其他品種,Peterson、Pollock、Walter Hole和RKYYL8-13四者間甾醇含量無顯著差異。
同時對不同碳鏈長度內蠟各組分的含量在5個油梨品種間進行了比較分析(表2)。結果表明,烷烴物質主要成分為C27和C29,其中C27烷烴在RKYYL8-13中的含量顯著高于其他品種,為0.812 μg·cm-2,RKYYL6-2的含量為0.114 μg·cm-2,在所有品種中含量最低;對于C29烷烴,Walter Hole的含量為1.392 μg·cm-2,顯著高于其他4個品種,Pollock和RKYYL8-13兩者間無顯著差異,但顯著高于Peterson和RKYYL6-2。對于醛類(C30和C32)、酸類(C26、C28、C30和C32)、醇類(C30和C32)和單酰甘油(單軟脂酸甘油酯和單硬脂酸甘油酯物質),Walter Hole中的含量在所有品種中最高;經統計分析發現,除C28酸外,其余物質在Walter Hole中的含量均顯著高于其他品種。對于甾醇物質,Peterson和Pollock中豆甾醇的含量無顯著差異,但顯著高于RKYYL6-2、Walter Hole和RKYYL8-13這3個品種;對于谷甾醇(β-Sitosterol)物質,5個品種間均無顯著差異。對于生育酚物質,δ-Tocopherol和α-Tocopherol物質在Walter Hole中的含量顯著高于其他品種,其余4個品種無顯著差異;γ-Tocopherol物質含量在Peterson、RKYYL6-2和Pollock中無顯著差異,但RKYYL6-2和Pollock的γ-Tocopherol含量顯著高于Walter Hole和RKYYL8-13。
2.4 不同油梨品種果實總蠟質含量、外蠟內蠟比例的比較分析
嵌入角質的內蠟和覆蓋在最外層的外蠟共同構成植物表皮的蠟質層。圖4-A展示了5個油梨品種的果實總蠟質含量(外蠟和內蠟相加得到)。對5個油梨總蠟含量進行統計學分析發現,Walter Hole的總蠟質含量為9.09 μg·cm-2,顯著高于其他4個品種,RKYYL6-2含量僅為2.17 μg·cm-2,顯著低于其他品種,Peterson、Pollock和RKYYL8-13三者的總蠟含量沒有顯著差異,其含量分別為4.13、4.29和4.73 μg·cm-2。圖4-B展示了5個油梨品種果實外蠟和內蠟在總蠟含量中的占比,油梨外蠟僅占總蠟含量的8.02%~12.81%,而內蠟占總蠟含量的87.19%~91.99%。總之,油梨果實的外蠟、內蠟比例在不同品種間相差不大,且內蠟在總蠟含量中的占比遠高于外蠟。
3 討 論
表皮蠟質層由外蠟和內蠟組成,其中外蠟附著于植物表面,內蠟嵌于角質中,兩者是植物應對環境脅迫、保障自身生長發育的關鍵物理屏障[23]。果、蔬等園藝作物的表皮蠟質與環境直接接觸,是抵御外界不利脅迫的第一道屏障,對生長發育和采后貯藏至關重要[24-25]。不同果蔬表皮蠟質的晶體結構、化學成分和含量差異較大[24-25]。目前,研究人員已經對柑橘、蘋果、梨、枸杞、李、黃瓜、西瓜等眾多果蔬的蠟質開展了研究[5],但關于油梨果面蠟質的描述鮮有報道。筆者在本研究中,首先利用掃描電子顯微鏡對5個油梨品種果面蠟質的超微結構進行了觀察,發現油梨蠟質晶體主要為片狀和顆粒狀,且相互堆疊。果皮蠟質的超微結構形態與蠟質化學成分的組成密切相關。藍莓果實的蠟質晶體呈現為管狀,這與其蠟質的主要成分為β-二酮有關[9]。油梨果面蠟質呈不規則片狀,可能是因為烷烴物質為其主要成分,這與梨[26]和柑橘[27]中的研究一致。筆者進一步對5個不同油梨品種的果面蠟質進行了測定和分析,發現油梨果實的總蠟質含量在2.17~9.09 μg·cm-2,遠低于蘋果(366.00~2 185.00 μg·cm-2)、梨(653.00~1 431.00 μg·cm-2)等果實的蠟質含量,與柑橘(3.80~8.20 μg·cm-2)和番茄(14.60~17.90 μg·cm-2)的蠟質含量接近[5]。同時測定了油梨果面蠟質的化學成分,發現其蠟質由脂肪族化合物和脂環族化合物構成;其中,脂肪族蠟質組分與番茄[14]、蘋果[8]、梨[28]、桃[29]等果實類似,均由烷烴、醛類、酸類、醇類等物質組成,且烷烴的含量最高;而脂環族蠟質的組成與其他果實差別較大。大多數果實的脂環族蠟質以香樹脂醇、羽扇豆醇、熊果酸、齊墩果酸等三萜類物質為主[5],而油梨果實的脂環族物質主要是甾醇(豆甾醇和谷甾醇)和生育酚(α、γ、δ三種構型)兩大類物質,未檢測到三萜類物質。這暗示油梨脂環族蠟質的代謝途徑與其他果實有較大差別,代謝通路差異的原因以及油梨蠟質中甾醇和生育酚的生物學功能有待進一步研究。
前人在試驗中對果面蠟質提取主要采用三氯甲烷、正己烷等有機溶劑直接浸泡的方式[5],但這一方法不能區分外蠟和內蠟。筆者在本研究中,首先使用物理方式將果實外蠟剝離,然后再使用三氯甲烷對果實內蠟進行提取,分別得到了油梨果實的外蠟和內蠟。對油梨外蠟和內蠟的化學組成進行比較分析,發現兩者的脂肪族化合物成分相近,但脂環族物質的組成成分不同。油梨外蠟中的脂環族物質僅有甾醇類物質,其含量占外蠟總量的3.93%~17.91%;而油梨內蠟的化學成分中,甾醇和生育酚均可檢測到,兩者占比高達18.65%~51.01%。在柑橘果實的蠟質中,也存在類似現象。王金秋等[5]報道了柑橘果面外蠟、內蠟的化學組成,發現三萜和甾醇類物質僅存在于總蠟中,外蠟中未檢測到。根據已有的研究和報道,蠟質的化學組成、外蠟和內蠟的比例等因素直接影響表皮蠟質的水分滲透性和抗病性等生物學功能[30-31]。油梨外蠟和內蠟的化學成分存在差異,由此引起的兩者生物學功能上的差異值得進一步研究。
4 結 論
通過對5個油梨品種的果面蠟質進行觀察和分析,發現油梨的蠟質晶體以片狀和顆粒狀為主,5個品種的總蠟質含量在2.17~9.09 μg·cm-2,蠟質的化學成分主要為烷烴、醛類、酸類、醇類、單酰甘油、甾醇和生育酚。筆者在本研究中對油梨蠟質的超微結構、化學成分和含量進行了初步分析,為后續油梨蠟質生物學功能及合成代謝的研究提供了參考和基礎數據。
參考文獻 References:
[1]?? YEATS T H,ROSE J K C. The formation and function of plant cuticles[J]. Plant Physiology,2013,163(1):5-20.
[2]?? SAMUELS L,KUNST L,JETTER R. Sealing plant surfaces:Cuticular wax formation by epidermal cells[J]. Annual Review of Plant Biology,2008,59:683-707.
[3]?? BARTHLOTT W,MAIL M,BHUSHAN B,KOCH K. Plant surfaces:Structures and functions for biomimetic innovations[J]. Nano-Micro Letters,2017,9(2):23.
[4]?? KOCH K,ENSIKAT H J. The hydrophobic coatings of plant surfaces:Epicuticular wax crystals and their morphologies,crystallinity and molecular self-assembly[J]. Micron,2008,39(7):759-772.
[5]?? WU W J,JIANG B,LIU R L,HAN Y C,FANG X J,MU H L,FARAG M A,SIMAL-GANDARA J,PRIETO M A,CHEN H J,XIAO J B,GAO H Y. Structures and functions of cuticular wax in postharvest fruit and its regulation:A comprehensive review with future perspectives[J]. Engineering,2023,23:118-129.
[6]?? 王金秋,何義仲,徐坤洋,羅懌,盛玲,羅燾,劉歡,程運江. 三種類型柑橘成熟果實表面蠟質分析[J]. 中國農業科學,2016,49(10):1936-1945.
WANG Jinqiu,HE Yizhong,XU Kunyang,LUO Yi,SHENG Ling,LUO Tao,LIU Huan,CHENG Yunjiang. Characterization of mature fruit surface waxes of three cultivated citrus species[J]. Scientia Agricultura Sinica,2016,49(10):1936-1945.
[7]?? YANG H B,ZHU Z F,ZHANG M F,LI X,XU R W,ZHU F,XU J,DENG X X,CHENG Y J. QTL analysis reveals reduction of fruit water loss by NAC042 through regulation of cuticular wax synthesis in citrus fruit[J]. Horticultural Plant Journal,2022,8(6):737-746.
[8]?? CHAI Y F,LI A,WAI S C,SONG C C,ZHAO Y Y,DUAN Y Q,ZHANG B Q,LIN Q. Cuticular wax composition changes of 10 apple cultivars during postharvest storage[J]. Food Chemistry,2020,324:126903.
[9]?? CHU W J,GAO H Y,CAO S F,FANG X J,CHEN H J,XIAO S Y. Composition and morphology of cuticular wax in blueberry (Vaccinium spp.) fruits[J]. Food Chemistry,2017,219:436-442.
[10] KONG Q,LIU R L,WU W J,FANG X J,CHEN H J,HAN Y C,CHEN J Y. Cuticular wax triterpenes maintain storage quality of blueberries by reducing water loss[J]. Foods,2023,12(14):2643.
[11] WU J B,YOU Y Q,WU X,LIU F,LI G P,YIN H,GU C,QI K J,WEI Q,WANG S B,YAO Q S,ZHAN R L,ZHANG S L. The dynamic changes of mango (Mangifera indica L.) epicuticular wax during fruit development and effect of epicuticular wax on Colletotrichum gloeosporioides invasion[J]. Frontiers in Plant Science,2023,14:1264660.
[12] CROTEAU R,FAGERSON I S. The chemical composition of the cuticular wax of cranberry[J]. Phytochemistry,1971,10(12):3239-3245.
[13] ERNDWEIN L,KAWASH J,KNOWLES S,VORSA N,POLASHOCK J. Cranberry fruit epicuticular wax benefits and identification of a wax-associated molecular marker[J]. BMC Plant Biology,2023,23(1):181.
[14] LEIDE J,HILDEBRANDT U,VOGG G,RIEDERER M. The positional sterile (ps) mutation affects cuticular transpiration and wax biosynthesis of tomato fruits[J]. Journal of Plant Physiology,2011,168(9):871-877.
[15] WU H Q,LIU L,CHEN Y F,LIU T X,JIANG Q Q,WEI Z Y,LI C L,WANG Z H. Tomato SlCER1–1 catalyzes the synthesis of wax alkanes,increasing drought tolerance and fruit storability[J]. Horticulture Research,2022,9:uhac004.
[16] YANG M Y,LUO Z S,GAO S N,BELWAL T,WANG L,QI M,BAN Z J,WU B,WANG F Z,LI L. The chemical composition and potential role of epicuticular and intracuticular wax in four cultivars of table grapes[J]. Postharvest Biology and Technology,2021,173:111430.
[17] YANG M Y,LUO Z S,LI D,MA C,LI L. Role of epicuticular wax involved in quality maintenance of table grapes:Evidence from transcriptomic data[J]. Postharvest Biology and Technology,2023,196:112155.
[18] ARA?JO R G,RODRIGUEZ-JASSO R M,RUIZ H A,PINTADO M M E,AGUILAR C N. Avocado by-products:Nutritional and functional properties[J]. Trends in Food Science & Technology,2018,80:51-60.
[19] 王瑩,黃烈健,黃雪梅,張昭其,陳祖旭. 油梨貯藏保鮮技術研究進展[J]. 廣東農業科學,2010,37(8):167-169.
WANG Ying,HUANG Liejian,HUANG Xuemei,ZHANG Zhaoqi,CHEN Zuxu. Research progress on the storage of avocado fruit[J]. Guangdong Agricultural Sciences,2010,37(8):167-169.
[20] SAUCEDO-POMPA S,ROJAS-MOLINA R,AGUILERA-CARB? A F,SAENZ-GALINDO A,DE LA GARZA H,JASSO-CANT? D,AGUILAR C N. Edible film based on candelilla wax to improve the shelf life and quality of avocado[J]. Food Research International,2009,42(4):511-515.
[21] 潘永貴. 果實表皮組織對采后失水影響研究進展[J]. 廣東農業科學,2023,50(10):1-10.
PAN Yonggui. Research progress in the effects of epidermal tissue on postharvest fruit water loss[J]. Guangdong Agricultural Sciences,2023,50(10):1-10.
[22] LIU G S,LI H L,PENG Z Z,LIU R L,HAN Y C,WANG Y X,ZHAO X D,FU D Q. Composition,metabolism and postharvest function and regulation of fruit cuticle:A review[J]. Food Chemistry,2023,411:135449.
[23] LEWANDOWSKA M,KEYL A,FEUSSNER I. Wax biosynthesis in response to danger:Its regulation upon abiotic and biotic stress[J]. The New Phytologist,2020,227(3):698-713.
[24] 龔成勝,劉文革. 蔬菜作物果實和葉片表皮蠟質研究進展[J]. 中國瓜菜,2019,32(5):1-6.
GONG Chengsheng,LIU Wenge. Research progress on epidermis wax in fruits and leaves of vegetable crops[J]. China Cucurbits and Vegetables,2019,32(5):1-6.
[25] TRIVEDI P,NGUYEN N,HYKKERUD A L,H?GGMAN H,MARTINUSSEN I,JAAKOLA L,KARPPINEN K. Developmental and environmental regulation of cuticular wax biosynthesis in fleshy fruits[J]. Frontiers in Plant Science,2019,10:431.
[26] WU X,YIN H,CHEN Y Y,LI L,WANG Y Z,HAO P P,CAO P,QI K J,ZHANG S L. Chemical composition,crystal morphology and key gene expression of cuticular waxes of Asian pears at harvest and after storage[J]. Postharvest Biology and Technology,2017,132:71-80.
[27] WANG J Q,HAO H H,LIU R S,MA Q L,XU J,CHEN F,CHENG Y J,DENG X X. Comparative analysis of surface wax in mature fruits between Satsuma mandarin (Citrus unshiu) and ‘Newhall navel orange (Citrus sinensis) from the perspective of crystal morphology,chemical composition and key gene expression[J]. Food Chemistry,2014,153:177-185.
[28] WU X,YIN H,SHI Z B,CHEN Y Y,QI K J,QIAO X,WANG G M,CAO P,ZHANG S L. Chemical composition and crystal morphology of epicuticular wax in mature fruits of 35 pear (Pyrus spp.) cultivars[J]. Frontiers in Plant Science,2018,9:679.
[29] BELGE B,LLOVERA M,COMABELLA E,GRAELL J,LARA I. Fruit cuticle composition of a melting and a nonmelting peach cultivar[J]. Journal of Agricultural and Food Chemistry,2014,62(15):3488-3495.
[30] WANG X Y,KONG L Y,ZHI P F,CHANG C. Update on cuticular wax biosynthesis and its roles in plant disease resistance[J]. International Journal of Molecular Sciences,2020,21(15):5514.
[31] JETTER R,RIEDERER M. Localization of the transpiration barrier in the epi- and intracuticular waxes of eight plant species:Water transport resistances are associated with fatty acyl rather than alicyclic components[J]. Plant Physiology,2016,170(2):921-934.

