基因沉默番木瓜環斑病毒復制酶基因(PRSV-Nib)獲得抗病毒病番木瓜的研究
吳清鏵 賈瑞宗 郭靜遠 楊牧之 胡玉娟 郝志剛 趙輝 郭安平
關鍵詞:番木瓜;番木瓜環斑病毒;Nib 基因;RNA 介導的病毒抗性
中圖分類號:S436.67 文獻標志碼:A
番木瓜(Carica papaya L.)是熱帶和亞熱帶地區重要的經濟水果之一,其富含豐富的營養價值與潛在的醫療價值,深受大眾喜愛。番木瓜最主要的病害是番木瓜環斑病毒病(Papaya ringspotvirus, PRSV)[1-2],對番木瓜產業造成重大打擊。傳統的病毒防治措施如交叉保護[3-4],田間綜合管理[5],傳播媒介防治[6-7],以及抗病育種[8-9]在一定程度上阻止了病毒的傳播,但這并不足以避免農業生產上的損失[10]。通過基因工程提高番木瓜的抗病能力,使得轉基因番木瓜成為早期商業化種植的成功案例之一。
根據“致病菌衍生的抗病性(pathogen-derivedresistance, PDR)”原理,第一例夏威夷抗病毒的轉基因番木瓜問世,PDR 的抗病育種策略是轉錄后基因沉默(post-transcriptional gene silencing,PTGS)[11-12]。RNA 干擾(RNAi)是表現在轉錄水平上的基因沉默[13],已被證明在病毒防御反應中發揮作用,并已成功地作為生物技術工具用于轉基因植物的病毒抗性。RNAi 是一種由小RNA介導的基因表達調控機制。RNAi 過程涉及3 個基本特征:雙鏈RNA(dsRNA)誘導,dsRNA被切割成21~25 個核苷酸大小的小干擾RNA(siRNA)[14-15],以及siRNA 被整合到RNA 誘導沉默復合物(RNA-induced silencing complex,RISC)中進行序列特異性降解[16]。通過使用RNAi技術,針對目標mRNA 的外源性雙鏈RNA,抑制了靶基因的表達水平。由于外源序列并未表達產物,RNA 介導的病毒抗性具有生物安全優勢,且降低了引入外源基因植株帶來的風險[17]。
通過轉病毒外殼蛋白(coat protein, CP)基因在植物中表達而產生抗病性[18-20]。然而,外殼蛋白基因可能與自然界中的其他病毒或致病因子重組成新的致病因子產生可傳播和流行的危險病毒[21-22]。復制酶(nuclear inclusion b, Nib)基因是一種依賴于病毒RNA 的RNA 聚合酶(RNAdependentRNA polymerase, RdRp)[23],用病毒復制酶轉化植物已被證明可以產生穩定高效的抗性,通過與復制酶mRNA 結合[24],阻斷病毒mRNA 的復制或使病毒mRNA 通過RNAi 衰減直接影響病毒RNA 的復制[25],是獲得病毒抗性植物有效的方法。目前通過轉病毒Nib 基因使作物獲取抗性的方法被廣泛運用于大豆[26]、小麥[27-28]、豌豆[29]、煙草[24, 30]、芥菜[25]、大白菜[31]等作物。
前期工作發現,海南番木瓜環斑病毒遺傳多樣性差異較大[32],大規模種植單一抗性的轉基因番木瓜很容易促進靶標病毒的突變,導致抗性喪失。本團隊前期已經獲得1 個基于番木瓜外殼蛋白基因沉默番木瓜株系的培育并驗證具有一定抗性[33-34],建立基于多目標基因的沉默(CP+Nib)來提高番木瓜的廣譜抗性,以期應對靶標病毒的突變以及遺傳多樣性。因此本研究在前期工作的基礎上,采取了對Nib 基因沉默的策略創制番木瓜新品系,并驗證其抗病性,積累抗病新資源。
1 材料與方法
1.1 材料
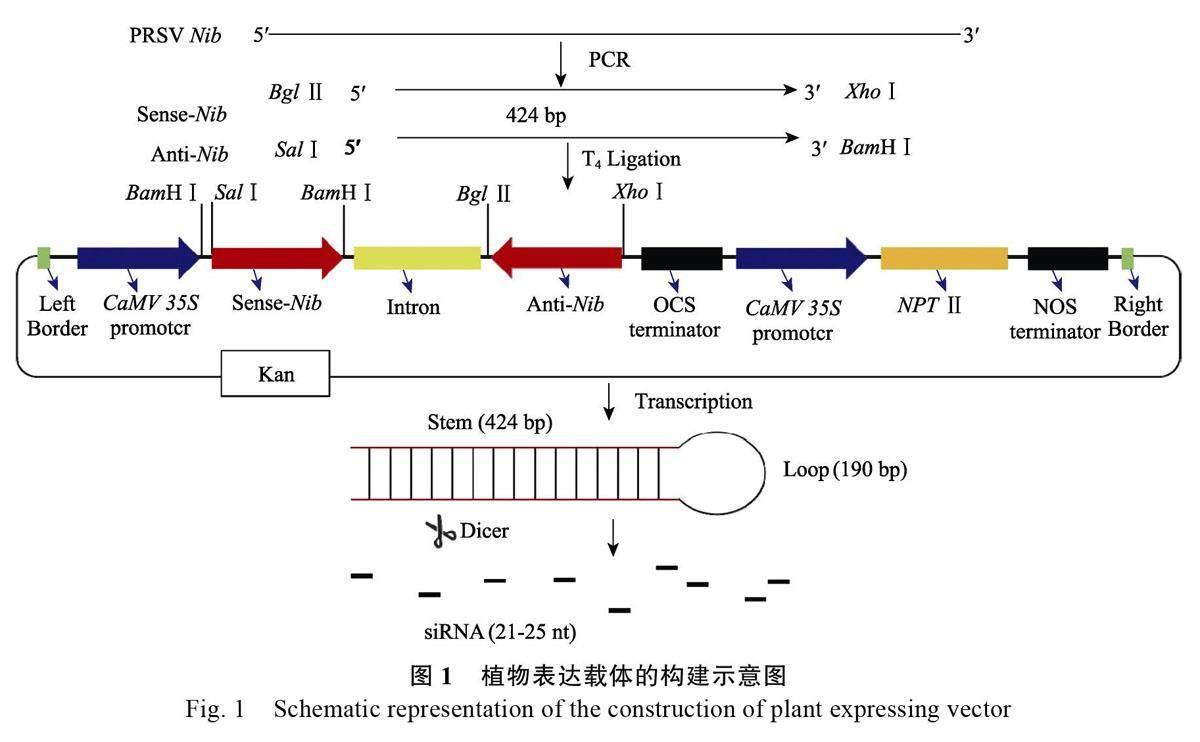
受體材料選擇番木瓜品種穗中紅48,由廣州市果樹研究所惠贈。遺傳轉化方法及再生苗由本實驗室提供[32-34]。大腸桿菌DH5α 購自Sangon 公司(B528413),農桿菌GV3101 由本實驗室保存。載體采用新霉素磷酸轉移Ⅱ 基因( NeomycinphosphotransferaseⅡ,NPTⅡ)作為標記基因,抗生素為卡那霉素(50 mg/L)。載體構建如圖1。
試劑與儀器:植物總RNA 抽提純化試劑盒(TIANGEN,DP441-H)、多糖多酚植物基因組DNA 提取試劑盒(TIANGEN,DP360)、FastKingRT Kit(TIANGEN,KR116)用于核酸提取試驗;瓊脂糖凝膠DNA 回收試劑盒(Sangon,B511139)、質粒小提試劑盒(Omega,D6943-100T)、pUCm-Tvector(Sangon,B620435)、IPTG 溶液(Sangon,B541007)、X-Gal 溶液(Sangon,B541006)用于hiTAIL-PCR 驗證轉化插入的位點實驗,其他常用試劑為國產分析純。超微紫外分光光度計(倍輝,DS-11)、冷凍型離心機(Therom Fisher,Micro21R)用于核酸提取、質粒提取;PCR 儀(AnalytikJena AG,TAdvanced 96SG)用于陽性株系的篩選;電泳儀( 北京君意東方電泳設備有限公司,JY600E)用于PCR 檢驗;化學發光成像系統用于凝膠回收(Azure,C300);控溫搖床用于大腸桿菌轉化(IKA,4000i);電熱恒溫水浴箱用于大腸桿菌轉化(上海一恒,DK-8D)。
1.2 方法
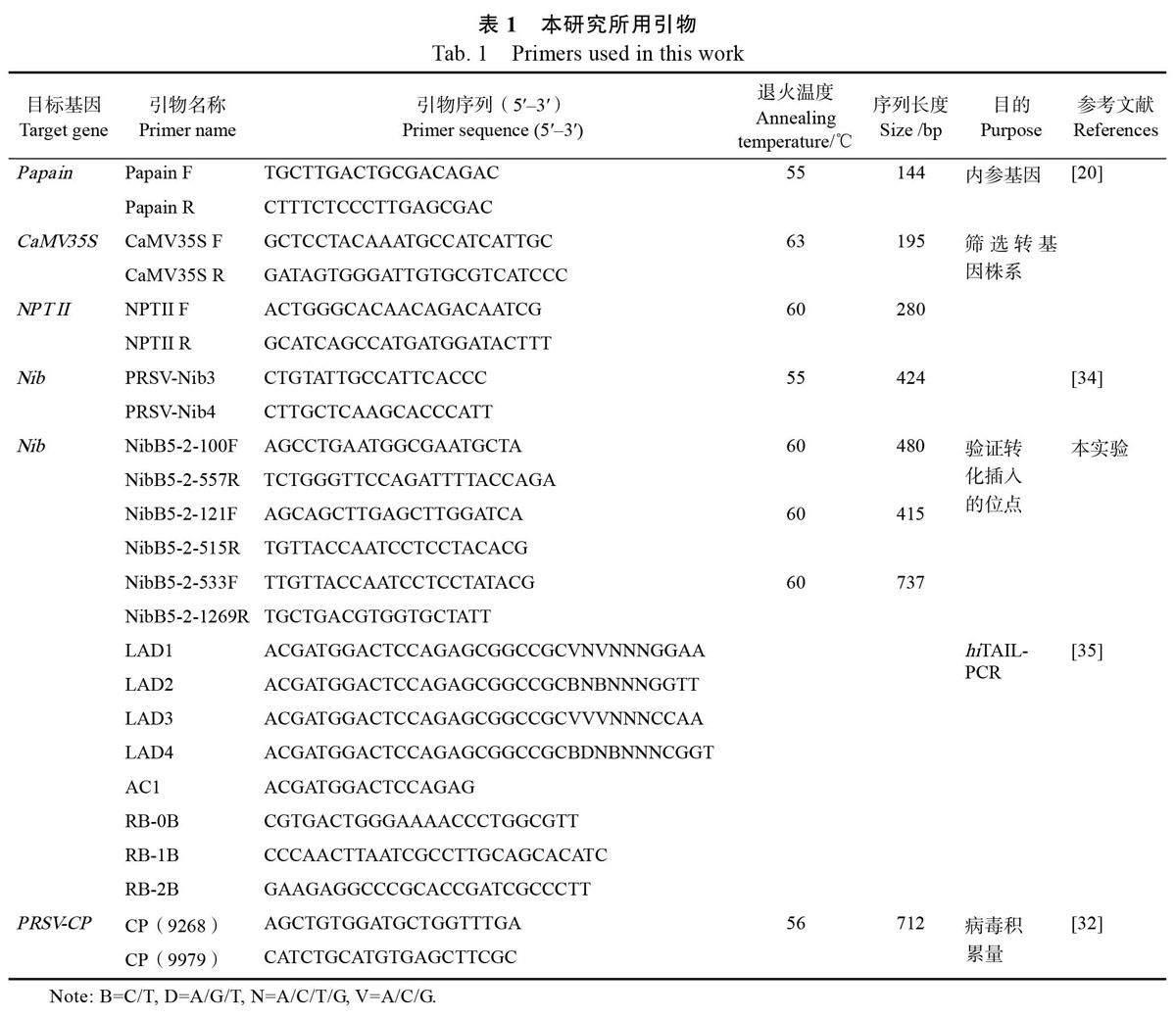
1.2.1 引物合成 引物設計使用NCBI 在線引物設計工具(https://www.ncbi.nlm.nih.gov/tools/primerblast/)在插入位點上游286 bp 處設計驗證引物NibB5-2-533F,在插入位置的下游451 bp 處設計驗證引物Nibb5-2-1269R;在插入位點上游和載體上設計2 對嵌合引物NibB5-2-100F/NibB5-2-557R和NibB5-2-121F/NibB5-2-515R,用于插入位點的驗證。引物及探針序列見表1,引物合成以及DNA測序均由北京六合華大基因科技有限公司完成。
1.2.2 核酸提取方法(DNA/RNA) 將0.2 g 新鮮番木瓜葉片在液氮中充分研磨后,使用植物基因組提取試劑盒提取植物總DNA,用于轉化特異性PCR 進行陽性轉化株的篩選,通過1.0%瓊脂糖凝膠電泳檢測DNA 的完整性,并利用紫外分光光度計測定DNA 濃度和純度,–20 ℃保存備用。將50 mg 的番木瓜葉片在液氮充分研磨后使用植物總RNA抽提純化試劑盒提取植物總RNA,通過1.0%瓊脂糖凝膠電泳檢測RNA 的完整性,利用紫外分光光度計測定RNA 濃度和純度,–80 ℃保存,用于后續研究葉片中PRSV 的病毒積累量。
1.2.3 轉基因植株轉化事件特異性PCR 篩選陽性株系 用轉化事件特異PCR 進行陽性轉化苗的篩選。引物分別是目標基因Nib 引物(PRSV-Nib3/PRSV-Nib4)、轉化事件特異性引物(CaMV35S F/Nib4)和內參引物(Papain F/PapainR)(表1),以陽性質粒為陽性對照(CK+),水為陰性對照(CK–)。PCR 擴增反應體系為:12.5 μL2×Taq master Mix、1.0 μL 上游引物(100 μmoL/L)、1.0 μL 下游引物(100 μmoL/L)、1.0 μL 番木瓜基因組DNA 模板、9.5 μL Nuclease-free water。PCR擴增條件:95 ℃預變性 5 min;95 ℃變性30 s,55 ℃退火30 s,72 ℃延伸30 s,共35 個循環;72 ℃再延伸10 min。反應完畢后,通過1.0%瓊脂糖凝膠電泳后EB 染色,拍照記錄。
1.2.4 hiTAIL-PCR 方法確定轉化株系的插入位點位置 采用高效熱不對稱交互式PCR( highefficiencyTAIL-PCR, hiTAIL-PCR)[35]方法檢測陽性品系插入位點的側翼序列。根據已有報道的研究方法[36]進行PCR 擴增,反應結束后將PCR 產物切膠回收,將回收的目標條帶DNA 與pUCm-Tvector 連接進行克隆載體的轉化,最后通過菌液PCR 挑選每個轉化的3 個重復陽性菌送往北京六合華大基因科技有限公司進行測序。
將獲得的DNA 序列在Phytozome v13.0(https://phytozome.jgi.doe.gov)在線軟件與番木瓜基因組(C. papaya, ASGPBv0.4)進行Blast 比對,以獲得側翼序列確定插入的位點信息。
1.2.5 插入位點驗證 利用引物NibB5-2-533F/Nibb5-2-1269R 驗證插入位點的準確性。使用2 對嵌合引物NibB5-2-100F/NibB5-2-557R 和NibB5-2-121F/NibB5-2-515R 進一步驗證插入位點。PCR 擴增反應體系為:12.5 μL 2×Taq masterMix,1.0 μL 上游引物(100 μmoL/L),1.0 μL 下游引物(100 μmoL/L),1.0 μL DNA 模板,9.5 μLNuclease-free water。PCR 擴增條件:95 ℃預變性5 min;95 ℃變性30 s,60 ℃退火30 s,72 ℃延伸30 s,共35 個循環;72 ℃再延伸10 min。擴增結束后通過1.0%瓊脂糖凝膠電泳后EB 染色,拍照記錄。
1.2.6 不同轉化品系T0 代田間自然抗病評估將轉Nib 基因的T0 代幼苗以及非轉基因對照移栽到田間中國熱帶農業科學院文昌試驗基地(19°32?14.521?N,110°44?51.652?E,具有隔離條件),進行抗病性篩選。分別在移栽3 個月后第90、100、110、120、130、140、150、180、210、240 天觀測和采樣。
1.2.7 T1代植株病毒接種試驗 海南PRSV 病毒活體植株保存于本實驗室。參照黃靜等[33] 的PRSV 制備病毒接種液和接種方法,具體如下:
(1)取含有PRSV 病毒的番木瓜葉樣適量,將感染病毒的葉片和磷酸緩沖液(1×PBS)按照1∶10 的比例(即1 g 葉片,10 mL PBS)混勻后充分研磨至勻漿狀,5000 r/min 離心10 min 后,吸取上清液作為接種液,4 ℃保存備用。
(2)在莖尖向下數第三葉,人工接種PRSV。首先在葉片表面上灑上少許石英砂,用碾磨棒或者指腹由葉脈向葉尖輕輕摩擦,而后滴加10 μL接種液并將其在葉片表面涂抹均勻。
(3)轉基因株系(NibB5-2 T1 代)為實驗組,非轉基因株系(NibB5-5 T1代)為對照組。分別進行病毒接種試驗,只接種緩沖液(不含病毒)的對照試驗,和不接種對照試驗。每種處理設3 個生物學重復。接種病毒后第0、4、8、12、16、20、24、28、32 天觀測發病情況,并取相鄰葉片(莖尖向下數第二葉片)檢測PRSV 病毒積累量。
1.2.8 PRSV 病毒積累量檢測 番木瓜總RNA的提取參見1.2.2,利用FastKing cDNA 第一鏈合成試劑盒以番木瓜總RNA 為模板合成cDNA 第一鏈。反應體系和程序為:2 μL 5×g DNA Buffer、2μL Total RNA、6 μL Nuclease-free water,PCR 儀中42 ℃ 3 min 后,置于冰水混合物中放置3 min。然后加入2 μL 10×King RT Buffer、1 μL FastKingRT Enzyme Mix、2 μL FQ-RT Primer Mix、5 μLNuclease-free water,于42 ℃ 15 min,95 ℃ 3 min,于–20 ℃保存。
使用PRSV-CP 特異性引物進行PCR 檢驗,以病毒接種液作為陽性對照(CK+),無核酸酶水作為陰性對照(CK–)。PCR 擴增反應體系為:12.5 μL2×Taq master Mix、1.0 μL CP(9268)、1.0 μL CP(9979)、1.0 μL cDNA 模板、9.5 μL Nuclease-freewater。PCR 擴增條件:95 ℃預變性5 min;95 ℃變性30 s,56 ℃退火30 s,72 ℃延伸30 s,共35個循環;72 ℃延伸10 min。反應完畢后,通過1.0%瓊脂糖凝膠電泳后EB 染色,拍照記錄。
2 結果與分析
2.1 PCR 篩選陽性轉化株系
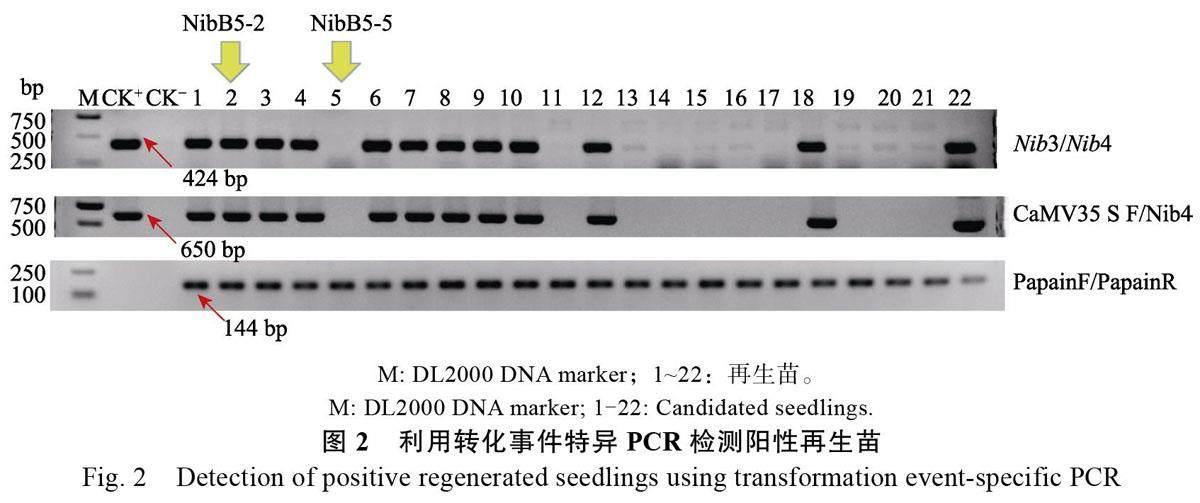
本研究共計獲得52 株已經過抗性篩選的再生苗,用轉化事件特異PCR 對再生苗進行篩選,一共篩選出24 株陽性株系,圖2 為部分篩選結果,選取在田間表現良好、栽培后能正常開花結果、抗性表現較好的T0 代陽性轉化株系代表Nib5-2進行分子特征檢測。
2.2 hiTAIL-PCR 驗證轉化體在番木瓜基因組上的插入位點
NibB5-2 樣品的hiTAIL-PCR 電泳結果如圖3,將測序結果經過Blast 比對,發現插入位點位于2號染色體的supercontig_30.113 的1976766 處,比對的詳細結果為Score=675 bits(748),Expect=0.0Identities=376/377(99%)(圖3)。插入位點上、下游最近的基因距離為3.6 kb,插入位點上游10 kb內有2 個Ankyrin Repeat 家族蛋白(evm.TU.supercontig_30.153、evm.TU.supercontig_30.149),下游10 kb 內有2 個Ankyrin Repeat 家族蛋白(evm.TU.supercontig_30.154、evm.TU.supercontig_30.155)、1 個反轉錄轉座子閉合蛋白(PF03732,evm.TU.supercontig_30.156)和1 個糖基轉移酶(evm.TU.supercontig_30.157)。
插入位點的上游引物NibB5-2-533F 與下游引物Nibb5-2-1269R 在非轉基因番木瓜DNA 中擴增得到預期約737 bp 的產物;而在轉基因株系中,由于外源載體的插入,PCR 產物預計大小為4.2 kb+737 bp(圖4)。將插入位點上游引物NibB5-2-100F/NibB5-2-121F 和載體上的引物NibB5-2-557R/NibB5-2-515R 匹配,擴增番木瓜基因組和載體序列的嵌合產物,在轉基因番木瓜中擴增得到預期大小條帶(480 bp 和415 bp),而在非轉基因番木瓜中未得到擴增產物(圖4)。
2.3 不同轉化株系T0代田間自然發病評估
通過對轉基因和非轉基因株系的田間發病觀測發現,轉Nib 番木瓜株系和非轉基因株系在田間的抗病性差異明顯。非轉基因株系均感病,具體表現為在移苗后第5 個月時表現出病癥,隨著時間的延長,病癥日益明顯,在第6 個月時出現典型病癥如果實上出現環斑(圖5C);轉Nib 番木瓜株系移苗后,植株整體表現健康,一直至第12 個月無明顯癥狀。通過對3~6 個月番木瓜樣品進行病毒積累量的PCR 檢測,NibB5-1 在第151 天開始出現病毒積累,NibB5-2 在第151 天開始出現病毒積累,NibB5~9 在第112 天出現病毒積累,非轉基因對照NibB5-5 在第112 天出現病毒積累(圖5A)。
2.4 轉基因番木瓜T1代抗性評價
轉基因番木瓜NibB5-2 T1代株系和非轉基因對照在接種病毒后32 d 內抗病性差異明顯。3 株接種病毒的對照植株表現一致,在第8 天時表現出病癥,隨著時間的延長,病癥日益明顯,在第24 天時出現病癥典型;同時接種病毒的3 株NibB5-2 T1植株在32 d 內,部分有病毒積累,但表型都正常。9 個采集時間點的植物樣品進行PCR檢測病毒積累量的檢測結果如圖6A。在相同模板量下,對照植株的凝膠檢測灰度呈指數增長趨勢,即隨著時間的延長感染病毒量逐漸遞增,NibB5-2T1代植株基本無變化(圖6B)。
3 討論
PRSV 是海南番木瓜生產的主要制約因素。雖然基于siRNA 和植物人工微RNA(amiRNA)的短發夾RNA(shRNA)可以有效地減少病毒復制,但廣泛的病毒遺傳變異可能會使病毒逃逸[37],PRSV 存在地理分化,各地的病毒株系差異大,在海南不同地區分布的PRSV 病毒株系差異大[32, 38],所以抗PRSV 轉基因番木瓜品種的種植僅限于某些地理區域[39]。RNA 介導的病毒抗性受到入侵病毒與目標轉基因之間序列同源性的影響[40],若siRNA 與其靶標之間存在不匹配,會影響靶標RNA 的識別切割,干擾效應降低,甚至使siRNA失活[41-42]。此外,有研究表明,抗病毒效果可能在于小靶區的同源性而并非全序列的同源性[43-44]。課題組前期通過海南全境內PRSV 遺傳多樣性進行研究發現,不同群體(HainanⅠ,Ⅱ,Ⅲ)[32]還根據RNAi 原理利用海南PRSV-CP 基因保守序列將抗海南番木瓜環斑病毒植物表達載體pCAMBIA2300-35S-CP-RNAi-OCS 轉入番木瓜中,對轉CP 基因番木瓜進行分子特征及抗病毒試驗分析,獲得了具有較好的PRSV 抗性的轉基因株系[33-34]。
在番木瓜中引入1 個發夾結構來靶向PRSVNib,理論上,病毒的RNA 與轉基因的RNA 的靶向方式相同,從而使植物能夠抵抗感染。在本研究中,描述了通過轉化苗進行陽性株系篩選、hiTAIL-PCR 驗證特異插入位點以及轉基因株系抗性試驗,鑒定了1 個抗病毒轉基因番木瓜NibB5-2 的基因組插入和側翼區域,這在轉基因作物的安全性評估和追蹤單個轉基因事件中非常重要[45]。轉基因植株NibB5-2 外源基因未插入到番木瓜編碼基因中,hiTAIL-PCR 顯示插入位點在第2 號染色體的supercontig_30 的1976766 位置,設計特異引物驗證插入位點時發現轉基因植株NibB5-2 為雜合子。轉基因植株NibB5-2 和非轉基因植株NibB5-5 通過田間自然發病試驗,對癥狀進行視覺評估,并使用PRSV(CP)外殼蛋白引物,通過RT-PCR 檢測病毒的存在,結果表明植株NibB5-2 對由病蟲傳播的PRSV 產生了抗性。這是由于轉基因番木瓜植株NibB5-2 體內含有Nib 發夾插入結構,轉入Nib 基因反向重復載體轉錄形成了dsRNA,含有dsRNA 的發夾結構被dicer 酶識別,誘導RNAi 機制的啟動[46],從而有效抑制了在田間PRSV 對番木瓜的危害。在轉基因植株NibB5-2 T1 代和非轉基因植株NibB5-5 T1代植株中進行摩擦接種實驗,在接種后,NibB5-2T1 代植株表現出抗性,T1 代植株中含有Nib 發夾插入,并在大多數情況下表達了該基因,假設RNAi 可以誘導植物的病毒防御,轉基因表達水平足夠強,足以引起影響。由雙鏈反向重復序列莖和單鏈內含子環組成了發夾RNA(hpRNA),雙鏈莖決定了反應的特異性是RNA 沉默的關鍵因素[47],內含子與RNA 沉默雖然沒有直接關系但內含子有利于hpRNA 的形成,提高其穩定性,誘導有效的基因沉默[48]。當莖長為200~800 bp 時,開始出現明顯的沉默, 沉默效率高達60%~80%[49]。
采用RNAi 策略獲得PRSV 抗性,目標基因的小片段可以最大限度地降低重組、轉化、協同作用和互補的風險,且還可避免田間釋放和商業化的潛在風險[50]。含PRSV-Nib 的轉基因番木瓜已遺傳到T1 代,對PRSV 仍具有抗性,可進一步用于抗病育種。為獲得廣譜抗 PRSV 的轉基因植株,還需要通過多代選擇,以此產生更穩定的品系,未來的工作還需要確定這些轉基因植株是否在田間條件和較高溫度下保持表達并提供抗性。

