β-葡萄糖醛酸酶(GUS)在原發性肝內膽管結石形成中的作用
李果 葉海軍 徐至開 李文濤 徐承雷 李江
摘要: 原發性肝內膽管結石 (PIS) 是我國西南地區高發和難治性疾病, 對患者的生活造成極大的影響。膽道系統慢性感染產生的β-葡萄糖醛酸酶等代謝產物, 在色素性結石的形成中起著重要作用, 除細菌產生的外源性β-葡萄糖醛酸酶, 肝內膽管細胞產生的內源性β-葡萄糖醛酸酶在結石的形成中亦扮演重要角色。本文就PIS發病機制中β-葡萄糖醛酸酶的作用研究進展予以分析, 以期為PIS的防治提供可能的方式。
關鍵詞: ?膽石; ?葡萄糖醛酸酶; ?病理過程
基金項目: ?云南省科技廳-高校聯合基金項目 (202101AY070001-129)
Role of β-glucuronidase in the formation of primary intrahepatic stones
LI Guo, ?YE Haijun, ?XU Zhikai, ?LI Wentao, ?XU Chenglei, ?LI Jiang. ?(Department of Hepatobiliary Surgery, ?The First Affiliated
Hospital of Kunming Medical University, ?Kunming 650032, ?China)
Corresponding author: ?LI Jiang, ?13888836057@163.com ?(ORCID: ?0000-0002-6872-9434)
Abstract: Primary intrahepatic stones (PIS) is a refractory disease with a high incidence rate in Southwest China, which greatly affects the life of patients. Metabolites, such as β-glucuronidase produced by chronic biliary tract infection, play an important role in the formation of pigmented stones. In addition to exogenous β-glucuronidase produced by bacteria, endogenous β-glucuronidase produced by intrahepatic bile duct cells also plays an important role in the formation of stones. This article analyzes the research advances in the role of β-glucuronidase in the pathogenesis of PIS, in order to provide a possible method for the prevention and treatment of PIS.
Key words: Gallstones; Glucuronidase; Pathologic Processes
Research funding: Yunnan Province Department of Science and Technology-University Joint Fund Project (202101AY070001-129)
原發性肝內膽管結石(primary intrahepatic stones,PIS), 區別于膽總管結石和膽囊結石, 特指原發于膽總管分叉以上, 肝內膽管近端的結石, 占膽石癥患者的10%~20%[1] 。該病在歐美地區較少見, 在我國長江流域西南地區較為高發。該病本身為良性疾病, 但其發病極其隱匿、 遷延, 能對肝內膽管及肝組織造成嚴重破壞, 當出現癥狀就醫時大多已經伴隨多次膽道感染、 肝細胞損傷、肝纖維化、 增殖性膽管炎甚至癌變。對患者的生活質量和醫療資源的利用效率造成極大的負面影響。該病發病機制的研究目前國內外僅見零星報道, 其中膽道感染后產生的內、 外源性β-葡萄糖醛酸酶 (β-glucuronidase,GUS) 在結石的形成中具有重要作用。本文就GUS在PIS形成中的作用進行綜述, 以期為GUS在PIS發病機制方面的研究探索方向。
1 PIS發病機制及膽道感染與PIS的關系
根據結石成分的不同, PIS可以分為膽色素性、 膽固醇性以及混合性結石, 比例上, PIS絕大多數為膽色素性結石[2] , 而形成機制較為明確的膽囊結石則主要為膽固醇結石[3] , 提示PIS與膽囊結石形成機制存在差異。一般認為, 感染、 膽汁淤積、 膽管解剖以及膽汁代謝異常是該病發病的主要危險因素[4-5] , 此外, 膽道及胃腸道寄生蟲感染、 腸道菌群失調、 飲食習慣、 飲水條件等也被認為和該病相關[6] 。在病理學上, PIS主要的表現為病變肝內膽管上皮慢性炎癥, 膽管上皮腺體增生, 膽管壁纖維化[7]。近來研究[8]發現, 健康膽道系統內并非無菌環境, 可能存在常規菌群定植, 通常認為膽道微環境對大多數細菌都是不利的, 感染治療中不可避免的抗生素應用可能會對正常生理的膽道微生物群檢測產生偏差。但PIS患者膽道內菌群和健康人膽道菌群種類和構成比例存在差異[9] , 因而, 很可能存在致石菌群, 其導致結石形成的機制亦將是研究的重點。
膽道感染主要由細菌和寄生蟲引起。其中, 寄生蟲導致肝內膽管結石的病例相對較少, 華支睪吸蟲和棘口吸蟲可寄生在膽道內, 引起持續性慢性炎癥, 導致膽管的機械性梗阻、 炎癥和膽管周圍纖維化, 而膽管內蠕蟲及其蟲卵通常是炎癥形成的基礎病灶, 刺激上皮細胞增生引起機械性梗阻和杯狀細胞增生引起黏蛋白過表達,成為結石形成的理想條件[10] 。在細菌檢測中, PIS患者膽道樣本主要檢出微生物主要為大腸桿菌、 糞腸球菌、肺炎克雷伯菌、 銅綠假單胞菌[11-12]。Clemente等[13]在73例復雜肝內膽管結石患者的膽汁中分離出上百種微生物, 其中多重耐藥腸球菌、 假單胞菌和大腸桿菌的檢出率分別為43. 9%、 41. 2和20. 6%, 表明細菌感染與結石的形成密切相關, 且常合并多種微生物感染。腸道細菌可通過血行和淋巴管傳播, 也可通過Oddi括約肌進入膽道并引起感染[4] 。在上述3種途徑中, 通過Oddi括約肌上行感染最為重要, 一旦Oddi括約肌的 “門戶” 功能異常或消失, 帶菌小腸液逆流入膽道, 感染膽管黏膜引起膽管炎及一系列下游病理變化。早期的Maki學說[14] 指出膽道感染后細菌分泌的GUS可將結合膽紅素水解成非結合膽紅素和葡萄糖醛酸, 非結合膽紅素再與鈣離子結合而形成膽紅素鈣, 從而在膽汁中析出成為肝內膽管結石的成石核心。而此后的研究發現, 膽道系統內的GUS可分為2類, 一類為腸道菌群微生物分泌, 主要為大腸桿菌, 其次包括脆弱類桿菌和梭形桿菌屬等, 也是肝內致石菌群的主要構成物種[8-9] , 此類菌群直接產生并釋放入膽道的GUS, 稱為外源性或細菌性GUS; 另一類則由機體自身組織細胞受內毒素等刺激后產生釋放的GUS, 主要由肝內膽管上皮細胞合成分泌, 稱為內源性或組織學GUS[15] 。外源性和內源性GUS在肝內膽管結石的形成中扮演重要角色, 尤其是內源性GUS存在時間長, 與結石的復發關系更為密切, 但其具體調控機制尚待研究。
2 GUS的功能及作用
2. 1 維持內源性成分的代謝穩態 GUS屬于兩個糖基水解酶家族2和家族79, 廣泛分布于人和多種腸道細菌中 (人GUS∶hGUS; 腸道細菌GUS∶BGUS)。hGUS主要存在于肝臟、 脾臟、 腸黏膜及胃黏膜上, BGUS主要存在于厚壁菌門、 變形菌門、 疣微菌門和擬桿菌門中[16] 。作為水解酶, GUS可以特異性催化O-或S-糖苷基部分水解,并從糖苷中分離出糖苷元。葡萄糖醛酸化是消除機體內、 外源性生物活性分子的最重要途徑之一, 例如, 甾體激素 (雌、 雄激素)、 神經遞質 (血清素、 兒茶酚胺等)、 膽紅素、 炎性介質等生物活性分子, 通過結合內源性葡萄糖醛酸分子, 生成極性更強、 水溶性更高的代謝物, 促進其從尿液或膽汁中排泄[17] 。
膽紅素作為葡萄糖醛酸化程度最高的內源性分子之一, 分別以單 (約16%)、 雙葡萄糖醛酸結合物 (約80%) 形式存在于健康人膽汁中[18] 。膽紅素葡萄糖醛酸酯被腸道菌群大量代謝為膽色素和尿膽原, 通過腸道上皮細胞重新吸收并進入腸肝循環[19] 。在某些新生兒中, GUS表達增加, 膽紅素被顯著地循環利用, 從而導致高膽紅素血癥[20] 。膽紅素也可以調節腸道微生物群的結構和代謝, 例如, 膽紅素對革蘭陽性菌具有潛在毒性, 可能是對膽紅素的敏感性破壞了細菌膜的完整性、 呼吸代謝和碳水化合物代謝。與革蘭陽性菌相比, 革蘭陰性菌外膜的結構或組成 (內膜和外膜) 可能賦予其抵抗膽紅素嵌入作用的能力, 從而抵抗膽紅素的毒性作用[21] 。另外, BGUS的糖化過程不僅是生物轉化的重要途經, 其產生的葡萄糖醛酸 (glucuronic acid, GlcA) 是維持腸道微生物群生長的碳源。多種腸道細菌已被證實可代謝GlcA, 但利用能力有所差別, 提示GlcA可影響腸道菌群及微環境[17] 。
2. 2 介導外源性成分的體內處置 人類接觸的許多藥物和外源性物質 (如膳食、 環境和工業化學品) 是非極性的親脂化合物。雖然這些化合物的親脂性促進了生物膜的擴散并隨后進入其作用部位, 但同樣的特性阻礙了它們通過腎臟、 腸道從體內消除, 因此利用高極性的GlcA形成親水的葡萄糖醛酸鹽, 轉化為更極性的親水化合物是一種消除途徑和清除機制[17] 。而腸道BGUS的水解可能會增加外源性成分在腸道的重新釋放, 增加胃腸炎癥或癌癥的發生風險。比如晚期結直腸癌患者接受伊立替康治療后發生遲發性腹瀉[22] , 這種毒性是由于其代謝物SN-38葡萄糖醛酸綴合物被BGUS分解而被重新激活而導致, 使其臨床療效受到嚴重限制。與單獨接受伊立替康治療的小鼠相比, BGUS抑制劑具有顯著的抗腹瀉保護作用而不影響療效, 還可以增加腸道微生物的豐富度, 減少變形桿菌水平[23] 。非甾體抗炎藥酮洛芬和吲哚美辛的胃腸道損傷也可以通過選擇性抑制細菌GUS來改善[24] 。目前確定了超過100種藥物經BGUS參與循環。這些藥物包括嗎啡、 雌激素、 布洛芬、 咪達唑侖及其結構類似物[25] 。因此開發有效的、 特異性的、 無細胞毒性的GUS抑制劑對于提高治療藥物的臨床療效和有效的疾病管理是必不可少的。
3 GUS在PIS形成中作用
3. 1 外源性GUS在PIS形成中作用 膽道菌群失調是結石形成的關鍵因素, Chen等[26] 分析了16例復發性膽總管結石患者和44例原發性膽總管結石患者的膽道微生物群, 16S rRNA測序顯示, 在原發性膽總管結石組中普遍存在變形菌門、 厚壁菌門、 擬桿菌門和放線菌門 (均為腸道細菌)。這些數據表明, 膽道微生物群可能起源于腸道微生物群, 并通過十二指腸乳頭進入膽道。總體上, PIS的致石菌群以革蘭陰性桿菌為主, 和腸道菌群有大量重合。感染膽汁中產生大量的BGUS, 促使葡萄糖醛酸綴合物釋放游離膽紅素, 并與鈣進一步沉淀, 形成色素性結石。而結石的形成又使得膽道中大腸桿菌、 克雷伯菌、 屎腸球菌、 擬桿菌等細菌容易聚集繁殖, 導致膽汁中BGUS活性升高[27] , 形成惡性循環。此外, 當某些外源性代謝生物增加 (如伊利替康), 會使腸道內產生更多腸桿菌科細菌, 導致腸道外源性GUS的表達增加[28] ,是否參與色素性結石的形成, 仍需進一步研究。GUS抑制劑能減少膽紅素的腸肝循環[29] , 通過口服GUS抑制劑D-葡萄糖二酸-1, 4-內酯, 檢測發現膽汁中GUS的活性顯著降低。在體外實驗中, 膽紅素鈣在人感染膽汁中孵育的蛔蟲卵表面顯著沉淀, 而加入D-葡萄糖二酸-1, 4-內酯后, 通過抑制BGUS的活性來控制膽汁中膽紅素鈣的分離, 從而明顯減少膽紅素在人膽汁中培養的蛔蟲卵表面的沉淀[14] 。
另外, 腸道細菌產生的脂多糖(LPS)通過 TACE/TGF-α/EGFR和EP4/p38MAPK途徑, 上調黏蛋白 (Mucin,MUC) 基因, 誘導的MUC過表達使膽汁中黏液蛋白的分泌增加, 可能協同GUS的成石作用[30] 。Li等[31] 發現增殖細胞核抗原 (PCNA shRNA) 處理動物膽管炎模型能有效抑制增殖相關基因: PCNA、 Ki-67的mRNA和蛋白表達, 抑制病變膽管壁膽道上皮、 黏膜下腺和膠原纖維的增生行為, 同時酸性黏液腺、 MUC3 RNA的表達和內源性GUS的分泌也被有效抑制。黏蛋白加重膽道梗阻促進結石, 是否需要GUS誘導膽色素鈣形成為結石提供材料; 而GUS致石作用提供的材料, 是否也需要黏蛋白加重膽道梗阻從而才能聚集成石?MUC與GUS是否存相同或相關的調節通路有待進一步研究。
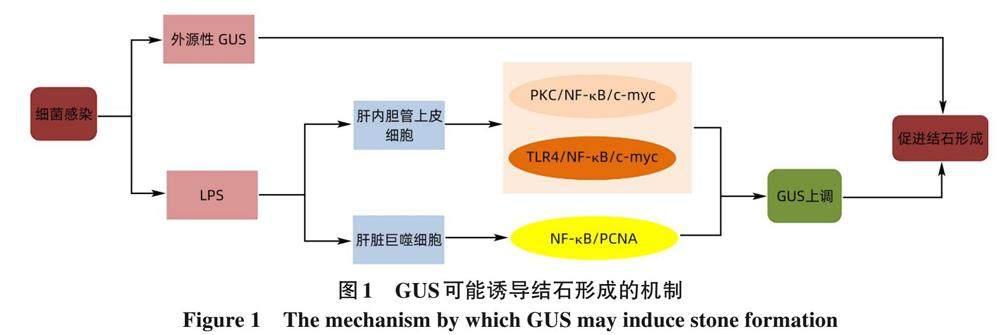
3. 2 內源性GUS在PIS形成中作用 隨著研究的深入,內源性GUS在PIS形成中的作用正逐漸被認識。1987年Oyabu等[32] 發現內源性GUS在結合膽紅素的分解過程中有重要作用, 促進色素性結石的產生, HO等[33] 發現肝內色素性結石患者肝臟組織內源性GUS水平較無結石者高約12倍, 同時, 當pH為4. 6時, 檢測液中有活性的GUS為內源性GUS, 這可能是膽汁感染, 肝細胞受損時,周圍組織pH降低, 激活了內源性GUS的表達來加速生物活性物質的清除。腸道存在大量產生LPS的細菌, 當膽汁反流或細菌移位, 外源性GUS在早期迅速升高, 參與結石的形成。若膽道系統通暢性好, 其內并無致石菌群長期定植, 在致石菌群感染中產生的GUS也可在細菌清除后12 h內隨膽汁排泄清除[34] 。張西波等[35] 通過動物模型發現膽道感染后, 首先外源性GUS增高, 但隨著感染控制和膽汁排空, 外源性GUS活性逐漸下降, 而內源性GUS活性持續增高并維持較長時間, 提示內源性GUS可能在色素結石形成過程中發揮長期作用, 研究內源性GUS的表達、 分泌和活性調控可能對揭示PIS的發生和復發機制更有意義。Yao等[36] 通過免疫組化染色評估了PIS膽管黏膜標本中內源性GUS、 c-myc、 p-p65和p-PKC的表達, 發現與正常肝標本相比PIS區域的膽管黏膜上述分子表型顯著增加。同時, 姚晨輝[37] 通過建立膽管上皮細胞損傷細胞模型研究, 發現 LPS 可通過TLR4/NF-κB/c-myc信號級聯, 誘導肝內膽管上皮細胞表達及分泌內源性GUS。NF-κB通過調節淋巴細胞和淋巴器官的發育和存活, 從而控制免疫應答、 惡性轉化、 細胞凋亡等多個過程, 在免疫系統中發揮核心作用。當膽道發生感染時, 可能存在多種炎癥因子參與, 多條以NF-κB為中心的信號通路串擾, 從而調控GUS的表達。此外, LPS激活肝竇內的巨噬細胞 (Kupffer細胞), 促進循環單核細胞向巨噬細胞的轉化, 參與并放大炎癥反應[38-39] 。在結石飲食喂養的小鼠試驗中, 肝內巨噬細胞浸潤明顯增加[40] 。Yang等[41] 發現肝內膽管結石患者肝臟標本中巨噬細胞標志物CD68、 CD206以及TNF-α、 內源性GUS的表達均較正常肝臟標本明顯升高, 且呈正相關。在LPS的刺激下具有抗炎和免疫調節的M2型巨噬細胞及其分泌產物TNF-α可能通過NF-κB/PCNA的信號級聯通路增加膽管上皮細胞內源性GUS的表達。通過使用NF-κB抑制劑有效抑制炎癥介質表達后, TNF-α和GUS的表達均下降, 表明巨噬細胞浸潤可能參與了肝內膽管細胞分泌GUS。肝臟巨噬細胞對肝損傷和修復過程有重要調控作用, 可能是通過去除細菌病原體、 抑制肝臟炎癥反應, 從而減少內源性GUS的表達。以上內源性GUS可能的信號通路見圖1。內源性GUS參與結石形成的調控機制尚不明確, 可能涉及多條信號通路偶聯,對相關信號通路的研究, 可能為干預PIS的形成或復發提供新的潛在治療靶點。
4 小結
PIS成因復雜, 其完整、 確切的發病機制尚不明確。外源性GUS在肝內膽管結石的形成中作用已得到肯定,內源性GUS在結石形成中的面紗在逐漸被揭開。近年來, 內源性GUS在肝內膽管結石形成中的作用逐漸得到重視, 但目前尚未有系統研究。對內源性GUS抑制的相關研究雖然取得一定成果, 但大多在體外或動物模型中進行, 缺乏臨床相關性。另外, GUS參與了人腦含葡萄糖醛酸的糖胺聚糖的降解, 若缺乏GUS可能引起Ⅶ型黏多糖病, 導致腦內溶酶體儲存功能障礙。如果GUS被抑制, 是否會發生相關嚴重副作用尚不清楚。因此揭示內源性GUS表達的調控機制, 研究其信號通路, 可能更有意義, 將為干預肝內結石的形成提供新的治療思路。
利益沖突聲明: 本文不存在任何利益沖突。
作者貢獻聲明: 李果、 葉海軍、 李江負責課題設計, 資料分析, 撰寫論文; 徐至開、 李文濤、 徐承雷、 李江參與收集數據, 修改論文; 李江負責擬定寫作思路, 指導撰寫文章并最后定稿。
參考文獻:
[1] HUANG ZQ, LIU YX. Surgical treatment of intrahepatic bile duct stones[J]. Chin J Pract Surg, 1997, 17(3): 14-18.黃志強, 劉永雄. 肝內膽管結石的外科治療(40年回顧)[J]. 中國實用外科雜志, 1997, 17(3): 14-18.
[2] TAZUMA S. Gallstone disease: Epidemiology, pathogenesis, and clas?sification of biliary stones (common bile duct and intrahepatic) [J]. Best Pract Res Clin Gastroenterol, 2006, 20(6): 1075-1083. DOI: 10.1016/j.bpg.2006.05.009.
[3] SUZUKI Y, MORI T, YOKOYAMA M, et al. Hepatolithiasis: Analysis of Japanese nationwide surveys over a period of 40 years[J]. J Hepato Biliary Pancreat, 2014, 21(9): 617-622. DOI: 10.1002/jhbp.116.
[4] RAN X, YIN BB, MA BJ. Four major factors contributing to intrahe?patic stones[J]. Gastroenterol Res Pract, 2017, 2017: 7213043. DOI: 10.1155/2017/7213043.
[5] XIA H, ZHANG H, XIN X, et al. Surgical management of recurrence of primary intrahepatic bile duct stones[J]. Can J Gastroenterol Hepatol, 2023: 5158580. DOI: 10.1155/2023/5158580.
[6] TANAKA Y, TAINAKA T, SUMIDA W, et al. The efficacy of resection of intrahepatic bile duct stenosis-causing membrane or septum for preventing hepatolithiasis after choledochal cyst excision[J]. J Pe?diatr Surg, 2017, 52(12): 1930-1933. DOI: 10.1016/j.jpedsurg.2017.08.056.
[7] TSUI WMS, LAM PWY, LEE WK, et al. Primary hepatolithiasis, recur?rent pyogenic cholangitis, and oriental cholangiohepatitis: A tale of 3 countries[J]. Adv Anat Pathol, 2011, 18(4): 318-328. DOI: 10.1097/PAP.0b013e318220fb75.
[8] MOLINERO N, RUIZ L, MILANI C, et al. The human gallbladder micro?biome is related to the physiological state and the biliary metabolic profile[J]. Microbiome, 2019, 7(1): 100. DOI: 10.1186/s40168-019-0712-8.
[9] REN JP, QIU JF, ZOU Y, et al. Research advances in the formation mechanism of primary intrahepatic stones caused by biliary flora[J]. J Clin Hepatol, 2022, 38(2): 477-482. DOI: 10.3969/j.issn.1001-5256.2022.02.045.
任江平, 邱錦飛, 鄒楊, 等. 膽道菌群導致原發性肝內膽管結石形成機理的研究進展[J]. 臨床肝膽病雜志, 2022, 38(2): 477-482. DOI: 10.3969/j.issn.1001-5256.2022.02.045.
[10] LIM JH. Liver flukes: The malady neglected[J]. Korean J Radiol, 2011, 12(3): 269-279. DOI: 10.3348/kjr.2011.12.3.269.
[11] CHEN AN, WANG H, ZHOU YN, et al. Supervision of the main patho?genic bacteria resistance rates and rationality analysis of antibacterial drugs usage in hepatolithiasis with biliary tract infection[J]. J Guang?dong Pharm Univ, 2017, 33(3): 388-392. DOI: 10.16809/j.cnki.2096-3653.2017011204.
陳安妮, 王慧, 周燕妮, 等. 肝內膽管結石病原菌監測及抗菌藥物使用合理性分析[J]. 廣東藥學院學報, 2017, 33(3): 388-392. DOI: 10.16809/j.cnki.2096-3653.2017011204.
[12] WU ZQ. Bacterial spectrum of bile in hepatolithiasis patients and it s relationship with the infection after operation[D]. Fuzhou: Fujian Medical University, 2017.
吳樟強. 肝內膽管結石患者膽汁細菌譜與術后感染的關系[D]. 福州: 福建醫科大學, 2017.
[13] CLEMENTE G, de ROSE AM, MURRI R, et al. Liver resection for pri?mary intrahepatic stones: Focus on postoperative infectious complica?tions[J]. World J Surg, 2016, 40(2): 433-439. DOI: 10.1007/s00268-015-3227-x.
[14] MAKI T. Pathogenesis of calcium bilirubinate gallstone: Role of E. coli, beta-glucuronidase and coagulation by inorganic ions, poly?electrolytes and agitation[J]. Ann Surg, 1966, 164(1): 90-100. DOI: 10.1097/00000658-196607000-00010.
[15] HUANG ZQ, YANG KZ, MENG XJ, et al. The significance of bile β- glucuronidase activity[J]. Chin J Surg, 1982, 20(1): 49-52, 64.
黃志強, 楊可楨, 孟憲鈞, 等. 膽汁β-葡萄糖醛酸酶活性的意義[J]. 中華外科雜志, 1982, 20(1): 49-52, 64.
[16] WANG PP, JIA YF, WU RR, et al. Human gut bacterial β-glucuroni?dase inhibition: An emerging approach to manage medication therapy[J]. Biochem Pharmacol, 2021, 190: 114566. DOI: 10.1016/j.bcp.2021.114566.
[17] CHEN ZQ, TANG S, ZHANG CX, et al. Research progress on the in?teraction between gut bacterial β-glucuronidase and Chinese herbal medicine[J]. Acta Pharm Sin B, 2022, 57(12): 3465-3479. DOI: 10.16438/j.0513-4870.2022-1091.
陳智強, 湯帥, 張暢煊, 等. 腸道菌群β-葡萄糖醛酸苷酶與中草藥的互作關系研究進展[J]. 藥學學報, 2022, 57(12): 3465-3479. DOI: 10.16438/j.0513-4870.2022-1091.
[18] FEVERY J, BLANCKAERT N, LEROY P, et al. Analysis of bilirubins in biological fluids by extraction and thin-layer chromatography of the in?tact tetrapyrroles: Application to bile of patients with gilbert s syn?drome, hemolysis, or cholelithiasis[J]. Hepatology, 2007, 3(2): 177-183. DOI: 10.1002/hep.1840030207.
[19] V?TEK L, OSTROW JD. Bilirubin chemistry and metabolism; harmful and protective aspects[J]. Curr Pharm Des, 2009, 15(25): 2869-2883. DOI: 10.2174/138161209789058237.
[20] TANG W, LU HY, SUN Q, et al. Characteristics of gut microbiota and its association with the activity of β-glucuronidase in neonates with hyperbilirubinemia[J]. Chin J Contemp Pediatr, 2021, 23(7): 677-683. DOI: 10.7499/j.issn.1008-8830.2102039.
唐煒, 盧紅艷, 孫勤, 等. 高膽紅素血癥新生兒腸道菌群特點及與β-葡萄糖醛酸苷酶活性的相關性[J]. 中國當代兒科雜志, 2021, 23(7): 677-683. DOI: 10.7499/j.issn.1008-8830.2102039.
[21] NIE YF, HU J, YAN XH. Cross-talk between bile acids and intestinal microbiota in host metabolism and health[J]. J Zhejiang Univ Sci B, 2015, 16(6): 436-446. DOI: 10.1631/jzus.B1400327.
[22] ROUGIER P, BUGAT R, DOUILLARD JY, et al. Phase II study of irinote?can in the treatment of advanced colorectal cancer in chemotherapy-naive patients and patients pretreated with fluorouracil-based che?motherapy[J]. J Clin Oncol, 1997, 15(1): 251-260. DOI: 10.1200/jco.1997.15.1.251.
[23] BHATT AP, PELLOCK SJ, BIERNAT KA, et al. Targeted inhibition of gut bacterial β-glucuronidase activity enhances anticancer drug effi?cacy[J]. Proc Natl Acad Sci USA, 2020, 117(13): 7374-7381. DOI: 10.1073/pnas.1918095117.
[24] SAITTA KS, ZHANG C, LEE KK, et al. Bacterial β-glucuronidase inhibi?tion protects mice against enteropathy induced by indomethacin, keto?profen or diclofenac: Mode of action and pharmacokinetics[J]. Xeno?biotica, 2014, 44(1): 28-35. DOI: 10.3109/00498254.2013.811314.
[25] ELMASSRY MM, KIM S, BUSBY B. Predicting drug-metagenome in?teractions: Variation in the microbial β-glucuronidase level in the hu?man gut metagenomes[J]. PLoS One, 2021, 16(1): e0244876. DOI: 10.1371/journal.pone.0244876.
[26] CHEN BR, FU SW, LU LG, et al. A preliminary study of biliary micro?biota in patients with bile duct stones or distal cholangiocarcinoma[J]. Biomed Res Int, 2019, 2019: 1092563. DOI: 10.1155/2019/1092563.
[27] SHEN HZ, YE FQ, XIE L, et al. Metagenomic sequencing of bile from gallstone patients to identify different microbial community patterns and novel biliary bacteria[J]. Sci Rep, 2015, 5: 17450. DOI: 10.1038/srep17450.
[28] STRINGER AM, GIBSON RJ, LOGAN RM, et al. Faecal microflora and beta-glucuronidase expression are altered in an irinotecan-in?duced diarrhea model in rats[J]. Cancer Biol Ther, 2008, 7(12): 1919-1925. DOI: 10.4161/cbt.7.12.6940.
[29] CHEN KW, YUAN TM. The role of microbiota in neonatal hyperbiliru?binemia[J]. Am J Transl Res, 2020, 12(11): 7459-7474.
[30] LI Y, SONG JM, YU H, et al. PGE(2) induces MUC2 and MUC5AC expression in human intrahepatic biliary epithelial cells via EP4/p38MAPK activation[J]. Ann Hepatol, 2013, 12(3): 479-486.
[31] LI FY, CHENG NS, CHENG JQ, et al. Proliferating cell nuclear anti?gen shRNA treatment attenuates chronic proliferative cholangitis in rats[J]. J Gastro And Hepatol, 2009, 24(5): 920-926. DOI: 10.1111/j.1440-1746.2008.05688.x.
[32] OYABU H, TABATA M, NAKAYAMA F. Nonbacterial transformation of bilirubin in bile[J]. Dig Dis Sci, 1987, 32(8): 809-816. DOI: 10.1007/BF01296701.
[33] HO KJ, HSU SC, CHEN JS, et al. Human biliary β -glucuronidase: Correlation of its activity with deconjugation of bilirubin in the bile[J]. Eur J Clin Investigation, 1986, 16(5): 361-367. DOI: 10.1111/j.1365-2362.1986.tb01010.x.
[34] WAUTERS L, CEULEMANS M, LAMBAERTS M, et al. Association be?tween duodenal bile salts and gastric emptying in patients with func?tional dyspepsia[J]. Gut, 2021, 70(11): 2208-2210. DOI: 10.1136/gutjnl-2020-323598.
[35] ZHANG XB, CUI NQ, LI DH. Effect of clearing heat and removing dampness method on formation of pigment gallstones in rabbits[J]. Chin J Integr Trad West Med, 2007, 27(3): 241-243. DOI: 10.3321/j.issn:1003-5370.2007.03.014.
張西波, 崔乃強, 李東華. 清熱利濕方防治兔膽色素結石形成的實驗研究[J]. 中國中西醫結合雜志, 2007, 27(3): 241-243. DOI: 10.3321/j.issn:1003-5370.2007.03.014.
[36] YAO DB, DONG QZ, TIAN Y, et al. Lipopolysaccharide stimulates endogenous β -glucuronidase via PKC/NF- κB/c-myc signaling cas?cade: A possible factor in hepatolithiasis formation[J]. Mol Cell Bio?chem, 2018, 444(1): 93-102. DOI: 10.1007/s11010-017-3234-3.
[37] YAO CH. The role of LINC00311 in LPS-induced human intrahepatic bile duct epithelial cells to activate TLR4/NF- κB/c-myc signaling pathway to up-regulate the expression of endogenous β-glucuroni?dase[D]. Shenyang: China Medical University, 2019.
姚晨輝. LINC00311在LPS誘導人肝內膽管上皮細胞激活TLR4/NF-κB/c-myc信號通路從而上調內源性β-葡萄糖醛酸酶表達過程中的作用[D]. 沈陽: 中國醫科大學, 2019.
[38] DONG XT, LIU JQ, XU YP, et al. Role of macrophages in experimen?tal liver injury and repair in mice (Review)[J]. Exp Ther Med, 2019: 3835-3847. DOI: 10.3892/etm.2019.7450.
[39] TACKE F. Targeting hepatic macrophages to treat liver diseases[J]. J Hepatol, 2017, 66(6): 1300-1312. DOI: 10.1016/j.jhep.2017.02.026.
[40] JIN CG, JIANG FR, ZHANG J, et al. Role of osteopontin in diet-in?duced brown gallstone formation in rats[J]. Chin Med J, 2021, 134(9): 1093-1100. DOI: 10.1097/CM9.0000000000001519.
[41] YANG Y, WANG Y, WANG CF, et al. Macrophages and derived-TNF-α promote lipopolysaccharide-induced upregulation of endogenous β-glucuronidase in the epithelial cells of the bile duct: A possible facili?tator of hepatolithiasis formation[J]. Clin Res Hepatol Gastroen?terol, 2023, 47(1): 102062. DOI: 10.1016/j.clinre.2022.102062.
收稿日期:2023-08-23; 錄用日期:2023-10-07
本文編輯:王亞南

