甲基乙二醛毒性機制及天然抑制劑的研究進展
易弛,王文悅,余帆,樊鑫,朱曉青,肖俊鋒,周夢舟,穆楊
(湖北工業大學發酵工程教育部重點實驗室,工業發酵省部協同創新中心,細胞調控與分子藥物“111”引智基地,湖北武漢 430068)
甲基乙二醛(methylglyoxal,MGO)是具有較高活性的二羰基化合物,可共價修飾核酸和氨基酸內的親核位點,形成晚期糖基化終末產物(advanced glycosylation end products,AGEs)。這些二羰基化合物和AGEs 在體內積累與各種慢性疾病相關聯,如糖尿病、心血管疾病、神經退行性疾病。除了人體內源性產生,膳食(外源性)MGO 對體內MGO 和AGEs 的積累以及對人類健康問題也有所影響。本文概述外源性MGO在人體胃腸道的消化吸收與代謝,強調胃腸道也可作為外源性AGEs 的場所來源。作為AGEs 重要前體物質的MGO 具有細胞毒性,可導致細胞損傷,引起氧化應激、細胞炎癥、誘導細胞凋亡,同時在分子機制上激活多種信號通路響應應激。
人體和食品加工中都能產生MGO,而人體中也含有清除MGO 的酶系統,但在高血糖、糖尿病患者體內清除系統受阻,易引起MGO 積累。目前已有的MGO清除劑二甲雙胍通過降低血糖水平、誘導乙二醛酶I(glyoxalase I,GLO1)活性,從而降低MGO 的水平[1]。氨基胍可通過胍基團與MGO 迅速反應消除還原羰基。但是這些氨基胍類化合物具有較大的副作用,主要包括胃腸反應、罕見發生乳酸酸中毒等[2],限制了其臨床應用。而天然化學產物因較高的安全性及其生理和藥理活性受到廣泛關注。因此利用天然產物抑制MGO 已成為研究的熱點。目前關于MGO 的代謝與毒性機制并未完全闡明,因此本文對MGO 的產生與代謝、細胞毒性機制進行總結,綜述其發揮毒性的信號轉導通路,以期為抑制MGO 體內毒性提供角度與思路。并對具有清除MGO 的天然化學產物進行分類,總結各種天然產物對MGO 的抑制機制,為開發新的MGO天然抑制劑提供理論基礎。
1 MGO 的產生及代謝
1.1 MGO 的產生
由于食品在貯藏和加工過程中各組分間相互作用發生美拉德反應,會產生有害活性中間產物α-二羰基化合物,如甲基乙二醛、乙二醛、3-脫氧葡萄糖酮等[3]。而具有較高活性的MGO 已在烘焙食品、乳制品、發酵食品以及油炸食品中被發現,通過膳食攝入在體內積累并影響人體健康[4]。據報道,食源性MGO 的產生主要來自美拉德反應、焦糖化反應(也稱己糖自氧化)、脂質過氧化以及微生物代謝[5-6]。美拉德反應有3 個階段,其中初級階段主要由于食品在儲存和熱處理過程中,葡萄糖和果糖與氨基酸反應經羰氨縮合生成席夫堿(Schiff Base),席夫堿發生分子內重排產生Amadori產物[7]。中間階段Amadori 產物經烯醇化、脫氨基、脫水、分裂等步驟形成1-脫氧葡萄糖醛酮(1-deoxyglucosone,1-DG)或3-脫氧葡萄糖醛酮(3-deoxyglucosone,3-DG)。隨后這些二羰基化合物可以進一步與氨基酸發生降解反應(Strecker 反應),裂解形成MGO,MGO 產生及代謝見圖1[6]。
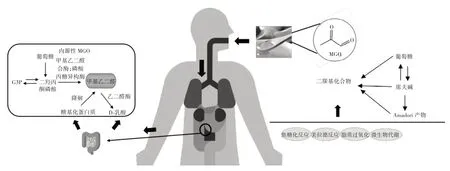
圖1 MGO 產生及代謝Fig.1 Production and metabolism of methylglyoxal
在一些含大量單糖的食物中(如蜂蜜),極易氧化裂解發生焦糖化反應,產生MGO,其中麥盧卡蜂蜜中的MGO 濃度最高,是普通蜂蜜的5~100 倍[8]。在高脂肪食品中如油炸薯條等,MGO 則通過不飽和脂肪酸的氧化產生。在發酵食品中(如醬油、醋)中檢測到相對高濃度的MGO(分別為12 mg/kg 和5 mg/kg),這是由于微生物酶的催化作用使糖酵解中形成的中間體轉化為MGO[6,9-10]。除了食源性的MGO 外,人體內源性也會產生MGO,主要來自糖酵解過程,少部分來自糖基化蛋白質的降解[11]。
1.2 食源性MGO 消化吸收與代謝
據報道,人體每天攝入的MGO 約為0.04~0.30 mmol,由于其親電性易與蛋白質和肽的側鏈氨基反應,導致形成晚期糖基化終產物(AGEs)[11]。經MGO 補充喂食的嚙齒動物,其腦和血清中會存在MGO 積累,并表明至少10% 的MGO 衍生AGEs 被吸收,然后積聚在血管、心臟、肝臟、腎臟和脂肪組織等組織中[12]。研究發現,食源性MGO 經口腔攝入后,經消化后被分解為D-乳酸等,然而MGO 在胃階段消化率極低,在pH 值為2的模擬胃階段基本穩定,但在十二指腸和結腸階段,隨著pH 值的升高和消化酶的作用,MGO 迅速反應[13]。研究表明可能是食物中存在的MGO 與消化酶、胃蛋白酶、胰酶形成糖基化蛋白,導致消化結束后MGO 含量降低[14]。在模擬MGO 和蛋白體系中,蛋白釋放的多肽可能與MGO 相互作用形成糖化蛋白,而糖基化后會降低蛋白質消化率,胃腸道也為AGEs 的產生提供了場所[15]。
總之,MGO 不僅存在于人體的各個細胞中,熱加工食品中也廣泛存在,現如今也發現胃腸道可能為MGO的轉變提供了場所,(寡聚)肽、游離氨基酸、蛋白酶都可能與MGO 在消化過程中發生額外的糖化反應。
2 MGO 的細胞毒性機制
MGO 對細胞的毒性通常通過誘導凋亡發生,MGO造成羰基應激和氧化應激,引起細胞毒性可能是由AGEs 激活晚期糖基化終末產物受體(the receptor for advanced glycation end products,RAGE)進而產生大量活性氧(reactive oxygen species,ROS),也可能是由MGO 誘導細胞凋亡而引起蛋白質氧化損傷,這一途徑可不依賴AGEs-RAGE 途徑而直接損害細胞功能,或者因線粒體損傷而引起[16],MGO 細胞毒性信號通路示意圖概述見圖2。
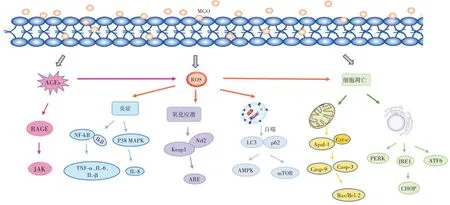
圖2 MGO 細胞毒性信號通路示意圖Fig.2 Schematic diagram of methylglyoxal-induced cytotoxicity signaling pathway
MGO 衍生形成AGEs,作用于RAGE 受體,激活JAK 通路,AGEs 可通過ROS 觸發炎癥、氧化應激、自噬以及細胞凋亡;MGO 通過ROS 介導炎癥,NF-κB 調控炎癥的表達,IκB 蛋白磷酸化并降解,促進腫瘤壞死因子α(tumor necrosis factor alpha-like,TNF-α)、白細胞介素-1β(interleukin 1β,IL-1β)和白細胞介素-6(interleukin 6,IL-6)的釋放;或通過p38MAPK 通路的激活,促進促炎細胞因子白細胞介素-8(interleukin 8,IL-8)分泌;MGO 通過ROS 介導氧化應激,Keap1 將Nrf2 釋放,Nrf2 與抗氧化反應元件ARE 序列結合,驅動ARE編碼抗氧化酶和解毒蛋白酶等基因的轉錄;MGO 通過ROS 介導自噬標志物p62 和LC3 的激活,引起腺苷單磷酸活化蛋白激酶(AMPK)以及mTOR 通路激活;MGO 誘導細胞凋亡,線粒體、內質網功能障礙,線粒體基質中的細胞色素C(cytochrome C,Cyt-C)結合凋亡蛋白酶活化因子(apoptotic protease activating factor-1,Apaf-1),激活Caspase-9/Caspase-3 啟動級聯反應,導致細胞凋亡;內質網應激受雙鏈RNA 激活蛋白激酶樣內質網激酶(PERK)、肌醇要求酶-1(IRE1)和激活轉錄因子6(ATF6)調控,激活促凋亡轉錄因子CHOP。
2.1 線粒體
線粒體既是活性氧的來源又是活性氧的作用目標。MGO 誘發線粒體功能障礙,并損害呼吸鏈重要步驟[17]。MGO 誘導發育中的胚胎細胞生長遲緩,可能與線粒體紊亂以及產生的ATP 減少有關[18]。MGO 增加了不同類型腎細胞中黏附分子、促炎細胞因子和轉化生長因子TGF-β 的表達,也使腎細胞的電子呼吸鏈受抑制,導致線粒體功能障礙,還誘導ROS 的生成并激活了轉化生長因子[19]。在人造骨細胞上,MGO 誘導ROS 的增加并進一步激活下游凋亡信號因子[20]。但在小鼠肌細胞中,MGO 不僅造成線粒體功能障礙而且還伴隨ROS 的增加,說明MGO 誘導的細胞損傷中還伴有ROS 的參與[21]。
線粒體的完整性對于細胞的生存至關重要,只有維持正常的線粒體膜電位才能使線粒體進行氧化磷酸化、產生三磷酸腺苷[17]。線粒體產生的ROS 會破壞電子運輸鏈復合物,使得線粒體內膜發生變化,引起線粒體內、外膜之間的線粒體通透性轉換膜(mitochondrial permeability transition pore,MPTP)不可逆的開放,線粒體膜電位下降,線粒體基質中的細胞色素C(cytochrome C,Cyt-C)被釋放到胞漿中[22]。Cyt-C 結合凋亡蛋白酶活化因子(apoptotic protease activating factor-1,Apaf-1),激活Caspase-9 形成凋亡小體,進而激活Caspase-3 啟動級聯反應,導致細胞凋亡。而Bcl-2 家族在調控線粒體通道上起著至關重要的作用,調節細胞線粒體凋亡途徑。MGO 可影響Bcl-2 家族蛋白的表達[16,22]。
綜上,MGO 誘導細胞ROS 積累,ROS 的過度積累會損害線粒體功能,使得線粒體膜電位發生變化,并激活Caspase-3 級聯反應響應MGO 引起的細胞凋亡。
2.2 內質網
MGO 靶向細胞中的蛋白質,會對蛋白質結構和功能產生不可逆的影響[11]。而蛋白質合成和修飾的場所發生在內質網(endoplasmic reticulum,ER)中,因而內質網可能是MGO 作用的一個靶點,同時內質網也是鈣離子在細胞內的存儲位置[23]。新合成的分泌膜蛋白被轉移到ER 進行修飾。如果未折疊蛋白反應(unfolded protein response,UPR)系統不能從內質網腔中去除未折疊或錯誤折疊的蛋白質,則會誘導內質網應激。內質網應激誘導后,新蛋白向內質網轉運減少,逆轉錄易位、蛋白降解,內質網折疊能力增強[24]。UPR 是一個由3 種內質網跨膜受體蛋白組成的復雜系統:雙鏈RNA 激活蛋白激酶樣內質網激酶[the protein kinase ribonucleic acid(RNA)-activated-like ER kinase,PERK]、肌醇要求酶-1(inositol-requiring kinase 1,IRE1)和激活轉錄因子6(activating transcription factor 6,ATF6)。CHOP(也稱為生長阻滯和DNA 損傷誘導蛋白GADD153)是一種只與內質網應激誘導的凋亡相關的促凋亡轉錄因子[25]。MGO 可誘導血管平滑肌上皮細胞內質網應激,并以時間和濃度依賴性的方式激活并響應內質網的三條主要應激途徑,但在VSMCs 細胞中未觀察到CHOP 促凋亡因子的變化[26]。MGO 還可以通過ROS 依賴的方式誘導ARPE-19 細胞死亡,MGO 激活了典型的URP 信號傳導通路,使用內質網應激抑制劑處理可降低MGO 誘導的ROS 生成以及細胞內鈣升高,對MGO 引起的線粒體膜電位(mitochondrial membrane potential,MMP)損失和細胞死亡都有所減少[27]。
可見,內質網應激依賴于細胞內ROS 的產生,而MGO 可通過ROS 介導內質網應激,激活典型URP 信號轉導途徑,細胞內鈣離子增加,線粒體膜電位損失,進而誘導細胞凋亡。
2.3 自噬
自噬是一種進化高度保守的細胞內機制,提供溶酶體,降解舊的或受損的細胞器、脂質和聚集蛋白來保持細胞穩態[28]。通過MGO 處理神經細胞增加了自噬標志物自噬銜接蛋白螯合體1(p62)以及微管相關蛋白輕鏈3(LC3)的脂化和活性形式[29]。MGO 通過與信號通路的直接相互作用或ROS 的形成來影響觸發自噬的信號通路。mTOR 是自噬的主要調節途徑,除此之外還可通過非依賴性途徑被激活。腺苷單磷酸活化蛋白激酶(AMPK)是維持細胞能量穩態的主要調節因子,磷酸化后,AMPK 可以通過將下游自噬相關蛋白募集到自噬體形成位點來控制自噬體的形成[28,30]。AMPK 的激活通常也會導致mTOR 失活和自噬增加,經MGO 處理細胞后,自噬通過AMPK 激活誘導,ACC(AMPK 底物)磷酸化增強,阻止mTOR 的激活[31]。
MGO 誘導細胞損傷,而自噬在二羰基應激中對細胞具有保護作用,且自噬激活劑可以顯著增加細胞活性。自噬調節途徑主要是通過mTOR 信號介導。
2.4 促進炎癥反應
腸道中的羰基化合物可以引起炎癥反應,如在炎癥性腸病(inflammatory bowel disease,IBD)患者腸道中促炎細胞因子白細胞介素-8(interleukin,IL-8)分泌增加,主要是超氧化物陰離子的誘導和p38MAPK 通路的激活[31]。MGO 誘導腸上皮細胞產生活性氧(ROS),使得不同信號通路受損后導致不同激酶級聯的激活,刺激IL-6 和IL-8 的合成[32]。動物實驗發現,MGO 會引起大鼠炎癥,誘導胰腺損傷,MGO 促進促炎細胞因子的釋放,增加促氧化酶如NADPH 氧化酶和JNK 的活性,并上調大鼠胰腺細胞中NF-κB 的表達[33]。NF-κB可促進細胞因子的釋放,包括腫瘤壞死因子α(TNFα)、白細胞介素-1β(IL-1β)和白細胞介素-6(IL-6)[11]。MAPK 在炎癥細胞因子、ROS、化學物質和氧化劑等多種因素誘導的胰島素抵抗發展中起關鍵作用,MGO 以氧化還原依賴性方式激活成骨細胞、內皮細胞和Jurkat 白血病細胞中的MAPK 炎癥途徑[34]。
綜上,MGO 引起細胞炎癥主要是通過MAPK 以及NF-κB 途徑,進而促進炎癥因子的表達,也可通過ROS的過度積累進一步導致炎癥的發生。
2.5 Keap1/Nrf2/ARE 信號系統調節
Keap1-Nrf2-ARE 是一種將外源刺激轉導成真核轉錄反應的信號通路。Keap1-Nrf2-ARE 途徑在細胞防御應激中至關重要,并且與醛應激直接相關[35]。MGO 對該信號通路具有雙重作用,編碼解毒蛋白和抗氧化酶的基因表達均受到轉錄因子Nrf2 調控,GLO1作為MGO 解毒的主要酶也受到Nrf2 調控,Nrf2 可促進GLO1 的表達和MGO 向D-乳酸的轉化[11]。Nrf2 為細胞內抗氧化劑和II 期解毒酶的關鍵調節因子通過許多ARE 依賴基因的轉錄上調,在胞液內Nrf2 與Keap1 結合存在,當細胞遭受MGO 攻擊后,與Keap1的半胱氨酸殘基和精氨酸殘基結合,形成交聯物質,并將Nrf2 釋放出來,隨后Nrf2 位移到細胞核與抗氧化反應元件ARE 序列結合,驅動ARE 編碼抗氧化酶和解毒蛋白酶等基因的轉錄[11,36]。Nrf2/Keap1 通路在MGO對抗神經元解毒機制中對MGO 誘導的羰基應激很重要,Nrf2 激活劑有助于羰基應激介質的積累和毒性表達的抑制[36]。NF-κB 參與拮抗Nrf2 的轉錄活性[12]。
MGO 引起細胞內ROS 積累,造成氧化應激,Keap1-Nrf2-ARE 作為氧化應激調節通路,在MGO 誘導的細胞氧化應激中起著關鍵解毒作用,Nrf2 促進GLO1 的表達和MGO 向D-乳酸的轉化。
2.6 AGE/RAGE
MGO 對細胞毒性的影響可通過形成AGEs 破壞生物分子的結構和功能特性,并參與ROS 的形成。MGO 來源的AGEs 可通過與特定的細胞表面受體晚期糖基化終產物受體(RAGE)結合,MGO 經人血清蛋白修飾后形成的AGEs 對人胚胎細胞造成損害,在細胞水平上引起炎癥反應[37]。AGE-RAGE 的信號效應最常通過激活JAK 和STAT 通路發生[38]。甲基乙二醛賴氨酸二聚體(methylglyoxal-lysine dimer,MOLD)處理小鼠系膜細胞后RAGE 表達明顯增加,并與RAGE 的v 型免疫球蛋白結構域連接[39]。AGEs 激活小膠質細胞可增加促炎細胞因子(如TNF-α、IL-1β 和IL-6)的表達和分泌[40]。
MGO 作為一種糖化劑,可導致MGO 衍生的AGEs水平升高,AGEs 可與RAGE 結合,激活下游JAK 和STAT 通路發生。AGEs 也可通過ROS 促進炎癥的正反饋調節。
綜上,ROS 在MGO 介導的細胞毒性中起著媒介作用,ROS 可直接或間接引起線粒體、內質網損傷,也可引起自噬、炎癥、氧化應激或AGEs 的產生。NF-κB既可促進炎癥因子的表達,也參與Nrf2 的調節,而對于炎癥和自噬之間除了ROS 的連接作用外,是否還有其它基因的共同調節還有待研究。
3 MGO 解毒系統
正常人體內含有清除MGO 的機制,主要以乙二醛酶1(glyoxalase 1,GLO1)和乙二醛酶2(glyoxalase 2,GLO2)組成的酶系統為主。在正常情況下,細胞通過不同的機制保護免受甲基乙二醛毒性,特別是乙二醛酶系統,這是甲基乙二醛解毒的最重要的途徑,除此之外,還有醛糖還原酶以及醛脫氫酶解毒系統,見圖3。
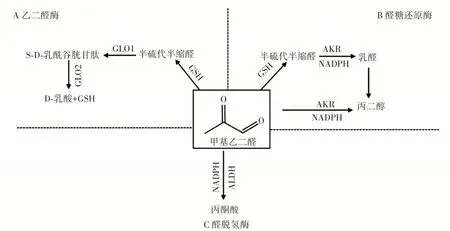
圖3 MGO 解毒系統Fig.3 Detoxification system of methylglyoxal
3.1 乙二醛酶系統
乙二醛酶系統是所有哺乳動物均含有的一種代謝途徑,能夠清除體內的MGO[11]。乙二醛酶系統由兩種酶組成,GLO1、GLO2 和還原型谷胱甘肽(glutathione,GSH)。MGO 與GSH 非酶反應形成半硫代縮醛,被GLO1 識別[41]。GLO1 將半硫代縮醛轉化為S-D-乳酰谷胱甘肽,S-D-乳酰谷胱甘肽為無毒化合物,因此GLO1 是MGO 解毒的關鍵,此外S-D-乳酰谷胱甘肽代謝為D-乳酸過程中GSH 再生,這意味著MGO 水平的大幅增加或GLO2 活性低均可能使S-D-乳酰谷胱甘肽積累,導致GSH 被捕獲[34]。研究表明在原代人主動脈內皮細胞中,GLO1 敲除增加了MGO 水平,并導致隨后的炎癥、凋亡和功能障礙,從而導致血管損傷和功能受損[42]。在神經母細胞瘤中,MGO 激發導致GLO1 酶活性受到抑制[18]。
3.2 醛糖還原酶
醛糖還原酶(aldose reductase,AKR)是NAD(P)H依賴性酶的超家族,可將醛和酮還原為反應性較低的醇。AKR 超家族包括來自細菌、酵母、植物和哺乳動物的酶,這些酶能夠減少存在于各種天然和合成化合物中的羰基。AKR 的幾個成員,包括AKR1A1、AKR1B1、AKR1C1 和AKR7A2,能夠代謝MGO[43-44]。AKR 介導的MGO 解毒通過兩種不同的途徑進行,一種是在GSH和MGO 的非酶反應之間形成半硫代縮醛,被AKR 和NADPH 轉化為乳醛;另一種是GSH 獨立性,MGO 與AKR 以及NADPH 反應生成丙二醇[40,45]。AKR7A2 和AKR1C3 酶參與保護神經母細胞瘤和星形細胞瘤細胞免受MGO 誘導的細胞毒性[44,46]。
3.3 醛脫氫酶
ALDHs 是一類煙酰胺腺嘌呤二核苷酸(NAD)和NAD 磷酸(NADP)依賴性酶,可將醛氧化成羧酸。醛脫氫酶ALDH1A1 通過氧化生成丙酮酸來代謝MGO。然而,由于存在高活性GLO1 和AKR1B1,該反應在體內不是主要的清除系統[1]。ALDH 的E1、E2 和E3 同工酶與MGO 反應,并以NAD 依賴的方式將其氧化為丙酮酸鹽。同樣,2-氧代醛脫氫酶(2-oxidative dehydrogenation,2-ODH)以NADP 依賴的方式將MGO 轉化為丙酮酸[43]。
4 天然產物對MGO 毒性緩解作用
天然化學產物是次生代謝物、生物活性物質和各種天然存在的化學部分,目前的研究多從膳食植物、水果和草藥中尋找有效的植物化學化合物去清除食品中或體內MGO 含量[41]。一些天然化學產物如黃酮、酚酸、多糖、萜類化合物、維生素等可以通過清除自由基、改善氧化應激、降低炎癥、調節相關代謝酶從而達到清除二羰基化合物的作用。常見天然化學產物清除MGO 作用見表1。

表1 常見天然化學產物清除MGO 作用Table 1 Common natural chemical products for methylglyoxal clearance
4.1 黃酮類化合物
黃酮類化合物的結構對其保護活性有重要影響,相較而言黃烷-3-醇亞型中的大多數化合物表現出較強的保護活性,其次是黃烷酮亞型,最后是黃烷醇亞型[60]。對于黃烷-3-醇亞型,表沒食子兒茶素3-O-沒食子酸酯(epigallocatechin gallate,EGCG)和表兒茶素3-O-沒食子酸酯(epicatechin gallate,ECG)顯示出比EGC和EC 更強的保護活性,表明沒食子酸鹽基團替代增強了MGO 處理的PC-12 細胞的保護活性[61]。對于黃烷酮亞型如柚皮素和芹菜素,保護作用在于結構上C-2和C-3 位置雙鍵。而黃烷醇亞型的保護作用主要是由于C 環上3 位羥基取代[62]。
兒茶素(catechins)屬于黃烷醇類化合物,具有很強的抗氧化活性,體外試驗證明,兒茶素能捕獲MGO中的羰基,從而抑制羰基化反應[61]。在人血管細胞中,兒茶素通過阻止線粒體通透性改變以及下游凋亡的啟動來抑制MGO 誘導的細胞凋亡[16]。天然類黃酮木犀草素可以阻止MGO 誘導的神經元細胞凋亡,通過阻止Bax 蛋白的激活,抑制Cyt-C 和Caspase-3 水平,從線粒體凋亡途徑減少神經元細胞凋亡,而Bax 蛋白是mTOR 的靶點,通過AKT/mTOR 途徑介導凋亡[50]。槲皮素通過GSK-3β/Nrf2 通路減少MGO 對成骨細胞凋亡,GSK-3β 能調控線粒體膜通道的開放[48]。桑黃素增加GLO1 活性和GSH 濃度,同時降低了MGO 的濃度[41]。白藜蘆醇衍生物PTS 通過提高GLO1 水平以及抑制氧化應激和相關的下游線粒體依賴性信號轉導凋亡級聯來減輕MGO 誘導的人臍靜脈內皮HUVEC 凋亡[49]。接骨木中的花青素和槲皮素能有效捕獲MGO后形成加合物,并降低MGO 對人肝癌HepG2 細胞的毒性作用[47]。
4.2 酚酸
酚酸具有高抗氧化活性以及清除自由基能力,螯合金屬離子,能在糖基化反應期間中和羰基中間體,從而抑制AGEs 的形成[53]。白酒酒糟提取物中七種酚酸化合物(阿魏酸、香草酸、綠原酸、對香豆酸、介子酸、咖啡酸、丁香酸)具有很好的捕獲乙二醛的能力,其捕獲/清除率高達49.57%[63]。香草酸抑制糖基化機制包括ROS、p38 和JNK、PKC 和氧化敏感蛋白p47phox 表達并且抑制MGO 衍生的CML 形成,從而減少了MGO誘導的神經-2A 細胞凋亡[52]。咖啡酸和綠原酸具有很好的抗糖機化作用,咖啡酸已被證明是一種脂氧合酶抑制劑,綠原酸可干擾葡萄糖吸收,具有清除自由基和金屬的能力,可調節一些抗氧化酶基因的表達[54]。體外BSA 模型中發現朝鮮薊固體廢物中提取的綠原酸具有捕獲MGO 的能力,并具有清除ABTS+自由基和DPPH 自由基能力[54-55]。阿魏酸可減少MGO 誘導的大鼠肝細胞毒性和氧化應激,降低ROS 形成和線粒體膜電位MMP 增加[51]。香草酸、綠原酸、丁香酸通過改變線粒體膜電位和降低Bax/Bcl-2 的升高、抑制Caspase-3 的激活以及PARP 的裂解減少MGO 對神經元細胞凋亡,抑制MAPK 信號通路(JNK 和p38)的激活[7]。
4.3 多糖
多糖是藥用植物中豐富的大分子,具有抗氧化、抗炎、降低血糖等功能。在牛血清蛋白(bovine serum protein,BSA)糖化模型中,Pholiotanameko多糖捕獲MGO 并減少MGO 誘導的官能團(羰基和ε-NH2),清除ABTS 和DPPH 自由基,螯合金屬亞鐵離子并保護人類成纖維細胞Hs68 在糖化脅迫下的細胞活力[56]。黃芪多糖能夠維持視網膜周細胞線粒體膜,抑制線粒體膜電位的下降,通過減少ROS 的產生從而抑制氧化應激,調節Bcl-2 家族蛋白(Bcl-2 和Bax)和Caspase 家族蛋白(Caspase-3 和Caspase-9)的表達進而減少MGO引起的細胞凋亡[7]。
4.4 萜類化合物
熊果酸及其異構體齊墩果酸是三萜類化合物,具有抗炎,抗關節炎,細胞抑制和抗增殖作用,對小鼠具有保肝作用,以及膜穩定特性[55]。齊墩果酸和熊果酸降低了醛糖還原酶(AKR)和山梨醇脫氫酶的腎活性,下調了AKR 的mRNA 表達,增強了GLO1 的活性和表達[57]。紅莧菜水提物中含有萜類化合物,能降低人類晶狀體上皮細胞HLE-B3 中MGO 水平和AKR 活性[64]。
4.5 維生素
維生素是維持人體正常生理功能所必需的有機物質,在新陳代謝中起著重要作用。其中,維生素C(抗壞血酸)、維生素E(α-生育酚)、苯基硫胺素和吡哆胺是優良的抗氧化劑,維生素E 可以阻止ROS 和MGO 衍生的AGEs 的增加[59]。吡哆胺淬滅MGO,改善功能失調的炎癥反應,并加速傷口愈合,糖尿病小鼠傷口組織和THP-1M1 樣巨噬細胞中GLO1 的表達下降[58]。吡哆醇、硫胺素和焦磷酸硫胺素可通過捕獲羰基來抑制AGEs 形成,抑制糖基化級聯中的后Amadori 階段[65]。
5 總結與展望
食品中的MGO 主要來自高糖的食品和飲料中或食品加工中,這些都會導致MGO 的積累。體內糖酵解是MGO 產生的核心,而體內MGO 水平升高與一些慢性疾病密切相關,如高血糖、糖尿病患者體內清除系統受阻,易引起MGO 積累。MGO 引起細胞毒性是多方面的,MGO 可直接作用細胞對細胞造成損傷,可介導ROS 的產生對線粒體、內質網產生影響,導致細胞凋亡,也可通過形成AGEs 誘導細胞損傷。在分子機制上,觸發mTOR-AMPK 激活自噬,MGO 還可能激活MAPK 和JAK 途徑,促使NF-κB 激活,促炎細胞因子IL-6、IL-8 釋放引起炎癥,MGO 通過Keap1/Nrf2/ARE信號系統誘導氧化應激等。
人體自身含有MGO 清除系統,正常生理條件下,98% 以上的MGO 均能通過GLO 系統解毒,食品和飲料中的MGO 在代謝過程中的積累現多集中在MGO和蛋白結合的模擬體系中,可采用食物基質如烘焙食品、乳制品等進一步研究MGO 在體內的代謝。此外,MGO 經胃腸道消化后產生的糖基化肽阻礙蛋白酶水解的深層機制仍需探究。
隨著對天然產物研究的深入,黃酮類化合物、酚酸、多糖、萜類化合物、維生素都可以清除MGO,通過捕獲羰基、清除自由基、螯合金屬離子來減少MGO 的積累,在體內增強GLO 酶系統活性。目前研究較多的是多酚類化合物,然而采用化學合成法提取的天然產物衍生物也存在產量有限、提取條件復雜等問題,與合成制劑相比,天然產物來源的MGO 抑制劑還未在臨床醫學上得到廣泛應用,可以與現有的合成藥物結合起來治療或預防疾病等健康問題。對于食源性MGO而言,可考慮在食品加工過程中添加天然產物,探究食品成分、加工過程與天然產物之間的作用以及清除MGO 能力。綜上,繼續開拓更多MGO 清除劑和糖基化抑制劑及其機制研究具有重要意義。

