透明細胞腎細胞癌中ENO2的表達及臨床意義
陳肖瑜,羅文奇,張鳳友,蔣芳誠,莫濡蔚,黨裔武
腎細胞癌包括三種主要的組織學亞型:透明細胞腎細胞癌(clear cell renal cell cancer, CCRCC)、乳頭狀腎細胞癌和嫌色腎細胞癌。CCRCC起源于腎小管上皮系統,形態具有異質性,是腎細胞癌最常見的類型,占腎細胞癌的70%。早中期CCRCC首選手術治療,早期術后5年生存率約70%,約30%患者術后3~5年內復發[1]。局部復發或轉移性CCRCC患者的預后較差。晚期CCRCC患者的最佳治療方案是免疫檢查點抑制劑(immune checkpoint inhibitor, ICI)聯合酪氨酸激酶抑制劑(tyrosine kinase inhibitor, TKI),但CCRCC異常糖酵解信號可促進腫瘤細胞形成抑制性免疫微環境,介導腫瘤免疫逃逸,從而影響免疫治療的效果[2]。惡性腫瘤的代謝重排是繼免疫治療后的又一研究熱點。人神經元特異性γ-烯醇酶2(enolase 2, ENO2),又稱神經元特異性烯醇化酶(neuron-specificenolase, NSE),它在糖酵解中起重要的作用,在促進β-甘油磷酸酯轉化為二羥磷酸丙酮的同時,形成腺苷三磷酸(ATP)和煙酰胺腺嘌呤二核苷酸(NADH),促進腫瘤細胞的增殖和侵襲[3]。目前有文獻報道ENO2作為癌基因可促進CCRCC的進展[4-5],本實驗通過免疫組化法對97例CCRCC組織進行分析,驗證其表達情況及診斷價值,初探其促進CCRCC發展的潛在分子機制。
1 材料與方法
1.1 材料收集2018年5月~2023年5月廣西醫科大學附屬腫瘤醫院存檔的97例CCRCC和對應正常腎組織石蠟標本,納入標準:(1)術前均未行放、化療或分子靶向治療;(2)近5年內的根治術標本;(3)經廣西醫科大學附屬腫瘤醫院醫學倫理委員會審批;(4)所有病例均經副主任醫師以上職稱病理專家審核確診。
1.2 方法
1.2.1免疫組化 采用免疫組化MaxVision法檢測ENO2(貨號MAB-0791,福州邁新公司,稀釋1∶100)蛋白的表達。實驗步驟嚴格按試劑盒說明書操作,采用檸檬酸高壓修復法。結果判讀:(1)按陽性細胞百分比評分:陽性細胞數<5%為0分,6%~25%為1分,26%~50%為2分,51%~75%為3分,76%~100%為4分。(2)按陽性細胞染色強度評分:無陽性著色為0分,呈淺黃色為1分,黃色或棕黃色為2分,深黃色或黃褐色為3分。將兩項評分相乘得到最終評分:>3分為高表達,≤3分為低表達。
1.2.2公共數據提取 從腫瘤基因組圖譜(the Cancer Genome Atlas, TCGA)(https://portal.gdc.cancer.gov)獲得542例CCRCC和72例正常腎組織mRNA測序數據,獲得ENO2 mRNA在CCRCC及正常組織中的表達水平。GEPIA數據庫(http://gepia.cancer-pku.cn/)儲存了來自TCGA數據庫的516例CCRCC的高通量測序數據以及對應的生存資料,根據516例CCRCC中ENO2 mRNA表達量的中位數分為ENO2高表達組和ENO2低表達組,利用GEPIA工具進行生存分析,以探究ENO2表達與CCRCC患者預后的關系。使用TIMER在線數據(https://cistrome.shinyapps.io/timer/)分析ENO2的表達與糖代謝路徑關鍵基因的相關性。
1.3 統計學方法采用SPSS 20.0軟件進行統計學分析。χ2檢驗分析ENO2蛋白表達與臨床病理特征的關系。獨立樣本t檢驗分析ENO2 mRNA表達在CCRCC組和對照正常組間的差異。ROC曲線分析ENO2在CCRCC中表達的敏感性和特異性。Log-rank檢驗TCGA數據庫516例CCRCC中ENO2高表達組和低表達組間的總生存期與預后的關系。
2 結果
2.1 CCRCC中ENO2蛋白和mRNA水平利用免疫組化法檢測97例CCRCC及配對正常腎石蠟包埋組織中ENO2蛋白的表達,ENO2蛋白定位于細胞質(圖1)。免疫組化結果統計發現,ENO2蛋白在CCRCC組織中的高表達率為71.13%(69/97),而在正常腎組織中均未見表達。ENO2蛋白在CCRCC組織的表達顯著高于正常腎組織,差異有統計學意義(P<0.001)。應用TCGA-CCRCC數據庫分析ENO2 mRNA的表達水平,結果顯示,與正常對照腎組織相比,CCRCC中ENO2 mRNA表達均顯著上調(P<0.001,圖2)。

圖1 A.正常腎組織HE染色;B.透明細胞腎細胞癌組織HE染色;C.正常腎組織中ENO2蛋白呈陰性,MaxVision法;D.透明細胞腎細胞癌組織ENO2蛋白呈弱陽性,MaxVision法;E.透明細胞腎細胞癌組織ENO2蛋白呈中等陽性,MaxVision法;F.透明細胞腎細胞癌組織ENO2蛋白呈強陽性,MaxVision法
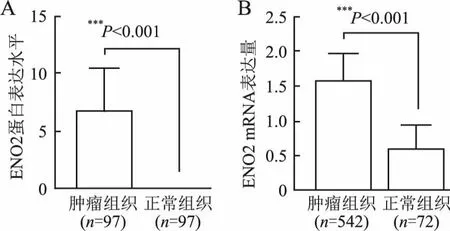
圖2 A. 97例根治術標本透明細胞腎細胞癌組織和對應的正常腎組織中ENO2蛋白的表達;B.TCGA數據庫透明細胞腎細胞癌組織和正常腎組織中ENO2 mRNA的表達
2.2 ENO2蛋白表達與CCRCC臨床病理特征的關系ENO2蛋白表達與ISUP/WHO分級(P=0.019)、有無腎周脂肪侵犯(P=0.028)密切相關(表1),而與患者年齡、性別、腫物大小、病理分期、有無癌栓均無關(P>0.05)。
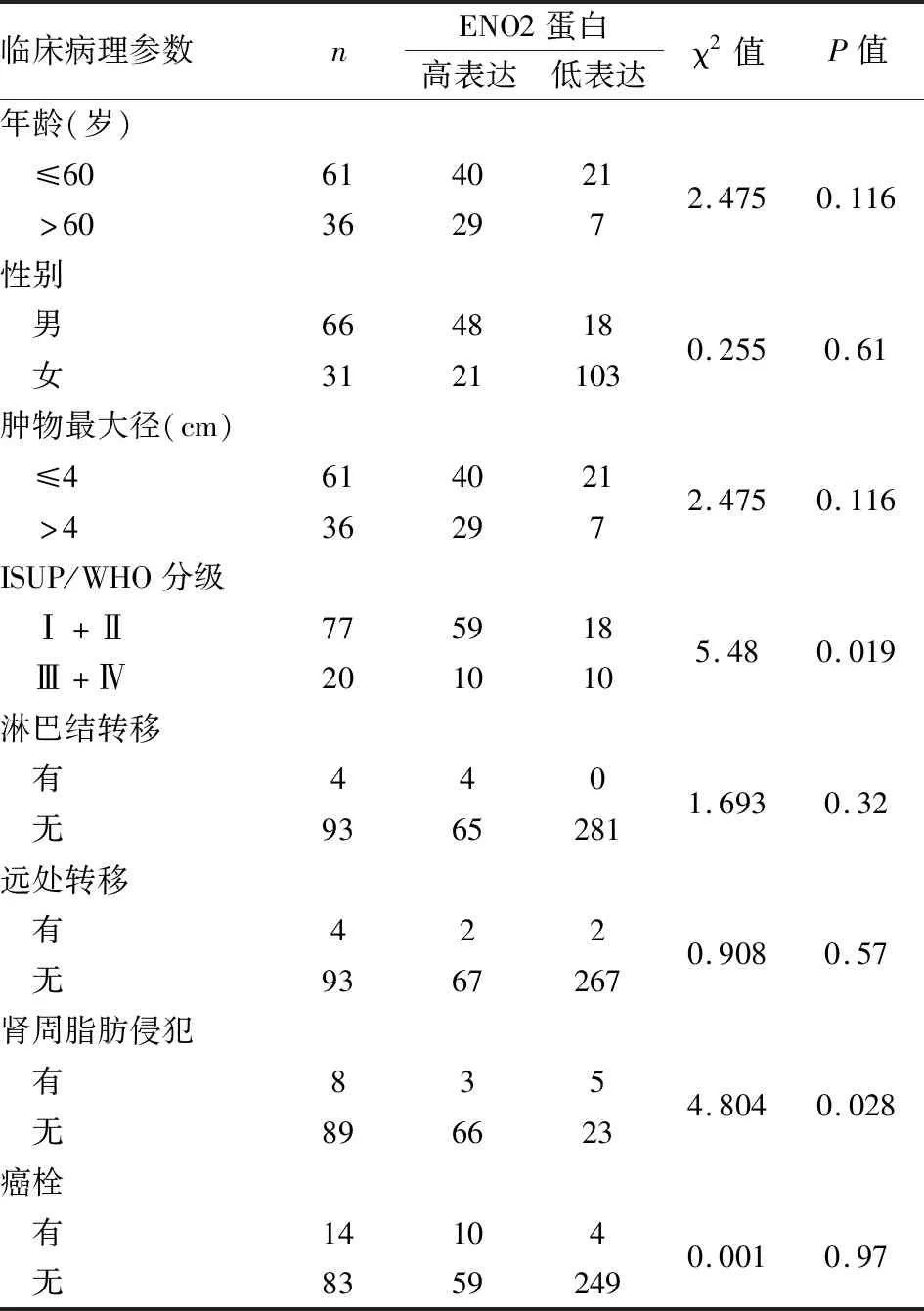
表1 ENO2蛋白表達與透明細胞腎細胞癌臨床病理特征的關系
2.3 ROC曲線分析ENO2在CCRCC中的敏感性和特異性應用TCGA數據庫中542例CCRCC和72例正常腎組織的ENO2 mRNA表達量及97例CCRCC根治術標本和對應的正常腎組織ENO2蛋白表達量作ROC曲線分析。ROC曲線提示:CCRCC中ENO2 mRNA(95%CI為0.941~0.978,AUC=0.959,P<0.001,圖3A)以及ENO2蛋白的表達(95%CI為0.934~0.994,AUC=0.964,P<0.001,圖3B)具有較高的敏感性和特異性,對CCRCC具有較高的診斷價值。
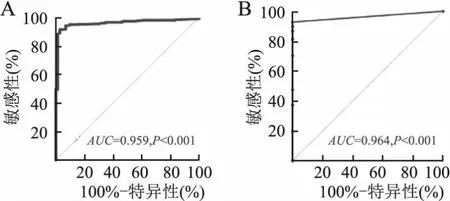
圖3 A. TCGA數據庫542例透明細胞腎細胞癌和72例正常腎組織的ENO2 mRNA表達量的ROC曲線;B.97例透明細胞腎細胞癌根治術標本和對應的正常腎組織ENO2蛋白表達量的ROC曲線
2.4 TCGA數據庫516例CCRCC的高通量測序數據及生存分析通過GEPIA在線網站分析ENO2與CCRCC患者預后的關系,其中ENO2 mRNA高表達組與低表達組樣本各258例,生存分析結果提示,ENO2 mRNA高表達組患者的總生存期(overall survival, OS)顯著低于低表達組,ENO2 mRNA高表達CCRCC患者具有更差的預后,OS更低(P=0.019,圖4)。
2.5 ENO2與糖代謝路徑相關基因的關系本組通過TIMER在線分析ENO2 mRNA表達與糖代謝路徑相關基因的關系,Peason相關性分析提示:ENO2 mRNA與糖代謝路徑相關基因HK2(R=0.346,P=1.81e-16)、ALDOA(R=0.201,P=2.92e-06)、PGK1(R=0.325,P=1.35e-14)、PKM2(R=0.203,P=2.34e-06)及LDHA(R=0.238,P=2.70e-08)的表達呈正相關(圖5)。
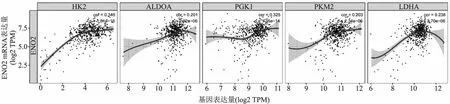
圖5 ENO2 mRNA與糖代謝路徑關鍵相關基因的關系
3 討論
CCRCC在泌尿系統中是常見的致死性疾病,全球每年新增約40.3萬腎細胞癌新發病例和17.5萬死亡病例[6]。晚期CCRCC患者的預后不佳,5年生存率大幅度下降。CCRCC糖酵解代謝異常活躍[7],被認為是一種代謝性疾病,涉及糖酵解、三羧酸循環、磷酸戊糖旁路、脂肪酸和氨基酸代謝通路的廣泛改變[8]。肥胖和糖尿病成為CCRCC發病的危險因素,通過糖酵解調控聯合免疫或靶向治療的方案將成為現有CCRCC治療的重要補充,從而改變晚期CCRCC治療現狀[2]。ENO2是一種長鏈酸性二聚體蛋白,含433個氨基酸,通常在成熟神經元和神經元來源的細胞中表達,是腫瘤中神經內分泌分化的常見標志物[9-10]。此外,它也在紅細胞、血小板、乳腺組織、前列腺和子宮組織中表達[11-12]。
據報道,ENO2在膠質瘤、胃癌、前列腺癌和許多其他類型的惡性腫瘤中表達上調[13-15]。在急性淋巴細胞白血病中ENO2能促進腫瘤細胞的增殖[16],在膠質母細胞瘤中,ENO2表達較高的患者OS明顯低于ENO2表達較低的患者,敲除ENO2能顯著抑制膠質母細胞瘤細胞的遷移[15]。本研究通過免疫組化檢測了97例CCRCC根治術標本和對應正常腎組織中ENO2蛋白的表達,結果顯示ENO2蛋白在正常腎組織中幾乎不表達,而在CCRCC中明顯高表達,并且具有較高的敏感性和特異性,對CCRCC和正常腎組織具有較好的區分能力,是一個潛在的CCRCC的鑒別診斷標志物。文獻報道ENO2也是小細胞肺癌診斷、預后和隨訪中可靠的腫瘤標志物[11]。分析TCGA數據庫中516例CCRCC的高通量測序數據以及對應的生存資料,結果顯示ENO2基因高表達組具有更差的預后,因此檢測ENO2蛋白對預測CCRCC患者生存有一定的指導價值[17],有望成為CCRCC患者的獨立預后因素。有研究發現,ENO2在CCRCC組織中高表達,并在激活細胞周期、EMT和PI3K/AKT信號通路中發揮作用[18-19]。同時,ENO2可能通過糖酵解促進CCRCC細胞的生長和侵襲,其中糖酵解/糖異生已經被證實與CCRCC的發病密切相關[20],而ENO2高表達可能與Warburg效應有關,提示ENO2參與促進CCRCC的發生、發展。TIMER分析ENO2與糖代謝路徑相關基因HK2、ALDOA、PGK、PKM2及LDHA的表達呈正相關,ENO2可促進腫瘤細胞糖酵解,滿足腫瘤細胞的能量代謝并促進增殖。通過調節晚期CCRCC患者的ENO2表達,控制糖酵解進程,促進腫瘤的免疫微環境形成,阻礙腫瘤細胞逃逸,再對其進行免疫治療或靶向治療,或許能取得更好的治療效果。最新研究[21]表明,ENO2高表達的結直腸癌患者對抗血管生成治療反應較差,由于ENO2衍生的磷酸烯醇丙酮酸作為內源性HDAC1抑制劑發揮作用,并對抗血管生成治療產生抗性。有效抑制ENO2或代謝相關基因的活性,可能給代謝重排和抗血管治療CCRCC患者提供新的機會。
綜上,本實驗基于免疫組化及TCGA、GEO、TIMER等數據庫分析,研究ENO2在CCRCC中的作用及潛在分子機制,豐富了ENO2在腎臟腫瘤中的研究理論依據,ENO2有望成為CCRCC潛在的診療及預后判斷的生物學標志物。

