低溫誘導的RBM3對各器官缺血再灌注損傷研究進展
孫路軒 黨曉平 孫子健
基金項目:陜西省衛生健康委員會項目(2022E029);西安醫學院第二附屬醫院院級課題(22KY0112);2022年國家級大學生創新創業訓練項目(202211840021)
作者單位:710038? ?西安,西安醫學院第二臨床醫學院(孫路軒,孫子健);710038? ?西安,西安醫學院第二附屬醫院(黨曉平)
通信作者:黨曉平,E-mail: 19084943@qq.com
【摘要】缺血再灌注損傷(IRI)是一種復雜的血流動力學紊亂狀態,致死率極高,且目前的治療方法相對有限。亞低溫治療是臨床上公認的一種緩解缺血、缺氧損傷的治療方式,尤其在腦保護中的研究較多。多項研究表明,RNA結合基序蛋白3(RBM3)作為一種冷應激蛋白,主要在低溫誘導下產生,可促進翻譯,減輕氧化應激、降低細胞凋亡率。因此,誘導RBM3可能代表一種治療IRI的新策略,代替亞低溫治療,減輕低溫對機體的不良影響。基于這一觀點,文章對RBM3蛋白功能的最新發現進行綜述,重點關注RBM3對各器官IRI相關疾病的保護作用以及未來前景,為相關研究提供新思路。
【關鍵詞】低溫;RNA結合基序蛋白3;腦缺血再灌注損傷;心缺血再灌注損傷;肝缺血再灌注損傷;
腎缺血再灌注損傷
Research progress in hypothermia-induced RBM3 in ischemia-reperfusion injury of various organs Sun Luxuan△, Dang Xiaoping, Sun Zijian. △The Second Clinical Medical College of Xian Medical College, Xian 710038, China
Corresponding author: Dang Xiaoping, E-mail: 19084943@qq.com
【Abstract】Ischemia-reperfusion injury (IRI) is a complex hemodynamic disorder with high mortality rates and limited treatment options. Mild hypothermia is a widely-accepted treatment method for alleviating ischemic and hypoxic injury, especially in the study of brain protection. Many studies have shown that RNA-binding motif protein 3 (RBM3), as a cold stress protein, is mainly produced under low-temperature induction, which can promote translation, alleviate oxidative stress, and reduce cell mortality. Therefore, inducing RBM3 may represent a new strategy for treating IRI, replacing mild hypothermia and mitigating the side effects of hypothermia on the body. In this study, the latest findings on the function of RBM3 protein were summarized, highlighting the protective role and future prospect of RBM3 in IRI-related diseases of various organs.
【Key words】Hypothermia; RNA-binding motif protein 3; Brain ischemia-reperfusion injury;
Heart ischemia-reperfusion injury; Liver ischemia-reperfusion injury; Renal ischemia-reperfusion injury
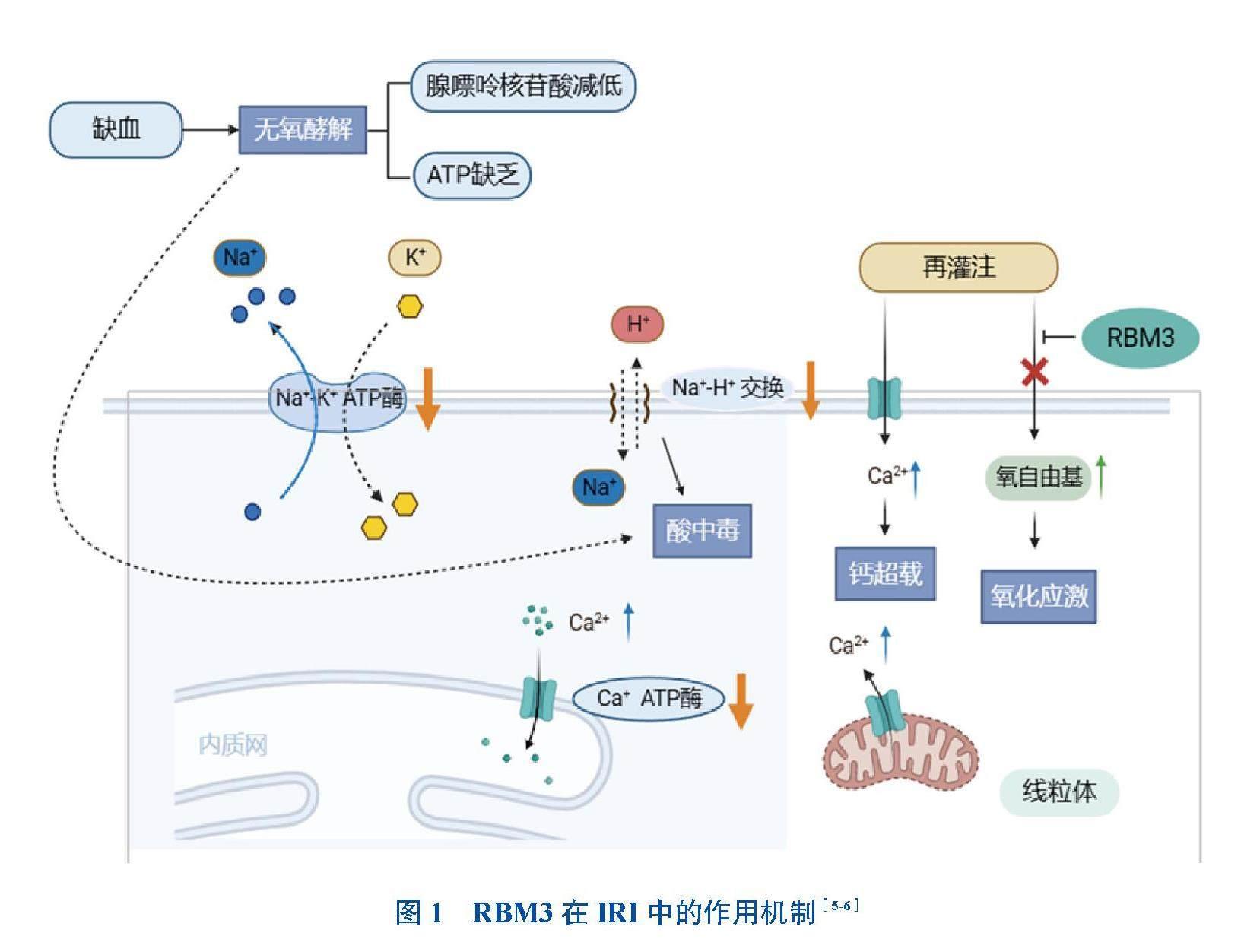
缺血再灌注損傷(IRI)是指組織缺血一段時間后血流恢復時,組織損傷進一步加重、器官功能進一步惡化的綜合征[1-2]。其誘導的氧化應激,伴隨炎癥反應,導致多種疾病的發病率和病死率進一步升高。當機體溫度降低時,生物體會產生一組蛋白來適應環境的變化,此類蛋白通常被稱為冷休克蛋白。RNA結合基序蛋白3(RBM3)是冷休克蛋白家族中重要的一員,在其N端擁有一個RNA識別結合區域,包含兩個核糖核蛋白結構域[3]。據最近的報道,RBM3參與哺乳動物的冷應激過程,這種蛋白質在各種正常細胞、組織和器官中以低水平表達,但在低溫的刺激下表達可以上調[4]。在冷應激反應過程中,RBM3可以結合并改變信使核糖核酸(mRNA)的翻譯,起到抗氧化和抑制細胞增殖的作用。在一項冬眠棕熊的報道中,增加RBM3的表達有助于冬眠期間棕熊肌肉質量的維持和減輕氧化應激[5]。有研究者發現,低溫狀態上調小鼠RBM3蛋白可促進蛋白激酶B(AKT)磷酸化,增強葡萄糖無氧酵解,減少骨骼肌細胞凋亡,提示低溫誘導的RBM3具有減少細胞凋亡的作用[6]。上述研究提示,亞低溫減輕氧化應激損傷與低溫誘導RBM3表達升高可能相關(圖1)[5-6]。有關RBM3減輕氧化應激損傷的機制,尚未見有進一步的闡明,為此本文結合近年來各器官IRI研究的最新進展進行綜述,以了解RBM3在IRI中的具體作用機制。
一、RBM3與腦IRI
大腦雖然只占體質量的2%,卻消耗人體約20%的腺苷三磷酸(ATP),其受損對各年齡段人群均可造成毀滅性的損傷,從而導致神經系統疾病的發生。新生兒出生時窒息、缺氧是新生兒腦病和終身神經系統后遺癥的主要原因[7]。缺血誘導的神經炎癥導致浸潤的免疫細胞釋放炎癥介質,募集多種免疫細胞和神經膠質細胞。這些免疫反應細胞雖然限制腦損傷的程度,但同時可能促使小膠質細胞的過度活化,釋放的細胞促炎因子可導致血-腦屏障破壞、神經元損傷和腦水腫,促進神經元進一步凋亡并損害神經可塑性,最終加劇神經功能破壞[8]。當血流恢復到缺血的腦組織區域時,就會發生再灌注損傷[9]。然而,血流再灌注后由于自由基氧化物和過氧亞硝酸鹽的過度形成和免疫系統的激活,再氧合也會導致繼發性損傷[10]。據報道,RBM3通過在晝夜節律過程中選擇性地結合不同的poly(A)尾位來調節蛋白質表達。當體溫正常時,敲低RBM3不影響神經發生過程;當冷應激下RBM3被抑制時,原發性神經干細胞(NSC)的神經元分化和增殖減少[11]。這些結果證實了RBM3在低溫下參與大腦皮層的發育,可能與神經保護功能有關。Peretti等[12] 建立的低溫-復溫式誘導野生型小鼠,結果發現RBM3的表達是通過腦源性神經營養因子(BDNF)-Trk B信號傳導誘導,藥理學Trk B的抑制可阻止朊病毒病小鼠冷卻誘導的神經保護,同時Trk B激動作用誘導RBM3也無需低溫即可具有神經保護作用。研究證明,RBM3在缺血、缺氧條件下維持NSC增殖能力的潛在靶點,且對新生兒和成人原發性NSC增殖具有一致影響[13]。同時有研究表明,過表達RBM3限制缺血誘導的細胞凋亡,提高原發性NSC的增殖率[14]。Zhu等[7]發現,在分化腦區域RBM3促進NSC中胰島素樣生長因子2(IGF2)mRNA結合蛋白2(IMP2)介導IGF2 mRNA的穩定,并促進缺血損傷后IGF2的表達和分泌,其中IMP家族成員和IGF2在細胞增殖中起到至關重要的作用。因此,在缺血、缺氧等病理條件下,RBM3的表達對于神經保護和損傷后神經再生是必不可少的。盡管其潛在的機制和下游通路在某種程度上仍然有待探索,但RBM3的靶向治療在急性腦缺血相關疾病和慢性神經退行性疾病中是安全的,上調RBM3的表達為提高NSC或其他類型干細胞的生存能力、增殖能力和其他潛能開辟一條新途徑,這可能有助提高IRI后的療效。
二、RBM3與心IRI
AMI是一種常見疾病,在世界范圍內發病率和病死率均處于較高水平,IRI是急性心肌梗死后心肌損傷的主要原因,然而其發病機制尚不清楚,因此,確定新的治療靶點尤為重要[15]。多項陰性隨機對照研究顯示,低溫治療是一種有前景的治療方法[16]。為了減輕低溫治療AMI患者的不良反應,應針對低溫治療的局限性開發解決方案。在一項探究低溫對IRI心肌功能的作用研究中,研究人員將全身麻醉的母豬冠狀動脈左前降支閉塞90 min,連續再灌注,30 min后,用溫鹽水或冷鹽水對心包沖洗60 min[17]。結果顯示低溫誘導后梗死心肌中的自噬通量、線粒體自噬、線粒體質量和功能的顯著增加,而細胞氧化應激、細胞凋亡、炎癥和心肌纖維化減少,梗死后心臟的收縮和舒張功能可以得到保留。結果表明,心肌細胞自噬和線粒體自噬是低體溫條件下心肌梗死后心肌細胞恢復的重要機制,針對這些途徑的新治療策略可以改善心力衰竭的預后,但未對自噬的上游信號分子進行說明。近期的一項研究給出部分解釋,該研究在體內和體外構建心肌缺血再灌注模型,并觀察到低溫誘導的RBM3表達對缺血再灌注條件下的心肌細胞凋亡具有標志性作用[18]。在低溫的條件下,RBM3的上調可能會干擾促凋亡信號通路p38和c-Jun氨基末端激酶(JNK),從而減少促凋亡蛋白Bax和Bad的表達;當下調RBM3表達時,將抑制心肌細胞自噬,促進細胞凋亡。此研究證實RBM3通過自噬途徑對IRI誘導的心肌細胞具有保護作用,提示上調RBM3的表達可能替代低溫治療,從而減少低溫治療對其他組織細胞的不良影響。近年來,研究人員發現Elabela可以激活α7煙堿型乙酰膽堿受體/Janus激酶2 /信號轉導子和轉錄激活子3(α7nAChR/JAK2/STAT3)信號通路,從而降低H2O2誘導的大鼠心肌細胞凋亡率, 降低心肌細胞凋亡相關蛋白Bax的產生、活性氧(ROS)陽性細胞數、乳酸脫氫酶和丙二醛(MDA)水平,同時增加超氧化物歧化酶(SOD)活性和Bcl-2表達,從而發揮心肌細胞的保護作用[19]。研究揭示了一條新的信號通路,為尋找RBM3下游分子提供新思路。
三、RBM3與肝IRI
肝IRI在臨床上是一種嚴重而常見的并發癥,是肝移植后肝損傷和肝衰竭的主要原因之一。IRI激活枯否細胞,導致ROS的產生,ROS的累積會導致肝細胞凋亡和壞死,并激活相關免疫、炎癥反應[20]。既往的研究已經報道多種改善肝IRI的保護性策略,包括藥物治療、缺血預處理、缺血后處理和機器再灌注等,但仍處于動物模型研究階段,目前臨床上還沒有可行的藥物可保護肝臟免受IRI的影響。治療性低溫作為一種潛在的治療方式來改善肝IRI的概念越來越受到研究人員的重視。美國學者的一項研究發現,與常溫環境下的肝IRI大鼠相比,經低溫處理大鼠的ALT和AST以及組織學評分、肝細胞壞死降低,IL-6、IL-10 和TNF-α水平下降,且大鼠體內電解質和血糖恢復更快[21]。此項研究提示低溫預處理對改善肝IRI的預后具有重要意義,但其潛在的機制和確切的治療靶點還有待闡明。近年來的一項研究也得出類似結論,亞低溫可明顯逆轉IRI誘導的肝細胞凋亡,對肝IRI有所改善,且ALT和AST水平有所降低,抗氧化劑SOD的產生增加、氧化物質ROS的產生減少[22]。同時,亞低溫預處理氧和葡萄糖剝奪組RBM3的表達水平也高于氧和葡萄糖剝奪再灌注組,表明RBM3的高表達可能與亞低溫的肝臟保護作用有關。研究者發現,在用于移植的供肝冷藏液中加入p38抑制劑可以顯著提高移植物的生存能力和受體的存活率,研究人員通過分析亞低溫對p38和JNK信號通路以及細胞凋亡的影響,認為RBM3的過表達通過抑制IRI誘導的p38和JNK信號通路,從而保護肝臟免受IRI誘導的氧化應激損傷和細胞凋亡。這一重要發現提示,亞低溫可以誘導RBM3表達來改善肝IRI,其可能主要通過阻斷p38和JNK信號通路實現保護作用。
四、RBM3與腎IRI
相對于腦、心、肝而言,低溫對腎臟保護方面的研究較少。腎IRI是指腎臟血流中斷后,血流恢復反而引起腎功能不全和組織損傷加重的現象,是導致急性腎損傷(AKI)的主要因素之一。AKI是腎臟病患者死亡的主要病因,其發病率高、預后差,嚴重威脅人類生命健康,以腎小球濾過率突然下降、腎功能急劇減退為特征,表現為血清肌酐增加、尿量減少、電解質和酸堿平衡紊亂。然而,目前對腎IRI的發生機制尚未研究清楚,也缺乏高效的方法預防或治療腎IRI。氧化應激作為IRI的重要病理表現,也是導致細胞凋亡的重要過程。2021年一項低溫腎移植氧化應激標志物的研究顯示,低溫對移植腎的保護作用與降低IRI氧化應激反應有關[23]。2020年有報道稱在腎移植手術過程中實行中心溫度<35 ℃,可以明顯減少AKI的發生,可能與低溫減少IRI引起的炎癥反應有關[24]。在新生兒窒息缺氧后給予亞低溫治療對腎功能的研究也得出類似結論,亞低溫治療可減少AKI的發生、減少血清肌酐升高和血清乳酸的累積、促進腎功能的恢復,可能與低溫抑制全身炎癥反應有關[25]。基礎研究顯示,亞低溫預處理后腎IRI大鼠細胞凋亡率低于未經低溫處理腎IRI大鼠,提示亞低溫預處理可減少細胞凋亡,Bcl-2/Bax比值升高,表明細胞抗凋亡能力增強,其作用機制可能與亞低溫通過上調RBM3蛋白抑制細胞凋亡有關[26]。研究者通過檢測MDA含量和SOD活性來評估氧化應激損傷,結果顯示低溫預處理后腎IRI大鼠的MDA含量較未低溫處理腎IRI大鼠減少,SOD 活性較IRI組升高,提示亞低溫處理可降低 MDA含量和提升SOD活性,表明亞低溫治療可以減輕大鼠腎IRI的氧化損傷并改善抗氧化防御系統。近年國外的一項研究也證實了這一結論,低溫在腎缺血期通過保留線粒體功能,在再灌注期通過調節全身和局部炎癥反應減少全身和局部IL-6,上調TNF-α mRNA表達和下調IL-1β mRNA表達,從而減輕腎損傷和組織學損傷[27]。
五、RBM3與其他疾病
腸移植已成為治療不可逆腸衰竭的重要方法,然而腸移植極易受IRI的影響,引起腸黏膜屏障破壞、絨毛壞死和脫落,導致腸壁通透性增加,腸道菌群異位和腸液滲出,不僅損害腸道吸收功能,還會引起全身炎癥反應綜合征,甚至敗血癥和MODS。有研究者發現低溫可以抑制Toll樣受體4/核轉錄因子-κB信號通路和半胱天冬酶-3的活化,從而減少炎癥因子的釋放,同時增加抗炎因子的表達,有利于維持腸黏膜屏障的正常結構[28]。此外,有研究者發現RBM3的表達在脂多糖(LPS)誘導的急性肺損傷小鼠肺組織中顯著上調,RBM3可通過抑制p53表達減少LPS誘導的細胞凋亡,增加細胞活性,保護細胞在缺血時避免受到傷害,可能在組織修復和發育過程中發揮重要作用[29]。敲除RBM3基因的小鼠存活率較低,RBM3缺失的小鼠肺部損傷、炎癥、肺組織細胞凋亡和氧化應激比正常小鼠更加嚴重[30]。
六、結語與展望
RBM3作為一種多功能的蛋白,其表達增強對缺血再灌注組織具有保護作用,因此探究其生理及病理學功能具有重要價值。同時,將其作為治療靶點時,代替亞低溫治療,可避開低溫造成的負面損傷,激活下游通路,抑制炎癥反應、減少細胞凋亡和減輕氧化應激,達到亞低溫治療相同或更佳的治療效果,且可減輕冷休克損傷。但目前有關RBM3對IRI的研究仍然有限,未來方向應該充分研究RBM3與IRI相關血流動力學、組織學聯系,探尋RBM3介導的信號途徑和新受體,并闡明其與其他因子及藥物的相互影響,以及如何運用于臨床預防和治療,從而為治療IRI相關疾病提供新思路。
參 考 文 獻
[1] Cai J, Chen X, Liu X, et al. AMPK: the key to ischemia-reperfusion injury[J]. J Cell Physiol, 2022, 237(11): 4079-4096.
[2] Patel N, Johnson M A, Vapniarsky N, et al. Elamipretide mitigates ischemia-reperfusion injury in a swine model of hemorrhagic shock[J]. Sci Rep, 2023, 13: 4496.
[3] Roy S, Boral S, Maiti S, et al. Structural and dynamic studies of the human RNA binding protein RBM3 reveals the molecular basis of its oligomerization and RNA recognition[J]. FEBS J, 2022, 289(10): 2847-2864.
[4] Liu J, Wei Q, Jin Y, et al. Cold-induced RNA-binding protein and RNA-binding motif protein 3: two RNA molecular chaperones closely related to reproductive development and reproductive system diseases[J]. Protein Pept Lett, 2023, 30(1): 2-12.
[5] Chazarin B, Ziemianin A, Evans A L, et al. Limited oxidative stress favors resistance to skeletal muscle atrophy in hibernating brown bears (ursus arctos) [J]. Antioxidants, 2019, 8(9): 334.
[6] Liu Y, Shi H, Hu Y, et al. RNA binding motif protein 3 (RBM3) promotes protein kinase B (AKT) activation to enhance glucose metabolism and reduce apoptosis in skeletal muscle of mice under acute cold exposure[J]. Cell Stress Chaperones, 2022, 27(6): 603-618.
[7] Zhu X, Yan J, Bregere C, et al. RBM3 promotes neurogenesis in a niche-dependent manner via IMP2-IGF2 signaling pathway after hypoxic-ischemic brain injury[J]. Nat Commun, 2019, 10: 3983.
[8] Alsbrook D L, Di Napoli M, Bhatia K, et al. Neuroinflammation in acute ischemic and hemorrhagic stroke[J]. Curr Neurol Neurosci Rep, 2023, 23(8): 407-431.
[9] Li M, Tang H, Li Z, et al. Emerging treatment strategies for cerebral ischemia-reperfusion injury[J]. Neuroscience, 2022, 507: 112-124.
[10] Lee J W, Hwang E T, Han J S. Protective effects of topical application of nitrite on testicular ischemia-reperfusion injury in rats[J]. Oxid Med Cell Longev, 2021, 2021: 5514537.
[11] Xia W, Su L, Jiao J. Cold-induced protein RBM3 orchestrates neurogenesis via modulating Yap mRNA stability in cold stress[J]. J Cell Biol, 2018, 217(10): 3464-3479.
[12] Peretti D, Smith H L, Verity N, et al. TrkB signaling regulates the cold-shock protein RBM3-mediated neuroprotection[J]. Life Sci Alliance, 2021, 4(4): e202000884.
[13] Yan J, Goerne T, Zelmer A, et al. The RNA-binding protein RBM3 promotes neural stem cell (NSC) proliferation under hypoxia[J]. Front Cell Dev Biol, 2019, 7: 288.
[14] Zhang J, Chai W, Xiang Z, et al. MZF1 alleviates oxidative stress and apoptosis induced by rotenone in SH-SY5Y cells by promoting RBM3 transcription [J]. J Toxicol Sci, 2021, 46(10): 477-486.
[15] 劉思齊, 楊正飛. 鐵死亡: 心肌缺血再灌注損傷分子機制和藥物治療研究新靶點[J]. 中山大學學報(醫學科學版), 2022, 43(5): 712-719.
Liu S Q, Yang Z F. Ferroptosis: novel research targets of molecular mechanism and drug therapy for myocardial ischemia-reperfusion injury[J]. J Sun Yat Sen Univ Med Sci, 2022, 43(5): 712-719.
[16] El Farissi M, Keulards D C J, Zelis J M, et al. Hypothermia for reduction of myocardial reperfusion injury in acute myocardial infarction: closing the translational gap[J]. Circ Cardiovasc Interv, 2021, 14(8): e010326.
[17] Marek-Iannucci S, Thomas A, Hou J, et al. Myocardial hypothermia increases autophagic flux, mitochondrial mass and myocardial function after ischemia-reperfusion injury[J]. Sci Rep, 2019, 9: 10001.
[18] Wang N, Wang L, Li C, et al. RBM3 interacts with Raptor to regulate autophagy and protect cardiomyocytes from ischemia-reperfusion-induced injury[J]. J Physiol Biochem, 2023, 79(1): 47-57.
[19] 杜勝利, 張大鵬, 賈增芹. Elabela通過α7nAChR/JAK2/STAT3信號通路改善心肌缺血/再灌注損傷的機制研究[J]. 新醫學, 2022, 53(9): 670-677.
Du S L, Zhang D P, Jia Z Q. Mechanism of Elabela alleviating myocardial ischemia/reperfusion injury through α7nAChR/JAK2/STAT3 signaling pathway[J]. J New Med, 2022, 53(9): 670-677.
[20] Singh K, Gupta J K, Kumar S, et al. Hepatic ischemia-reperfusion injury: protective approaches and treatment[J]. Curr Mol Pharmacol, 2024, 17: e030823219400.
[21] Nunes G, Ramos Figueira E R, Rocha-Filho J A, et al. Hypertonic saline solution decreases oxidative stress in liver hypothermic ischemia[J]. Surgery, 2021, 169(6): 1512-1518.
[22] Xiao Q, Liu Y, Zhang X, et al. Mild hypothermia ameliorates hepatic ischemia reperfusion injury by inducing RBM3 expression[J]. Apoptosis, 2022, 27(11/12): 899-912.
[23] Tejchman K, Sierocka A, Kotfis K, et al. Assessment of oxidative stress markers in hypothermic preservation of transplanted kidneys[J]. Antioxidants, 2021, 10(8): 1263.
[24] Oh T K, Ryu J H, Sohn H M, et al. Intraoperative hypothermia is associated with reduced acute kidney injury after spine surgery under general anesthesia: a retrospective observational study[J]. J Neurosurg Anesthesiol, 2020, 32(1): 63-69.
[25] Zhang P, Tong Y, Liu J, et al. The lower threshold of hypothermic oxygen delivery to prevent neonatal acute kidney injury[J]. Pediatr Res, 2022, 91(7): 1741-1747.
[26] 宋克芹, 肖琦, 肖建生, 等. 亞低溫上調冷休克蛋白RBM3表達減輕腎臟缺血-再灌注損傷[J]. 器官移植, 2021, 12(5): 571-578.
Song K Q, Xiao Q, Xiao J S, et al. Mild hypothermia alleviates renal ischemia-reperfusion injury by up-regulating the expression of cold-shock protein RBM3[J]. Organ Transplant, 2021, 12(5): 571-578.
[27] Schleef M, Gonnot F, Pillot B, et al. Mild therapeutic hypothermia protects from acute and chronic renal ischemia-reperfusion injury in mice by mitigated mitochondrial dysfunction and modulation of local and systemic inflammation[J]. Int J Mol Sci, 2022, 23(16): 9229.
[28] Hou W, Yang S, Lu J, et al. Hypothermic machine perfusion alleviates ischemia-reperfusion injury of intestinal transplantation in pigs[J]. Front Immunol, 2023, 14: 1117292.
[29] Feng J, Pan W, Yang X, et al. RBM3 increases cell survival but disrupts tight junction of microvascular endothelial cells in acute lung injury[J]. J Surg Res, 2021, 261: 226-235.
[30] Long F, Hu L, Chen Y, et al. RBM3 is associated with acute lung injury in septic mice and patients via the NF-κB/NLRP3 pathway[J]. Inflamm Res, 2023, 72(4): 731-744.
(收稿日期:2023-10-10)
(責任編輯:林燕薇)

