耐亞磷酸鹽除草劑轉基因油菜的創建和抗性評價
鐘 元 朱天宇 戴 成 馬朝芝
耐亞磷酸鹽除草劑轉基因油菜的創建和抗性評價
鐘 元 朱天宇 戴 成 馬朝芝*
華中農業大學作物遺傳改良全國重點實驗室 / 國家油菜工程技術研究中心 / 洪山實驗室, 湖北武漢 430070
在油菜的生產過程中, 大量伴生的雜草嚴重影響了其產量和品質。由于近年來田間抗除草劑雜草數量的增加, 除草劑的選擇正在迅速減少, 這影響了未來農業的可持續發展。植物可以通過正磷酸鹽(Pi)轉運蛋白吸收亞磷酸鹽(Phi), 但Phi不能被代謝為作物的磷肥料, 導致植物生長受到抑制。此前, 從羅爾斯通菌屬(sp. strain 4506)中分離出了(phosphite dehydrogenase)基因, 其139位的酪氨酸突變為谷氨酰胺(Y139Q)的突變蛋白ptxDQ催化Phi轉化為Pi的活性顯著提高。為了評價ptxD/Phi系統對甘藍型油菜雜草的防治效果, 本研究獲得了帶有密碼子優化的(Y139Q,ptxD)基因的轉基因甘藍型油菜。在以Phi為單一磷元素的條件下,ptxD轉基因油菜可以正常生長, 體內Pi含量顯著提高, 且Pi饑餓響應基因(和等)的表達水平被顯著抑制, 說明ptxD在油菜體內可以促使Phi轉化為Pi。此外,ptxD轉基因油菜具有比野生型油菜和單子葉雜草(狗尾草)更強的生長競爭優勢。綜上所述,ptxD/Phi是一種有效的油菜磷利用和雜草控制系統, 既可以抑制雜草的生長, 又可以為作物提供充足的Pi營養, 從而提高了農業的可持續性。
甘藍型油菜; 除草劑; 亞磷酸鹽;
油菜是十字花科蕓薹屬植物, 主要有油用、菜用和觀賞等用途[1]。在油菜整個生長周期中, 田間常會有大量的雜草伴生, 對油菜的產量和品質產生影響, 雜草會與油菜爭奪肥、光、水和生存空間等, 造成油菜減產10%~15%, 嚴重的甚至會減產50%以上[2]。為了保障和穩定油菜安全生產, 必須提高對草害的防治效率。目前, 化學防治是農業現代化進程中應用最為廣泛的雜草防治方法。相較于人工除草、輪作、生物防治、淺耕滅草等傳統技術, 化學除草效果顯著、人工成本低且不改變土層結構。然而農藥的大量使用不僅會破壞土壤中的生物多樣性, 還會危害人體健康[3]。現階段, 除草劑被廣泛用于控制雜草。乙胺磺隆、苯唑啉乙基和喹唑磷乙基(苯磺隆、草甘膦、草銨膦)都是油菜地常用的除草劑[4-6]。然而化學除草劑長期過量使用, 會導致農田中抗除草劑雜草數量急劇增加。因此, 迫切需要開發能夠有效治理雜草的新工具, 特別是非除草工具, 以有效地管理雜草。
磷(P)是一種必需的常量營養素, 它通過被吸收成重要的細胞成分而起著至關重要的作用, 是所有生物體所必需的[7-9]。磷酸鹽主要有2種形式, 正磷酸鹽(Pi)和亞磷酸鹽(Phi)[10-12]。Phi是Pi的一種簡化形式, 其中一個氧原子被氫原子取代[13], 它被廣泛用于控制卵菌病原菌引起的植物真菌病害[14-16]。雖然植物可以通過Pi轉運體吸收Phi, 但Phi不能被代謝為作物的磷肥[17-19]。亞磷酸酯脫氫酶()基因來源于細菌(如WM88), 它編碼一種催化Phi氧化成Pi的酶[18,20]。轉基因株系使植物將Phi作為磷的唯一來源進行發育[21-23],/Phi系統作為雜草控制的非除草劑工具, 已成功應用于許多作物中, 如水稻、玉米和棉花等[19,23-24]。此外,/Phi系統在不使用抗生素/除草劑抗性基因的轉基因植物中具有很大的潛力[25-26]。
從sp. 4506(PtxDR4506)中分離到基因[27], 通過定向進化獲得了第139位酪氨酸突變為谷氨酰胺的ptxD突變蛋白(Y139Q, ptxDQ), 其催化Phi轉化為Pi的效率比PtxDR4506提高了5.8倍[27]。在此基礎上, 我們優化了ptxD的密碼子, 構建了轉化油菜的雙元載體pCambia1300-ptxD, 將載體轉化到油菜, 獲得了ptxD轉基因油菜株系。轉基因株系可以在只有Phi存在的情況下正常生長, 且在提供Phi的條件下可抑制Pi饑餓誘導的基因的表達水平, 表明ptxD轉基因油菜可以將Phi轉化為Pi, 從而提供其生長所需的Pi。此外, 當P以Phi的形式供給時,ptxD轉基因甘藍型油菜在人工基質中的競爭優勢超過了狗尾草()這類單子葉雜草。以上結果表明,ptxD/Phi技術是一種較好的油菜雜草抑制系統。
1 材料與方法
1.1 試驗材料和生長條件
以甘藍型油菜‘Westar’為材料進行植株轉化。所有野生型(Westar、B409和Damor)和轉基因植株均在20~23℃、光照強度為100 μmol m–2s–1、相對濕度為60%的溫室中生長(光照/暗時間16 h/8 h)。
1.2 載體構建
本研究以pcb11-P139Q為模板(華中農業大學植物科學技術學院吳高兵老師惠贈), 用ptxD基因特異性引物進行片段PCR擴增, 跑膠確認目的基因ptxD擴增產物。再與線性化后的載體進行重組, 轉化大腸桿菌DH5α, 挑取單克隆進行PCR檢測, 陽性菌株送公司經測序確認, 提取質粒并保存于–20℃, 得到植物表達載體-ptxD。進一步用電轉法將新構建的植物表達載體p1300-ptxD轉入農桿菌, 28℃培養36~48 h后挑選單菌落, 用引物ptxD-F、ptxD- R進行陽性鑒定。相關引物見表1。
1.3 甘藍型油菜轉基因植株的產生與篩選
在獲得-ptxD載體后, 通過農桿菌介導的油菜遺傳轉化獲得轉基因株系。農桿菌介導的甘藍型油菜的轉化過程參考實驗室先前的研究方法[28]:將構建的載體轉農桿菌后侵染油菜受體材料Westar的下胚軸, 經過組織培養的繼代轉化方式獲得陽性苗。用Hygromycin B (120 μg mL–1)、Phi (1 mmol L–1)或Phi + Pi (1.5 mmol L–1+ 0.5 mmol L–1)篩選陽性愈傷組織和轉基因植株。其中M2是愈傷誘導培養基, M3、M4分別是芽分化與根誘導的培養基。利用ptxD基因特異性引物對T0代轉基因系進行PCR擴增。相關引物見表1。
1.4 RNA提取和qRT-PCR分析
葉片組織收集自ptxD的轉基因系和有或無Phi處理的野生型油菜。利用RNA Prep Pure Plant Kit (Cat. No. LS1040, Promega, 美國)試劑盒提取植物組織RNA, 利用Transcript RT kit (Cat. No. AE311, TransGen Biotech, 中國)反轉錄獲得cDNA, 反轉錄產物稀釋100倍作為模板。為內參基因。qRT-PCR反應體系為2×SYBR Green Master Mix 5 μL, 包含上下游引物各0.4 μL、cDNA模板4.2 μL。qRT-PCR反應程序為95℃ 5 min; 95℃ 30 s, 59℃ 1 min, 72℃ 10 min, 30個循環。每個處理3個生物學重復, 依照2–ΔΔCt方法分析基因相對表達量。相關引物見表1。
1.5 油菜磷元素含量的測定
將ptxD的T1代轉基因系和甘藍型油菜‘Westar’在Hoagland培養基中萌發1周, 然后使用無P、Pi (KH2PO4)和不同Phi (KH2PO3)濃度的營養液中再萌發2周。將0.2~0.3 g完全干燥的樣品磨成粉末, 加入30 mL去離子水轉移到50 mL容量瓶中。然后加入2滴2,6二硝基苯酚指示劑, 用6 mol L–1NaOH調節pH至黃色, 加入10 mL鉬酸釩銨溶液混合均勻,最后用水定容。采用分光光度計(UV2100, UNICO, 中國)在440 nm波長處測定無機Pi的濃度。以適當濃度的KH2PO4作為標準。根據公式計算磷含量: P (μg g–1葉鮮重) = C × (V/W)。式中: C為提取液的磷含量(μg mL–1); V為提取液的體積(mL); W為樣品鮮重(g)。
1.6 轉基因甘藍型油菜的生長
以無磷MS培養基(不含KH2PO4, 貨號PM1011- P)為基礎, 添加不同濃度的KH2PO3(1 mmol L–1、2 mmol L–1、4 mmol L–1和8 mmol L–1)和1 mmol L–1的KH2PO4, 將油菜種子播種到這些培養基上, 生長7 d后, 觀察其生長表現。
營養液水培: 將生長7 d左右的幼苗用海綿固定在穴盤上面, 使用無P、1 mmol L–1Pi和4 mmol L–1Phi的營養液水培, 在溫室(16 h光照, 8 h黑暗)繼續培養。
營養液土培: 將T1子代培養在沙子︰蛭石=1︰1的塑料托盤中, 并用含無P、1 mmol L–1Pi、4 mmol L–1Phi和8 mmol L–1Phi的營養液澆灌, 在溫室進行培養。
在播種后2周測量其鮮重、株高和根長, 用SPAD-502儀測定葉片葉綠素含量。每次加入的所有分析至少重復3次。在一個重復中, 每組數量為15~20株。
1.7 雜草的競爭試驗
為了檢驗ptxD/Phi系統對雜草(狗尾草)的防治效果, 將T1子代、野生型Westar油菜和雜草播種在塑料托盤中, 用沙子︰蛭石=1︰1, 用含有8 mmol L–1Phi或1 mmol L–1Pi的營養液作為P源澆灌3周。在競爭試驗中, 在試驗結束當天, 對每個處理的代表性托盤進行拍照, 并確定植物的生長參數。所有參數采用SPSS Statistics Base (version 22)軟件進行統計分析。采用單因素方差分析和檢驗評估顯著差異。

表1 本研究中使用的引物
2 結果與分析
2.1 創建ptxDQ轉基因甘藍型油菜
由于缺乏Phi分解代謝酶, 植物的生長發育會受到Phi的抑制[29-30]。本研究首先考察了甘藍型油菜Westar對Phi處理是否敏感。以無磷MS培養基(不含KH2PO4)為基礎, 添加不同濃度的KH2PO3(1 mmol L–1、2 mmol L–1、4 mmol L–1和8 mmol L–1)和1 mmol L–1的KH2PO4, 將Westar種子播種到這些培養基上, 生長7 d后, 觀察其生長表現。與無P條件下生長的Westar植株相比, 在1 mmol L–1Pi條件下的幼苗生長良好, 下胚軸長度約為無P條件下長度的1.4倍(圖1-a, b)。在Phi條件下, 甘藍型油菜Westar的根長和鮮重受到抑制, 且與Phi的濃度呈正相關關系, 當Phi濃度為8 mmol L–1時, 其鮮重和根長分別下降了約49%和65% (圖1-c, d), 說明甘藍型油菜Westar對Phi處理敏感。為了分析Phi是否對不同生態型油菜都具有抑制作用, 本研究分析了3種油菜品系Westar、Damor和B409在水培條件下對Phi的敏感度。將在正常條件下萌發7 d的油菜幼苗轉移到含有4 mmol L–1Phi或1 mmol L–1Pi的Hoagland培養液中(附圖1-a), 生長2周后發現, 與Pi處理相比, 在Phi處理下的Westar、Damor和B409生長都受到了嚴重的抑制(附圖1-b), 其中根長下降了25%左右(附圖1-c), 鮮重下降了62.5%左右(附圖1-d), 表明Phi對不同的油菜品系都有抑制作用。
在此之前, 從sp. 4506菌株中克隆了基因(PtxD), 蛋白序列分析結果表明, PtxDR4506與假單胞桿菌來源的PtxD蛋白(PtxDWM88)同源性為54 % (附圖2)。在PtxD基礎上, 通過定向進化獲得了第139位酪氨酸突變為谷氨酰胺的ptxD突變蛋白(Y139Q, ptxDQ), 其催化Phi轉化為Pi的效率比PtxDR4506提高了5.8倍[27]。為檢測ptxDQ在油菜中是否具有生物學功能, 我們將ptxD的基因序列進行密碼子優化, 進一步擴增ptxD基因片段, 構建到pCambia1300載體中, 獲得載體p1300- ptxDQ(圖1-e)。其中35S啟動子驅動ptxD基因表達(圖1-e), 此外該載體還包含一個潮霉素抗性基因的位點(HygR) (圖1-e)。
/Phi系統在多個植物中已經證明可以用于轉基因植株的篩選[17,19,22-23,25-26]。為了驗證/Phi系統是否可以用于轉基因油菜的篩選, 本研究將p1300-ptxD載體轉化至油菜受體Westar中, 分別以HygB (120 μg mL–1)、Phi (1 mmol L–1)和Phi + Pi (1.5 mmol L–1+0.5 mmol L–1)為篩選劑篩選陽性愈傷。在HygB為篩選劑的條件下, 油菜愈傷可以正常膨大并分化出芽(圖1-f)。在以Phi為單一磷元素的條件下, 油菜愈傷雖然可以分化, 但是在芽分化培養基上(M3), 愈傷不能正常膨大, 且沒有分化出芽(附圖3-a), 說明在Phi為單一磷元素的篩選條件下, 不能獲得油菜轉基因株系。在Phi + Pi (1.5 mmol L–1+ 0.5 mmol L–1)篩選條件下, 愈傷組織和芽均生長良好(圖1-f, g)。其中, 81.47%~90.32 %的外植體在Phi + Pi篩選條件下轉化為愈傷, 29.23%~49.07%的外植體在HygB條件下轉化為愈傷(表2)。0.64%~1.73%外植體在Phi + Pi篩選條件下分化出正常生長的植株; 3.22%~4.17%外植體在HygB篩選條件下分化出正常生長的植株(表2)。最終獲得了油菜轉化再生苗共41株, 其中基于Pi+Phi篩選得到了11株, 基于HygB篩選得到了30株(表2)。
為了進一步驗證篩選所獲得的植株是陽性轉基因株系, 本研究設計了特異性擴增ptxD基因片段的引物。PCR結果顯示, 通過HygB篩選所獲得的30株再生苗均擴增出1009 bp大小的特異性條帶(附圖3-b), 而通過Pi+Phi篩選得到的11株再生苗未擴增出目的條帶(附圖3-b)。說明, 目前的組培篩選條件(Phi + Pi: 1.5 mmol L–1+ 0.5 mmol L–1)不適用于油菜轉基因株系的篩選。進一步通過RT-PCR鑒定ptxD基因在轉基因株系中的表達水平。與野生型對照(Westar)相比, 6個轉基因株系(L1、L4、L5、L10、L22和L24)均檢測到ptxD基因的表達(圖1-h)。進一步通過qRT-PCR驗證上述6個轉基因株系中ptxD基因的表達水平。結果顯示,ptxD基因在5個轉基因株系(L1、L4、L5、L10和L22)中的表達水平均顯著高于野生型對照(Westar) (圖1-i), 其中L5和L10的表達量最高。此外, 我們檢測了ptxD基因在L10株系各個組織中的表達水平, RT-PCR結果顯示L10植株的根、莖、葉樣品均擴增出216 bp的目的條帶(附圖3-c), 說明ptxD基因在L10轉基因油菜植株的根、莖、葉中都有表達。最終選擇表達量較高的2個轉基因油菜株系L5和L10進行后續研究。

圖1 含有密碼子優化ptxDQ的轉基因甘藍型油菜的產生
(a) 甘藍型油菜Westar在Pi和不同Phi濃度處理7 d后的生長情況。標尺為2 cm。(b) 生長7 d后下胚軸長度的統計情況。(c) 生長7 d后根長的統計情況。(d) 生長7 d后鮮重的統計情況。(e) 植物轉化載體p1300-ptxD示意圖。(f)和(g)以120 μg mL–1Hygromycin B和0.5 mmol L–1Pi +1.5 mmol L–1Phi為篩選劑進行轉化。標尺為2 cm。(h) 油菜再生苗RNA水平的PCR鑒定。(i) 油菜再生苗ptxD基因相對表達量分析。數字編號為不同的油菜再生苗單株, M為marker,為油菜內參基因。使用檢驗進行顯著性檢驗, *、**、***分別表示在0.05、0.01、0.001概率水平差異顯著。
(a): the growth ofWestar treated with Pi and Phi at different concentrations for 7 days. Scale bar: 2 cm. (b): statistics of hypocotyl length after 7 days of growth. (c): statistics on root length after 7 days of growth. (d): Statistics on fresh weight after 7 days of growth. (e): Schematic diagram of the plant transformation vectorp1300-ptxD. (f) and (g): 120 μg mL–1hygromycin B and 0.5 mmol L–1Pi + 1.5 mmol L–1Phi were used as the screening agents for transformation. Scale bar: 2 cm. (h): PCR identification of RNA levels inseedlings. (i): the relative expression level ofptxDgene inregenerated seedlings. The numbers are differentregenerated seedling monocots, M is marker, andisinternal gene. The significance is analyzed by t-test. *, **, and *** mean significant difference at the 0.05, 0.01, and 0.001 probability levels, respectively.
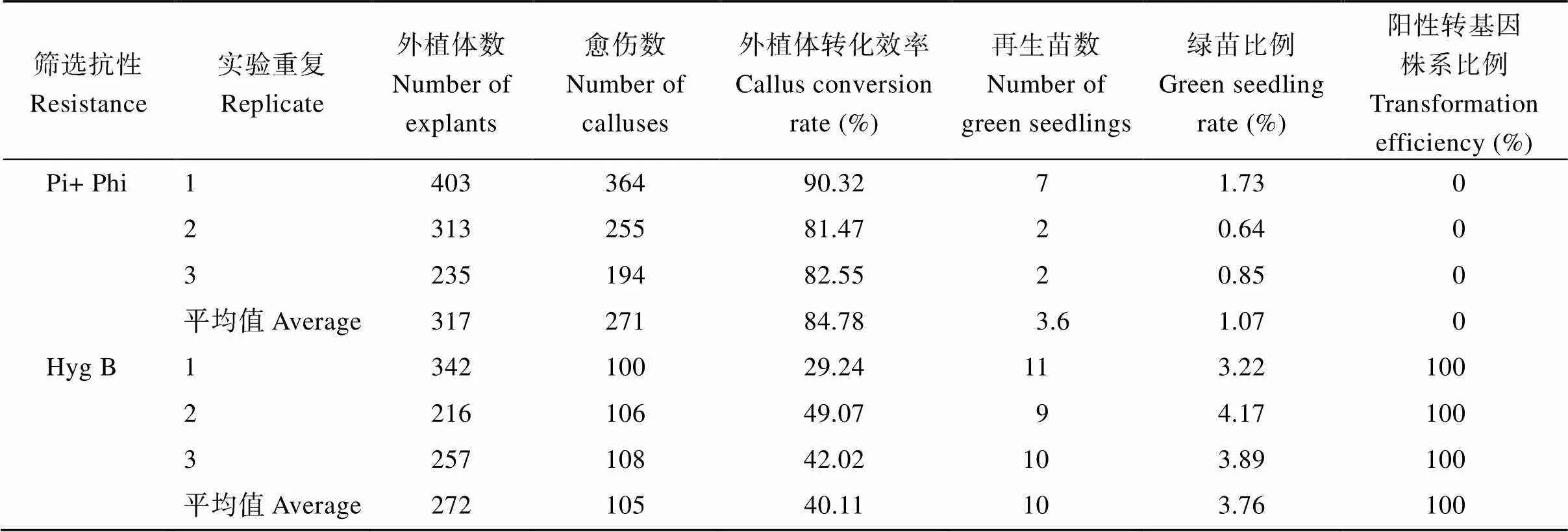
表2 同一載體(pCMBIA1300-PtxDQ)不同篩選劑的轉化情況統計
2.2 ptxDQ轉基因油菜可以利用亞磷酸鹽作為磷的唯一來源
為了研究ptxD過表達的甘藍型油菜是否可以利用亞磷酸鹽轉變為磷酸鹽來供油菜的生長發育, 本研究將對照(Westar)和T1代轉基因植株(L5和L10)分別培養在塑料托盤中, 其中沙子和蛭石的比例為1︰1。分別用含無磷(No P)、4 mmol L–1Phi和1 mmol L–1Pi的Hogland營養液處理。播種14 d后, 在無磷和1 mmol L–1Pi條件下, 對照(Westar)和ptxD過表達株系的生長差異不明顯(圖2-a); 在Phi處理下, 對照(Westar)長勢較弱, 而ptxD過表達株系(L5和L10)長勢相對正常(圖2-a)。播種后56 d時, 與1 mmol L–1Pi處理條件相比, 對照(Westar)在不含P和Phi處理下的生長受到非常強的抑制(圖2-b);ptxD過表達株系(L5和L10)在不含磷和1 mmol L–1Pi處理條件下和對照無顯著差異, 而在外施4 mmol L–1Phi的條件下,ptxD過表達株系可以正常生長(圖2-b)。此外, 對照材料和ptxD過表達株系在Pi處理下在第68天左右開花, 而在Phi處理下,ptxD過表達株系在第76天開花, 對照材料Westar第89天時才開花(圖2-c)。
SPAD-502儀測定葉片葉綠素含量結果顯示, 不含P和Pi處理下的對照材料Westar和T1代ptxD過表達株系的SPAD值沒有顯著差異(圖2-d); 但外施Phi后, 轉基因植株L5和L10的葉綠素水平高于野生型植株Westar (圖2-d)。進一步測定了對照株系Westar和ptxD過表達株系在不同處理條件下植物體內的Pi含量, 結果表明, 對照材料Westar在無P和Pi處理條件下, Pi含量分別為0.25 mg g–1DW和0.90 mg g–1DW,ptxD過表達株系L5和L10在無P和Pi處理條件下, Pi含量也分別在0.25 mg g–1DW和0.95 mg g–1DW, 兩者之間并無顯著差異(圖2-e)。在Phi處理條件下, 對照(Westar)體內Pi含量為0.25 mg g–1DW, 而ptxD轉基因植株的Pi水平為2.0~2.2 mg g–1DW, 顯著高于對照植株(圖2-e)。表明ptxD轉基因株系可以有效地將Phi轉變為Pi, 從而提高轉基因油菜的生物量和葉綠素相對含量。
已有研究結果表明, 擬南芥磷轉運蛋白(、和)和磷響應轉錄因子()編碼基因在植物缺P或低P條件下會顯著上調[31-33]。本研究進一步檢測對照株系(Westar)和T1代ptxD過表達株系(L5和L10)在無P、含有Phi或Pi培養2周后, 磷饑餓誘導基因的表達水平。在對照(Westar)材料中,、、和基因的表達水平在無P和Phi處理下與Pi處理相比顯著提高(圖3), 說明油菜、、和同源基因也受到低磷的誘導。在ptxD過表達株系中,等基因的表達水平在無P的條件下被顯著誘導; 而Phi處理后,等基因的表達水平與Pi處理后的表達水平無顯著差異(圖3)。進一步說明ptxD可以將Phi轉變為Pi, 抑制低磷響應基因的表達水平。
2.3 ptxDQ油菜在Phi處理下比雜草競爭力強
為了檢測Phi作為除草劑的可行性, 我們將對照材料(Westar)、T1代ptxD過表達株系(L5和L10)和單子葉雜草(狗尾草)分別培養在塑料托盤中, 分別用含無磷(No P)、8 mmol L–1Phi和1 mmol L–1Pi的Hogland營養液處理。添加Pi后, 狗尾草、野生型植株Westar和兩個轉基因品系L5和L10生長旺盛(圖4-a, b)。與Pi處理相比, 在Phi處理下野生型植株Westar和狗尾草的生長受到了顯著的抑制, 而ptxD轉基因株系L5和L10無顯著的差異(圖4-a, b)。經Phi處理后, 狗尾草的鮮重顯著降低, 約為Pi處理條件下的54% (圖4-c);ptxD轉基因植株幼苗的鮮重也降低, 約為Pi處理條件下的26%, 與降低了84%的Westar相比, 顯著高于野生型植株Westar和狗尾草(圖4-d)。Phi處理過的ptxD轉基因植株的株高和根長度也沒有受到抑制, 它們比Phi處理過的野生型植株Westar更長(圖4-d), 這表明Phi具有作為苗期前除草劑殺死或抑制田間雜草的潛力。有意思的是, T1代ptxD過表達株系中有部分植株在外施Phi條件下, 植株生長顯著被抑制(圖4-e), 進一步利用ptxD基因特異性引物檢測部分株系(圖4-e中紅框標記)的基因組中是否插入了ptxD基因片段, 通過PCR結果顯示, 生長受抑制的株系均不能擴增ptxD基因特異性條帶(圖4-e), 推測T1代ptxD過表達株系中出現了分離。我們后續會擴大群體, 通過Southern blot等其他方法來檢測其拷貝數和計算分離比。
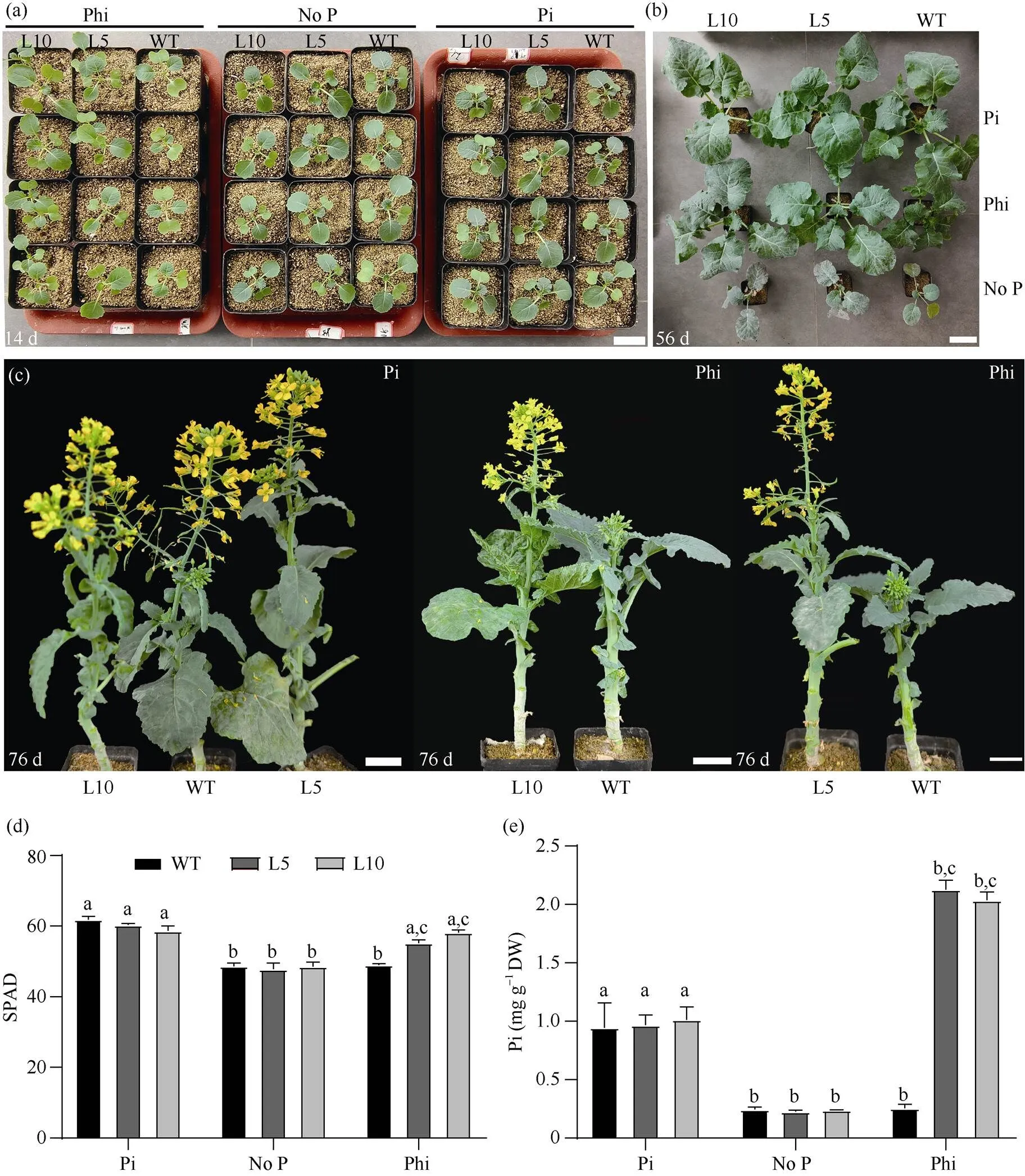
圖2 沙培水培法研究Phi對野生型和ptxDQ轉基因甘藍型油菜植株生長的影響
(a)~(c)野生型植株和2個ptxD轉基因系(L5和L10, T1代)在沙培養(沙 : 蛭石=1:1)中分別生長14 d (a)、56 d (b)和76 d (c), 分別用無P、Pi或Phi營養液處理。(a)~(c)中比例尺分別為3 cm、7 cm、7 cm。(d) 柱狀圖為不含P、Pi或Phi營養液灌溉2周后野生型植株和2個ptxD轉基因品系的SPAD值。(e)柱狀圖為不加P、Pi或Phi營養液灌溉2周后野生型植株和2個ptxD轉基因品系的Pi含量。使用檢驗進行顯著性檢驗: 當≤ 0.05時, 如果用不同的小寫字母標注, 則條形圖代表的值存在顯著差異。
(a)–(c): the image shows the Westar plants and twoptxDtransgenic lines (L5 and L10, T1generation) grown in sand culture (sand : vermiculite = 1:1) for 14-day (a), 56-day (b) and 76-day (c) by irrigating no P, Pi, or Phi nutrient solutions. In (a)–(c), the scale bar was 3, 7, and 7 cm, respectively. (d): bar graph shows the SPAD values of Westar and twoptxDtransgenic lines irrigated by no P, Pi, or Phi nutrient solutions for two weeks. (e): bar graph shows the Pi contents of Westar and twoptxDtransgenic lines irrigated by no P, Pi, or Phi nutrient solutions for two weeks. Different lowercase letter indicates significant difference at≤ 0.05 by-test.
(a)的相對表達量; (b)的相對表達量; (c)的相對表達量; (d)的相對表達量。使用檢驗進行顯著性檢驗: 當≤ 0.05時, 如果用不同的小寫字母標記, 則條形圖代表的值存在顯著差異。
(a): the relative expression level of; (b): the relative expression level of; (c): the relative expression levels of; (d): the relative expression of. Different lowercase letter indicates significant difference at≤ 0.05 by-test.

(圖4)
(a)和(b) Westar、狗尾草和轉基因植株在Pi和Phi處理3周后的生長發育情況, Pi濃度為1 mmol L-1, Phi濃度為8 mmol L-1。(a) 標尺為5 cm; (b) 標尺為2 cm。(c) 柱狀圖為(a)所示43株狗尾草的鮮重。使用檢驗進行顯著性檢驗: ***,< 0.0001。(d) Westar和轉基因植株在Pi和Phi處理3周后的鮮重、株高、根長的情況。(e) T1代轉基因株系中的ptxD特異性條帶的PCR分析。1~5, 表示L10的不同轉基因植株。使用檢驗進行顯著性檢驗: 當≤ 0.05時, 如果用不同的小寫字母標記, 則條形圖代表的值存在顯著差異。
(a) and (b): growth and development of Westar, Setaria, and transgenic plants after 3 weeks of Pi and Phi treatment, Pi concentration was 1 mmol L-1, Phi concentration was 8 mmol L-1, (a) Scale bar: 5 cm; (b) Scale bar: 2 cm. (c): bar graph shows fresh weight ofrepresenting in (a).The significance is analyzed by-test: ***:< 0.0001.(d): fresh weight, plant height, and root length of Westar and transgenic plants after 3 weeks of Pi and Phi treatment. (e):ptxDspecific band in T1transgenic lines by PCR.1-5, indicated different transgenic plants of L10. Different lowercase letter indicates significant difference at≤ 0.05 by-test.
3 討論
油菜田間常伴生著大量的雜草, 嚴重影響了油菜的生產, 加上除草劑(如草甘膦等)過量使用, 油菜田間抗除草劑雜草的數量逐年增加[34-36]。已有研究表明,/Phi系統可以有效控制棉花和煙草中的雜草[19,22], 但是該系統在油菜中的應用還未見報道。本研究將來源于羅爾斯通菌中的ptxD基因轉化到甘藍型油菜,ptxD轉基因油菜能夠在以亞磷酸為唯一磷源的條件下正常生長, 且與雜草相比具有顯著的生長優勢, 為解決磷利用和控制油菜田間雜草提供了一條新途徑。
由于除草劑在農業中的持續大量使用, 抗除草劑雜草的數量急劇增加, 因此需要尋找新的除草劑資源。常規除草劑針對特定的代謝酶, 如草甘膦可以抑制莽草酸途徑(shikimate pathway)中的關鍵酶 5-烯醇式丙酮莽草酸-3-磷酸合酶(EPSPS)的活性[37]。此前已經有很多報道, 將EPSPS不同位點的脯氨酸突變可以顯著降低草甘膦與EPSPS的結合[38-40]。其原理是隨著氨基酸種類的改變, EPSPS的結構和功能發生變化, 從而使其與底物的親和力增加, 導致草甘膦無法再占據PEP結合位點, 植物因此形成對草甘膦的抗性[41]。但是, 持續使用相同的除草劑加速了雜草的進化。Gaines等[42]發現了一種高度抗草甘膦的雜草, 其中基因擴增了100倍, 導致過表達40倍。植物的生長依賴于Pi的持續供應, 然而, 大部分Pi會與土壤中的金屬離子(如Ca2+、Fe3+和Al3+)結合形成不溶性磷酸鹽, 并且Pi被細菌迅速轉化為不能被植物直接吸收和利用的有機形式[16,18,43]。磷肥的過量使用還會導致水系富營養化[44-45]。因此, 尋找能夠替代磷的新型肥料成為農業可持續發展的迫切需要。與Pi相比, Phi具有獨特的生化特性, 有更高的溶解度, 但與金屬離子的化學反應性較低, 大多數微生物無法利用[44,46-47]。Phi在結構上類似于Pi, 植物能夠通過Pi轉運蛋白吸收Phi[13]。植物自身不能直接代謝Phi, 外施Phi顯著抑制植物的生長發育[17-19], 表明Phi可以作為單子葉和雙子葉植物的苗前和苗后除草劑。在自然界中, Phi可以被少數土壤和海洋細菌利用[14,26], 通過NAD依賴性亞磷酸酯氧化還原酶(PTXD)將Phi轉化為Pi[47-49]。我們之前從sp. 4506(PtxDR4506)中克隆了基因, 通過定向進化將139位的酪氨酸突變為谷氨酰胺, 脫氫酶的催化活性顯著提高[27]。ptxD轉基因品系可以通過將Phi轉化為Pi來緩解Phi對油菜的生長抑制(圖2), 并通過提供Phi來減弱ptxD轉基因品系的磷饑餓反應(圖3)。這些結果表明, 我們可以利用ptxD基因建立以Phi為磷肥和除草劑的植物磷利用與雜草控制相結合的體系。此外我們可以看到, Phi可以抑制非轉基因油菜和狗尾草的生長, 因此我們推測Phi對雙子葉雜草可能也有同樣的作用效果, 因為本研究所用的雜草為狗尾草, 在后續在試驗過程中, 我們會在田間進行外施Phi觀察其對雙子葉雜草的防控效果。此外也會選擇一些抗性雜草進行驗證。
在組織培養中, 抗生素和除草劑抗性基因常被用作篩選轉基因陽性植株的選擇性標記。然而, 這些抗性基因有可能會轉移到可共存的其他雜草中, 從而產生“超級雜草”和10種抗生素耐藥性[50-51]。此外, 很少有選擇性藥物對植物細胞增殖和分化有負面影響[17,52]。由于可以作為植物遺傳轉化的新型選擇性標記, 因此在植物生物技術發展過程中顯示出巨大的潛力[25]。基因與以Phi為唯一磷源的選擇性培養基結合, 作為一種有效的系統來選擇多種植物的轉化細胞[17,19,23]。我們發現Phi強烈抑制愈傷組織再生(附圖2), 與煙草的研究結果一致[22]。在Phi培養基中添加了Pi后, 油菜愈傷可以進行再分化(圖1-f), 并最終獲得了再生苗, 但這些再生植株并不是陽性轉基因株系, 推測可能是使用的Phi濃度過低, 加上轉化的外植體數量不足等原因導致我們未能通過Phi篩選到陽性轉基因株系,接下來我們將繼續驗證其作為油菜轉化系統的可能性。
4 結論
本研究首先使用含有不同濃度的亞磷酸鹽處理甘藍型油菜, 結果表明, 隨著亞磷酸濃度的升高, 油菜的生長被顯著抑制, 表明亞磷酸對油菜幼苗的生長具有較強抑制作用。前期研究發現, 羅爾斯通菌屬(sp. strain 4506)中ptxD蛋白139位的酪氨酸突變為谷氨酰胺(Y139Q)后能夠提高其催化Phi轉化為Pi的活性。在此基礎上, 通過遺傳轉化將ptxD轉入到甘藍型油菜并獲得陽性轉基因株系。與對照植株相比,ptxD轉基因油菜可以明顯減輕亞磷酸鹽對油菜生長的抑制作用, 且體內正磷酸鹽含量在ptxD轉基因株系中顯著提高, 表明轉基因油菜能將Phi氧化成Pi供油菜生長發育。此外,p1300- ptxD轉基因油菜比狗尾草具有更強的生長競爭優勢, 表明ptxD/Phi系統可以有效控制雜草生長。綜上所述,ptxD轉基因油菜具有將Phi轉化為Pi的能力, 從而賦予其在Phi條件下比野生型油菜和雜草更強的生長競爭優勢, 表明ptxD/Phi是有效的油菜磷利用和雜草控制系統, 為有效解決油菜磷利用和雜草控制提供了全新的可行方案。
[1] 李利霞, 陳碧云, 閆貴欣, 高桂珍, 許鯤, 謝婷, 張付貴, 伍曉明. 中國油菜種質資源研究利用策略與進展. 植物遺傳資源學報, 2020, 21: 1–19. Li L X, Chen B Y, Yan G X, Gao G Z, Xu K, Xie T, Zhang F G, Wu X M. Proposed strategies and current progress of research and utilization of oilseed rape germplasm in China., 2020, 21: 1–19 (in Chinese with English abstract).
[2] 敖禮林, 余增鋼, 饒衛華. 油菜田雜草綜合高效防控技術. 科學種養, 2019, (1): 39–40. Ao L L, Yu Z G, Rao W H. Comprehensive and efficient prevention and control technology of weeds in rapeseed fields., 2019, (1): 39–40 (in Chinese).
[3] de F Sousa M G, da Silva A C, Dos Santos Araújo R, Rigotto R M. Evaluation of the atmospheric contamination level for the use of herbicide glyphosate in the northeast region of Brazil., 2019, 191: 604.
[4] Heap I, Duke S O. Overview of glyphosate-resistant weeds worldwide., 2018, 74: 1040–1049.
[5] Husken A, Dietz-Pfeilstetter A. Pollen-mediated intraspecific gene flow from herbicide resistant oilseed rape (L.)., 2007, 16: 557–569.
[6] Squire G R, Hawes C, Begg G S, Young M W. Cumulative impact of GM herbicide-tolerant cropping on arable plants assessed through species-based and functional taxonomies., 2009, 16: 85–94.
[7] Schachtman D P, Reid R J, Ayling S M. Phosphorus uptake by plants:from soil to cell., 1998, 116: 447–453.
[8] Sun S, Wang L, Mao H, Shao L, Li X, Xiao J, Ou-Yang Y, Zhang Q. A G-protein pathway determines grain size in rice., 2018, 9: 851.
[9] Wang Y, Chen Y F, Wu W H. Potassium and phosphorus transport and signaling in plants., 2021, 63: 34–52.
[10] Bozzo G G, Singh V K, Plaxton W C. Phosphate or phosphite addition promotes the proteolytic turnover of phosphate- starvation inducible tomato purple acid phosphatase isozymes., 2004, 573: 51–54.
[11] Eshraghi L, Anderson J P, Aryamanesh N, McComb J A, Shearer B, Hardy G S. Suppression of the auxin response pathway enhances susceptibility towhile phosphite- mediated resistance stimulates the auxin signalling pathway., 2014, 14: 68.
[12] Kariman K, Barker S J, Jost R, Finnegan P M, Tibbett M. Sensitivity of jarrah () to phosphate, phosphite, and arsenate pulses as influenced by fungal symbiotic associations., 2016, 26: 401–415.
[13] Burra D D, Berkowitz O, Hedley P E, Morris J, Resjo S, Levander F, Liljeroth E, Andreasson E, Alexandersson E. Phosphite- Induced changes of the transcriptome and secretome inleading to resistance against., 2014, 14: 254.
[14] Achary V M M, Ram B, Manna M, Datta D, Bhatt A, Reddy M K, Agrawal P K. Phosphite: a novel P fertilizer for weed management and pathogen control., 2017, 15: 1493–1508.
[15] Danova-Alt R, Dijkema C, DE Waard P, Kock M. Transport and compartmentation of phosphite in higher plant cells: kinetic and31P nuclear magnetic resonance studies., 2008, 31: 1510–1521.
[16] Thao H T B, Yamakawa T, Myint A K, Sarr P S. Effects of phosphite, a reduced form of phosphate, on the growth and phosphorus nutrition of spinach (L)., 2008, 54: 761–768.
[17] Dormatey R, Sun C, Ali K, Fiaz S, Xu D R, Calderon-Urrea A, Bi Z Z, Zhang J L, Bai J P./Phi as alternative selectable marker system for genetic transformation for bio-safety concerns: a review., 2021, 9: e11809.
[18] Loera-Quezada M M, Leyva-Gonzalez M A, Lopez-Arredondo D, Herrera-Estrella L. Phosphite cannot be used as a phosphorus source but is non-toxic for microalgae., 2015, 231: 124–130.
[19] Pandeya D, Lopez-Arredondo D L, Janga M R, Campbell L M, Estrella-Hernandez P, Bagavathiannan M V, Herrera-Estrella L, Rathore K S. Selective fertilization with phosphite allows unhindered growth of cotton plants expressing thegene while suppressing weeds., 2018, 115: E6946–E6955.
[20] Costas A M, White A K, Metcalf W W. Purification and characterization of a novel phosphorus-oxidizing enzyme fromWM88., 2001, 276: 17429–17436.
[21] Changko S, Rajakumar P D, Young R E B, Purton S. The phosphite oxidoreductase gene,as a bio-contained chloroplast marker and crop-protection tool for algal biotechnology using., 2020, 104: 675–686.
[22] Lopez-Arredondo D L, Herrera-Estrella L. Engineering phosphorus metabolism in plants to produce a dual fertilization and weed control system., 2012, 30: 889–893.
[23] Nahampun H N, Lopez-Arredondo D, Xu X, Herrera-Estrella L, Wang K. Assessment ofgene as an alternative selectable marker for-mediated maize transformation., 2016, 35: 1121–1132.
[24] Manna M, Achary M M, Islam T, Agrawal P K, Reddy M K. The development of a phosphite-mediated fertilization and weed control system for rice., 2016, 6: 24941.
[25] Lopez-Arredondo D L, Herrera-Estrella L. A novel dominant selectable system for the selection of transgenic plants underand greenhouse conditions based on phosphite metabolism., 2013, 11: 516–525.
[26] Pandeya D, Campbell L M, Nunes E, Lopez-Arredondo D L, Janga M R, Herrera-Estrella L, Rathore K S.gene in combination with phosphite serves as a highly effective selection system to generate transgenic cotton (L)., 2017, 95: 567–577.
[27] Liu T T, Yuan L L, Deng S R, Zhang X X, Cai H M, Ding G D, Xu F S, Shi L, Wu G B, Wang C. Improved the activity of phosphite dehydrogenase and its application in plant biotechno-logy., 2021, 9: 764188.
[28] Dai C, Li Y, Li L, Du Z, Lin S, Tian X, Li S, Yang B, Yao W, Wang J, Guo L, Lu S. An efficient-mediated transformation method using hypocotyl as explants for., 2020, 40: 96.
[29] Carswell C, Grant B R, Theodorou M E, Harris J, Niere J O, Plaxton W C. The fungicide phosphonate disrupts the phosphate-starvation response in Brassica nigra seedlings., 1996, 110: 105–110.
[30] Varadarajan D K, Karthikeyan A S, Matilda P D, Raghothama K G. Phosphite, an analog of phosphate, suppresses the coordinated expression of genes under phosphate starvation., 2002, 129: 1232–1240.
[31] Ren F, Guo Q Q, Chang L L, Chen L, Zhao C Z, Zhong H, Li X B.gene encoding a MYB-like protein functions in response to phosphate starvation., 2012, 7: e44005.
[32] Ren F, Zhao C Z, Liu C S, Huang K L, Guo Q Q, Chang L L, Xiong H, Li X B. APHT1 phosphate transporter, BnPht1;4, promotes phosphate uptake and affects roots architecture of transgenic., 2014, 86: 595–607.
[33] Li Y, Wang X, Zhang H, Wang S, Ye X, Shi L, Xu F, Ding G. Molecular identification of the phosphate transporter family 1 () genes and their expression profiles in response to phosphorus deprivation and other abiotic stresses in., 2019, 14: e220374.
[34] Buddenhagen C E, James T K, Ngow Z, Hackell D L, Rolston M P, Chynoweth R J, Gunnarsson M, Li F, Harrington K C, Ghanizadeh H. Resistance to post-emergent herbicides is becoming common for grass weeds on New Zealand wheat and barley farms., 2021, 16: e0258685.
[35] Green J M, Siehl D L. History and outlook for glyphosate- resistant crops., 2021, 255: 67–91.
[36] Holmes K H, Lindquist J L, Rebarber R, Werle R, Yerka M, Tenhumberg B. Modeling the evolution of herbicide resistance in weed species with a complex life cycle., 2022, 32: e02473.
[37] Zabalza A, Orcaray L, Fernandez-Escalada M, Zulet-Gonzalez A, Royuela M. The pattern of shikimate pathway and phenylpropanoids after inhibition by glyphosate or quinate feeding in pea roots., 2017, 141: 96–102.
[38] Wakelin A, Preston C. A target-site mutation is present in a glyphosate-resistantpopulation., 2006, 46: 432–440.
[39] Yu Q, Cairns A, Powles S. Glyphosate, paraquat and ACCase multiple herbicide resistance evolved in abiotype., 2007, 225: 499–513.
[40] Baerson S R, Rodriguez D J, Tran M, Feng Y, Biest N A, Dill G M. Glyphosate-resistant goosegrass. Identification of a mutation in the target enzyme 5-enolpyruvylshikimate-3-phosphate synthase., 2002, 129: 1265–1275.
[41] Sammons R D, Gaines T A. Glyphosate resistance: state of knowledge., 2014, 70: 1367–1377.
[42] Gaines T A, Zhang W, Wang D, Bukun B, Chisholm S T, Shaner D L, Nissen S J, Patzoldt W L, Tranel P J, Culpepper A S, Grey T L, Webster T M, Vencill W K, Sammons R D, Jiang J, Preston C, Leach J E, Westra P. Gene amplification confers glyphosate resistance in., 2010, 107: 1029–1034.
[43] Robertson I D, Dean L M, Rudebusch G E, Sottos N R, White S R, Moore J S. Alkyl phosphite inhibitors for frontal ring-opening metathesis polymerization greatly increase pot life., 2017, 6: 609–612.
[44] Mehta D, Ghahremani M, Perez-Fernandez M, Tan M, Schlapfer P, Plaxton W C, Uhrig R G. Phosphate and phosphite have a differential impact on the proteome and phosphoproteome ofsuspension cell cultures., 021, 105: 924–941.
[45] Rima F B, da Silva Y, Teixeira M P R, Maia A J, Assis K G O, da Silva R, de Souza Junior V S, da Silva Y, Lopes J W B, Barbosa R S, Singh V P. Phosphorus in soils and fluvial sediments from a Cerrado biome watershed under agricultural expansion., 2022, 194: 388.
[46] Baammi S, Daoud R, El Allali A. Assessing the effect of a series of mutations on the dynamic behavior of phosphite dehydrogenase using molecular docking, molecular dynamics and quantum mechanics/molecular mechanics simulations., 2023, 41: 4154–4166.
[47] Gonzalez-Morales S I, Pacheco-Gutierrez N B, Ramirez- Rodriguez C A, Brito-Bello A A, Estrella-Hernandez P, Herrera-Estrella L, Lopez-Arredondo D L. Metabolic engineering of phosphite metabolism inPCC 7942 as an effective measure to control biological contaminants in outdoor raceway ponds., 2020, 13: 119.
[48] Sandoval-Vargas J M, Jimenez-Clemente L A, Macedo-Osorio K S, Oliver-Salvador M C, Fernandez-Linares L C, Duran-Figueroa N V, Badillo-Corona J A. Use of thegene as a portable selectable marker for chloroplast transformation in., 2019, 61: 461–468.
[49] Yuan H, Wang Y, Liu Y, Zhang M, Zou Z. A novel dominant selection system for plant transgenics based on phosphite metabolism catalyzed by bacterial alkaline phosphatase., 2021, 16: e0259600.
[50] Chavana J, Singh S, Vazquez A, Christoffersen B, Racelis A, Kariyat R R. Local adaptation to continuous mowing makes the noxious weeda superweed candidate by improving fitness and defense traits., 2021, 11: 6634.
[51] Garcia M J, Palma-Bautista C, Rojano-Delgado A M, Bracamonte E, Portugal J, Alcantara-de la Cruz R, De Prado R. The triple amino acid substitution TAP-IVS in thegene confers high glyphosate resistance to the superweed., 2019, 20: 2396.
[52] Scarrow R. Glyphosate resistance: of superweeds and survivors., 2017, 3: 17078.
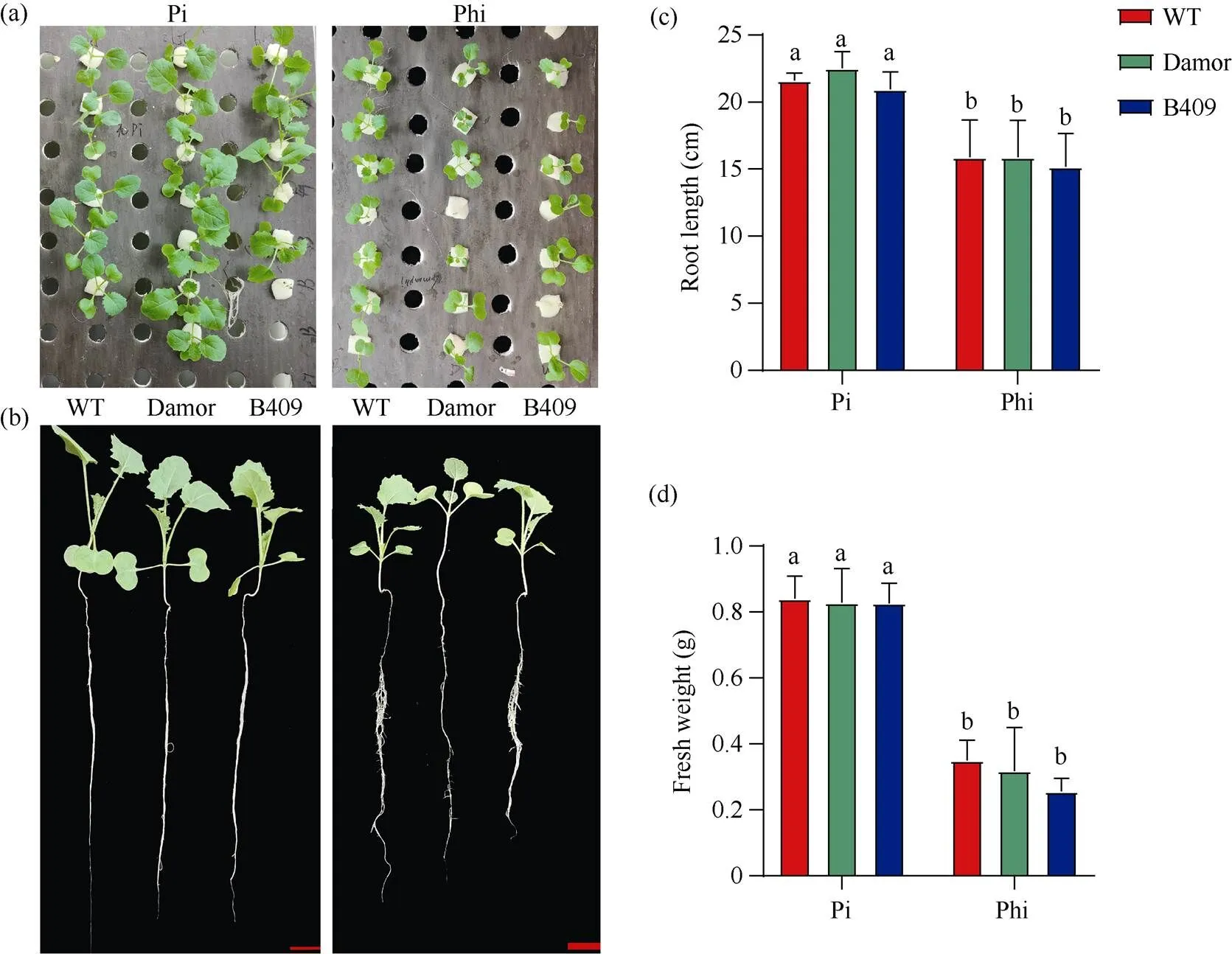
附圖1 不同生態型油菜在Pi和Phi下的水培試驗
Fig. S1 Hydroponics experiments of different ecotypes ofunder Pi and Phi
(a)和(b) 處理2周后不同油菜的生長狀況。Pi濃度為1 mmol L–1, Phi濃度為4 mmol L–1。標尺為2 cm。(c) 處理2周后不同油菜根長的統計。(d) 處理2周后不同油菜鮮重的統計。使用檢驗進行顯著性檢驗: 當≤ 0.05時, 如果用不同的小寫字母標注, 則條形圖代表的值存在顯著差異。
(a) and (b) growth of differentafter 2 weeks of treatment. The Pi concentration is 1 mmol L–1and the Phi concentration is 4 mmol L–1. Scale bar: 2 cm. (c) statistics of differentroot length after 2 weeks of treatment. (D) statistics of differentfresh weight after 2 weeks of treatment. The significance is analyzed at≤ 0.05 by-test. The values represented by the bars chart are significantly different if marked with different lowercase.

附圖2 ptxD蛋白序列分析
Fig. S2 Protein sequence analysis ofptxD
PtxDR4506、PtxDR4506(Y139Q)和PtxDWM88氨基酸序列比對。相同的殘基用黑色表示, 相似的殘基用灰色表示。
Alignment of PtxDR4506, PtxDR4506(Y139Q), and PtxDWM88amino acid sequence. The identical residues were shaded by black, and the similar residues were shaded by gray.
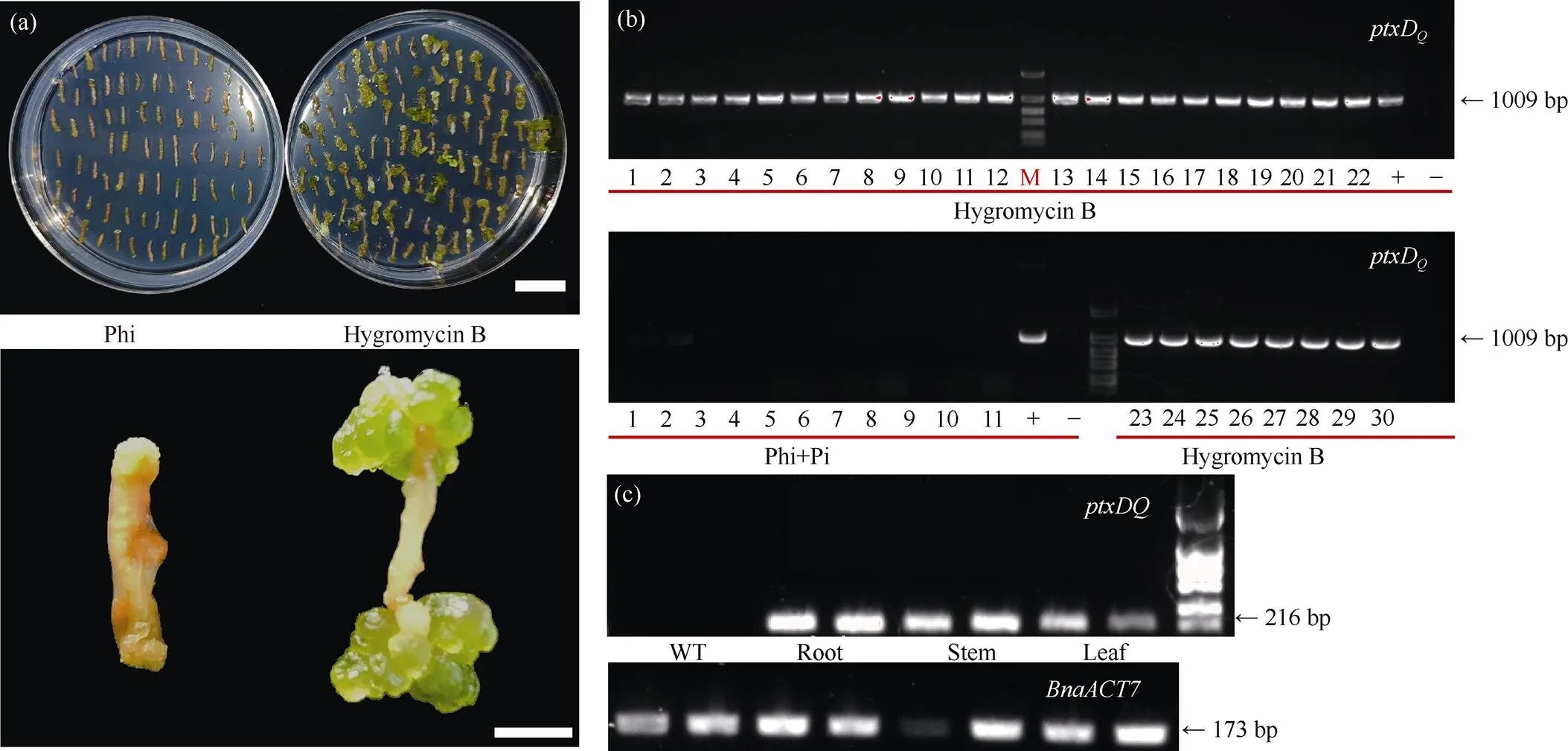
附圖3 潮霉素B和Phi對愈傷組織再生的影響
Fig. S3 Callus regeneration with Hygromycin B or Phi selection on shoot initiation media
(a) 以120 μg mL–1Hygromycin B和1 mmol L–1Phi為篩選劑進行轉化。標尺為2 cm。(b) 油菜再生苗DNA水平的PCR分析。數字編號為不同的油菜再生苗單株, M為marker。(c) 轉基因油菜L10株系的根、莖、葉的RT-PCR分析。為油菜內參基因。
(a) 120 μg mL–1Hygromycin B and 1 mmol L–1Phi were used as screening agents for transformation. Scale bar: 2 cm. (b) PCR identification ofseedlings at DNA level. The numbers are differentregenerated seedling monocots, M is marker. (c) RT- PCR analysis of roots, stems, and leaves of L10 strain of transgenic rapeseed.isinternal gene.
Developing and resistance assessing of phosphite-tolerant herbicide transgenicL.
ZHONG Yuan, ZHU Tian-Yu, DAI Cheng, and MA Chao-Zhi*
National Key Laboratory of Crop Genetic Improvement, Huazhong Agricultural University / National Engineering Research Center of Rapeseed / Hongshan Laboratory, Wuhan 430070, Hubei, China
During the production of, the yield and quality of the crop are seriously affected by a large number of accompanying weeds. Herbicide control options are rapidly diminishing due to the recent increase in the number of herbicide-resistant weeds in fields, which affects the sustainable development of agriculture in the future. Plants can take up phosphite (Phi) via orthophosphate (Pi) transporters, but the Phi cannot be metabolized and used as a phosphorus fertilizer for crops, resulting in plant growth inhibition. Previously, agene isolated fromsp. 4506, and the mutant protein ptxDQat position 139, which had tyrosine mutation to glutamine (Y139Q), significantly improved the conversion activity of Phi to Pi. To evaluate the efficacy ofptxD/Phi-based weed control system in, we generated transgenicplants with a codon-optimized(Y139Q,ptxD) gene. Ectopic expression ofptxDconfered the ability to convert Phi to Pi, resulting in improving plant growth in the presence of Phi. Pi-starvation-induced genes (e.g.and) were suppressed in theptxDtransgenic lines by supplying Phi, indicating thatptxDcan transform Phi into Pi in rapeseed. In addition,ptxDtransgenichad a greater competitive growth advantage over wild-typeand monocotyledonous weeds (). In conclusion, theptxD/Phi system provided an effective alternative for suppressing the weed growth while providing adequate Pi nutrition to the crops, which in turn improved the sustainability of agriculture.
; herbicide; phosphite;
10.3724/SP.J.1006.2024.34110
本研究由國家自然科學基金項目(32072105)資助。
This study was supported by the National Natural Science Foundation of China (32072105).
馬朝芝, E-mail: yuanbeauty@mail.hzau.edu.cn
E-mail: zy14745140090623@163.com
2023-07-03;
2023-10-23;
2023-12-13.
URL: https://link.cnki.net/urlid/11.1809.S.20231212.1648.002
This is an open access article under the CC BY-NC-ND license (http://creativecommons.org/licenses/by-nc-nd/4.0/).

