亞抑菌濃度抗菌藥物影響金黃色葡萄球菌生物膜形成的研究進(jìn)展
張曉潤(rùn),宋 爽,朱麗瑩,王文靜,陶 臻
(南京醫(yī)科大學(xué)附屬南京醫(yī)院/南京市第一醫(yī)院感染性疾病科,江蘇 南京 210000)
金黃色葡萄球菌(Staphylococcusaureus, SA)是一種在自然界廣泛存在的病原菌,在臨床上可以引起多種感染性疾病,如皮膚軟組織感染、血流感染和中樞神經(jīng)系統(tǒng)感染等[1]。近年來(lái),因全球范圍內(nèi)廣譜抗菌藥物的過(guò)度使用,SA的耐藥率呈現(xiàn)不斷上升趨勢(shì),除了耐藥基因的表達(dá)外,還有一個(gè)重要的原因是生物膜的形成。生物膜是細(xì)菌在生長(zhǎng)過(guò)程中黏附于生物或非生物表面后,被細(xì)菌自身分泌的胞外物質(zhì)包裹而形成的細(xì)菌聚集膜樣物,可以保護(hù)細(xì)菌免受宿主免疫系統(tǒng)、抗菌藥物及物理機(jī)械壓力的影響[2]。SA生物膜相關(guān)感染往往會(huì)造成治療失敗以及復(fù)發(fā)性感染,不僅導(dǎo)致疾病的發(fā)病率和病死率上升,還會(huì)給全球經(jīng)濟(jì)造成巨大的損失[3]。目前研究[4]表明,抗菌藥物在亞抑菌濃度(sub-MIC)下會(huì)對(duì)SA生物膜的形成產(chǎn)生影響,且不同抗菌藥物影響細(xì)菌生物膜形成的作用機(jī)制不同。因此,本綜述將對(duì)SA生物膜的形成過(guò)程及基因調(diào)控、不同抗菌藥物在sub-MIC下對(duì)SA生物膜形成的影響及作用機(jī)制進(jìn)行概述,以期為臨床有效控制及治療SA生物膜相關(guān)感染提供一定依據(jù)。
1 sub-MIC的定義及意義
最低抑菌濃度(MIC)是抑制細(xì)菌生長(zhǎng)的最低藥物濃度,敏感菌株在抗菌藥物濃度高于MIC時(shí)被抑制,而耐藥菌株則需要更高的抗菌藥物濃度才能被抑制,其上限被稱(chēng)為防突變濃度(MPC),兩者之間的濃度集合被稱(chēng)為突變選擇窗口(MSW)。MSW理論認(rèn)為,耐藥突變菌株的選擇性富集只發(fā)生在MSW內(nèi),當(dāng)抗菌藥物濃度低于MIC時(shí),雖然治療無(wú)效但也不會(huì)導(dǎo)致耐藥菌的富集[5]。隨著研究人員對(duì)細(xì)菌耐藥機(jī)制的深入研究,進(jìn)一步提出了sub-MIC和最小選擇濃度(MSC)的概念,補(bǔ)充了MSW理論。研究人員將野生型敏感菌和同源的耐藥菌按1∶1 的比例混合,當(dāng)抗菌藥物濃度較低時(shí),因耐藥菌存在適應(yīng)性代價(jià),故敏感菌具有生長(zhǎng)優(yōu)勢(shì);當(dāng)抗菌藥物濃度增加時(shí),耐藥菌逐漸克服適應(yīng)性代價(jià),兩者生長(zhǎng)速度相同、適應(yīng)性相同的藥物濃度即為MSC,當(dāng)抗菌藥物濃度高于MSC但仍低于MIC時(shí)就可以選擇性富集耐藥突變菌株[6-7]。見(jiàn)圖1。因此,sub-MIC是指低于MIC但仍對(duì)細(xì)菌具有選擇作用的抗菌藥物濃度,由于藥物在體內(nèi)濃度分布不同和藥物自身不良反應(yīng)的影響,以及臨床長(zhǎng)期應(yīng)用抗菌藥物導(dǎo)致菌群MIC值升高,細(xì)菌不可避免會(huì)處于sub-MIC環(huán)境[8]。當(dāng)菌群處于sub-MIC環(huán)境時(shí),不僅可以富集預(yù)先存在的耐藥突變菌株,還可以通過(guò)增加適應(yīng)性進(jìn)化頻率來(lái)產(chǎn)生更高水平的耐藥突變,最終導(dǎo)致藥物治療失敗[9]。
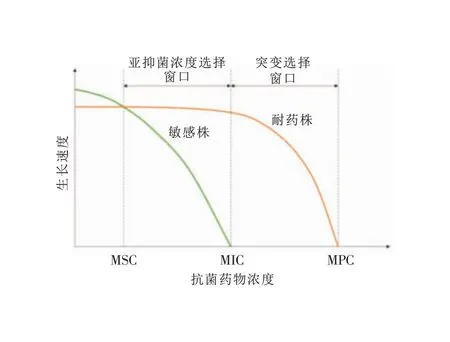
圖1 細(xì)菌在sub-MIC選擇窗口和傳統(tǒng)突變選擇窗口中的生長(zhǎng)[9]
2 SA生物膜的形成過(guò)程及基因調(diào)控
生物膜是細(xì)菌附著于表面后被自身分泌的胞外基質(zhì)(ECM)包裹形成的結(jié)構(gòu)性群落,ECM主要由胞外多糖(EPS)、胞外DNA(eDNA)、蛋白質(zhì)、脂類(lèi)和其他生物分子組成[10]。目前關(guān)于生物膜的研究主要以體外模型為主,盡管參與生物膜形成的分子成分因細(xì)菌種類(lèi)不同而異,但廣泛認(rèn)可的生物膜生長(zhǎng)模型包括三個(gè)連續(xù)階段:黏附、聚集/成熟、分離/擴(kuò)散[11]。隨著研究的深入,Moormeier等[12]借助微流控活細(xì)胞分析系統(tǒng)和延時(shí)顯微鏡實(shí)時(shí)觀察SA生物膜的發(fā)展過(guò)程,并提出了五階段生物膜生長(zhǎng)模型,即黏附、聚集、外流、成熟、擴(kuò)散。見(jiàn)圖2。接下來(lái)將對(duì)五個(gè)階段及相關(guān)基因調(diào)控進(jìn)行概述。
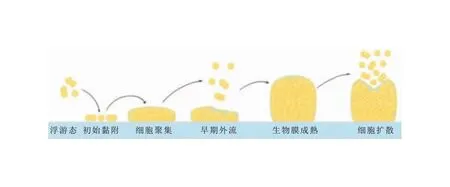
圖2 SA生物膜生長(zhǎng)模型
2.1 初始黏附 生物膜形成的第一步是浮游的SA黏附到生物或非生物表面。SA與生物表面之間主要通過(guò)一組N端含有信號(hào)肽序列、C端含有“LPXTG”模體(motif)的表面蛋白即細(xì)胞壁錨定蛋白進(jìn)行黏附,其中一類(lèi)與ECM成分結(jié)合的蛋白分子稱(chēng)為識(shí)別黏附基質(zhì)分子的微生物表面成分(MSCRAMMs)[13]。MSCRAMMs主要包括凝集因子A(ClfA)和凝集因子B(ClfB)、纖維蛋白結(jié)合蛋白A(FnBPA)和纖維蛋白結(jié)合蛋白B(FnBPB)、絲氨酸-天冬氨酸重復(fù)序列蛋白(Sdr)、骨唾液酸結(jié)合蛋白(Bbp)、膠原黏附素(Cna)等[14]。這些蛋白由其對(duì)應(yīng)的基因編碼,可以促進(jìn)細(xì)菌與生物表面進(jìn)行特異性黏附。而SA與非生物表面之間則是通過(guò)靜電作用和疏水作用實(shí)現(xiàn)非特異性黏附[15]。除此之外,SA自身分泌的自溶素(atlA)亦有助于細(xì)菌在聚苯乙烯表面黏附[16]。
2.2 細(xì)胞聚集 完成初始黏附后的細(xì)菌在存在流體剪切力的情況下很容易脫離表面,因此,SA會(huì)產(chǎn)生多種因子幫助細(xì)胞聚集從而增加生物膜的穩(wěn)定性。首先,SA在黏附過(guò)程中產(chǎn)生的一些細(xì)胞外蛋白可以在最初附著后即發(fā)揮促進(jìn)細(xì)胞聚集的作用,如FnBPA、FnBPB、ClfB和SdrC[17]。其次,多糖胞間黏附素(PIA)已被證明可以在SA生物膜形成的第二階段即細(xì)胞聚集中發(fā)揮重要作用[18]。PIA的合成主要受ica基因的調(diào)控,ica由四個(gè)功能基因(icaA、icaD、icaB、icaC)和一個(gè)調(diào)節(jié)基因(icaR)組成,其表達(dá)容易受環(huán)境條件(如高溫、高滲透壓、抗菌藥物等)的影響,因此,只有特定菌株或在特定條件下SA可以依賴(lài)PIA實(shí)現(xiàn)細(xì)胞聚集[19]。此外,研究[20]表明,SA可以通過(guò)烯醇化酶和甘油三醛-3-磷酸脫氫酶(GAPDH)在低pH值環(huán)境下使細(xì)胞自我裂解釋放eDNA和細(xì)胞質(zhì)蛋白,從而促進(jìn)細(xì)胞聚集。
2.3 早期外流 過(guò)去認(rèn)為,SA與其他細(xì)菌一樣有著相似的生物膜形成過(guò)程[21],但研究人員通過(guò)延時(shí)顯微鏡對(duì)SA生物膜形成過(guò)程觀察后發(fā)現(xiàn),在聚集階段開(kāi)始后約6 h,細(xì)胞出現(xiàn)了明顯的釋放,即早期外流階段[12]。此階段主要由SA自身分泌的核酸酶(nuc)介導(dǎo),nuc是一種熱穩(wěn)定的核酸內(nèi)切酶,也是SA的一種重要毒力因子,可以降解生物膜的主要成分eDNA引起細(xì)胞早期外流[22]。SA nuc突變體缺少早期外流階段,同時(shí)也無(wú)法觀察到生物膜成熟所需的微菌落結(jié)構(gòu)的形成[12]。因此,SA獨(dú)特的早期外流階段便于生物膜進(jìn)行結(jié)構(gòu)重建,進(jìn)而形成更有利于生物膜發(fā)展的結(jié)構(gòu)形態(tài)。
2.4 生物膜成熟 無(wú)論何種細(xì)菌,其生物膜成熟的關(guān)鍵都在于微菌落結(jié)構(gòu)的形成[23],SA亦不例外。通過(guò)延時(shí)顯微鏡觀察SA生物膜形成發(fā)現(xiàn),在生物膜成熟過(guò)程中,不斷有細(xì)菌脫離黏附,殘留在基底層的細(xì)胞則生成小簇菌落結(jié)構(gòu),即微菌落[13]。這些微菌落不斷解離和生成,使得生物膜高度結(jié)構(gòu)化,以便于細(xì)菌進(jìn)行營(yíng)養(yǎng)交換與廢物排除[24]。在此過(guò)程中,SA主要通過(guò)一類(lèi)具有表面活性劑性質(zhì)的α-螺旋多肽兩性分子,即酚溶性調(diào)節(jié)蛋白(PSMs)實(shí)現(xiàn)生物膜成熟。PSMs可以破壞生物膜的非共價(jià)作用,使得生物膜結(jié)構(gòu)得到修飾和重塑進(jìn)而逐漸趨于成熟,而PSMs的表達(dá)則受Agr系統(tǒng)的嚴(yán)格調(diào)控[25]。
2.5 細(xì)胞擴(kuò)散 生物膜積累成熟后,生物膜內(nèi)的細(xì)胞可以通過(guò)擴(kuò)散重新恢復(fù)到浮游狀態(tài),因此細(xì)胞擴(kuò)散既是生物膜生長(zhǎng)和發(fā)展過(guò)程的最后階段,也是另一個(gè)生長(zhǎng)周期的開(kāi)始[26]。此階段主要受機(jī)械力、表面活性劑PSMs以及降解生物膜基質(zhì)分子酶(如蛋白酶等)的影響,因此細(xì)胞擴(kuò)散很大程度上亦受Agr系統(tǒng)調(diào)控[27]。在Agr系統(tǒng)中,首先由啟動(dòng)子P2、P3分別啟動(dòng)RNA II和 RNA III的轉(zhuǎn)錄,然后再由RNA II編碼AgrA、AgrB、AgrC和AgrD蛋白,其中AgrD編碼自誘導(dǎo)肽前體(pre-AIP),在AgrB的作用下成熟為自誘導(dǎo)肽(AIP),當(dāng)細(xì)胞外AIP濃度達(dá)閾值時(shí),Agr系統(tǒng)被激活,AgrC結(jié)合AIP后使AgrA磷酸化,從而再反作用于P2、P3啟動(dòng)子以及其他幾個(gè)轉(zhuǎn)錄靶點(diǎn),調(diào)控相關(guān)細(xì)胞外蛋白酶的表達(dá)而促進(jìn)生物膜擴(kuò)散[28]。同時(shí),AgrA還可以直接調(diào)控PSMs的表達(dá),從而有助于生物膜的擴(kuò)散[29]。
3 sub-MIC抗菌藥物影響SA生物膜形成的作用機(jī)制
sub-MIC抗菌藥物既可以促進(jìn)生物膜形成,也可以抑制生物膜形成。現(xiàn)已充分證實(shí)不同抗菌藥物在sub-MIC下影響SA生物膜形成[30-43],本文針對(duì)常見(jiàn)抗菌藥物對(duì)SA生物膜的影響進(jìn)行概述。見(jiàn)表1。由于生物膜形成過(guò)程中涉及眾多基因及其復(fù)雜的調(diào)控機(jī)制,至今還無(wú)法將常用抗菌藥物與SA生物膜形成的作用靶點(diǎn)一一對(duì)應(yīng)。因此,以下部分總結(jié)了目前sub-MIC抗菌藥物影響SA生物膜形成的作用機(jī)制。見(jiàn)圖3。
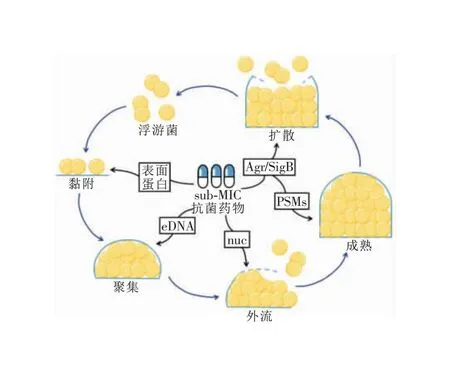
圖3 sub-MIC抗菌藥物影響SA生物膜形成的作用機(jī)制
3.1 改變初始黏附 初始黏附是生物膜形成的早期關(guān)鍵步驟。SA可以通過(guò)細(xì)胞表面蛋白與表面相互作用,也可以通過(guò)靜電作用和疏水作用與表面黏附。已有多項(xiàng)研究觀察到SA在sub-MIC抗菌藥物作用下,其表面蛋白含量(包括黏附相關(guān)蛋白)會(huì)發(fā)生變化。通過(guò)對(duì)氨芐西林誘導(dǎo)和非氨芐西林誘導(dǎo)的生物膜進(jìn)行轉(zhuǎn)錄組學(xué)分析發(fā)現(xiàn),SA在sub-MIC氨芐西林作用下,一些編碼表面蛋白基因以及黏附相關(guān)基因的表達(dá)會(huì)上調(diào),有助于細(xì)菌形成生物膜[30]。同時(shí),研究[34,40]表明,sub-MIC鏈霉素或諾氟沙星可以通過(guò)改變SA表面電荷和疏水性增加細(xì)菌與表面的初始黏附,促進(jìn)生物膜的形成。
3.2 釋放eDNA 細(xì)菌生物膜主要由EPS、eDNA、蛋白質(zhì)、脂類(lèi)和其他生物分子組成[10]。在過(guò)去的生物膜研究中,EPS被認(rèn)為是主要和最重要的組成部分,然而隨著研究的不斷深入,人們發(fā)現(xiàn)eDNA在生物膜形成中發(fā)揮著重要作用[44]。由于生理、生長(zhǎng)速率或細(xì)胞周期的不同,大多數(shù)細(xì)菌在抗菌藥物敏感性上會(huì)表現(xiàn)出一定的異質(zhì)性,即一些細(xì)胞在抗菌藥物濃度低于MIC時(shí)就會(huì)死亡[45-46]。因此,sub-MIC抗菌藥物影響生物膜形成的另一種潛在機(jī)制可能是細(xì)胞死亡后eDNA的釋放。sub-MIC阿莫西林可以誘導(dǎo)SA eDNA的釋放而增加生物膜的形成[31]。eDNA除了可以直接釋放到細(xì)胞外空間促進(jìn)生物膜形成外,還可以封閉在膜囊泡內(nèi)參與生物膜的形成[47],如sub-MIC萬(wàn)古霉素刺激SA生物膜形成的潛在機(jī)制是膜囊泡分泌的增加[39]。
3.3 調(diào)控Agr系統(tǒng) 群體感應(yīng)系統(tǒng)(QS系統(tǒng))是細(xì)菌細(xì)胞間的一種通訊系統(tǒng),控制著許多基因的表達(dá)以響應(yīng)群體密度[48],而Agr系統(tǒng)是SA QS系統(tǒng)的重要部分[49]。Agr系統(tǒng)在生物膜形成過(guò)程中起著至關(guān)重要的調(diào)控作用,因此,sub-MIC抗菌藥物可以通過(guò)直接影響Agr系統(tǒng)而影響SA生物膜的形成,也可以通過(guò)影響Agr系統(tǒng)調(diào)節(jié)下游基因的表達(dá)而影響生物膜的形成。例如,sub-MIC環(huán)丙沙星促進(jìn)SA生物膜形成的作用機(jī)制是sub-MIC環(huán)丙沙星結(jié)合了AgrC受體,從而影響下游agrA、icaA及icaR基因的表達(dá)[41]。sub-MIC莫匹羅星則通過(guò)上調(diào)cidA的表達(dá)刺激SA生物膜的形成,故cidA的表達(dá)受到群體感應(yīng)Agr系統(tǒng)的正向調(diào)節(jié)[50]。最近研究[51]表明,SA在sub-MIC左氧氟沙星和萬(wàn)古霉素作用下可能引起Agr系統(tǒng)發(fā)生自發(fā)基因突變,刺激群體欺騙效應(yīng),導(dǎo)致生物膜形成的增加。
3.4 改變nuc活性 nuc是SA分泌的一種胞外核酸內(nèi)切酶,主要由nuc1基因編碼,其不僅可以降解eDNA引起細(xì)胞早期外流從而促進(jìn)生物膜的形成[22],還可以切斷中性粒細(xì)胞胞外陷阱(NET)的主干DNA從而實(shí)現(xiàn)免疫逃逸,避免NET對(duì)生物膜產(chǎn)生殺傷作用[52]。因此,sub-MIC抗菌藥物可以通過(guò)影響n(yōu)uc活性從而影響SA生物膜的形成,如多西環(huán)素在sub-MIC下可抑制nuc活性,從而抑制SA生物膜的形成[53]。
3.5 觸發(fā)應(yīng)激反應(yīng) 為了在不同的環(huán)境條件下生長(zhǎng),SA可以利用高效的信號(hào)轉(zhuǎn)導(dǎo)系統(tǒng)調(diào)整細(xì)胞生理機(jī)能,從而響應(yīng)環(huán)境刺激,這種信號(hào)轉(zhuǎn)導(dǎo)系統(tǒng)的一個(gè)關(guān)鍵轉(zhuǎn)錄因子是σB(SigB),其主要參與細(xì)菌的應(yīng)激反應(yīng)[54]。因此,sub-MIC抗菌藥物可以通過(guò)影響σB而影響應(yīng)激反應(yīng)的發(fā)生,從而調(diào)節(jié)SA生物膜的形成。如sub-MIC克林霉素可以替代σB,從而觸發(fā)細(xì)菌的應(yīng)激反應(yīng),并上調(diào)生物膜相關(guān)基因如atlA、agrA、psm、fnbA和fnbB的表達(dá),使得SA生物膜的形成增加[42]。
4 小結(jié)
sub-MIC抗菌藥物會(huì)影響SA的生物膜結(jié)構(gòu)和基因表達(dá),也會(huì)對(duì)細(xì)菌的毒力表達(dá)和耐藥性產(chǎn)生不同程度的影響。目前關(guān)于sub-MIC抗菌藥物作用下生物膜的相關(guān)研究大部分為體外研究,且樣本量較小,因而難免造成抽樣誤差的增加,使得研究結(jié)果的可靠性下降。因此,不同抗菌藥物在sub-MIC狀態(tài)下對(duì)SA生物膜的影響還存在爭(zhēng)議。同時(shí),正如本綜述中所提到的,sub-MIC抗菌藥物影響SA生物膜是一個(gè)涉及多基因的復(fù)雜過(guò)程,雖然與之相關(guān)的研究很多,但大多數(shù)未闡明具體的作用機(jī)制。因此,對(duì)于sub-MIC抗菌藥物對(duì)SA生物膜形成的影響及相關(guān)機(jī)制還需要更多的研究進(jìn)一步證明。
利益沖突:所有作者均聲明不存在利益沖突。

