蓮草直胸跳甲短神經(jīng)肽F 受體基因sNPFR的克隆及表達分析
王康 趙雪瑩 霍楠 胡軍 王苑馨 楊軍 賈棟

摘要:為明確蓮草直胸跳甲(Agasicles hygrophila)短神經(jīng)肽F 受體AhsNPFR 功能及其表達特點,為探索蓮草直胸跳甲生防作用奠定理論基礎,利用PCR 技術克隆鑒定蓮草直胸跳甲AhsNPFR 基因并進行生物信息學分析,通過實時熒光定量PCR 技術分析其在蓮草直胸跳甲不同發(fā)育時期和組織中的時空表達譜。結果表明,克隆獲得基因AhsNPFR 全長1 669 bp,開放閱讀框1 257 bp,編碼418 個氨基酸;預測其蛋白質(zhì)分子質(zhì)量為48.11 ku,理論等電點為8.21,AhsNPFR 具有7 個典型保守跨膜結構域,屬于GPCRs 家族,系統(tǒng)進化樹分析表明,其與玉米根螢葉甲Diabrotica virgifera virgifera sNPFR 親緣關系最近。AhsNPFR 基因在不同發(fā)育階段均有表達,在1 齡幼蟲中的表達量最高,是卵中表達量的9.06 倍;在卵中表達量最低;雌成蟲的表達量顯著高于雄成蟲。AhsN ?PFR 基因在不同組織中均有表達,在3 齡幼蟲后腸中顯著高表達,是脂肪體表達量的12.21 倍;在雌雄成蟲后腸顯著高表達,并在所有組織中均沒有雌雄表達差異。
關鍵詞:蓮草直胸跳甲;短神經(jīng)肽F 受體基因sNPFR;基因克隆;發(fā)育時期表達;組織表達
中圖分類號:S476.2文獻標識碼:A 文章編號:1002?2481(2024)01?0137?08
神經(jīng)肽是一類重要的信號分子,在昆蟲的生長發(fā)育、繁殖和行為等多種生物學過程中發(fā)揮重要調(diào)節(jié)作用[1]。昆蟲神經(jīng)肽作為配體通過與同源的G 蛋白偶聯(lián)受體(G protein-coupled receptors,GPCRs)相互作用介導其生物學功能[2]。短神經(jīng)肽F(shortneuropeptide F,sNPF)是最初通過神經(jīng)肽F(neuro?peptide F,NPF)C 末端抗體在馬鈴薯甲蟲Leptino?tarsa decemlineata 和沙漠蝗蟲Schistocerca gregaria中鑒定得到的一類NPF 短肽[3-4],這些NPF 短肽僅由8~10 個氨基酸組成,而不是無脊椎動物NPF 典型的36~40 個氨基酸[5],基于其羧基末端的RLRF酰胺序列類似于無脊椎動物的NPF 的RPRF 基序[6],因此,命名為sNPF。
與大多數(shù)神經(jīng)肽信號系統(tǒng)相同,sNPF 也是通過激活其特異性短神經(jīng)肽F 受體(short neuropep?tide F receptor,sNPFR),進而引發(fā)細胞信號傳導機制發(fā)揮系列功能[7]。sNPFR 首次在黑腹果蠅中發(fā)現(xiàn)[8],隨后在紅火蟻Solenopsis invicta 和岡比亞按蚊Anopheles gambiae 中相繼克隆出來[9-10]。sNPF 信號系統(tǒng)在昆蟲的晝夜節(jié)律[11]、生長發(fā)育[12]、寄主定位[13-14]、取食等生理過程中發(fā)揮重要作用,尤其在昆蟲取食中的調(diào)控作用引起相關研究者的廣泛關注。在黑腹果蠅Drosophila melanogaster 中,DmsNPF及其受體DmsNPFR 的表達能促進取食量增加及體型增大,相反RNA 干擾二者的功能后果蠅的取食量減少且體型變小[15-16]。華山松大小蠹Dendrocto?nus armandi 中敲除DasNPF 及其受體DasNPFR后,幼蟲和雌雄成蟲的取食量均減少[17]。與上述昆蟲相反,在沙漠飛蝗S. gregaria 中,SgsNPF 及其受體SgsNPFR 的敲除反而會導致取食量增加[18-19]。大量研究表明,昆蟲頭部和腸道是sNPFR 的主要表達部位,但在其他組織部位如中樞神經(jīng)系統(tǒng)(cen?tral nervous system,CNS)、觸角、脂肪體、馬氏管等也都有表達[10,17,20],關于sNPFR 的表達部位目前還沒有明確結論。
蓮草直胸跳甲Agasicles hygrophila 是世界惡性雜草喜旱蓮子草Alternanthera philoxeroides 的專食性天敵昆蟲[21-23]。本研究擬基于神經(jīng)肽sNPF信號系統(tǒng)與昆蟲的寄主定位及取食密切相關的特性,克隆鑒定蓮草直胸跳甲sNPF 信號系統(tǒng)的sNPFR 基因,檢測其在不同發(fā)育階段及組織的表達模式,旨在為后續(xù)深入研究蓮草直胸跳甲專一性定位寄主與取食的分子調(diào)控機制提供理論基礎。
1材料和方法
1.1 試驗材料
供試蓮草直胸跳甲采自華南農(nóng)業(yè)大學,后飼養(yǎng)于山西農(nóng)業(yè)大學生物安全與生物防治實驗室養(yǎng)蟲室。飼養(yǎng)條件為:溫度(25±1)℃ ,相對濕度為85%±5%,光周期14L∶10D。幼蟲飼養(yǎng)于玻璃培養(yǎng)皿(直徑15 cm,高2.5 cm),成蟲飼養(yǎng)于養(yǎng)蟲罐(直徑12 cm,高17 cm)。
喜旱蓮子草采自浙江省玉環(huán)縣,現(xiàn)種植于太谷區(qū)山西農(nóng)業(yè)大學生物安全與生物防治基地。
1.2 試驗方法
1.2.1 昆蟲樣品收集
基因克隆樣品為蓮草直胸跳甲不同發(fā)育階段的混合樣本。各發(fā)育階段的取樣分別為:1 日齡卵,1 日齡的1、2、3 齡幼蟲,1 日齡蛹和雌雄成蟲。其中,3 齡幼蟲組織的取樣為:頭、前腸、中腸、后腸、馬氏管、脂肪體;雌雄成蟲取樣為:觸角、頭、前腸、中腸、后腸、馬氏管、脂肪體。以上樣本均3 次生物學重復,液氮速凍,-80 ℃冰箱保存?zhèn)溆谩?/p>
1.2.2 RNA 的提取與cDNA 合成
總RNA 使用Trizol 試劑(TaKaRa,大連)提取,通過超微量蛋白核酸分析儀(BioDrop,Cambridge,UK)測定濃度,1% 瓊脂糖凝膠電泳檢測質(zhì)量。以1 μg RNA 為模板,采用HiScript? Ⅲ 1stStrand cDNA Synthesis Kit(+gDNA wiper)試劑盒(Vazyme,南京)的步驟合成cDNA 第1 鏈,-20 ℃?zhèn)溆谩?/p>
1.2.3 AhsNPFR 的克隆鑒定與序列分析
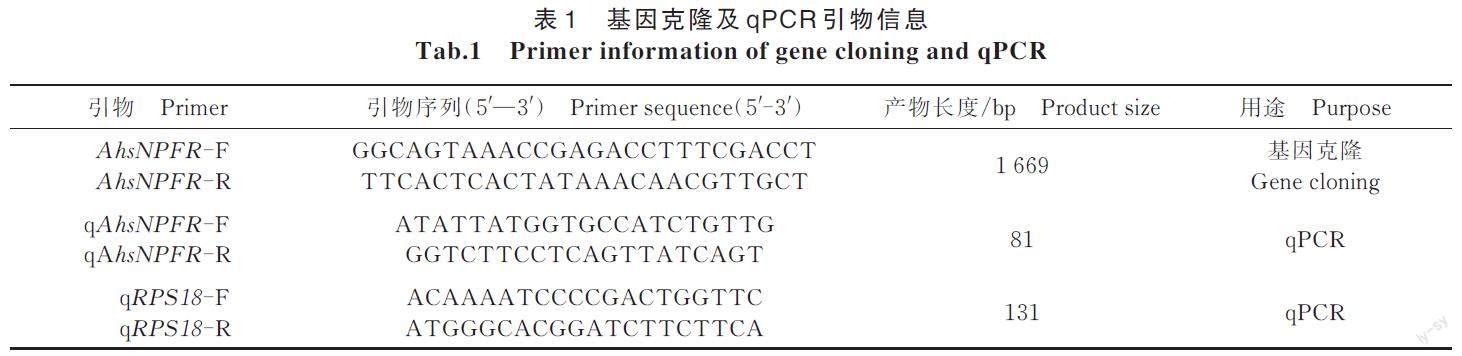
基于課題組的蓮草直胸跳甲轉錄組數(shù)據(jù)[24],利用Primer5.0 設計目的基因的擴增引物(表1),以1.2.2 合成cDNA 為模板,利用Phanta? Max Super-FidelityDNA Polymerase 試劑盒(Vazyme,南京)進行PCR擴增。PCR 反應體系為:2×Phanta Max Buffer10 μL,引物AhsNPFR-F/AhsNPFR-R 各0.8 μL,1 ? cDNA 1 μL,Phanta MAX Super-Fidelity DNApolymerase 0.5 μL,dNTP Mix 0.4 μL,加ddH2O 至20 μL。PCR反應條件為:95 ℃預變性3 min;95 ℃變性15 s,48 ℃退火15 s,72 ℃延伸2 min,35 個循環(huán);徹底延伸5 min。PCR 產(chǎn)物用1% 瓊脂糖凝膠電泳檢測,通過M5 Gel Extraction Kit(Mei5bio,Beijing,China)進行回收,連接于pEASY?-Blunt3 CloningVector(Trans Gen Biotech,北京),轉入TOP10 感受態(tài)細胞(ANGYUBIO,上海),菌液送上海生工生物工程有限公司測序。
利用NCBI ORF(Open Reading Frame)(https://www.ncbi.nlm.nih.gov/orffinder)預測AhsNPFR 基因的開放閱讀框,DNAMAN 進行多序列比對,ExPASy-ProtParam(http://web. expasy. org/prot?param/)預測等電點及蛋白質(zhì)分子量大小,DeepT?MHMM(https://dtu. biolib. com/DeepTMHMM)預測跨膜結構域,InterPro(https://www.ebi.ac.uk/interpro/search/sequence/)預測保守結構域與蛋白家族。通過MEGA 7.0 采用鄰接法構建系統(tǒng)發(fā)育樹,重復1 000 次。
1.2.4 AhsNPFR 基因的表達模式分析
以1.2.2合成cDNA 為qPCR 模板,通過BeaconDesign 7.0設計AhsNPFR 特異性引物,以18S 核糖體蛋白(RPS18)[25]作為不同發(fā)育階段和不同組織處理的內(nèi)參基因進行實時熒光定量PCR(表1)。qPCR 所使用的儀器為ABI7500(Applied Biosystems,F(xiàn)os?ter City,CA,USA)。反應體系為:2?ChamQ Uni?versal SYBR qPCR Master Mix 10 μL,上下游引物各0.8 μL,10 ? cDNA 1 μL,加ddH2O 至20 μL。qPCR 反應條件為:95 ℃ 預變性3 min;95 ℃ 變性10 s,55 ℃退火30 s,72 ℃延伸30 s,40 個循環(huán)。不同發(fā)育階段和各組織樣品分別設置3 次生物學重復和3 次技術重復。
1.3 數(shù)據(jù)分析
qPCR 相對表達量數(shù)據(jù)采用2-ΔΔCt[26]法進行分析,使用SPSS 26.0 軟件進行單因素方差分析(one-way ANOVA),Tukey?s HSD 進行多重比較差異分析,差異顯著性標準為P<0.05。所得結果采用平均值± 標準誤表示,柱狀圖均由GraphPadPrism 8 繪制。
2結果與分析
2.1 AhsNPFR 基因克隆鑒定
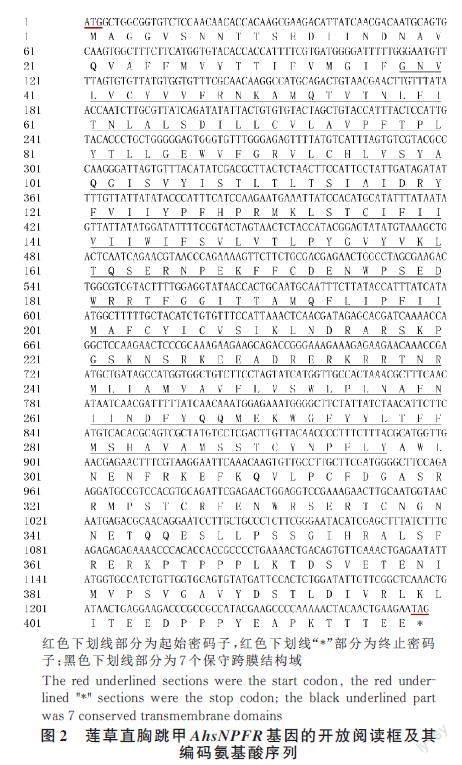
克隆獲得了1 個短神經(jīng)肽受體基因,產(chǎn)物經(jīng)1% 瓊脂糖凝膠電泳檢測,得到與預期長度一致的目的片段(圖1),其開放閱讀框ORF 長1 257 bp,編碼418 個氨基酸(圖2),命名為AhsNPFR(Gen?Bank 登錄號為OQ550102)。
2.2 序列與系統(tǒng)發(fā)育分析
蓮草直胸跳甲AhsNPFR 蛋白質(zhì)分子質(zhì)量為48.11 ku,等電點(pI)為8.21;結構域預測顯示,在38—297 位氨基酸殘基之間具有GPCRs 家族的保守結構域,屬于GPCRs 家族;多序列比對結果(圖3)顯示,蓮草直胸跳甲AhsNPFR 氨基酸序列與其他5 種鞘翅目昆蟲的sNPFR 序列相似性最高,為72.15%~87.22%,其中,與玉米根螢葉甲Di?abrotica virgifera virgifera 相似性最高(87.22%),與鱗翅目昆蟲家蠶Bombyx mori 相似性次之(52.34%),與雙翅目昆蟲黑腹果蠅D. melanogaster相似性最低(38.83%)。根據(jù)與其他昆蟲sNPFR共有的7 個典型保守跨膜結構域,克隆序列應該為AhsNPFR 基因。
將蓮草直胸跳甲sNPFR 氨基酸序列與鞘翅目、鱗翅目、雙翅目和半翅目等其他26 種昆蟲進行多序列比對,構建系統(tǒng)發(fā)育樹,結果如圖4 所示,蓮草直胸跳甲AhsNPFR 與其他鞘翅目昆蟲聚為一支;其中與玉米根螢葉甲DvsNPFR、光肩星天牛AgsNPFR 和馬鈴薯甲蟲LdsNPFR 親緣關系較近;其他目昆蟲也能分別聚類,符合分類學關系。
2.3 AhsNPFR 基因在蓮草直胸跳甲不同發(fā)育階段的表達模式
通過qPCR 分析了AhsNPFR 基因在蓮草直胸跳甲不同發(fā)育階段內(nèi)的表達水平。結果表明,AhsNPFR 基因在蓮草直胸跳甲各發(fā)育階段均有表達,其中幼蟲期(1~3 齡幼蟲)和成蟲期(雌雄成蟲)的表達量均顯著高于卵期和蛹期(P<0.05),1、3 齡幼蟲表達量顯著高于2 齡幼蟲,雌成蟲表達量顯著高于雄成蟲(P<0.05)。AhsNPFR 在1~3 齡幼蟲、蛹、雌、雄成蟲的相對表達量分別是卵期AhsNPFR表達量的9.05 倍、6.16 倍、8.03 倍、3.20 倍、8.84 倍和5.55 倍(圖5)。
2.4 AhsNPFR 基因在蓮草直胸跳甲不同組織的表達模式
通過qPCR 分析了AhsNPFR 基因在蓮草直胸跳甲3 齡幼蟲不同組織的表達水平,結果表明(圖6),AhsNPFR 基因在3 齡幼蟲各組織均有表達,其中后腸的表達量最高,顯著高于其他組織,是脂肪體表達量的12.21 倍(P<0.05);在頭、前腸、中腸和馬氏管的表達量間沒有顯著差異(P>0.05);在脂肪體的表達量最低。
通過qPCR 分析了AhsNPFR 基因在蓮草直胸跳甲雌雄成蟲不同組織的表達水平,結果表明(圖7),AhsNPFR 基因在蓮草直胸跳甲雌雄成蟲各個組織均有表達,且表達模式相似,后腸的表達量均顯著高于其他組織(P<0.05);觸角、頭、前腸、中腸、馬氏管、脂肪體的表達量沒有顯著差異,雌雄成蟲相同組織中表達量差異不顯著(P>0.05)。
3結論與討論
本研究克隆了蓮草直胸跳甲sNPFR 基因全長序列,其開放閱讀框編碼418 個氨基酸殘基,具有GPCRs 家族的保守結構域。目前,已鑒定的節(jié)肢動物短神經(jīng)肽受體sNPFR 均屬于GPCRs 家族[18],主要典型特征為含有7 個跨膜結構域。本研究結果顯示,蓮草直胸跳甲AhsNPFR 也含有7 個跨膜結構域,并且與其它昆蟲sNPFR 的保守結構域高度保守。系統(tǒng)發(fā)育分析也表明該基因可用于物種的進化關系研究。
蓮草直胸跳甲AhsNPFR 基因在幼蟲和成蟲期的表達量顯著高于卵和蛹期,1 齡幼蟲表達量最高。有研究表明,在豌豆蚜Acyrthosiphon pisum 中,ApsNPFR 在若蟲和成蟲中都有表達,且1 齡若蟲表達量最高,敲除ApsNPFR 后,刺探電位圖譜(EPG)結果顯示,豌豆蚜A. pisum 刺吸植物的次數(shù)和刺吸時間顯著減少[27]。在黑腹果蠅中,DmsNPFR的過表達導致取食量增加[16]。由此可見,sNPFR 在調(diào)控昆蟲取食中發(fā)揮重要功能作用,蓮草直胸跳甲是喜旱蓮子草的專食性天敵昆蟲,我們推測,AhsNPFR 也可能與蓮草直胸跳甲取食密切相關,但其功能還需后續(xù)基因干擾及行為試驗驗證。另外發(fā)現(xiàn),蓮草直胸跳甲雌成蟲AhsNPFR 表達量顯著高于雄成蟲,相關結果在其它文獻未見報道,推測可能為蓮草直胸跳甲雌成蟲取食量高于雄成蟲的重要分子基礎。
AhsNPFR 基因在蓮草直胸跳甲3 齡幼蟲和雌雄成蟲后腸中顯著高表達。有研究表明,在華山松大小蠹D. armandi 中,DasNPFR 基因在頭和中腸組織中顯著高表達,功能驗證表明其主要與取食相關[17]。在橘小實蠅Bactrocera dorsalis 中,BdsN ?PFR 在觸角和中樞神經(jīng)系統(tǒng)顯著高表達,通過CRISPR/Cas9 敲除BdsNPFR,發(fā)現(xiàn)該蟲定位寄主能力變?nèi)酰籈AG 反應中,對3 種氣味物質(zhì)的電生理反應均顯著降低[28]。家蠶B. mori sNPF 的3 個同源受體(BNGR-A7、BNGR-A10 和BNGR?A11)在不同組織中表達模式不同,其中BNGR?A7 僅在成蟲頭部高表達,BNGR?A10 在幼蟲和蛹的馬氏管中高表達,而在成蟲馬氏管中表達量較低,BNGRA11在幼蟲和成蟲的馬氏管、中腸和精巢中表達量較高,而在蛹期的卵巢中相對表達量較高[20]。由此可見,短神經(jīng)肽受體sNPFR 在不同昆蟲的調(diào)控模式可能不同。本研究中檢測了AhsNPFR 基因在蓮草直胸跳甲觸角、頭、前腸、中腸、后腸、馬氏管和脂肪體的表達情況,但仍有不足。有文獻報道,sN ?PFR 在昆蟲中樞神經(jīng)系統(tǒng)中顯著高表達[27],由于技術原因,沒有檢測AhsNPFR 在中樞神經(jīng)系統(tǒng)CNS中的表達情況。
本研究克隆鑒定了蓮草直胸跳甲AhsNPFR 基因,明確了AhsNPFR 基因在蓮草直胸跳甲不同發(fā)育時期和不同組織的表達模式,為進一步解析短神經(jīng)肽受體AhsNPFR 調(diào)控蓮草直胸跳甲的取食調(diào)控機制奠定依據(jù),也為蓮草直胸跳甲生防世界惡性雜草喜旱蓮子草提供一些新的思路。
參考文獻:
[1] ALTSTEIN M,N?SSEL D R. Neuropeptide signaling in in?sects[J]. Advances in Experimental Medicine and Biology,2010,692:155-165.
[2] HEWES R S,TAGHERT P H. Neuropeptides and neuropep?tide receptors in the Drosophila melanogaster genome[J]. Ge?nome Research,2001,11(6):1126-1142.
[3] SPITTAELS K,VERHAERT P,SHAW C,et al. Insect neu?ropeptide F(NPF)-related peptides:isolation from Colorado po?tato beetle(Leptinotarsa decemlineata) brain[J]. Insect Biochem?istry and Molecular Biology,1996,26(4):375-382.
[4] SCHOOFS L,CLYNEN E,CERSTIAENS A,et al. Newlydiscovered functions for some myotropic neuropeptides in locusts[J]. Peptides,2001,22(2):219-227.
[5] N?SSEL D R,WEGENER C. A comparative review of shortand long neuropeptide F signaling in invertebrates:any similari?ties to vertebrate neuropeptide Y signaling? [J]. Peptides,2011,32(6):1335-1355.
[6] MAULE A G,SHAW C,HALTON D W,et al. NeuropeptideF(Moniezia expansa):localization and characterization usingspecific antisera[J]. Parasitology,1992,105( Pt 3):505-512.
[7] 栗洪飛. 短神經(jīng)肽F 受體(sNPFR)參與調(diào)控桔小實蠅覓食和取食行為[D]. 重慶:西南大學,2022.
LI HF. The short neuropeptide F receptor(sNPFR)involved inregulating foraging and feeding behaviors in the oriental fruit flyBactrocera dorsalis(Hendel)[D]. Chongqing:Southwest Univer?sity,2022.
[8] MERTENS I,MEEUSEN T,HUYBRECHTS R,et al. Char?acterization of the short neuropeptide F receptor from Dro?sophila melanogaster[J]. Biochemical and Biophysical ResearchCommunications,2002,297(5):1140-1148.
[9] GARCZYNSKI S F,CRIM J W,BROWN M R. Characteriza?tion and expression of the short neuropeptide F receptor in theAfrican malaria mosquito,Anopheles gambiae[J]. Peptides,2007,28(1):109-118.
[10] CHEN M E,PIETRANTONIO P V. The short neuropeptideF-like receptor from the red imported fire ant,Solenopsis in?victa Buren(Hymenoptera:Formicidae)[J]. Archives of InsectBiochemistry and Physiology,2006,61(4):195-208.
[11] JOHARD H A D,YOISHII T,DIRCKSEN H,et al. Peptider?gic clock neurons in Drosophila:ion transport peptide and shortneuropeptide F in subsets of dorsal and ventral lateral neurons[J]. The Journal of Comparative Neurology,2009,516(1):59-73.
[12] 李梅梅. 黏蟲種群遺傳結構與神經(jīng)肽F 及其受體基因功能研究[D]. 楊凌:西北農(nóng)林科技大學,2022.
LI M M. Study on genetic structure and neuropeptide F and itsreceptor gene function of armyworm population[D]. Yangling:Northwest A & F University,2022.
[13] JIANG H B,GUI S H,XU L,et al. The short neuropeptide Fmodulates olfactory sensitivity of Bactrocera dorsalis upon star?vation[J]. Journal of Insect Physiology,2017,99:78-85.
[14] ROOT C M,KO K I,JAFARI A,et al. Presynaptic facilita?tion by neuropeptide signaling mediates odor-driven food search[J]. Cell,2011,145(1):133-144.
[15] LEE K S,YOU K H,CHOO J K,et al. Drosophila short neu?ropeptide F regulates food intake and body size[J]. Journal ofBiological Chemistry,2004,279(49):50781-50789.
[16] LEE K S,KWON O Y,LEE J H,et al. Drosophila short neu?ropeptide F signalling regulates growth by ERK-mediated insu?lin signalling[J]. Nature Cell Biology,2008,10:468-475.
[17] LIU B,F(xiàn)U D Y,NING H,et al. Identification of the short neu?ropeptide F and short neuropeptide F receptor genes and theirroles of food intake in Dendroctonus armandi[J]. Insects,2021,12(9):844.
[18] DILLEN S,ZELS S,VERLINDEN H,et al. Functional char?acterization of the short neuropeptide F receptor in the desertlocust,Schistocerca gregaria[J]. PLoS One,2013,8(1):e53604.
[19] DILLEN S,VERDONCK R,ZELS S,et al. Identification ofthe short neuropeptide F precursor in the desert locust:evi?dence for an inhibitory role of sNPF in the control of feeding[J].Peptides,2014,53:134-139.
[20] MA Q,CAO Z,YU Y N,et al. Bombyx neuropeptide Gprotein-coupled receptor A7 is the third cognate receptor forshort neuropeptide F from silkworm[J]. The Journal of Biologi?cal Chemistry,2017,292(50):20599-20612.
[21] 賈棟,趙龍龍,王森,等. 蓮草直胸跳甲Hsp70 蛋白的生物信息學分析[J]. 山西農(nóng)業(yè)科學,2015,43(4):397-400.
JIA D,ZHAO L L,WANG S,et al. Bioinformatic analysis ofAgasicles hygrophila Hsp70[J]. Journal of Shanxi AgriculturalSciences,2015,43(4):397-400.
[22] 馬瑞燕. 空心蓮子草天敵:蓮草直胸跳甲引進中國后的生態(tài)適應性研究[D]. 北京:中國農(nóng)業(yè)科學院,2001.
MA R Y. Ecological adaptation of the introduced biocontrolagent,Agasicles hygrophila,for alligatorweed,Alternantheraphiloxeroides,in china[D]. Beijing:Chinese Academy of Agri?cultural Sciences,2001.
[23] 余國梁,李政,李健,等. 喜旱蓮子草生物防治研究進展[J]. 湖南生態(tài)科學學報,2020,7(4):62-67.
YU G L,LI Z,LI J,et al. Research progress on biological con?trol of Alternanthera philoxeroides[J]. Journal of Hunan Eco?logical Science,2020,7(4):62-67.
[24] JIA D,WANG Y X,LIU Y H,et al. SMRT sequencing offull-length transcriptome of flea beetle Agasicles hygrophila(Selman and Vogt)[J]. Scientific Reports,2018,8:2197.
[25] 賈棟,紀周瑜,劉艷紅,等. 蓮草直胸跳甲不同發(fā)育階段內(nèi)參基因的篩選與驗證[J]. 山西農(nóng)業(yè)大學學報(自然科學版),2020,40(4):53-58.
JIA D,JI Z Y,LIU Y H,et al. Screening and validation of in?ternalreference genes in different developmentalstages of Agas?icles hygrophila[J]. Journal of Shanxi Agricultural University(Natural Science Edition),2020,40(4):53-58.
[26] LIVAK K J,SCHMITTGEN T D. Analysis of relative geneexpression data using real-time quantitative PCR and the2?ΔΔCT method[J]. Methods,2001,25(4):402-408.
[27] AMIR M B,SHI Y,CAO H H,et al. Short neuropeptide Fand its receptor regulate feeding behavior in pea aphid(Acyrtho?siphon pisum)[J]. Insects,2022,13(3):282.
[28] LI H F,HUANG X Y,YANG Y H,et al. The short neuropep?tide F receptor regulates olfaction-mediated foraging behaviorin the oriental fruit fly Bactrocera dorsalis(Hendel)[J]. InsectBiochemistry and Molecular Biology,2022,140:103697.

