HMGB1在三叉神經痛中的作用
沈 蓮,吳貝貝,王烈成,王元銀
三叉神經痛(trigeminal neuralgia,TN)是一種常見的神經病理性疼痛[1],嚴重影響患者的生活質量,其發病機制目前仍不明確。臨床上治療TN的方法主要有藥物治療、手術治療、伽馬刀放射治療、中醫治療等[2],但大多數效果不佳或副作用大。因此,TN的靶向治療一直是臨床上巨大的挑戰。高遷移率族蛋白B1(high-mobility group box-1,HMGB1)是一種高度保守的核蛋白,因其在聚丙烯酰胺凝膠電泳中速度快而得名[3]。HMGB1作為一種損傷相關模式分子參與級聯反應并成為神經痛的研究熱點,目前已在骨癌疼痛及坐骨神經痛中有相關研究[3-4]。HMGB1由膠質細胞或神經元釋放后,與Toll樣受體4(Toll-like receptor 4,TLR4)結合激活下游核因子κB(nuclear factor kappa-B,NF-κB)通路,進而引起背根神經痛[5]。而HMGB1在TN中研究甚少,該研究通過眶下神經縮窄術構造大鼠TN模型探索HMGB1對TN的作用,以期對TN的靶向治療提供方向。
1 材料與方法
1.1 材料
1.1.1主要材料和儀器 PCR引物由上海生工生物工程股份有限公司提供;Von Frey毛刷(美國North Coast公司,貨號:NC12775);Tissue RNA Purification Kit Plus(上海奕杉生物科技有限公司,貨號:RN002plus);PrimeScriptTMRT試劑盒及TB Green Premix Ex TagⅡ(日本TaΚaRa生物科技有限公司,貨號:RR047A、RR820A);HMGB1抑制劑Glcyrrhizin(美國MedChemexpress生物科技公司,貨號:HY-N0184);SDS-PAGE凝膠配制試劑盒(上海碧云天生物技術有限公司,貨號:P0012AC);HMGB1抗體(武漢三鷹生物技術有限公司,貨號:10829-1-AP);TLR4抗體、NF-κB p65抗體、NF-κB p-p65抗體(江蘇親科生物研究中心有限公司,貨號:AF7017、AF5006、AF2006,);水合氯醛(上海麥克林生化股份科技有限公司,貨號:C804539);超微量分光光度計(美國Thermo Scientific公司,型號:NanoDrop 2000/2000c);熒光定量PCR儀(美國ABI公司,型號:9700);高速低溫組織研磨儀(武漢賽維爾生物科技有限公司,型號:KZ-III-F)。
1.1.2實驗動物 選取體質量200 g左右的成年雄性Sprange-Dawley(SD)大鼠,共50只,維持型飼料飼養,可自由飲水和攝食,飼養間溫度25 ℃,12 h晝夜交替。術前3 d對大鼠使用Von-frey毛刷刺激絲進行適應性訓練,剔除反應遲鈍或敏感大鼠。所需實驗動物由安徽醫科大學實驗動物中心提供,實驗遵循動物實驗倫理(倫理學批號:LLSC20190705)。
1.2 方法
1.2.1實驗分組 將SD大鼠隨機分為4組:空白(Sham)組、手術(chronic constriction injury,CCI)組、CCI+生理鹽水(normal saline,NS)組及CCI+甘草酸(glcyrrhizin,GL)組。第1部分實驗探索HMGB1在TN大鼠三叉神經節(trigeminal ganglion,TG)中的表達及其可能機制,組別為CCI組和Sham組,每組10只。第2部分實驗探索HMGB1抑制劑GL對三叉神經痛的影響,組別為CCI組、CCI+NS組及CCI+GL組,每組10只。
1.2.2大鼠模型建立 使用0.1 mg/ml的水合氯醛按每100 g注射0.35 ml的劑量對雄性SD大鼠予以全身麻醉,術區碘伏消毒,CCI組大鼠行眶下神經縮窄術,即大鼠左側顴弓前1/3下方靠鼻旁做5 mm斜行切口,血管鉗鈍性分離肌肉和筋膜,用玻璃分針分離出眶下神經,5-0外科線結扎眶下神經,兩結扎處線相距約2 mm,松緊度適宜,保證僅眶下神經受壓迫,而不阻斷血流。用3-0外科線縫合皮膚,術區涂布金霉素眼膏預防感染。Sham組大鼠除眶下神經不結扎,其余處理方式同CCI組。其中CCI+GL組自手術第1天起每天予以50 mg/kg腹腔注射1次GL,連續2周。GL按每100 mg溶于50 ml NS比例配置,混勻,現配現用。CCI+NS組自術后第1天起每天予以等量NS腹腔注射,連續2周。按上述進行實驗分組,每組大鼠5只用于機械痛閾測定,剩余大鼠在術后第14天,予以過量水合氯醛處死,收集大鼠術側TG,-80 ℃冰箱保存,用于后續實驗。
1.2.3機械痛閾測定 為了減少干擾因素,測試前先將大鼠置于安靜環境中適應0.5 h,在術前1 d及術后第0、2、4、6、8、10、12、14、16、18、20天檢測各組大鼠術側的機械閾值,使用Von-frey毛刷刺激絲由小到大的強度順序對大鼠進行機械痛閾檢測。每個強度的毛刷刺激絲重復10次,每次間隔30 s。大鼠出現如下任一反應稱為陽性反應:快速縮頭、逃避或攻擊、搔抓刺激部位或洗臉的動作。10次刺激中有6次及6次以上陽性反應時,此時毛刷所對應的數值為該只大鼠此時的機械疼痛閾值,其余情況按順序更換大一號強度刺激絲測定大鼠機械痛閾。
1.2.4實時熒光定量PCR(RT-qPCR)檢測TG中HMGB1、TLR4和NF-κB p65 mRNA表達 使用Tissue RNA Purification Κit Plus試劑盒提取mRNA;使用超微量分光光度儀檢測樣本濃度和純度,保留A260/A280在1.9~2.0間的樣本,使用PrimeScriptTMRT進行cDNA合成,TB Green Premix Ex Taq Ⅱ進行PCR的擴增;熒光定量PCR儀檢測TG中HMGB1,TLR4及NF-κB p65的mRNA表達情況,使用2-ΔΔCT計算其相對表達水平。實驗所用熒光定量PCR基因引物序列見表1。

表1 qRT-PCR基因引物序列表
1.2.5Western blot檢測TG中HMGB1、TLR4和NF-κB p65 及其磷酸化p65(p-p65) 蛋白表達 收集大鼠術側TG組織,稱重后加入RIPA裂解液,配平,置于高速低溫組織研磨儀按4 ℃、12 000 r/min研磨15 min,直至組織成勻漿,吸取上清液至EP管中,加入蛋白上樣緩沖液,100 ℃加熱10 min使蛋白充分變性,-80 ℃冰箱保存。制備凝膠,恒壓80 V上樣電泳,恒流260 mA轉至PVDF膜上,置于5%脫脂奶粉中,室溫下搖床封閉2 h。封閉完成后,TBST搖床洗膜5次。一抗稀釋后,將PVDF膜置于一抗HMGB1抗體(1∶1 000),TLR4抗體(1∶1 000),NF-κB p65抗體(1∶1 000),NF-κB p-p65抗體(1∶1 000)稀釋液中,4 ℃搖床孵育過夜,TBST漂洗PVDF膜,置于二抗稀釋液辣根過氧化物酶標記山羊抗兔IgG (1∶1 000)中室溫孵育2 h,再次漂洗,配置顯影液,曝光成像,使用ImageJ進行圖像處理。
2 結果
2.1 機械痛閾測試結果術前1 d及術后0 d,CCI組與Sham組大鼠的機械閾值差異無統計學意義(t=0.63、0.01,P>0.05)。從術后第2天開始,CCI組大鼠機械痛閾較Sham組降低(t=4.34、6.63、7.36、6.99、8.14、8.75、9.10、9.83、8.30、8.64,均P<0.01);在術后第14天,CCI組大鼠機械疼痛閾值達到最低值(t=7.81,P<0.001);在術后第20天,CCI組大鼠機械痛閾仍處于較低水平,提示大鼠TN模型構造成功。見圖1。
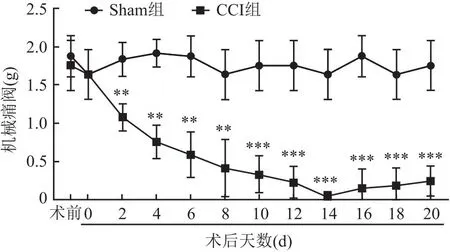
圖1 Sham組和CCI組大鼠不同時間點術側機械痛閾的比較
2.2 HMGB1在Sham組及CCI組大鼠TG中mRNA和蛋白表達量的變化RT-qPCR和Western blot檢測結果顯示,術后第14天,CCI組大鼠術側TG中HMGB1的mRNA和蛋白表達量較Sham組升高(t=11.42、3.37,均P<0.05)。見圖2。

圖2 Sham組和CCI組大鼠術后14 d術側TG中HMGB1的mRNA和蛋白表達的比較
2.3 TLR4在Sham組及CCI組大鼠TG中mRNA和蛋白表達量的變化RT-qPCR和Western blot檢測結果顯示,術后第14天,CCI組大鼠術側TG中TLR4的mRNA和蛋白的表達量較Sham組升高(t=31.07、10.61,均P<0.01)。見圖3。

圖3 Sham組和CCI組大鼠術后14 d術側TG中TLR4的mRNA和蛋白表達的比較
2.4 NF-κB p65和p-p65在Sham組及CCI組大鼠TG中mRNA和蛋白表達量的變化RT-qPCR結果顯示,術后第14天CCI組大鼠術側TG中p65的mRNA的表達量較Sham組升高(t=4.43,P<0.05)。見圖4A。Western blot結果顯示術后第14天,CCI組大鼠術側TG中p65的蛋白表達量較Sham組差異無統計學意義(t=0.11,P>0.05);CCI組大鼠術側TG中p-p65的蛋白表達量較Sham組升高(t=10.81,P<0.01)。見圖4B。
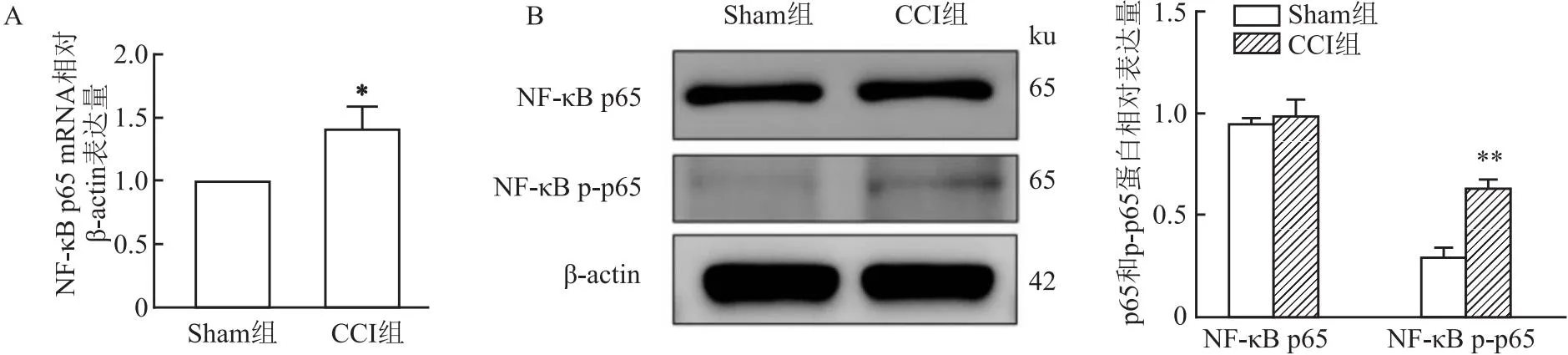
圖4 Sham組和CCI組大鼠術后14 d術側TG中NF-κB p65及p-p65的mRNA和蛋白表達的比較
2.5 HMGB1抑制劑GL對大鼠術側機械痛閾的影響在術后的第0~4天,三組大鼠機械痛閾均下降且差異無統計學意義(P>0.05)。在術后的第6天開始,CCI+GL組大鼠術側機械閾值開始高于CCI組和CCI+NS組(tCCI=3.42,tCCI+NS=3.57,均P<0.05);CCI組與CCI+NS組大鼠術側機械痛閾差異無統計學意義。在術后第10天,CCI+GL組大鼠術側機械痛閾開始升高,而CCI組與CCI+NS組仍繼續下降(tCCI=4.03、4.92、5.40、6.42、6.82、6.55,tCCI+NS=4.51、4.92、6.11、6.34、5.78、5.63,均P<0.01)。見圖5。行為測試結果表明,抑制HMGB1表達可以提高大鼠TN模型中術側的機械痛閾。
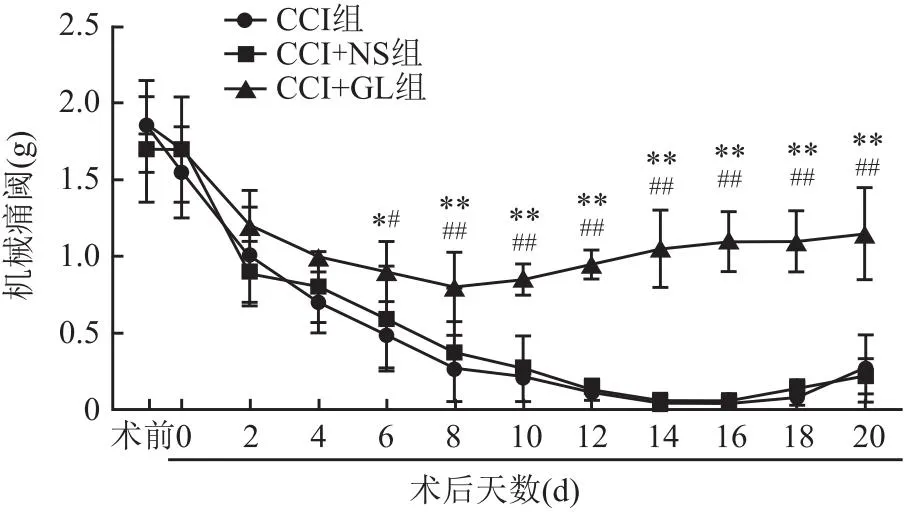
圖5 各組大鼠的術側機械閾值的比較
2.6 GL對HMGB1的mRNA和蛋白表達量的影響RT-qPCR和Western blot檢測結果顯示,與CCI組及CCI+NS組相比,在術后第14天,CCI+GL組大鼠術側TG中HMGB1的mRNA和蛋白表達量降低(tCCI=4.53、33.13,tCCI+NS=4.83、6.60,均P<0.01)。見圖6。CCI組與CCI+NS組大鼠術側TG中HMGB1表達差異無統計學意義(t=1.74、1.93,P>0.05)。表明GL成功抑制大鼠HMGB1的mRNA和蛋白表達。

圖6 各組大鼠術后14 d術側TG中HMGB1的mRNA和蛋白表達的比較
2.7 GL對TLR4的mRNA和蛋白表達量的影響RT-qPCR和Western blot檢測結果顯示,與CCI組和CCI+NS組相比,在術后第14天,CCI+GL組大鼠術側TG中TLR4的mRNA和蛋白表達量降低(tCCI=25.23、17.60,tCCI+NS=4.83、23.99,均P<0.01)。CCI組與CCI+NS組大鼠術側TG中TLR4的mRNA和蛋白表達量差異無統計學意義(t=0.03、2.76,均P>0.05)。見圖7。
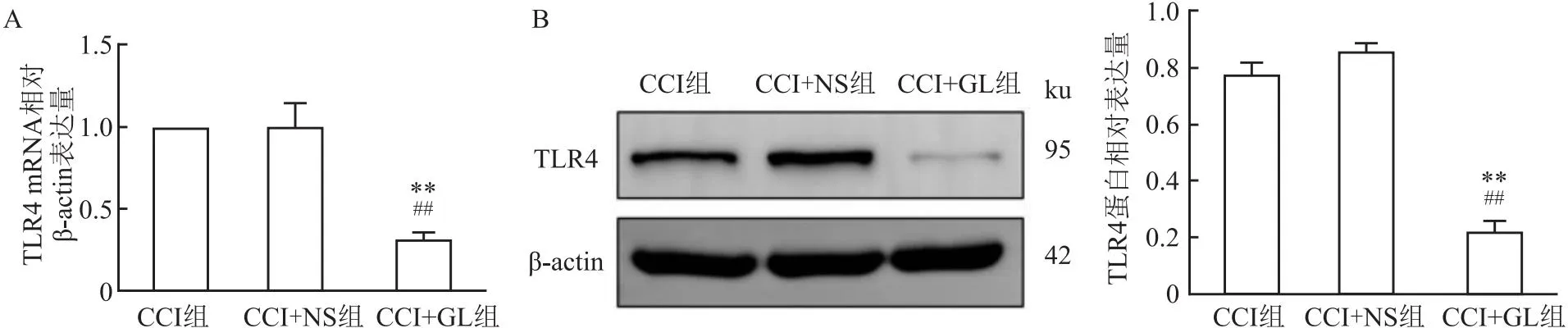
圖7 各組大鼠術后14 d術側TG中TLR4的mRNA和蛋白表達的比較
2.8 GL對NF-κB p65及p-p65的mRNA和蛋白表達量的影響RT-qPCR結果顯示,與CCI組及CCI+NS組相比,在術后第14天,CCI+GL組大鼠術側TG中p65 mRNA表達量降低(tCCI=14.48,tCCI+NS=3.91,均P<0.05)。見圖8A。Western blot檢測結果顯示,在術后第14天,CCI+GL組大鼠術側TG中p-p65蛋白表達量降低(tCCI=30.66,tCCI+NS
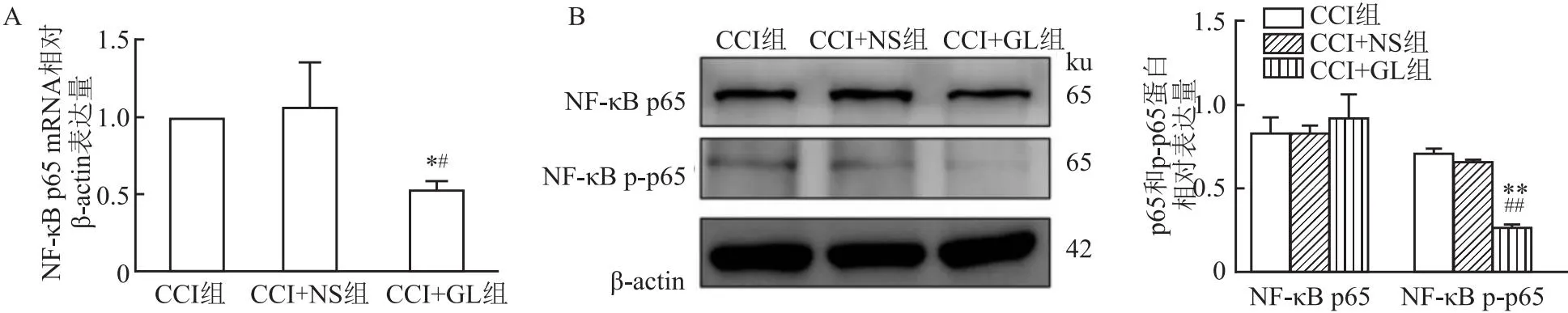
圖8 各組大鼠的術側TG中NF-κB p65及p-p65的mRNA和蛋白表達的比較
=35.46,均P<0.01),而p65蛋白無統計學差異;CCI組與CCI+NS組大鼠術側TG中p-p65蛋白表達差異無統計學意義(t=0.29,P>0.05)。見圖8B。
3 討論
目前原發性TN發病機制不明確,核磁共振影像學顯示三叉神經受到壓迫性損傷,因此推測三叉神經可能由于受到血管壓迫,引起神經脫髓鞘改變,進而引起神經過度興奮從而導致神經痛[6]。本研究采用大鼠眶下神經縮窄術模擬神經壓迫性損傷,構造TN大鼠疼痛模型,行為學測試[7]顯示經眶下神經縮窄術后大鼠術側機械閾值降低,提示造模成功。
HMGB1是HMG蛋白中研究最廣泛的蛋白之一,它由帶正電荷的A盒和B盒以及帶負電荷的酸性末端組成,其氨基酸殘基89~108段可與TLR4結合,促進炎癥反應和基因轉錄。HMGB1在受損的脊髓背角和周圍神經疼痛模型中均上調,提示HMGB1可能在慢性疼痛的發生和維持中起到至關重要的作用[5]。研究[8]顯示在空白組小鼠鞘內注射重組HMGB1抗體可引起疼痛超敏反應,而坐骨神經結扎組小鼠給予抗HMGB1抗體鞘內注射可顯著逆轉部分機械痛覺超敏反應。本研究中,眶下神經縮窄術組大鼠機械痛閾升高,同時術側TG中HMGB1的mRNA和蛋白表達量均升高,與前人研究結果一致[9]。GL是甘草的根和莖的主要活性成分,已廣泛用于肝炎、腫瘤等疾病的治療。GL具有抗炎護肝等作用,是一種天然的HMGB1抑制劑[10]。研究[11]顯示,在脂多糖激活的BV2小膠質細胞中HMGB1表達量升高,而GL可以抑制HMGB1表達量升高。在本研究中,連續兩周腹腔注射HMGB1抑制劑GL后,大鼠術側機械痛閾雖然在術后的前8 d降低,但較對照組降低幅度減緩,且仍高于對照組,同時從第10天開始,機械痛閾上升。以上結果提示,HMGB1與TN有關,抑制HMGB1可以緩解TN的疼痛。
TLR4是Toll樣受體(TLRs)家族之一,在星形膠質細胞和小膠質細胞等多種細胞表面表達,與神經痛發生密切相關[12]。當損傷的神經元或者膠質細胞將HMGB1釋放到細胞外后,可與TLR4結合,啟動炎癥轉導通路,激活NF-κB通路,核因子κB磷酸化入核增加[13]。在膠原抗體誘導的小鼠關節炎模型中,TLR4基因敲除小鼠鞘內注射重組HMGB1后沒有出現明顯的機械痛閾升高[14]。本研究分子學檢測結果表明,GL可以使得HMGB1、TLR4、NF-κB p65磷酸化降低。因此推測HMGB1可能通過TLR4/NF-κB通路調控疼痛的發展。
綜上所述,大鼠TN模型中HMGB1上調,GL可以抑制HMGB1上調,HMGB1可能通過TLR4/NF-κB調控TN。因此,HMGB1可能是治療TN的一個潛在的分子靶點,后續將繼續探索HMGB1的致痛機制,為TN的治療提供新的思路。

