子癇前期患者胎盤中EG-VEGF及其PROKR1和PROKR2的表達情況*
李 瓊,王永紅,劉 淼,張桂玲,陳 瑤,趙晨陽
郴州市第一人民醫院/湘南學院第一附屬學院婦產科,湖南郴州 423000
子癇前期(PE)是臨床常見妊娠并發癥,全世界范圍內PE的發病率在3%~8%,以高血壓、蛋白尿為主要特征,且常伴有水腫、全身多器官損害,其病理特征為母體全身小血管痙攣、血管內皮損傷、胎盤組織缺血[1-2]。PE是導致胎兒生長受限、早產、死胎的主要原因,嚴重危及母嬰生命健康。目前仍缺乏治療PE的特效藥物,因而探究PE發病機制有助于尋找新型治療靶點。內分泌腺源性血管內皮生長因子(EG-VEGF)是一種新型血管生成因子,主要存在于生殖器官中,定位于合胞體滋養層,可激活受體前動力蛋白1(PROK1)、前動力蛋白2(PROK2),促進滋養層細胞遷移、侵襲,增強毛細血管內皮細胞增殖、分化、趨化能力[3-4]。目前,關于EG-VEGF、PROKR1、PROKR2水平與PE相關性的研究較少,本研究主要探討PE患者血清及胎盤組織中EG-VEGF、PROKR1、PROKR2水平,分析其與PE患者臨床病理特征、病情嚴重程度、新生兒結局的相關性,為PE防治提供新思路及理論依據。
1 資料與方法
1.1一般資料 選取2019年1月至2022年1月本院收治的100例PE患者作為研究組,依據病情嚴重程度[5]分為輕度組和重度組,各50例。另選取同期行剖宮產手術的健康孕婦50例作為對照組。研究組孕婦年齡20~34歲,平均(27.03±2.10)歲;孕周36~39周,平均(37.71±0.26)周;孕次1~3次,平均(2.31±0.21)次;產次1~3次,平均(2.01±0.11)次;身高155~170 cm,平均(163.01±2.03)cm,體重66~80 kg,平均(73.36±2.12)kg。對照組孕婦年齡19~35歲,平均(26.85±2.06)歲;孕周37~40周,平均(37.75±0.32)周;孕次1~3次,平均(2.28±0.17)次;產次1~3次,平均(1.98±0.10)次;身高157~170 cm,平均(163.32±2.08)cm;體重67~81 kg,平均(74.03±2.18)kg。兩組一般資料比較,差異無統計學意義(P>0.05),具有可比性。本研究經本院倫理委員會批準,患者及其家屬知情且簽署知情同意書。
1.2納入與排除標準 納入標準:符合PE診斷標準[6];單胎妊娠;無其他妊娠期并發癥;行剖宮產分娩;規律接受產檢;自然受孕。排除標準:既往妊娠過程中有PE史;生殖器官畸形;先天性遺傳疾病;合并甲狀腺功能亢進(甲亢)等自身免疫性疾病;伴慢性高血壓等心血管疾病;合并糖尿病等代謝性疾病;伴精神障礙或認知功能障礙;年齡<19歲或>35歲。
1.3方法
1.3.1采集組織、血液標本 剖宮產術中收集胎盤組織,切取胎盤組織80 mg(2份),取胎盤組織時應避開出血、鈣化灶。將其中一份放入含有RNAlater液(1 mL)的凍存管內,置于-20 ℃冰箱內保存;另一份用生理鹽水清洗,使用10%中性多聚甲醛固定,過夜后用石蠟包埋,制備厚度約為3 μm的蠟塊。分別于剖宮產前24 h采集兩組空腹外周靜脈血6 mL,3 500 r/min離心5 min留取血清,于-80 ℃冰箱內保存。
1.3.2熒光定量PCR(qPCR)法檢測血清、胎盤組織中EG-VEGF、PROKR1、PROKR2 mRNA水平 取出凍存胎盤組織、血清標本,使用Trizol試劑(美國Invitrogen公司)分別提取組織總RNA,采用miRNeasy Serum/Plasma Kit(上海復申生物)提取血清總RNA。取1.0 μg RNA標本參照反轉錄試劑盒(北京天根生化)合成cDNA。取0.2 μg cDNA,按照熒光定量PCR試劑盒說明書(北京天根生化)配制反應體系:10×PCR Buffer 2.5 μL,MgSO42.5 μL,dNTPs 2.5 μL,正、反向引物各0.5 μL,RNase-Free ddH2O補足反應體系至25 μL。以GAPDH為內參,采用2-ΔΔCt法計算EG-VEGF、PROKR1、PROKR2 mRNA相對表達水平。
1.3.3免疫組化法檢測胎盤組織中EG-VEGF、PROKR1、PROKR2蛋白陽性表達率 取胎盤組織蠟塊,經梯度乙醇水化后置于枸櫞酸鹽溶液(10 mmol/L,pH 6.0)中20 min(95~100 ℃),滴加3%過氧化氫溶液孵育25 min(37 ℃),用磷酸鹽緩沖液(PBS)洗滌后,加入山羊血清反應15 min,加入EG-VEGF(1∶800,美國Abcam公司)、PROKR1(1∶800、武漢艾美捷科技有限公司)、PROKR2(1∶800、武漢艾美捷科技有限公司)一抗稀釋液,4 ℃孵育過夜,次日清洗后加入山羊抗兔IgG二抗(1∶2 000、美國Abcam公司),37 ℃孵育2 h,棄PBS后加入Max VisionTM免疫組化試劑盒試劑50 μL(上海聯邁生物工程有限公司),37 ℃孵育15 min,然后滴加二氨基聯苯胺(DAB)顯色(江蘇綠葉生物),蘇木素復染,于1%鹽酸中清洗,使用梯度乙醇脫水,中性樹脂封固,使用CX23光學顯微鏡觀察(日本奧林巴斯)。
結果判定標準[7]:每張切片隨機挑選5個視野(400倍),統計陽性染色細胞數量,具體評分如下。(1)根據染色程度計數:未顯色為0分,淺黃色為1分,棕黃色為2分,深棕色為3分;(2)根據陽性細胞數目:陽性細胞率<25%為0分,25%≤陽性細胞率≤50%為1分,50%<陽性細胞率<75%為2分,陽性細胞率≥75%為3分。取兩項評分的乘積作為最終得分,≤3分記為陰性,>3分記為陽性。
1.4觀察指標 (1)比較兩組臨床特征:包括γ-谷氨酰轉移酶(GGT)、乳酸脫氫酶(LDH)、尿酸(UA)、收縮壓、舒張壓、血小板計數、新生兒體重、螺旋動脈管壁厚度、螺旋動脈管腔面積、丙二醛(MDA)、超氧化物歧化酶(SOD)、谷氨酸氨基轉移酶(ALT)、天冬氨酸氨基轉移酶(AST)、尿素氮(BUN)。(2)分析不同組、不同病情嚴重程度、不同新生兒結局者血清、胎盤組織中EG-VEGF、PROKR1、PROKR2 mRNA水平。(3)分析血清各指標與臨床特征相關性及其對PE診斷價值。
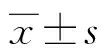
2 結 果
2.1兩組臨床特征比較 與對照組比較,研究組收縮壓、舒張壓、血小板計數、螺旋動脈管壁厚度增高,GGT、LDH、UA、ALT、AST、MDA水平升高,新生兒體重、螺旋動脈管腔面積降低,BUN、SOD水平降低(P<0.05),見表1。
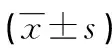
表1 兩組臨床特征比較
2.2兩組血清、胎盤組織中EG-VEGF、PROKR1、PROKR2 mRNA水平比較 與對照組比較,研究組血清、胎盤組織中EG-VEGF、PROKR1、PROKR2 mRNA水平降低(P<0.05)。見表2。
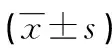
表2 兩組血清、胎盤組織中EG-VEGF、PROKR1、PROKR2 mRNA水平比較
2.3兩組胎盤組織中各指標陽性表達率比較 EG-VEGF、PROKR1、PROKR2蛋白定位于細胞膜、細胞質,陽性顆粒呈棕黃色、淺黃色、深棕色,研究組EG-VEGF、PROKR1、PROKR2蛋白陽性表達率低于對照組(P<0.05),見表3。

表3 兩組胎盤組織中各指標陽性表達率比較[n(%)]
2.4不同病情嚴重程度患者血清、胎盤組織中各指標水平比較 與輕度組患者比較,重度組患者血清、胎盤組織中EG-VEGF、PROKR1、PROKR2 mRNA水平降低(P<0.05)。見表4。
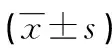
表4 不同病情嚴重程度患者血清、胎盤組織中各指標水平比較
2.5血清中各指標與臨床特征、病情嚴重程度相關性 血清EG-VEGF、PROKR1、PROKR2水平與新生兒體重、螺旋動脈管腔面積、BUN、SOD呈正相關(P<0.05),與收縮壓、舒張壓、螺旋動脈管壁厚度、GGT、LDH、ALT、MDA、病情嚴重程度呈負相關(P<0.05)。見表5。

表5 各指標與臨床特征、病情嚴重程度的相關性
2.6ROC曲線分析血清中各指標對PE的診斷價值 以研究組100例為陽性標本,以對照組50例為陰性標本繪制ROC曲線,結果顯示,聯合診斷PE的曲線下面積(AUC)大于單項診斷(P<0.05)。見表6、圖1。

圖1 各指標對PE的ROC曲線分析

表6 ROC曲線分析血清中各指標對PE的診斷價值
2.7不同新生兒結局孕婦血清中各指標水平比較 研究組中新生兒不良結局發生率為62.00%(62/100),對照組新生兒為足月正常新生兒(50例)。與足月正常新生兒比較,胎盤早剝、巨大兒、胎兒窘迫、早產兒、新生兒窒息等孕婦血清EG-VEGF、PROKR1、PROKR2 mRNA水平降低(P<0.05)。見表7。
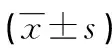
表7 不同新生兒結局孕婦血清中各指標水平比較
3 討 論
胎盤組織發育過程中滋養層細胞可分泌激素、細胞因子,PE可分為2個階段:第1階段為滋養層細胞浸潤不足誘發子宮螺旋動脈重塑障礙,導致母體全身血管阻力增加,血小板聚集增強,促使凝血系統異常,致使胎兒缺血缺氧,因而探究其浸潤行為的病理機制具有重要意義[8-9];第2階段為胎盤因子進入母體血液循環,可激活氧化應激、炎癥反應,造成血管內皮細胞損傷,進一步引起生理病理改變[10-11],因而調節血管內皮障礙、凝血及血管生成的功能是目前治療、預防PE發生發展的主要途徑。
PE患者外周血、胎盤中EG-VEGF水平降低,可抑制下游細胞外信號調節激酶(ERK)/基質金屬蛋白酶9(MMP-9)信號傳導,導致滋養層細胞入侵不足[12]。本研究結果顯示,研究組血清、胎盤組織中EG-VEGF水平低于對照組,與文獻[12]研究結果相似。本研究進一步分析發現,重度患者低于輕度患者,研究組EG-VEGF陽性表達率低于對照組,表明EG-VEGF表達下調與PE發生發展密切相關。本研究結果還顯示,血清EG-VEGF水平與新生兒體重呈正相關,而與病情嚴重程度呈負相關,表明血清EG-VEGF水平在一定程度上可反映疾病嚴重程度。本研究發現,血清EG-VEGF水平與LDH呈負相關,其原因可能為EG-VEGF可調控滋養細胞侵襲、胎盤血管生成,其水平降低可引起血管系統內皮功能障礙,增加LDH釋放量,同時還可能與PE患者體內存在血管內皮細胞損傷、溶血有關。隨著PE病情加重,胎盤螺旋動脈管腔面積降低,螺旋動脈管壁厚度增加[13]。本研究結果顯示,血清EG-VEGF水平與螺旋動脈管腔面積呈正相關,而與螺旋動脈管壁厚度呈負相關,表明EG-VEGF水平降低可能參與胎盤螺旋動脈重鑄過程。EG-VEGF水平降低可能影響內皮細胞生成,誘發胎盤螺旋動脈生成障礙,引起螺旋動脈灌注不足。氧化應激反應加劇是PE發生的重要病理改變。MDA屬于氧化代謝產物,SOD屬于抗氧化酶,本研究中,研究組MDA水平高于對照組,SOD水平低于對照組,表明PE患者體內存在氧化-抗氧化失衡,這與既往研究結果[14]相似,進一步分析發現,EG-VEGF與SOD呈正相關,而與MDA呈負相關。這提示EG-VEGF可調節氧化應激反應,但其是否可通過介導氧化應激參與PE發生發展過程尚需深入探討。
BUN、GGT、ALT與PE病情相關,可參與氧化應激反應、谷胱甘肽代謝,引起血管內皮細胞損傷,并可能是影響PE發生的危險因素[15]。本研究中,研究組GGT、ALT水平高于對照組,BUN水平低于對照組,且EG-VEGF與BUN呈正相關,而與GGT、ALT呈負相關,表明EG-VEGF水平降低可能引起肝腎功能指標異常變化,促使氧化應激反應加劇,影響滋養層細胞入侵,進一步誘發PE。EG-VEGF與子宮內膜脈動指數(PI)呈正相關,并可作為評估不明原因不孕婦女局部血管生成的標志物[16]。EG-VEGF表達失調與細胞增殖、轉移有關[17]。目前臨床常采用24 h尿蛋白、臨床癥狀等診斷PE,但難以及時診斷及評估病情進展。EG-VEGF診斷PE未能顯示足夠大的AUC,表明該指標診斷PE的價值有限,需與其他指標結合使用。基質金屬蛋白酶(MMPs)合成、降解失衡可能誘發PE,MMPs與絨毛膜外滋養細胞侵襲有關,EG-VEGF可激活受體PROKR1、PROKR2,促進絲裂原激活蛋白激酶(MAPK)、MMP-9表達,進一步促進滋養層細胞遷移、侵襲[18-19]。PROK1、PROKR2失調與妊娠并發癥有關,可調節胚胎著床,胎盤/蛻膜血管發育,并可抑制炎癥細胞浸潤[20-21]。本研究嘗試性分析PROK1、PROKR2與PE發生發展相關性,結果顯示研究組血清、胎盤組織中PROKR1、PROKR2水平低于對照組,且與臨床特征、病情嚴重程度密切相關,進一步分析發現其水平異常變化與新生兒不良結局有關。EG-VEGF、PROKR1、PROKR2可能參與PE發生發展的機制:EG-VEGF水平降低導致滋養層細胞入侵不足,致使子宮動脈重建,增加生長因子分泌量;EG-VEGF可能調節氧化應激反應,減輕血管內皮細胞損傷,改善胎盤組織缺氧狀況;PROKR1、PROKR2可調節炎癥反應,減輕交感神經活動程度,改善血管內皮細胞功能障礙。本研究結果顯示,血清EG-VEGF、PROKR1、PROKR2水平聯合診斷PE的AUC大于單項診斷,表明聯合檢測血清各指標水平可提高PE診斷價值。
綜上所述,PE患者血清、胎盤組織中EG-VEGF、PROKR1、PROKR2水平降低,且與臨床特征、病情嚴重程度及新生兒結局有關,其對PE的診斷具有臨床應用價值,需進一步探究其與PE發生發展機制的相關性,可為PE的治療提供新方向。

