基于牡丹澇害脅迫的轉錄組分析及SSR引物開發
劉慧春,許雯婷,周江華,張加強,史小華,朱開元
(浙江省園林植物與花卉研究所,浙江 杭州 311251)
牡丹(PaeoniasuffruticosaL.)是原產于中國的著名花灌木,也是一種具有深厚文化內涵的中國傳統花卉。牡丹原產于北方,主要種植于黃河流域中下游地區,根系肥厚,對澇害較為敏感。長江以南地處長江中下游,地下水位偏高,雨季土壤水分過飽和,臺風、洪水等災害嚴重影響了長江以南牡丹的種植和應用。隨著人們欣賞水平的提高,迫切需要篩選出適合江南地區廣泛種植的牡丹品種。耐澇品種的選育一直是牡丹南下栽培的重點和難點。目前,江南牡丹的種植主要采用塑料薄膜防雨,限制了植物的自然光照,從而影響了牡丹的開花質量。如何提高牡丹的耐澇性已成為牡丹生產中亟待解決的問題。因此,深入研究牡丹在澇害脅迫下的響應機制,對牡丹生產具有重要的現實意義和應用價值。
在過去的幾年里,轉錄組測序技術已被廣泛應用于功能基因組研究。隨著新一代測序的快速發展,RNA-Seq已成為一種有效的轉錄組數據分析方法。此外,它還被用來闡明對各種非生物脅迫的反應機制,包括干旱、低溫、鹽堿和澇害[1-7]。到目前為止,很少有關于牡丹澇害脅迫相關分子機制的報道。僅見報道的有,通過全長轉錄組測序和第二代轉錄組測序的結合,初步探討了鳳丹牡丹對淹水脅迫反應的分子機制[8]。因此,對牡丹響應澇害脅迫的綜合轉錄組學分析還有待進一步研究和提升。
隨著高通量測序技術的快速發展,進一步延伸出利用轉錄組序列開發SSR標記,并已被廣泛應用于群體遺傳學、遺傳連鎖圖的構建,種質與標記輔助選擇育種之間的遺傳關系分析[9-12]。前人也曾通過RNA-Seq開發出牡丹的一些SSR標記[13]。例如,前人在滇牡丹(P.delavayi)中開發了10個SSR標記[14],在紫斑牡丹(P.rockii)中開發了11個與農藝性狀相關的SSR標記、44個與種子性狀相關的SSR標記[15-16],在牡丹(P.suffruticosa)中開發了12個與花色形成有關的SSR標記[17]。然而,與玉米(Zeamays)和大豆(Glycinemax)等作物相比,牡丹中目前的SSR標記數量仍然有限,而且關于牡丹澇害脅迫相關基因的SSR分子標記的報道很少。
在本研究中,通過RNA-Seq對耐澇牡丹根的轉錄組進行了分析,以闡明其對澇害脅迫反應的分子機制。基于構建的高通量RNA-Seq數據庫,在牡丹中開發了調控澇害脅迫性狀的SSR標記。該研究結果對牡丹進行了大規模轉錄組注釋,將為未來耐澇牡丹品種的育種研究提供寶貴的基因組資源,并為進一步研究其遺傳多樣性、功能基因的發現和定位、種質資源鑒定和標記輔助選擇提供科學依據。
1 材料與方法
1.1 植物材料及處理
實驗材料為3年生鳳丹牡丹的實生苗,由浙江省園林植物與花卉研究所提供。選擇50株在人工澇害脅迫處理下能夠存活下來的植株,在含有泥炭、珍珠巖和園土(體積比2∶1∶1)的培養基質中培養。培養條件為:光照14 h,溫度25 ℃,光照強度為160 μmol·m-2·s-1光子,相對濕度為50%~60%。將其中25株幼苗作為處理組,放置在土壤表面上方含有3 cm水深的泡沫箱中。將另外25株未經處理的幼苗置于正常培養條件下作為對照。處理48 h后,從兩個處理(對照和處理的植株)中采集幼根,然后在液氮中快速冷凍并在-80 ℃下儲存備用。
1.2 RNA提取
將對照樣品(CK1、CK2和CK3)和澇害處理的樣品(W1、W2、W3)的根作為3個生物學重復。根據產品說明書,使用植物總RNA純化試劑盒(GeneMark TR02)分離總RNA。通過變性瓊脂糖凝膠電泳檢測RNA質量,并使用NanoDrop 2000分光光度計(Thermo Scientific,USA)測定RNA濃度。
1.3 RNA序列文庫的構建
從經過正常條件(對照樣品CK1、CK2、CK3)和澇害條件(澇害處理的樣品W1、W2、W3)的牡丹根中分離的6個高質量RNA樣品,分別用于cDNA文庫的構建,然后將文庫加入高通量測序平臺(Illumina HiSeq 2500,USA)進行測序。cDNA文庫的構建方法和Illumina深度測序的過程參考Li等[18]的方法。RNA-Seq讀數通過Illumina數據處理軟件(Version 1.8)生成。
1.4 數據組裝、讀取和基因注釋
按照Li等[18]描述的方法進行轉錄組數據組裝,采用NR、Swissport、KOG和KEGG數據庫對基因功能進行注釋,這些數據庫通過BLASTA進行比對,截斷E值≤1.0-5。
1.5 差異表達基因分析
基于上述獲得的RNA-Seq數據,采用在線工具degust (http://vicbioinformatics.com/degust/) 生成主成分分析(PCA)圖。通過軟件包RPKM評估和量化基因表達水平,并使用Cufflinks軟件的Cuffdiff程序(v2.0.2,http://cole-trapnell-lab.github.io/cufflinks/),使用FDR調整基因的多次測試和分析中的P閾值。FDR調整后的P≤0.05和log2R倍數變化的絕對值≥1(倍數變化≥2)被設定為顯著差異表達的閾值。基于Wallenius非中心超基因組分布的GOseq R軟件包對DEG進行GO富集分析,該軟件包可以調整DEG中的基因長度偏差。采用KOBAS軟件測試KEGG途徑中DEG的統計富集。
1.6 qRT-PCR分析
隨機選擇14個來自所有DEG的單基因,使用qPCR驗證基于RNA-Seq的表達水平分析的可靠性和準確性。利用Oligo 7.57軟件設計單基因的引物,按照Li等[18]描述的方法進行qRT-PCR驗證。PCR反應體系為20 μL,包括:1 μL cDNA模板、1 μL引物混合物、10 μL 2×SYBR Green qPCR混合物和8 μL ddH2O。用Mastercycler?ep realplex4進行qPCR反應,反應程序如下:95 ℃預變性3 min;95 ℃變性5 s,60 ℃退火10 s,40個循環;最后95 ℃延伸15 s。選擇18S rRNA作為參考基因,并使用2-ΔΔCT方法對基因的相對表達水平進行測算。
1.7 SSR鑒定、引物設計和PCR擴增
根據RNA-Seq數據,使用SSRIT軟件(http://archive/gramene.org/db/markers/ssrtool)鑒定SSR位點[17]。已鑒定的基因位點包含二、三、四、五和六個核苷酸,最小重復數分別為4、3、3、4和2。使用Primer Premier 5.0從差異基因表達數據中選擇并設計這些SSR基因位點。SSR引物的參數設定為:GC含量40%~60%,引物長度20~25 bp,預期片段大小100~300 bp,退火溫度55~65 ℃,上下游引物差異在2 ℃以內。
PCR擴增的反應體系為20 μL,包括:dd H2O 14.8 μL,dNTP 0.4 μL,緩沖液2 μL,20 μmol·L-1上下游引物各0.3 μL,DNA模板2 μL和Taq0.2 μL。PCR擴增的反應程序為:94 ℃預變性5 min;94 ℃變性30 s,54 ℃復性35 s,72 ℃延伸40 s,共35個循環;最后,72 ℃延伸3 min。通過1.5%瓊脂糖電泳檢測PCR擴增產物,點樣量為3 μL。將3 μL可產生特定條帶的PCR擴增產物與5 μL加載緩沖液混合。離心后,在94 ℃變性5 min,在冰箱中冷凍1 min,然后采用6%變性聚丙烯酰胺凝膠進行垂直電泳分析,銀染后觀察結果。能擴增出清晰條帶的引物被視為有效引物,不能擴增出清晰條帶或擴增條帶不在范圍內的引物被認為是無效引物。
2 結果與分析
2.1 轉錄組測序和組裝
為了獲得牡丹耐澇性的總體情況,使用高通量測序平臺構建并測序了來自CK1、CK2、CK3(處理)和W1、W2、W3(對照)的6個cDNA文庫。總共產生了444 382 372個Illumina原始讀數,其長度范圍從低于50 bp到151 bp。在去除接頭序列和低質量讀數后,獲得了438 315 223個干凈讀數。每個樣本中的表達基因數量在57 024到61 583之間。從組裝轉錄物中共獲得74 756個參考unigene,平均長度為743 bp,長度范圍為201~12 252 bp。基于長度的unigene分布如圖1所示。
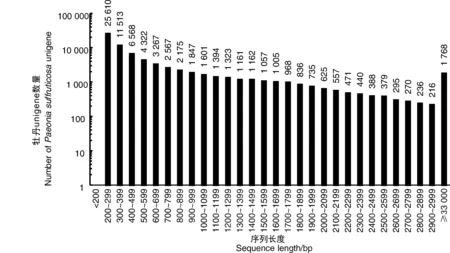
圖1 牡丹轉錄組unigene的長度分布和豐度Fig.1 Length distribution and abundance of unigenes from the P. suffruticosa transcriptome
2.2 功能注釋
利用4個公共數據庫(NR、Swissprot、KOG和KEGG)對unigene進行注釋。注釋結果顯示,在NR數據庫中有33 105個unigene(44.28%)匹配,在Swissprot數據庫中有22 715個(30.38%)匹配,KOG數據庫中有19 613個(26.24%)匹配,KEGG數據庫中有12 763個(17.07%)匹配。共有33 278個unigene(44.51%)與4個數據庫中的一個或多個數據庫匹配,其中9 761個unigene在所有4個數據庫中匹配(13.06%)。同時,這些結果表明,Illumina測序測試了牡丹中廣泛表達的基因,其中6 106、1 986、1 964和1 921個分別與葡萄、核桃、可可和土瓶草的表達基因高度相似(圖2)。
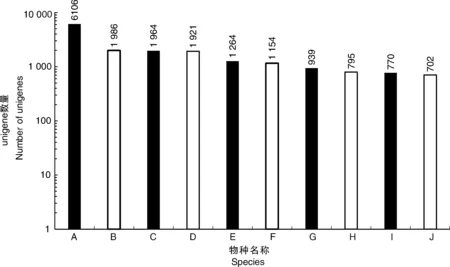
A,葡萄;B,核桃;C,可可;D,土瓶草; E,蓮藕;F,酸棗;G,梅花;H,麻瘋樹;I,柑橘; J,木豆。A, Vitis vinifera; B, Juglans regia; C, Theobroma cacao; D, Cephalotus follicularis; E, Nelumbo nucifera; F, Ziziphus jujuba; G, Prunus mume; H, Jatropha curcas; I, Citrus sinensis; J, Cajanus cajan.圖2 unigene BLASTX比對結果的物種分布圖Fig.2 Species distribution of unigene BLASTX results
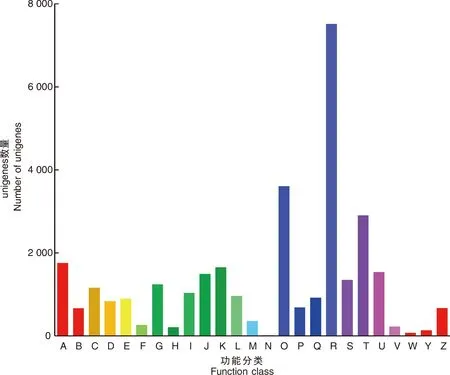
利用GO分析,將預測的牡丹unigene的功能分為3類:生物過程、細胞成分和分子功能。每個類別分別被進一步聚類為17、15和11個子類別,共包含43個子類別(圖3)。對于生物過程類別,“細胞過程”(2 687)、“代謝過程”(3 297)和“單體過程”(2 163)是前3個富集組。細胞成分類別主要包含涉及“細胞”(1 588)、“細胞部分”(1 584)和“細胞器”(1 132)的基因。在分子功能類別中,“結合”(2 309)、“催化活性”(3 454)和“轉運蛋白活性”(330)子類別的代表性很高。
a-q,生物過程(a,再生產;b,免疫系統過程;c,代謝過程;d,細胞過程;e,再生過程;f,生物黏附;g,信號傳導;h,多細胞生物過程;i,發展過程;j,增長;k,單體過程;l,韻律過程;m,對刺激的反應;n,本地化;o,多生物過程;p,生物調控;q,細胞成分組織或生物發生); r-z,A-F,細胞成分 (r,細胞外區域;s,細胞;t,膜;u,病毒粒子;v,細胞連接;w,細胞外基質;x,膜封閉管腔;y,大分子復合物;z,細胞器;A,細胞外基質成分;B,細胞器部分;C,病毒粒子部分;D,膜部分;E,細胞部分;F,超分子纖維); G-Q,分子功能 (G,轉錄因子活性、蛋白質結合;H,核酸結合轉錄因子活性;I,催化活性;J,信號轉換器活動;K,結構分子活性;L,轉運蛋白活性;M,綁定;N,電子載體活性;O,抗氧化活性;P,分子轉導活性;Q,分子功能調節劑)。a-q, Biological process (a, reproduction; b, immune system process; c, metabolic process; d, cellular process; e, reproductive process; f, biological adhesion; g, signaling; h, multicellular organismal process; I, developmental process; j, growth; k, single-organism process; l, rhythmic process; m, response to stimulus; n, localization; o, multi-organism process; p, biological regulation; q, cellular component organization or biogenesis) ; r-z, A-F, Cellular component (r, extracellular region; s, cell; t, membrane; u, virion; v, cell junction; w, extracellular matrix; x, membrane-enclosed lumen; y, macromolecular complex; z, organelle; A, extracellular matrix component; B, organelle part; C, virion part; D, membrane part; E, cell part; F, supramolecular fiber) ; G-Q, Molecular function (G, transcription factor activity, protein binding; H, nucleic acid binding transcription factor activity; I, catalytic activity; J, signal transducer activity; K, structural molecule activity; L, transporter activity; M, binding; N, electron carrier activity; O, antioxidant activity; P, molecular transducer activity; Q, molecular function regulator).圖3 澇害脅迫下牡丹差異表達基因的GO分類圖Fig.3 GO classification map of differentially expressed genes during waterlogging stress in P. suffruticosa
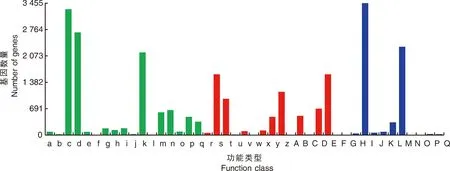
此外,共有32 059個unigene被分配到KOG分類中,并分為25個特定類別(圖4)。最大的一組屬于“僅一般功能預測”(7 512),其次是“翻譯后修飾、蛋白質周轉、伴侶蛋白”(3 604)和“信號轉導機制”(2 901)。只有少數unigene被分為“細胞外結構”(68)和“細胞運動性”(13)。
A,RNA加工和修飾;B,染色質結構和動力學;C,能源產生與轉換;D,細胞周期控制、細胞分裂、染色體分割;E,氨基酸運輸和代謝;F,核苷酸運輸和代謝;G,碳水化合物運輸和代謝;H,輔酶運輸和代謝;I,脂質運輸和代謝;J,翻譯、核糖體結構與生物發生;K,轉錄;L,復制、重組和修復;M,細胞壁/膜/包膜生物發生;N,細胞運動性;O,翻譯后修飾、蛋白質轉運蛋白、伴侶蛋白;P,無機離子運輸和代謝;Q,次生代謝產物的生物合成、運輸和分解代謝;R,僅通用功能預測;S,功能未知;T,信號轉導機制;U,細胞內運輸、分泌和囊泡運輸;V,防御機制;W,細胞外結構;Y,核結構;Z,細胞骨架。A, RNA processing and modification; B, Chromatin structure and dynamics; C, Energy production and conversion; D, Cell cycle control, cell division, chromosome partitioning; E, Amino acid transport and metabolism; F, Nucleotide transport and metabolism; G, Carbohydrate transport and metabolism; H, Coenzyme transport and metabolism; I, Lipid transport and metabolism; J, Translation, ribosomal structure and biogenesis; K, Transcription; L, Replication, recombination and repair; M, Cell wall/membrane/envelope biogenesis; N, Cell motility; O, Posttranslational modification, protein turnover, chaperones; P, Inorganic ion transport and metabolism; Q, Secondary metabolites biosynthesis, transport and catabolism; R, General function prediction only; S, Function unknown; T, Signal transduction mechanisms; U, Intracellular trafficking, secretion, and vesicular transport; V, Defense mechanisms; W, Extracellular structures; Y, Nuclear structure; Z, Cytoskeletion.圖4 澇害脅迫下牡丹差異表達基因的KOG分類和分析Fig.4 KOG classification and analysis of differentially expressed genes during waterlogging stress in P. suffruticosa
KEGG系統還對與澇害脅迫相關的unigene生物途徑進行了注釋。總共發現13 881個unigene參與了135個KEGG途徑。涉及最多unigene的途徑是“代謝途徑”(2 733,39.22%),其次是“次級代謝產物的生物合成”(1 453,20.85%)和“抗生素的生物合成”(669,9.6%)。
2.3 澇害脅迫下的差異表達基因
為了可視化6個RNA-Seq樣本之間的差異表達基因,進行了PCA繪圖。該圖顯示,3個對照樣品(CK1、CK2、CK3)和3個澇害處理的樣品(W1、W2、W3)分別沿維度1和維度2清晰區分(圖5)。為了鑒定在淹水脅迫下積累的牡丹的差異表達轉錄物,使用RPKM方法測量基因表達水平。使用FDR≤0.05和log2R≥1(R≥2)的值作為閾值來估計差異基因表達的顯著性。在W組和CK組之間共檢測到780個表達顯著改變的基因,包括155個上調基因和625個下調基因(圖6)。此外,在W和CK的文庫中分別有71 187和70 697個轉錄本特異性表達。基于這些結果,我們發現牡丹的大多數基因在對淹水脅迫的反應中都有差異表達。在這些差異表達基因中,大量基因可能在淹水脅迫中發揮關鍵作用。
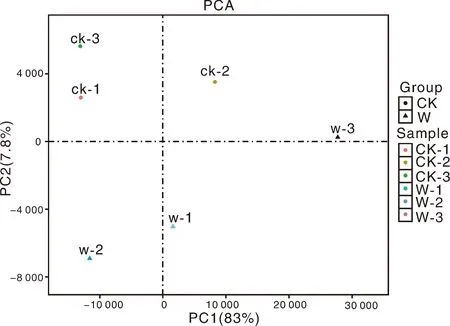
圖5 六個RNA-Seq樣本的主成分分析(PCA)圖Fig.5 Principal component analysis (PCA) plot of 6 RNA-Seq samples
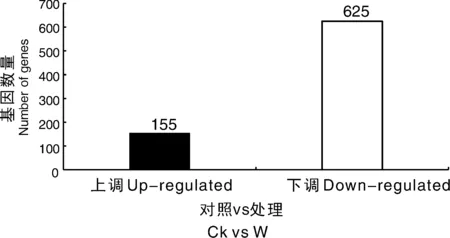
圖6 澇漬脅迫下牡丹差異表達基因統計圖Fig.6 Changes in gene expression profiles between the waterlogging stress and control libraries of P. suffruticosa
2.4 差異表達基因的功能分析
進行GO富集分析,對澇害處理組和對照組之間差異表達基因的推定功能進行分類。如上所述,差異表達的基因被分為3大類,包括生物進程、分子功能和細胞成分。在這3個類別下,前30個富集的功能組如表1所示,具體包括核小體組織、蛋白質-DNA復合物亞單位組織、染色體組織、蛋白質復合物亞單位組織等10個生物進程類功能組,蛋白質二聚化活性、蛋白質結合、核酸結合、雜環化合物結合等10個分子功能類功能組,以及無膜細胞器、細胞內無膜細胞器、核腔、細胞器腔等10個細胞成分類的功能組。

表1 GO類別下最富集的30個功能組Table 1 Top 30 most enriched functional groups under GO categories
為了進一步闡明差異表達的unigene在響應澇害脅迫中的功能,將差異表達的轉錄物與KEGG數據庫類別進行匹配。結果顯示,共有74條途徑與澇害脅迫顯著相關。前11個富集的功能途徑如表2所示。在這11條KEGG途徑中,3條最顯著富集的途徑分別是DNA復制、核糖體和嘧啶代謝。此外,還發現了與吞噬體、堿基切除修復、內質網蛋白質加工、嘌呤代謝等相關的其他重要途徑,推測是牡丹響應澇害脅迫的主要途徑。

表2 最富集的11個KEGG途徑Table 2 Top 11 most enriched KEGG pathways
2.5 響應澇害脅迫的轉錄因子的鑒定
在澇害處理和對照條件下鑒定出多種差異表達的轉錄因子。在57個轉錄因子(TF)家族中,前10個TF家族如圖7所示。在這10個TF家族中,大多數TF屬于bHLH(92個unigene)、ERF(74個unigene)和MYB_related(65個unigene)。bHLH家族是在澇害脅迫條件下顯著差異表達數量最多的一類轉錄因子,其他7個轉錄因子家族分別屬于C2H2(62個unigenes)、FAR1(62個unigenes)、MYB(53個unigenes)、bZIP(51個unigenes)、C3H(50個unigenes)、NAC(44個unigenes)和WRKY(40個unigenes)家族。有25個、14個和12個差異表達的unigenes分別被分為HD-ZIP、ARF和AP2家族。

圖7 前10個轉錄因子家族的基因數量Fig.7 Gene number of top 10 transcription factor families
2.6 qRT-PCR驗證
為了驗證RNA-Seq數據的準確性和可靠性,從差異表達基因中隨機選擇14個unigenes,使用特異性引物進行qRT-PCR分析。在14個被檢測的unigenes中,11個基因的qRT-PCR表達模式與RNA-Seq數據(圖8)顯示出高度相似性。這一結果反映了基于RNA-Seq的差異表達分析是可靠和準確的。此外,使用倍數變化測量來計算RNA-Seq和qRT-PCR數據之間的相關性。隨后,在兩個數據組之間發現了良好的一致性(R2=0.933 8)(圖8),證實了RNA-Seq方法獲得的結果是有效和可靠的。
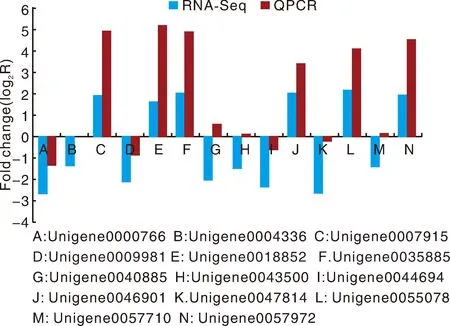
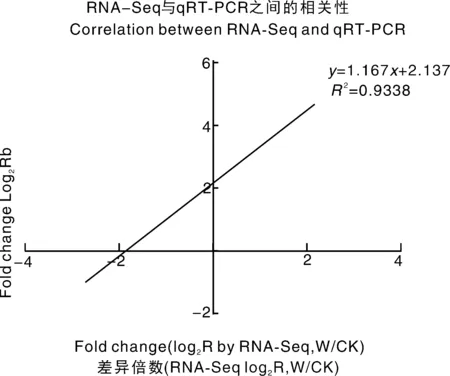
圖8 qRT-PCR對基因相對表達水平的驗證Fig.8 Verification of the relative expression levels of genes by qRT-PCR
2.7 SSR標記的分布和特征
從牡丹RNA-Seq數據中,在74 756個unigenes中發現了4 596個unigenes,包含5 204個SSR位點,頻率為6.15%(包含SSR位點的unigene占總unigene的比例)。每個unigene至少有1個SSR位點,302個unigenes包含多個SSR位點。在5 204個SSR基因位點中,二核苷酸重復序列(3 025個,58.13%)占優勢,其次是三核苷酸(1 411個,27.11%)、四核苷酸(377個,7.24%)、五核苷酸(128個,2.46%)和六核苷酸重復(263個,5.05%)(表3)。
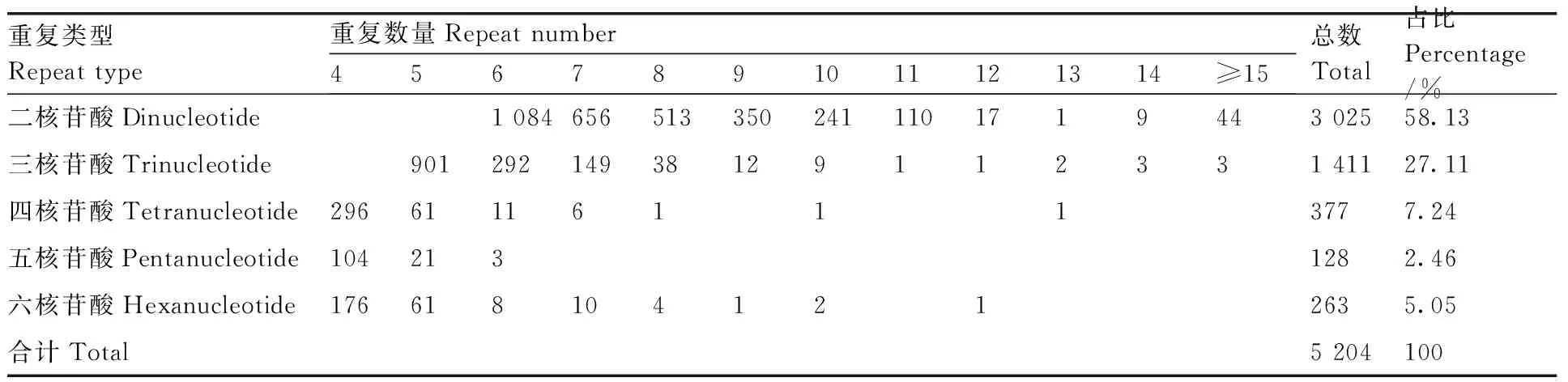
表3 牡丹耐澇相關unigene中SSR的類型、數量和分布頻率Table 3 Type, number and distribution frequency of SSRs in Paeonia suffruticosa waterlogging related unigenes
對轉錄組中SSR的核苷酸類型進行分析,結果表明,在5 204個SSR位點中有212個重復基序。在二核苷酸重復基序中,最明顯的顯性基序是AG/CT(2 153,41.4%),其次是AT/AT(513,9.9%)和AC/CT(352,6.8%)。在三核苷酸重復基序中,最常見的基序是AAG/CTT(362,7%)、ACC/GGT(277,5.3%)和ATC/ATG(196,3.8%)。重復基序AAAT/ATT(171,3.3%)僅存在于四核苷酸重復基序中。然而,在其他類型中沒有明顯的顯性基序(表4、圖9)。
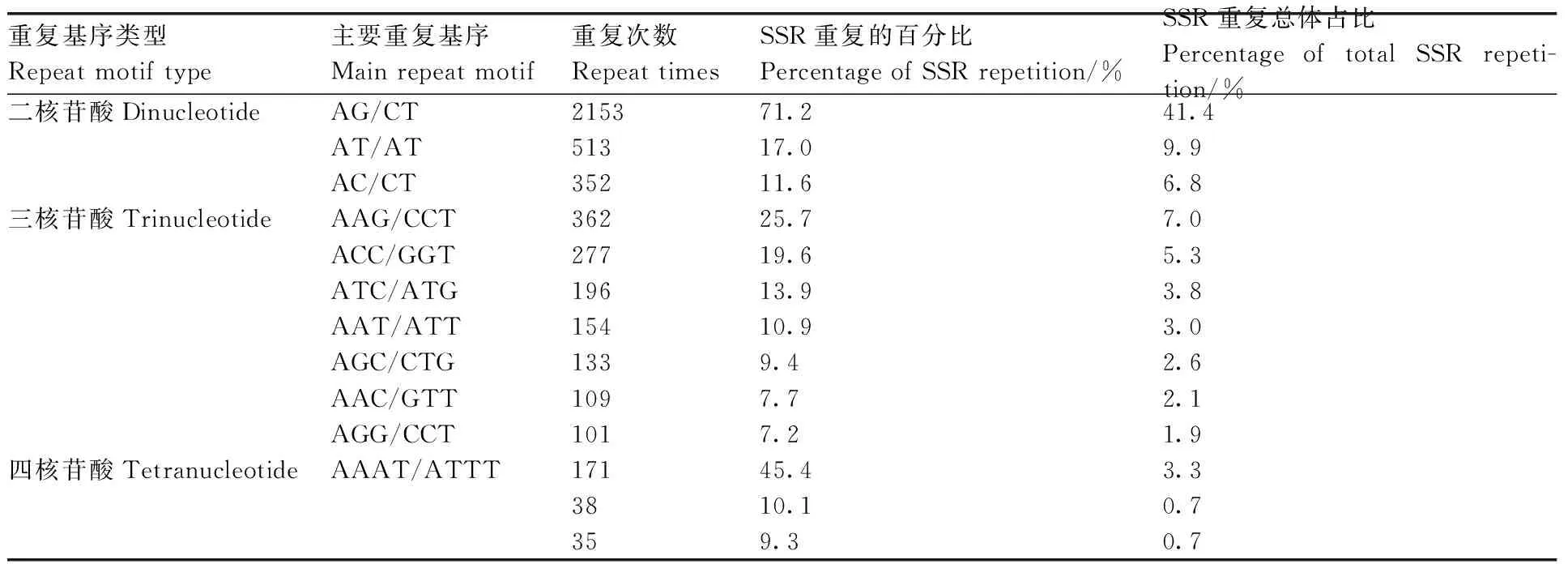
表4 牡丹澇害轉錄組SSR重復基序的類型和頻率分布Table 4 Types and frequency distribution of SSR repeat motifs in the waterlogging transcriptome of Paeonia suffruticosa
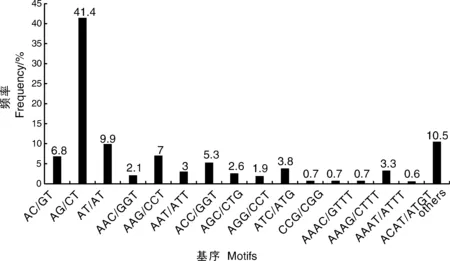
圖9 二核苷酸、三核苷酸、四核苷酸和其他類型重復基序的頻率分布Fig.9 Frequency distribution of di-, tri-, tetra-nucleotide and other type repeat motifs
2.8 澇害脅迫下SSR標記開發
本研究以與澇害脅迫調控相關的基因為候選基因,在葉片中發現了780個與澇害脅迫反應相關的差異表達基因。通過與SSR基因位點的比較,從差異表達的基因中發現55個含有SSR基因位點。設計了110對引物,篩選得到45對引物(表5)。以牡丹嫩葉DNA為模板,初步測試了引物的有效性,并對12對引物進行了二次篩選,在9個品種(紅芙蓉、玉樓春、大富貴、一品紅、島錦、島輝、鳳丹和2個新品種)中擴增出清晰穩定的靶帶(圖10),平均多態性為83%。
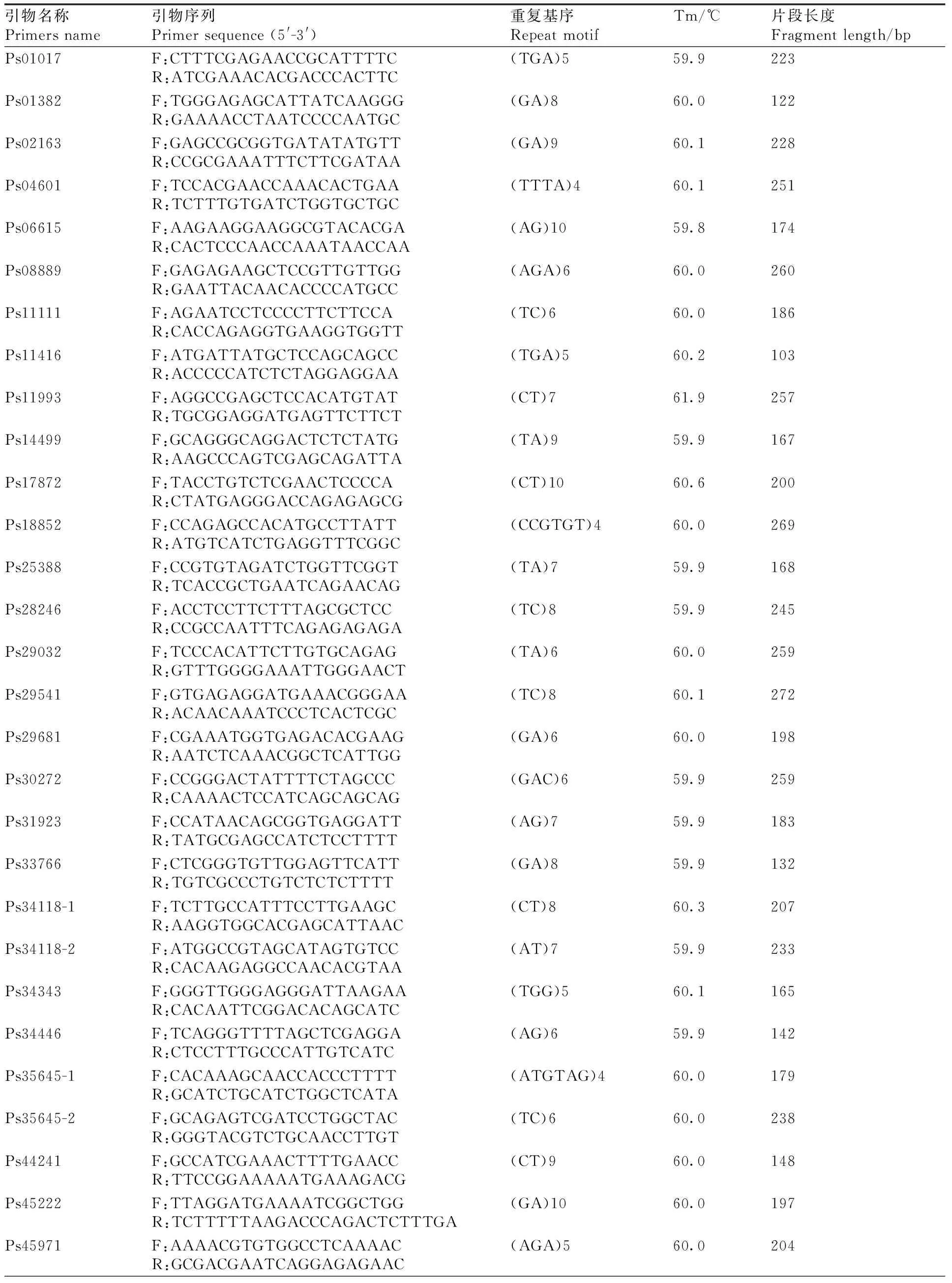
表5 牡丹澇害脅迫相關的SSR引物開發Table 5 SSR primers developed from genes related to waterlogging stress in Paeonia suffruticosa
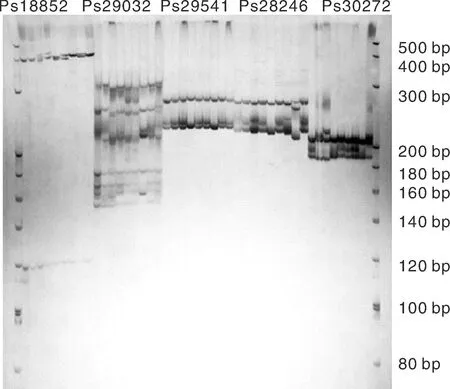
圖10 SSR引物Ps18852, Ps28246, Ps29032, Ps29541和 Ps30272在9個牡丹品種中的擴增結果Fig.10 Polymorphism of Ps18852, Ps28246, Ps29032, Ps29541, and Ps30272 of SSR primers in 9 samples of P. suffruticosa
9個牡丹品種基因組DNA中12對引物的擴增帶均具有多態性(表6),其中5對引物占100%的多態性,4對引物占80%以上的多態性。觀察到的等位基因數(Na)在1.333 3~2.000 0,平均為1.830 7。有效等位基因數(Ne)在1.060 4~1.692 6,平均1.388 4。Nei基因多樣性的變異范圍為0.148 1~0.397 2,平均為0.256 1。香農信息指數在0.109 6~0.5581 8,平均值為0.372 0。這些結果表明,本研究開發的12對EST-SSR引物都是有效的通用引物,可用于牡丹品種的遺傳多樣性分析和品種鑒定。

表6 十二個SSR引物在9個牡丹品種中的遺傳多樣性指數Table 6 Genetic diversity index for 12 SSR primers among 9 Paeonia suffruticosa cultivars
3 討論
耐澇性是一個極其復雜的特征,涉及許多代謝途徑和大量基因。在差異表達的基因中,一些具有功能注釋的基因可能參與了耐澇性的調節,其中一些是未報道的基因。它們差異表達的原因和作用機制尚不清楚,需要進一步研究。對這些基因的進一步研究將有助于我們更好地了解牡丹耐澇性的調控機制。
本研究篩選出780個差異表達基因,其中37個差異表達最明顯的基因與耐澇性相關,包含10個上調基因和27個下調基因。在37個差異表達基因中,有6個基因含有4個Hsp70和2個Hsp80,它們與熱休克同源蛋白(Hsp)有關。Hsp70是一種熱休克蛋白,長期以來一直被認為是最保守的蛋白家族之一。它可以對外部環境刺激作出反應,提高身體適應不利環境的能力。Hsp70蛋白廣泛存在于細菌、植物和人類中[19]。在植物中,它們在應對非生物脅迫方面發揮著至關重要的作用,如熱、冷、干旱和鹽度等環境因素[20]。然而,Hsp對澇害脅迫的反應尚未報道。
通過分析,我們還發現了一些與轉錄因子相關的基因,如AP2/ERF、MYB和bZIP轉錄因子。這些轉錄因子均上調,并對其靶基因的表達產生進一步影響,從而決定牡丹的耐澇性。AP2/ERF基因家族成員被報道為與植物澇害脅迫相關的重要基因[21-23],ERFⅦ亞家族N末端的一個保守基序(NH2-MCGGAI/L)被證實與澇害脅迫適應有關[24]。MYB轉錄因子調節包括澇害脅迫在內的大量應激反應基因的表達譜[25-26]。例如,對棉花電子表達譜的分析表明,GhMYB基因在棉鈴中特異性表達,并由根和葉中的耐澇脅迫誘導[27]。bZIP轉錄因子是近年來研究最多的轉錄因子家族之一。bZIP家族在包括擬南芥、煙草、水稻、小麥等在內的大量植物中被鑒定,其表達和功能被證明與耐澇性有關[25,28]。我們目前的研究結果進一步支持AP2/ERF、MYB和bZIP轉錄因子可能在牡丹的耐澇反應中發揮作用,并對許多耐澇基因的激活起重要作用,從而增強耐澇性。因此,提高一個關鍵轉錄因子的表達可能會提高牡丹的耐澇性。
還有一些其他與脫氫酶相關的蛋白質基因,如MDH、ADH、GDH等,以及一些編碼滲透調節物質的相關基因如APX,可能在牡丹耐澇性的調節中發揮重要作用。
SSR標記作為一種能夠區分顯性和隱性等位基因的共顯性標記,已被廣泛用于研究種質之間的遺傳關系和遺傳多樣性,以及連鎖定位和基因定位[29-30]。新一代高通量測序技術(RNA-Seq)的快速發展為SSR標記的開發提供了一種快速有效的方法[31]。與普通的EST-SSR標記物相比,在基因或候選基因中開發的SSR可以更好地適應特定和多樣化的市場需求。本研究在牡丹轉錄組數據庫中檢索了74 756個單基因拼接的SSR,獲得了5 204個SSR位點,頻率為6.56%,高于馬尾松的4.32%[32]、菊花的2.84%[33],但低于三角梅的44.91%[34],24.46%的杜鵑[35]和15.2%的鳳丹[14]。這表明轉錄組SSR中包含的信息不僅在物種之間不同,而且在品種之間也不同,或者SSR分析軟件設定的標準不同。
多態性SSR分子標記的開發是物種重要性狀分子標記輔助育種的基礎和前提。在本研究中,獲得了12個多態性引物,占有效引物的26.67%,低于牡丹(62%)[16],但高于牡丹(19.61%)[14]。它接近牡丹的27%[36]、25%[13]和24%[17]。大量研究表明,SSR基因座中重復序列的長度越長,SSR標記的多態性程度通常越高[37-38]。此外,多態性水平也可能受到遺傳基礎和實驗材料樣本量的影響[38]。例如,在24個芝麻樣品中,多態性SSR的百分比為11.59%。樣本量增加到25個后,多態性SSR的百分比上升到60.50%[39]。據預測,SSR引物多態性的比例也會隨著樣本遺傳背景和樣本量的增加而增加。
在本研究中,我們利用牡丹的轉錄組信息開發了多個與澇害脅迫基因相關的SSR分子標記,并驗證了這些標記的有效性和普遍性。研究結果進一步豐富了牡丹的特異性分子標記數量,為后續牡丹分子標記輔助育種及相關分子生物學研究奠定了基礎。接下來,我們將進一步驗證這些SSR標記與耐澇性狀之間的關系,為牡丹耐澇種質鑒定、遺傳多樣性分析和分子標記輔助育種提供科學依據。

