丹參SmWRKY33基因的克隆與表達(dá)分析
龔婷 劉靈娣 溫春秀 武玉翠 王升 萬修福 孫亞倩 姜濤


摘要:為了研究WRKY33基因在丹參非生物脅迫中的作用機制,以白花丹參為試驗材料,對丹參轉(zhuǎn)錄組數(shù)據(jù)進(jìn)行分析,挖掘出丹參WRKY33基因參考序列并設(shè)計特異性引物,利用基因克隆技術(shù)從丹參中克隆出WRKY33基因的全長cDNA,命名為SmWRKY33。對SmWRKY33基因進(jìn)行生物信息學(xué)分析,同時利用熒光定量方法探究SmWRKY33基因在逆境脅迫下的表達(dá)模式。結(jié)果表明,SmWRKY33基因核苷酸長度為1 635 bp,編碼544個氨基酸。生物信息學(xué)分析顯示,SmWRKY33基因的理論相對分子量為60 835.66,等電點為7.00,定位于細(xì)胞核,不存在跨膜區(qū)及信號肽,SmWRKY33蛋白為不穩(wěn)定親水蛋白。親緣關(guān)系顯示,SmWRKY33與紫蘇、芝麻、白花泡桐的WRKY33親緣關(guān)系較近。密碼子偏好性分析得出擬南芥真核表達(dá)最適應(yīng)丹參SmWRKY33基因的外源表達(dá)。qRT-PCR結(jié)果表明,SmWRKY33基因在低溫、高溫、PEG、NaCl等逆境脅迫誘導(dǎo)下具有不同的表達(dá)模式,其中低溫、NaCl能顯著誘導(dǎo)SmWRKY33基因的高表達(dá),說明該基因?qū)囟日{(diào)節(jié)、鹽脅迫較為敏感,猜測其參與溫度、鹽脅迫調(diào)控反應(yīng)機制。本試驗首次從丹參中克隆出SmWRKY33基因,探討了該基因在丹參逆境脅迫下的作用機制,旨在為培育丹參的抗逆新品種提供參考基因。
關(guān)鍵詞:丹參;SmWRKY33基因;生物信息學(xué);qRT-PCR;基因克隆
中圖分類號:S567.5+30.1? 文獻(xiàn)標(biāo)志碼:A
文章編號:1002-1302(2024)03-0053-08
丹參(Salvia miltiorrhiza Bunge)是唇形科、鼠尾草屬多年生直立草本植物,是我國的大宗藥材之一[1]。2020版《中華人民共和國藥典》中記載:丹參以干燥根莖入藥,具有活血、止痛、生新等功效,用于治療胸痹心痛、月經(jīng)不調(diào)、衰弱失眠等病癥,臨床上常用于心血管疾病的治療[2]。丹參發(fā)揮藥效的成分主要有2類,其中包括丹酚酸類、丹參酮類化合物[3]。此外,丹參基因組完善,生育期短,成為研究中藥材在環(huán)境脅迫下的模型植物[4]。近些年來,丹參市場不斷擴大,野生丹參遠(yuǎn)不能滿足市場的需求;而在人工種植過程中,干旱會極大影響丹參的生長和品質(zhì)。劉大會等通過研究不同土壤和水分對丹參植株的影響,發(fā)現(xiàn)嚴(yán)重干旱和過多水分會導(dǎo)致丹參酮、丹酚酸B的含量與累積量明顯下降,進(jìn)而影響丹參的產(chǎn)量和品質(zhì)[5]。如何提高丹參的抗旱性和耐鹽性,培育丹參抗逆品種,成為一個熱門研究話題。
WRKY轉(zhuǎn)錄因子作為植物轉(zhuǎn)錄因子(transcription factors,TF)的一個大家庭,參與了植物的生長發(fā)育、防御調(diào)控、逆境反應(yīng)等多種生物學(xué)過程,并在其中起著積極或消極的調(diào)節(jié)作用[6]。WRKYs通常由2個結(jié)構(gòu)組成,包括高度保守的WRKYGQK七肽結(jié)構(gòu)域(位于其N端的WRKY結(jié)構(gòu)域)和C端的鋅指基序[7]。WRKY結(jié)構(gòu)域能和順式作用元件W-box(C/T)TGAC(C/T)以及RAV1A、WLS元件特異性結(jié)合,說明它們具有不同的結(jié)合方式,并參與下游目的基因調(diào)控[8]。Yu等從小麥克隆出TaWRKY1-2D基因,研究表明TaWRKY1-2D蛋白可能參與小麥中植物激素生物合成、轉(zhuǎn)錄后基因調(diào)控、代謝途徑、蛋白激酶信號傳導(dǎo),調(diào)節(jié)下游基因的表達(dá)以影響小麥生長機制,表明TaWRKY1-2D基因可以提高小麥的耐旱性[9]。Cai等從玉米中克隆出ZmWRKY17基因,結(jié)果發(fā)現(xiàn),ZmWRKY17在擬南芥中通過抑制一些ABA和逆境反應(yīng)基因的表達(dá),提高對鹽脅迫的敏感性,降低對ABA的敏感性,以此來提高植物的耐鹽性[10]。Xiang等以擬南芥為模式植物,從中克隆出MFWRKY70基因,研究發(fā)現(xiàn)MFWRKY70基因定位于細(xì)胞核,通過該基因促進(jìn)根系生長和保水,極大提高根系對干旱、滲透、鹽脅迫的耐受性,以及在應(yīng)激條件下增強抗氧化酶系統(tǒng)和維持活性氧(ROS)穩(wěn)態(tài)和膜脂穩(wěn)定性[11]。目前丹參的WRKY33基因還未被研究發(fā)現(xiàn),本研究首次從丹參中克隆出WRKY33基因并進(jìn)行生物信息學(xué)分析,同時利用qRT-PCR對特異性表達(dá)模式進(jìn)行分析,旨在為進(jìn)一步研究丹參調(diào)控次生代謝產(chǎn)物生物合成及逆境響應(yīng)的分子機制提供參考。
1 材料和方法
1.1 材料與試劑
試驗材料為丹參幼苗,品種為白花丹參,來自河北省農(nóng)林科學(xué)院(114.45°E,38.06°N),于2022年12月采樣進(jìn)行后續(xù)試驗。取丹參葉片,清水洗凈后液氮速凍,用于丹參RNA的提取。
RNA提取試劑盒TransZol Up Plus RNA Kit、cDNA反轉(zhuǎn)錄試劑盒TransScript One-Step gDNA Removal、高保真酶試劑盒2×TranStart FastPfu、瓊脂糖凝膠回收試劑盒、質(zhì)粒提取試劑盒、熒光定量試劑盒等,購自天北京全式金生物技術(shù)有限公司;pMD19-T載體、2×Taq Plus Master Mix,購自北京白鯊生物科技有限公司。
1.2 試驗方法
1.2.1 總RNA的提取及cDNA的合成
依照全式金高純度RNA植物提取試劑盒(目錄號:ER501-01)說明書,提取丹參葉片的總RNA;以丹參總RNA為模板,依照全式金TransScript One-Step Removal and cDNA Synthesis SuperMix試劑盒(目錄號:AT311-03)說明書反轉(zhuǎn)錄體系,對丹參進(jìn)行cDNA的合成。
1.2.2 丹參引物合成
根據(jù)丹參轉(zhuǎn)錄組數(shù)據(jù)庫,利用Primer 5.0軟件設(shè)計SmWRKY33基因特異性引物。上游引物:SmWRKY33-F 5′-ATGGCTTCTTCTAGCGGAAGC-3′;下游引物:SmWRKY33-R 5′-TCAGCTGAGGAAAGAGTCGAA-3′,送至生工生物工程(上海)股份有限公司進(jìn)行引物合成。
1.2.3 丹參SmWRKY33基因克隆
以丹參cDNA為模板,參照全式金生物有限公司高保真DNA聚合酶2×TranStart FastPfu試劑盒方法擴增SmWRKY33基因全長。25 μL擴增體系如下:12.5 μL 2×Taq Plus MasterMix,1.0 μL SmWRKY33-F,1.0 μL SmWRKY33-R,1.0 μL Template cDNA,9.5 μL ddH2O。PCR擴增程序如下:95 ℃ 2 min;95 ℃ 20 s,54 ℃ 20 s,72 ℃ 1 min,共35個循環(huán);72 ℃ 5 min;16 ℃保存。PCR產(chǎn)物用瓊脂糖凝膠進(jìn)行電泳監(jiān)測,用紫外成像儀進(jìn)行觀察,全式金膠回收試劑盒回收目的片段。將目的片段與表達(dá)載體pMD19-T和大腸桿菌DH5α進(jìn)行轉(zhuǎn)化連接,挑取單克隆菌液送生工生物工程(上海)股份有限公司測序。
1.2.4 丹參SmWRKY33基因生物信息學(xué)分析
利用在線軟件ExPASy-ProtParam(https://web.expasy.org/protparam/),ExPASy-ProScale(https://web.expasy.org/protscale/)對分子量、等電點等理化性質(zhì)和親疏水性進(jìn)行分析,利用Conserved Domains(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)在線分析保守結(jié)構(gòu)域,利用SignalP 4.1 Server(http://www.cbs.dtu.dk/services/SignalP-4.1/)、TMHMM 2.0(https://services.healthtech.dtu.dk/services/TMHMM/)對序列信號肽、跨膜結(jié)構(gòu)進(jìn)行分析,利用NetNGlyc 1.0 Server(http://www.cbs.dtu.dk/services/NetNGlyc/)、NetPhos 3.1 Server(http://www.cbs.dtu.dk/services/NetPhos/)在線分析磷酸化、糖基化位點,利用PSORT Prediction(http://psortl .hgc.jp/form.html)對基因SmDREB2A的cDNA編碼氨基酸序列亞細(xì)胞進(jìn)行定位,利用SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.plpage=npsa_sopma.html)、SWISS-MODEL(https://swissmodel.expasy.org)對SmWRKY33蛋白進(jìn)行二、三級結(jié)構(gòu)等預(yù)測;利用CodonW、EMBOSS軟件分析丹參SmWRKY33基因密碼子的偏好性。
1.2.5 丹參SmWRKY33基因表達(dá)分析
對丹參根進(jìn)行低溫、高溫、PEG、NaCl處理,使用熒光定量分析SmWRKY33相對表達(dá)量,以丹參肌動蛋白基因Actin為內(nèi)參基因,利用軟件Primer 5.0進(jìn)行引物設(shè)計(表1)。
參照全式金PerfectStart Green qPCR SuperMix試劑盒中說明書進(jìn)行操作,20 μL反應(yīng)體系如下:10 μL PerfectStart Green qPCR SuperMix,0.4 μL引物-F(正向引物),0.4 μL 引物-R(反向引物),2.0 μL cDNA (1 ng),7.2 μL ddH2O。擴增條件:95 ℃ 30 s;95 ℃ 5 s,60 ℃ 30 s,共40個循環(huán);4 ℃ 保存。每個反應(yīng)重復(fù)3次,使用2-ΔΔCT 法分析丹參SmWRKY33基因表達(dá)量。
2 結(jié)果與分析
2.1 丹參SmWRKY33基因cDNA克隆與序列分析
根據(jù)丹參轉(zhuǎn)錄組數(shù)據(jù)得到的基因信息,發(fā)現(xiàn)1個丹參WRKY33抗逆基因,以此序列設(shè)計特異性引物,對丹參WRKY33進(jìn)行基因克隆。經(jīng)PCR擴增得到1條特異性片段,其大小約為1 600 bp,與預(yù)期大小長度一致(圖1-A)。對PCR產(chǎn)物進(jìn)行回收后,連接至pMD19-T測序載體,使用大腸桿菌DH5α進(jìn)行轉(zhuǎn)化,挑取單克隆菌液送公司測序。對測序結(jié)果進(jìn)行分析,發(fā)現(xiàn)該序列含有1 635 bp的完整開放閱讀框(ORF),編碼544個氨基酸(圖1-B),命名為SmWRKY33。在SmWRKY33基因的氨基酸組成中,絲氨酸(Ser)含量最高,占14.2%;其次為脯氨酸(Pro)含量,占9.5%;色氨酸(Trp)、半胱氨酸(Cys)含量最低,各占0.7%。
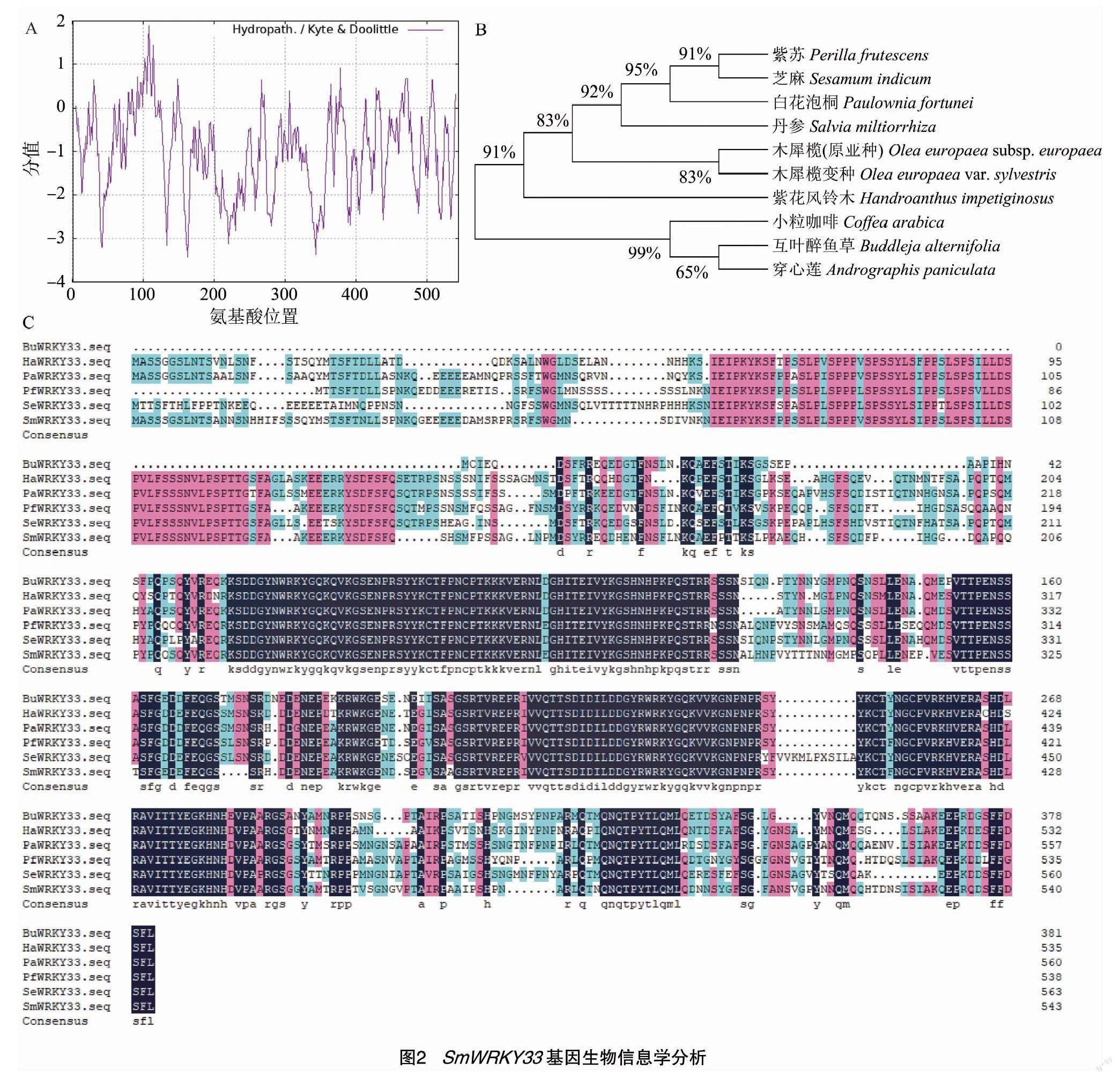
利用ProtParam在線軟件分析SmWRKY33蛋白的理化性質(zhì),SmWRKY33蛋白的相對分子量為60 835.66,等電點為7.00,分子式為C2 641H4 039N769O862S15,不穩(wěn)定指數(shù)為69.58,脂肪族指數(shù)為46.60,總平均親水性為-1.007,歸類為不穩(wěn)定親水蛋白。ExPasy-ProtSCale在線軟件分析SmWRKY33蛋白親/疏水性,結(jié)果顯示,SmWRKY33蛋白疏水性最強的位點是第108個氨基酸,疏水最高值為1.889;親水性最強的位點是第133個氨基酸,親水性最低值為 -3.156(圖2-A)。但從整條肽鏈的預(yù)測值結(jié)果分析來看,該蛋白整體趨于親水性,為親水蛋白。
2.2 丹參SmWRKY33基因生物信息學(xué)分析
利用NCBI數(shù)據(jù)庫對丹參SmWRKY33基因進(jìn)行Blast分析,結(jié)果表明,SmWRKY33基因的氨基酸序列與PfWRKY33(紫蘇,Perilla frutescens,KAH6798330.1)、PaWRKY33(白花泡桐,Paulownia fortunei,KAI3447833.1)、BuWRKY33(互葉醉魚草,Buddleja alternifolia,KAG8374463.1)、SeWRKY33(芝麻,Sesamum indicum,XP-011077504.1)的同源性較高,同源性分別為78.27%、73.39%、73.13%、66.78%(圖2-C)。在線軟件NCBI分析得出SmWRKY33基因有2個WRKY基因保守結(jié)構(gòu)域。利用MEGA 11軟件分析SmWRKY33基因氨基酸序列親緣關(guān)系,結(jié)果顯示SmWRKY33基因與紫蘇、芝麻、白花泡桐WRKY33親緣關(guān)系較近(圖2-B)。
在線軟件WoLF-PSORT預(yù)測SmWRKY33蛋白的亞細(xì)胞定位,該蛋白可能定位于細(xì)胞核。利用TMHMM Sever 2.0預(yù)測SmWRKY33蛋白的跨膜結(jié)構(gòu)域,結(jié)果顯示該蛋白沒有存在跨膜結(jié)構(gòu)域,可能不屬于跨膜蛋白(圖3-A)。使用NetNGlyc 1.0 Server對SmWRKY33蛋白糖基化位點進(jìn)行預(yù)測,結(jié)果表明該蛋白共有6個糖基化位點(圖3-B)。利用NetPhos 3.1 Server對SmWRKY33蛋白的磷酸化位點、蛋白激酶結(jié)合位點進(jìn)行分析(圖3-C),預(yù)測值大于0.5共發(fā)現(xiàn)149個磷酸化位點,分別含有絲氨酸(S)108個、蘇氨酸(T)27個、酪氨酸(Y)14個。SmWRKY33蛋白的信號肽使用在線軟件SignalP 4.1 Server進(jìn)行分析,C值、S值、Y值都小于閾值0.5,說明該蛋白沒有信號肽位點,屬于非分泌蛋白(圖3-D)。
2.3 丹參SmWRKY33蛋白二級三級結(jié)構(gòu)預(yù)測
利用SOPMA分析SmWRKY33蛋白的二級結(jié)構(gòu),結(jié)果顯示該蛋白二級結(jié)構(gòu)以無規(guī)則卷曲為主,占77.39%,其次是延伸鏈、α-螺旋、β-轉(zhuǎn)角,各占10.48%、10.29%、1.84%(圖4-A)。結(jié)合在線軟件SWISS-Model建立SmWRKY33蛋白的三級結(jié)構(gòu)模型,空間結(jié)構(gòu)以隨機卷曲為主,這與二級結(jié)構(gòu)的預(yù)測結(jié)果相符(圖4-B)。
2.4 丹參SmWRKY33基因密碼子偏好性分析
利用CodonW、EMBOSS軟件分析丹參SmWRKY33基因的密碼子適應(yīng)指數(shù)(codon adaptation index,CAI)、有效密碼子數(shù)(effective number of codons,ENC)、GC1s含量、GC2s含量、GC3s含量、總GC含量、同義密碼子相對適應(yīng)度(relative synonymous codon usage,RSCU)。結(jié)果表明,CAI為0.222、ENC為54.16,說明密碼子偏性較弱;總GC含量值0.4 979,其中GC1s、GC2s、GC3s含量值分別為0.4 752、0.4 569、0.5 615,說明該基因的A/U含量高于G/C含量。當(dāng)RSCU=1時,密碼子沒有偏好性;RSCU>1時,密碼子具有偏好性。表2中,RSCU>1的密碼子共有28個,其中A/U結(jié)尾有9個 G/C結(jié)尾有19個 說明丹參基因偏好于從數(shù)據(jù)庫CodcmUsage Database查找煙草(Nicotiana tabacum L.)、擬南芥[Arabidopsis thaliana(L.) Heynh.]、大腸桿菌(Escherichia coli)、酵母(Sacchammyces cerevisiae)基因組的密碼子偏好性,利用在線軟件EMBOSS-CHIP分析丹參SmWRKY33基因密碼子的使用頻率,表3列舉了丹參與其4個基因密碼子的使用頻率,分別用Sm/Nt、Sm/At、Sm/Ec、Sm/Sc來表達(dá)丹參SmWRKY33基因與煙草、擬南芥、大腸桿菌、酒釀酵母的密碼子使用頻率比值。若2個物種間密碼子使用頻率比值為0.5~2.0,則表明密碼子使用偏向比較接近,超過此范圍則差異較大。差異較大的密碼子個數(shù)越少,越有利于基因的異源表達(dá)。結(jié)果顯示,SmWRKY33與煙草、擬南芥、大腸桿菌、酒釀酵母分別有23、22、28、24個差異較大的密碼子,由此得出擬南芥真核表達(dá)最適應(yīng)丹參SmWRKY33基因的外源表達(dá)。
2.5 丹參SmWRKY33基因表達(dá)分析
利用熒光定量PCR分析丹參SmWRKY33基因在逆境脅迫下的相對表達(dá)量 結(jié)果表明SmWRKY33基因在低溫、高溫、PEG、NaCl等逆境脅迫下有不同程度的表達(dá)差異性。在低溫逆境脅迫下SmWRKY33基因的相對表達(dá)量顯著提高,在6 h時達(dá)到最高(圖5-A);在高溫逆境處理下相對表達(dá)量較低(圖5-B),說明該基因參與丹參的低溫響應(yīng)機制。同時,為探究SmWRKY33基因在干旱、鹽脅迫下的表達(dá)模式,使用PEG、NaCl進(jìn)行逆境脅迫試驗。結(jié)果表明,在PEG處理下,SmWRKY33基因在不同時間點的表達(dá)量不同,在24 h表達(dá)量達(dá)到最高(圖5-C)。在NaCl處理下,SmWRKY33基因的相對表達(dá)量隨時間增加總體逐漸升高,但在24 h時出現(xiàn)下降的趨勢,隨后又逐漸上升,表明NaCl顯著誘導(dǎo)SmWRKY33基因的高表達(dá)(圖5-D)。SmWRKY33基因表達(dá)譜分析結(jié)果顯示,該基因易受低溫和鹽等非生物脅迫的誘導(dǎo)表達(dá)。
3 結(jié)論與討論
丹參是我國傳統(tǒng)中藥材,據(jù)《神農(nóng)本草經(jīng)》所述,其皆為上品,因藥用部位根部呈紫紅色,被人們稱為“丹心”[12]。《本草綱目》原文記載丹參“小花成穗如蛾形,中有細(xì)子,其根皮丹而肉紫”,具有活血、治疝痛、通心包絡(luò)等作用[13]。Mei等闡述了不同溫度下丹參在干燥過程中產(chǎn)生的代謝變化,發(fā)現(xiàn) 100 ℃ 是丹參代謝物譜變化的關(guān)鍵轉(zhuǎn)折點,主要表現(xiàn)為酶促催化生物合成(≤100 ℃) 和化學(xué)誘導(dǎo)轉(zhuǎn)化(≥100 ℃)[14]。Tong等將代謝組學(xué)與質(zhì)譜成像方法相結(jié)合,對丹參空間代謝組進(jìn)行生物合成,發(fā)現(xiàn)丹參素是丹參生產(chǎn)多種酚酸的重要前體[15]。意大利學(xué)者對丹參進(jìn)行研究,首次證明丹參中的丹參酮可以改善以奧沙利鉑為主進(jìn)行化療所帶來的神經(jīng)病理性疼痛,同時可以降低膠質(zhì)母細(xì)胞瘤中癌細(xì)胞的發(fā)展速度[16]。
近年來,越來越多的研究證明轉(zhuǎn)錄因子在生物和非生物脅迫信號傳遞中起著關(guān)鍵作用,一些WRKY轉(zhuǎn)錄因子在干旱/冷脅迫或干旱/熱激脅迫下可以同時被誘導(dǎo),從而提高植物的抗逆性[17]。Chen等詳細(xì)闡述了WRKY轉(zhuǎn)錄因子在植物非生物脅迫中的作用,表明WRKY轉(zhuǎn)錄因子在植物生長過程中具有重要作用[18]。WRKY33作為WRKY家族的轉(zhuǎn)錄因子之一,其轉(zhuǎn)錄活性依賴于MPK3/6介導(dǎo)的磷酸化。Wang等使用反向遺傳方法和酵母表達(dá)系統(tǒng),明確了擬南芥轉(zhuǎn)錄因子WRKY33是通過與CesA8遠(yuǎn)端啟動子區(qū)域的W-box元件結(jié)合,直接調(diào)節(jié)CesA8的表達(dá),參與植物的干旱生長機制[19]。Zhou等通過AtWRKY33基因?qū)ν粗参锓裌RKY33脅迫響應(yīng)中的功能分析,發(fā)現(xiàn)在植物生長過程中,WRKY33轉(zhuǎn)錄因子在植物結(jié)構(gòu)、功能、調(diào)控網(wǎng)絡(luò)上高度保守,可以有效保護(hù)植物免受生物和非生物的脅迫[20]。目前已經(jīng)從蘋果[21]、向日葵[22]、毛果楊[23]成功克隆出WRKY33,研究表明WRKY33轉(zhuǎn)錄因子可以提高植物的耐鹽性和抗旱性。
隨著基因克隆技術(shù)的發(fā)展,越來越多WRKY基因家族的轉(zhuǎn)錄因子被相繼挖掘出來并進(jìn)行深入研究。Li等從玉米中克隆出ZmWRKY33,對其進(jìn)行干旱、高鹽、冷處理及ABA外源誘導(dǎo)試驗,結(jié)果表明轉(zhuǎn)基因擬南芥具有更高的抗逆性[24]。本研究根據(jù)丹參轉(zhuǎn)錄組數(shù)據(jù),挖掘出丹參具有耐鹽性和抗旱性轉(zhuǎn)錄因子WRKY33,利用基因克隆技術(shù)首次從丹參中克隆了SmWRKY33基因,該基因全長為1 635 bp,編碼544個氨基酸。利用在線軟件進(jìn)行生物信息學(xué)分析,SmWRKY33蛋白的相對分子量為60 835.66,等電點為7.00,分子式為C2? 641H4 039N769O862S15,為不穩(wěn)定親水蛋白。親緣關(guān)系分析顯示SmWRKY33與紫蘇、芝麻、白花泡桐的WRKY33親緣關(guān)系較近。利用在線軟件WOLF PSORT 進(jìn)行亞細(xì)胞定位預(yù)測,結(jié)果顯示丹參SmWRKY33蛋白可能定位于細(xì)胞核中。熒光定量PCR分析SmWRKY33基因在低溫、高溫、PEG、NaCl處理下的相對表達(dá)量情況,結(jié)果顯示SmWRKY33基因易受低溫、NaCl誘導(dǎo)表達(dá),說明SmWRKY33基因參與了丹參在生長過程中耐低溫和耐鹽機制。本研究利用基因克隆技術(shù),初步探討了SmWRKY33的生物學(xué)功能,以期為培育丹參抗逆新品種提供理論支撐。
參考文獻(xiàn):
[1]張夏楠,關(guān)紅雨,高 偉,等. 中藥丹參資源開發(fā)現(xiàn)代研究進(jìn)展[J]. 轉(zhuǎn)化醫(yī)學(xué)研究(電子版),2014,4(4):26-36.
[2]國家藥典委員會.中華人民共和國藥典[M]. 北京:中國醫(yī)藥科技出版社,2020.
[3]馬曉晶,楊 健,馬桂榮,等. 中藥丹參的現(xiàn)代化研究進(jìn)展[J]. 中國中藥雜志,2022,47(19):5131-5139.
[4]宋經(jīng)元,羅紅梅,李春芳,等. 丹參藥用模式植物研究探討[J]. 藥學(xué)學(xué)報,2013,48(7):1099-1106.
[5]劉大會,郭蘭萍,黃璐琦,等. 土壤水分含量對丹參幼苗生長及有效成分的影響[J]. 中國中藥雜志,2011,36(3):321-325.
[6]Wang Z R,Liu L,Su H,et al. Jasmonate and aluminum crosstalk in tomato:identification and expression analysis of WRKYs and ALMTs during JA/Al-regulated root growth[J]. Plant Physiology and Biochemistry,2020,154:409-418.
[7]Chen X J,Li C,Wang H,et al. WRKY transcription factors:evolution,binding,and action[J]. Phytopathology Research,2019,1(1):1-15.
[8]Zhang Y L,Du P,Xiong F Q,et al. WRKY genes improve drought tolerance in Arachis duranensis[J]. Frontiers in Plant Science,2022,13:910408.
[9]Yu Y,Song T Q,Wang Y K,et al. The wheat WRKY transcription factor TaWRKY1-2D confers drought resistance in transgenic Arabidopsis and wheat (Triticum aestivum L.)[J]. International Journal of Biological Macromolecules,2023,226:1203-1217.
[10]Cai R H,Dai W,Zhang C S,et al. The maize WRKY transcription factor ZmWRKY17 negatively regulates salt stress tolerance in transgenic Arabidopsis plants[J]. Planta,2017,246(6):1215-1231.
[12]吳 普,孫星衍,孫馮翼. 神農(nóng)本草經(jīng)[M]. 太原:山西科學(xué)技術(shù)出版社,2010.
[13]高學(xué)敏. 本草綱目[M]. 北京:印刷工業(yè)出版社,2011:73.
[14]Mei X G,Wang S Q,Zhang L,et al. Widely targeted metabolomics analysis revealed components change regularity of Salvia miltiorrhiza Bunge after post-harvest drying under different temperature[J]. Industrial Crops and Products,2022,188:115638.
[15]Tong Q,Zhang C,Tu Y,et al. Biosynthesis-based spatial metabolome of Salvia miltiorrhiza Bunge by combining metabolomics approaches with mass spectrometry-imaging[J]. Talanta,2022,238:123045.
[16]di Cesare Mannelli L,Piccolo M,Maione F,et al. Tanshinones from Salvia miltiorrhiza Bunge revert chemotherapy-induced neuropathic pain and reduce glioblastoma cells malignancy[J]. Biomedicine & Pharmacotherapy,2018,105:1042-1049.
[17]Wang H P,Chen W Q,Xu Z Y,et al. Functions of WRKYs in plant growth and development[J]. Trends in Plant Science,2023,28(6):630-645.
[18]Chen L G,Song Y,Li S J,et al. The role of WRKY transcription factors in plant abiotic stresses[J]. Biochimica et Biophysica Acta-Gene Regulatory Mechanisms,2012,1819(2):120-128.
[19]Wang X J,Du B J,Liu M,et al. Arabidopsis transcription factor WRKY33 is involved in drought by directly regulating the expression of CesA8[J]. American Journal of Plant Sciences,2013,4(6):21-27.
[20]Zhou J,Wang J,Zheng Z Y,et al. Characterization of the promoter and extended C-terminal domain of Arabidopsis WRKY33 and functional analysis of tomato WRKY33 homologues in plant stress responses[J]. Journal of Experimental Botany,2015,66(15):4567-4583.
[21]張遠(yuǎn)嬿. 蘋果MdWRKY33基因的克隆與功能分析[D]. 沈陽:沈陽農(nóng)業(yè)大學(xué),2018:13-17.
[22]范榮偉. 大白菜BrWRKY33基因及其上游調(diào)控序列的克隆與功能研究[D]. 北京:首都師范大學(xué),2009:11-21.
[23]張 蕾. 毛果楊WRKY33基因的克隆及抗旱耐鹽堿性研究[D]. 哈爾濱:東北林業(yè)大學(xué),2022:6-14.
[24]Li H,Gao Y,Xu H,et al. ZmWRKY33,a WRKY maize transcription factor conferring enhanced salt stress tolerances in Arabidopsis[J]. Plant Growth Regulation,2013,70(3):207-216.

